2. 甘肃农业大学动物科学技术学院,兰州 730070
2. College of Animal Science and Technology, Gansu Agricultural University, Lanzhou 730070, China
动物屠宰放血后,由于细胞营养物质及氧供应中断,进而发生缺血、缺氧和能量逐渐耗尽等剧烈应激变化[1],机体细胞为维护内环境的平衡导致细胞迅速发生凋亡[2]。诱发细胞凋亡的可能途径有以下三种:第一种为涉及Cyt-c释放并激活Caspase-3的内源性线粒体信号途径[3];第二种为由Caspase-8和Caspase-10激活介导的外源性死亡受体途径[4];第三种为由Caspase-12激活介导的内质网信号途径[5]。随着凋亡概念引入宰后肌肉嫩化,大多数研究发现宰后肌肉中的细胞凋亡酶被激活[6-7],且认为细胞凋亡与宰后肌肉的嫩化高度相关[8],其中线粒体凋亡途径被认为是引起肌肉嫩度改善的主要途径[9]。线粒体途径细胞凋亡是指线粒体上游信号分子作用于线粒体膜,随着线粒体通透性转换孔的打开,Cyt-c等凋亡蛋白从孔道中释放,线粒体通透性转换孔是由多种线粒体蛋白构成的复合孔道,同时,细胞过氧化反应积累的活性氧可调控线粒体通透性转换孔从而引起线粒体氧化损伤直至细胞功能缺失甚至凋亡[10]。
大量研究表明,饲粮中添加天然或合成抗氧化剂可显著提高动物宰后肌肉的抗氧化性能。王玉龙和费兆生[11]研究发现,日粮中添加茶叶提取物可显著提高育肥猪肌肉中GSH-Px等抗氧化酶的活性,提示可能是由于茶叶中的茶多酚进入肌细胞清除过氧化物,从而提高肌肉的抗氧化能力。李月明[12]研究发现,日粮中补充活性干酵母制剂可显著提高牛肉中超氧化物歧化酶的含量并降低活性氧水平,说明活性干酵母饲喂对宰后牛肉抗氧化能力的提高具有积极的作用效果。此外,高毅刚[13]研究发现,基础日粮中添加0.2%硒锗酵母对延边黄牛臀肉总抗氧化能力下降具有明显抑制作用,这是由于日粮中添加硒锗酵母显著增加了牛肉中微量元素硒的含量,其可清除细胞代谢产生的有害过氧化物,进而减轻细胞的氧化损伤。
动物屠宰后,凋亡程序开始启动,随着成熟时间的延长,细胞ROS的大量积累以及机体抗氧化能力的减弱,凋亡加剧。线粒体是产生ROS的主要细胞器,且易受其攻击产生氧化损伤。在细胞发生凋亡时,促凋亡因子可从受损的线粒体中释放,进而激活细胞凋亡酶,并参与宰后肌肉的嫩化[14]。王琳琳[15]研究发现,利用N, N, N’, N’-四甲基对苯二胺二盐酸盐处理宰后牦牛肉可减弱线粒体氧化损伤,同时显著抑制了Caspase-3及Caspase-9的活性,并导致了嫩度的降低。此外,李文东等[16]研究发现,快速冷却可显著降低牦牛背最长肌成熟初期的Caspase-3和Caspase-9的活性,最终导致肌原纤维降解的减弱。因此,动物宰后成熟过程中,线粒体发生氧化损伤可通过调控细胞凋亡进程从而影响肌肉的嫩化。
目前,对于饲喂富硒日粮提高宰后动物的免疫能力、抗氧化能力及肉品质的研究较为广泛[17-18],而在肉鸡宰后成熟过程中,酵母硒饲喂对线粒体氧化损伤及细胞凋亡造成何种影响,尚未见相关报道。本文以添加酵母硒日粮饲养的肉鸡胸肉为试验对象,分别测定宰后成熟过程中对照组和酵母硒组的硒含量、抗氧化酶活性、线粒体氧化损伤程度、细胞凋亡酶活性及嫩度,研究日粮添加酵母硒对宰后肉鸡线粒体氧化损伤及细胞凋亡的影响,同时探究酵母硒饲喂对肉嫩度的影响,以期为营养调控肉鸡宰后成熟嫩化提供理论依据。
1 材料与方法 1.1 材料与试剂1.1.1 试验材料 本试验选用l日龄白羽肉用雏鸡180只,随机分成3组,每组设6个重复,每个重复10只。在玉米-杂粕型基础日粮的基础上,参照NRC(1994)营养需要添加酵母硒(购自加拿大拉曼公司,商品名Lalmin Se 2000,硒含量2 000 mg·kg-1),按添加酵母硒水平的不同分为3个处理组,分别为CK(基础日粮)组、0.3S组(基础日粮+0.3 mg·kg-1酵母硒)和0.6S组(基础日粮+0.6 mg·kg-1酵母硒)。在相同饲养条件下饲养,饲养周期为42 d,分为(0~21 d)和(22~24 d)两个阶段,其中前期(0~21 d)饲粮组成为64.16%玉米、2%植物油、20%豆粕、3%棉籽粕、3%玉米蛋白粉、3%菜籽粕、1.2%石粉、1.7%磷酸氢钙、0.5%预混料、0.4%食盐、0.15%蛋氨酸、0.5%赖氨酸、0.2%小苏打及0.2%氯化胆碱;营养水平为:12.34 MJ·kg-1代谢能、20%粗蛋白、1%钙、0.45%有效磷、1.15%赖氨酸、0.54%蛋氨酸。后期(22~24 d)饲粮组成为65.27%玉米、3.5%植物油、16%豆粕、4%棉籽粕、3%玉米蛋白粉、4%菜籽粕、1.1%石粉、1.2%磷酸氢钙、0.5%预混料、0.35%食盐、0.16%蛋氨酸、0.48%赖氨酸、0.24%小苏打及0.2%氯化胆碱;营养水平为:12.97 MJ·kg-1代谢能、18%粗蛋白、0.8%钙、0.35%有效磷、1.05%赖氨酸、0.4%蛋氨酸。其中,代谢能是根据原料组成计算所得(干物质为基础),其他均为实测值。饲养结束后,将180只白羽肉鸡割断颈静脉,放血2 min处死。去内脏,取出鸡胸肉(尽量保护细胞组织)。在宰后0 h和4 ℃下分别成熟12、24、48和72 h后,迅速测定鸡胸肉剪切力并分割成约3.0 g的肉块,于-80 ℃保存,随后进行其他指标的测定。
1.1.2 试剂 DNPH、PIPES、DTNB、乙二胺四乙酸(EDTA)、NaN3、磷酸氢二钾、磷酸二氢钾、盐酸胍、盐酸、氯化钾、Triton-X-100购自天津市光复科技发展有限公司;NaCl、CuSO4·5H2O、NaOH和Na3PO4均为分析纯,购自国药集团有限公司;本试验试剂盒均选用北京索莱宝生物工程所的试剂盒。
1.2 试验方法1.2.1 鸡肉中硒含量的测定 鸡肉中硒含量的测定采用GB 5009.93—2017《食品安全国家标准食品中硒的测定》。
1.2.2 活性氧水平的测定 参照Zhu等[19]的方法。1 g鸡肉样本加入4倍体积预冷缓冲液(10 mmol·L-1 Tris-HCl,10 mmol·L-1蔗糖,0.1 mmol·L-1 EDTA-2 Na,0.8% g·L-1 NaCl,pH7.4),匀浆破碎,匀浆液于3 000×g、4 ℃离心15 min。上清液与等体积的反应缓冲液(10 mmol·L-1 Tris-HCl,10 mmol·L-1蔗糖,0.1 mmol·L-1 EDTA-2 Na,0.8% g·L-1 NaCl,10 μmol·L-1 DCFH-DA,pH 7.4)迅速混合,37 ℃孵育30 min,于激发波长488 nm、发射波长525 nm处测定荧光强度。
1.2.3 谷胱甘肽过氧化物酶活性的测定 谷胱甘肽过氧化物酶活性的测定采用北京索莱宝生物工程所的试剂盒进行测定。
1.2.4 总抗氧化能力的测定 总抗氧化能力活性的测定采用北京索莱宝生物工程所的试剂盒进行测定。
1.2.5 线粒体提取 参照Li等[20]的方法,取2 g鸡胸肉样,剪碎后置于10倍体积的线粒体分离介质中(220 mmol·L-1甘露醇,70 mmol·L-1蔗糖和2.0 mmol·L-1EDTA,5.0 mmol·L-1 4-丙磺酸基吗啉和0.5%BSA,pH 7.4)匀浆。匀浆液于4 ℃、1 000×g离心10 min;取上清液于4 ℃、1 000×g离心10 min;随后在4 ℃,8 000×g离心20 min,所得沉淀即为线粒体。
1.2.6 线粒体膜电位的测定 线粒体膜电位的测定按照北京索莱宝生物工程所的试剂盒并按说明书进行操作。通过JC-1从红色荧光到绿色荧光的转变可以检测到线粒体膜电位的下降。取总蛋白含量为100 μg·mL-1的纯化线粒体加入0.9 mL 5倍稀释的JC-1染色工作液,孵育20 min,然后测定荧光值,红绿荧光强度的比值能够反映线粒体膜电位水平(检测JC-1单体时,可以把激发光设置为490 nm,发射光设置为530 nm;检测JC-1聚合物时,可以把激发光设置为525 nm,发射光设置为590 nm)。
1.2.7 线粒体膜通透性的测定 参考陈骋[21]所述的方法。将10 g鸡肉样本加入100 mL分离液(250 mmol·L-1蔗糖,10 mmol·L-1 Tris-HCl,1 mmol· L-1 EDTA,pH 7.4),于10 000×g匀浆2 min后于1 500×g、4 ℃条件下离心15 min,取上清液于12 000×g、4 ℃条件下离心20 min,沉淀用提取液冲洗两次后与缓冲液(250 mmol·L-1蔗糖,10 mmol·L-1 Tris-HCl,pH 7.4)混合均匀,即得到线粒体悬浮液。采用双缩脲法测定线粒体蛋白的浓度。迅速将稀释好的线粒体溶液300 μL(3 g·L-1) 加入到700 μL测试介质(230 mmol·L-1甘露醇,70 mmol·L-1蔗糖,3 mmol·L-1 HEPES,pH 7.4)中,25 ℃孵育3 min后,于540 nm波长处测定吸光值。3 mL测试介质作为对照,试验过程保证上样量一致。
1.2.8 MPTP开放程度的测定 按照“1.2.5”的方法提取线粒体,使用前用MPTP测试介质(230 mmol·L-1甘露醇、70 mmol·L-1蔗糖、3.0 mmol·L-1Hepes,pH 7.4)稀释至0.3 mg·mL-1蛋白质量浓度。取1 mL定量好的线粒体悬浮液与3 mL MPTP测试介质混合加入到石英杯中,检测540 nm处的吸光度值。
1.2.9 胞浆Cyt-c还原水平的测定 参照Borutaite和Brown[22]的方法,制备胞浆悬液,取一定量的悬液,分别在550 nm和535 nm处测定吸光度,用不同波长下的吸光值之差与蛋白浓度的比值来表示胞浆Cyt-c的还原水平。
1.2.10 Caspase-3/9活性的测定 参考王琳琳等[23]的方法,取160 mg肉样,剪碎后加入1 mL Caspase-3/9裂解液,冰水浴条件下用玻璃匀浆器匀浆30次。匀浆液于4 ℃离心10 min(10 000×g),取上清液待测,用Bradford法测定蛋白浓度。取170 μL Caspase-3/9反应缓冲液,20 μL待测上清液(蛋白原液),10 μL 2 mmol·L-1Caspase-3/9的反应底物DEVD-pNA,依次加入96孔酶标板中,对照孔加入190 μL反应缓冲液,于37 ℃恒温反应2 h,用酶标仪测定405 nm处吸光度值。
1.2.11 肌原纤维小片化指数(MFI)的测定 参考Culler等[24]方法稍作修改。取2 g已修整鸡肉,绞碎,加入20 mL MFI缓冲液(100 mmol·L-1KCl,8.8 mmol·L-1KH2PO4,1 mmol·L-1 EGTA,11.2 mmol·L-1 K2HPO4,1 mmol·L-1 MgCl2,1 mmol·L-1 NaN3),高速匀浆3次,每次20 s(间隔1 min),1 000×g离心15 min。弃去上清液,在沉淀中加入20 mL缓冲液,搅匀,离心1次;取沉淀物加入5 mL缓冲液后搅匀并滤除结缔组织。另用5 mL缓冲液洗涤滤渣。用MFI缓冲液将滤液蛋白配制成(0.5±0.05) mg·mL-1,在540 nm处测定光密度值,将测得数值乘以200即为肌原纤维小片化指数。
1.2.12 剪切力的测定 将样品顺着肌纤维方向切为截面为1 cm×1 cm的3个肉条,嫩度仪垂直肌纤维方向进行剪切,结果取3次剪切力读数的平均值。
1.3 仪器与设备C-LM4嫩度仪购自东北农业大学工程学院;FSH-2A可调高速匀浆机购自江苏省金坛市友联仪器研究所;雷磁PHS-25 pH计购自上海仪电科学仪器股份有限公司;TGL-16MC台式高速冷冻离心机购自湖南湘仪集团;RF-5301PC荧光分光光度计购自日本岛津公司;SP-756P紫外可见分光光度计购自上海美普达仪器有限公司;AFS-230E原子荧光光度计购自上海仪器有限公司。
1.4 数据处理使用Excel 2019计算平均值作为试验数据,用SPSS 20.0对数据进行单因素方差分析及两因子交互作用分析,运用Origin 2018绘制主成分分析双标图及柱状图,差异显著性分析采用邓肯氏新复极差法(P<0.05)。
2 结果 2.1 鸡胸肉中硒含量由表 1可知,宰后0 h,0.3S和0.6S饲喂组鸡胸肉中硒含量均显著高于对照组(P<0.05),分别增加了96%和156%。可见,日粮中添加酵母硒可通过动物自身的代谢和积累有效地在鸡肉中富集,同时存在剂量效应关系。
|
|
表 1 饲喂酵母硒日粮对白羽肉鸡胸肉硒含量的影响 Table 1 The effect of diet supplemented with yeast selenium on the selenium content of white-feathered broiler breast |
由表 2可知,3种饲喂方式下,鸡胸肉中ROS水平在成熟过程中均呈上升趋势,其中,在同一成熟时间点,0.3S和0.6S处理组中鸡胸肉ROS水平显著低于对照组(P<0.05),且在宰后0 h及24~48 h,0.3 mg·kg-1饲喂组ROS水平显著低于0.6 mg·kg-1饲喂组(P<0.05)。说明,日粮中添加酵母硒可以显著降低宰后鸡胸肉的ROS水平,且存在剂量效应关系。
|
|
表 2 饲喂酵母硒日粮对白羽肉鸡胸肉活性氧水平的影响 Table 2 The effect of diet supplemented with yeast selenium on active oxygen level of white-feathered broiler breast |
由表 3可知,随着成熟时间的延长,各饲喂组鸡胸肉GSH-Px活性均呈下降趋势,但是,添加酵母硒的饲喂组鸡胸肉中GSH-Px活性相较于对照组均显著提高,且0.6S组鸡胸肉GSH-Px活性显著高于0.3S组(P<0.05)。表明日粮中添加酵母硒可提高宰后鸡胸肉的GSH-Px活性,且高剂量的酵母硒效果更加显著(P<0.05)。此外,不同浓度的酵母硒添加量与成熟时间对鸡肉中GSH-Px的活性存在极显著交互作用影响(P<0.01)。
|
|
表 3 饲喂酵母硒日粮对白羽肉鸡胸肉谷胱甘肽过氧化物酶活性的影响 Table 3 The effect of diet supplemented with yeast selenium on glutathione peroxidase activity of white-feathered broiler breast |
由表 4可知,3种饲喂方式下,鸡胸肉的总抗氧化能力在成熟过程中均呈下降趋势。0.3S组和0.6S组在宰后0~12 h较对照组鸡胸肉总抗氧化能力均显著提高,且0.6S组显著高于0.3S组(P<0.05),在成熟后期(48~72 h),添加酵母硒的处理组较对照组总抗氧化能力差异不显著。表明,日粮中添加酵母硒可显著提高成熟初期鸡胸肉的总抗氧化能力(P<0.05),且高剂量的酵母硒效果更加显著,在其它时间,添加酵母硒组鸡胸肉的总抗氧化能力相较于对照组有所提高,但差异不显著(P>0.05)。此外,不同酵母硒添加量与成熟时间对鸡胸肉的总抗氧化能力存在极显著交互作用影响(P<0.01)。
|
|
表 4 饲喂酵母硒日粮对白羽肉鸡胸肉总抗氧化能力的影响 Table 4 Effects of diet supplemented with yeast selenium on the total antioxidant capacity of white-feathered broiler breast |
由表 5可知,3种饲喂方式下,鸡胸肉线粒体膜电位在宰后成熟过程中均呈下降趋势,宰后0~72 h,0.3S和0.6S组线粒体膜电位显著高于对照组(P<0.05),且0.6S组显著高于其他两组(P<0.05)。可见,日粮中添加酵母硒可显著提高宰后鸡胸肉的线粒体膜电位,且高剂量的酵母硒效果更加显著。此外,不同酵母硒添加量与成熟时间对鸡胸肉线粒体膜电位的变化存在极显著交互作用影响(P<0.01)。
|
|
表 5 饲喂酵母硒日粮对白羽肉鸡胸肉线粒体膜电位的影响(JC-1单体荧光值/聚集态荧光) Table 5 Effect of diet supplemented with yeast selenium on mitochondrial membrane potential of white-feathered broiler breast (JC-1 monomer fluorescence value/aggregated fluorescence) |
由表 6可知,随着成熟时间的延长,3种饲喂方式下鸡胸肉线粒体膜通透性均呈上升趋势(P<0.05)。除宰后48 h外,0.3S和0.6S组在鸡胸肉线粒体膜通透性显著低于对照组(P<0.05),且除12 h外,0.3S组和0.6S组鸡胸肉线粒体膜通透性差异不显著(P>0.05)。综上,日粮中添加酵母硒可显著降低宰后鸡胸肉的线粒体膜通透性(P<0.05)。
|
|
表 6 饲喂酵母硒日粮对白羽肉鸡胸肉线粒体膜通透性的影响(吸光值) Table 6 Effects of diet supplemented with yeast selenium on mitochondrial membrane permeability of white-feathered broiler breast (absorbance value) |
由表 7可知,3种饲喂方式下,鸡胸肉中线粒体通透性转换孔在宰后成熟过程中逐渐开放(P<0.05),0.3S和0.6S组在宰后0~72 h鸡胸肉中线粒体通透性转换孔的开放程度显著低于对照组(P<0.05)。并且,0.6S组在宰后0~48 h显著低于0.3S组。表明,酵母硒可通过减弱线粒体氧化应激损伤保护线粒体的结构和功能,从而抑制线粒体通透性转换孔的开放,且高剂量的酵母硒效果更加显著。
|
|
表 7 饲喂酵母硒日粮对白羽肉鸡胸肉线粒体通透性转换孔开放程度的影响 Table 7 The effect of diet supplemented with yeast selenium on the opening degree of mitochondrial permeability transition pore of white-feathered broiler breast |
由表 8可知,随着成熟时间的延长,各饲喂组鸡胸肉Cyt-c还原水平均呈下降趋势(P<0.05),0.3S和0.6S处理组Cyt-c还原水平显著高于对照组(P<0.05),且除宰后24 h,0.6S组显著高于0.3S组(P<0.05)。可见,与对照组相比,日粮中添加酵母硒后鸡胸肉表现出更高的Cyt-c还原水平,且高剂量的酵母硒效果更加显著。
|
|
表 8 饲喂酵母硒日粮对白羽肉鸡鸡胸肉Cyt-c还原水平的影响 Table 8 The effect of diet supplemented with yeast selenium on the Cyt-c reduction level of white-feathered broiler breast |
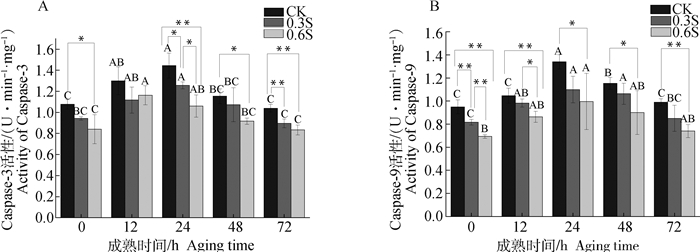
由图 1可知,在3种饲喂方式下,Caspase-3和Caspase-9活性随成熟的进行均呈现先上升后下降的趋势,在宰后24 h酶活性达最大值。其中,酵母硒饲喂组Caspase-3和Caspase-9活性均低于对照组,且0.6 mg·kg-1添加量时的活性更低。综上,日粮中添加酵母硒抑制了鸡肉中Caspase-3和Caspase-9的活性,且高剂量的酵母硒效果更加显著。
|
不同大写字母表示同一饲喂方式下不同成熟时间的差异显著性(P<0.05);对照组和添加酵母硒组在同一成熟时间指标变化差异显著用“*”表示(P<0.05),差异极显著用“**”表示(P<0.01) Different capital letters indicate the significance of the difference in different maturation times under the same feeding method (P < 0.05); the significant difference in index changes between the control group and the yeast-selenium-added group at the same maturity time is indicated by "*"(P < 0.05), The very significant difference is represented by "**"(P < 0.01) 图 1 酵母硒处理对宰后鸡胸肉成熟过程中Caspase-3(A)和Caspase-9(B)活力变化的影响 Fig. 1 The effect of diet supplemented with yeast selenium on the changes of Caspase-3 (A) and Caspase-9 (B) activity during the maturation of chicken breast after slaughter |
由表 9可知,随着成熟的进行,3种饲喂方式下鸡胸肉的MFI值逐渐增大,整体呈现上升的趋势。酵母硒饲喂可显著降低鸡胸肉的MFI值,其中,宰后0和24 h,0.6S组鸡胸肉的MFI值显著低于0.3S组(P<0.05),而在宰后其他的时间点差异不显著(P>0.05)。表明,日粮中添加酵母硒可抑制宰后鸡肉中肌原纤维的降解。
|
|
表 9 饲喂酵母硒日粮对白羽肉鸡鸡胸肉肌原纤维小片化指数的影响 Table 9 The effect of diet supplemented with yeast selenium on the flaking index of white-feathered broiler breast meat myofibril |
由表 10可知,随着成熟时间的延长,3种饲喂方式下鸡肉的剪切力均呈下降趋势(P<0.05)。0.3S组和0.6S组除了宰后24 h外,其余成熟时间点的剪切力值较对照组均显著增加,且0.6S组在宰后0和72 h鸡胸肉的剪切力显著高于0.3S组(P<0.05),这一结果与MFI测定结果一致。说明,酵母硒通过延缓线粒体细胞凋亡进程进一步抑制了其对鸡肉嫩度改善的作用。
|
|
表 10 饲喂酵母硒日粮对白羽肉鸡鸡胸肉剪切力的影响 Table 10 The effect of diet supplemented with yeast selenium on the shearing force of white-feathered broiler breast |
基于线粒体氧化损伤及细胞凋亡酶活性等指标进行主成分分析结果如表 11所示。PC1和PC2分别解释了74.69%和16.32%的方差贡献率,累计达91.01%,基本反映了3种饲喂方式下鸡肉成熟过程中12个相关指标的大部分初始信息。因此,可提取前两个主成分因子进行讨论分析,分析结果如图 2所示。由表 11可得各指标成分载荷,绝对值大者表明主成分与指标相关性较高,正负号表明正相关与负相关。PC1主要综合了ROS、MPTP、线粒体膜电位、线粒体膜通透性、Cyt-c还原水平、T-AOC、Se含量的信息,主要表征宰后鸡胸肉的氧化损伤程度,故将PC1定义为氧化因子;PC2主要综合了Caspase-3和Caspase-9,主要表征鸡胸肉中的凋亡酶的活性,故将PC2定义为凋亡因子。PC1与线粒体转孔开放程度、线粒体膜电位、线粒体膜通透性、Cyt-c还原水平、剪切力、GSH-Px活性、总抗氧化能力及硒含量呈正相关。PC2与Caspase-3和Caspase-9这两个指标的相关性较高。
|
|
表 11 主成分的特征向量、特征值、贡献率及累计贡献率 Table 11 The eigenvectors, eigenvalues, contribution rate and cumulative contribution rate of the principal components |

|
CK表示对照组,CK后面数字1~5分别表示宰后0 h,成熟12、24、48、72 h。0.3S表示日粮添加0.3 mg·kg-1酵母硒组,0.6S表示添加0.6 mg·kg-1酵母硒组 CK means control group, the digit 1-5 behind CK mean 0 h after slaughter and 12, 24, 48, 72 h postmortem, respectively. 0.3S means diet supplemented with 0.3 mg·kg-1 yeast selenium group, 0.6S means adding 0.6 mg·kg-1 yeast selenium group 图 2 主成分分析双标图 Fig. 2 Principal component analysis double plot |
不同饲喂方式下鸡肉成熟过程中硒含量、各个氧化和抗氧化指标及嫩度变化的主成分分析双标图如图 2所示,鸡肉成熟过程中,硒含量、GSH-Px活性、总抗氧化能力、MPTP开放程度、线粒体膜电位、线粒体膜通透性、剪切力及Cyt-c还原水平的变化明显;在成熟的12~24 h,Caspase-3和Caspase-9的活性发生显著变化;而在成熟48~72 h,ROS水平及MFI的值变化明显,这与表 1~10及图 1的结果一致。由图可知,随着成熟时间的延长,各处理组从右上部分,逐渐转移至左下部分,从对应指标来看,鸡肉中硒含量变少、线粒体的氧化程度增大及发生细胞凋亡,肉的嫩度变好;对照组,0.3S组,0.6S组从左至右均匀分布。表明,随着饲粮中酵母硒含量的增加,鸡胸肉中硒含量不断增加,鸡肉的抗氧化性能提高,细胞凋亡酶的活性降低,抑制了鸡肉的嫩化。同时,高剂量的酵母硒减弱线粒体氧化损伤的效果更加显著,存在剂量效应。
3 讨论日粮中添加微量元素硒可以显著提高宰后动物肌肉中硒的沉积。何珍[25]研究发现,日粮中添加有机硒(SeO)可显著提高黄羽肉鸡胸肌中硒的含量,同时,硒的沉积与添加硒的浓度存在剂量效应。此外,Lu等[26]研究发现,日粮中添加0.3 mg·kg-1酵母硒使海兰褐母鸡鸡胸肉的硒含量相较于对照组提高了299.44%。上述研究结果表明,酵母硒饲喂可显著提高宰后鸡肉中硒的含量,这是由于有机硒中的硒代蛋氨酸可渗入蛋白质分子中而在动物体内很好地沉积。本试验研究结果发现,0.3和0.6 mg·kg-1酵母硒处理组较对照组分别提高了96%和156%,可以看出日粮中添加酵母硒可显著提高鸡胸肉中硒的沉积,且存在剂量效应。
宰后动物自身的氧化与抗氧化失衡,过多的ROS积累会导致细胞内部发生一系列氧化应激损伤。弓剑[27]研究发现,日粮中添加0.9 mg·kg-1酵母硒时,奶牛乳腺的抗氧化功能相较于0.6 mg·kg-1时显著降低,这可能是由于低剂量的硒通过提高动物体内的抗氧化酶活性进而有效降低了ROS水平,改善机体的抗氧化功能,且效果随硒浓度的增加而提高。当硒的浓度过量时,可能产生一定的毒性,此时硒不再是发挥清除ROS的作用,还有可能产生更多的ROS,消耗机体的抗氧化酶,从而降低抗氧化能力[28]。本试验中,酵母硒饲喂组鸡胸肉中ROS水平显著低于对照组,同时,日粮中添加0.3 mg·kg-1酵母硒的清除效果优于0.6 mg·kg-1处理组。说明日粮中添加酵母硒可通过抑制细胞过氧化反应显著降低鸡胸肉中ROS水平,进而减弱了线粒体的氧化应激。因此,在一定的剂量范围内,提高日粮中硒的添加水平可显著提高鸡肉的抗氧化功能,但剂量过高可能会产生不利影响。此外,本研究还发现,日粮中添加酵母硒组鸡胸肉的GSH-Px活性在宰后成熟过程中均显著高于对照组,且存在剂量效应,这一结果与樊懿萱等[29]研究发现多不饱和脂肪酸中添加457 mg·kg-1DM酵母硒(即0.75 mg·kg-1硒)可显著提高湖羊肌肉中GSH-Px这一结果一致。这可能是由于硒是GSH-Px的活性成分,而酵母硒饲喂通过提高宰后鸡肉中硒的富集增强了GSH-Px的活性,GSH-Px作为内源性抗氧化酶可参与动物的过氧化防御系统[30],其广泛存在于动物机体,能催化谷胱甘肽(GSH)生成氧化型谷胱甘肽(GSSG),进而保护细胞膜的结构及功能[31]。此外,酵母硒饲喂可显著提高宰后初期鸡胸肉的总抗氧化能力,但随成熟时间的延长虽有提高但并不显著。这可能是由于随着机体代谢的进行,细胞产生过量的ROS会破坏细胞膜的完整性,而动物自身存在酶与非酶抗氧化防御系统保护细胞内环境稳态,但是随着宰后成熟时间的延长,动物的抗氧化能力逐渐下降,自由基大量积累,细胞发生氧化。酵母硒饲喂可通过增加宰后鸡肉中硒蛋白的含量从而提高机体过氧化物酶活性达到清除细胞中过量自由基的效果,间接提高了动物宰后初期对缺氧的耐受程度,降低应激损伤[32]。
细胞凋亡的发生受到诸多因素的影响,其中ROS已被证实为细胞凋亡重要诱因之一[33]。有研究指出,在应激状态下,细胞产生大量ROS,促使线粒体内外膜间的MPTP构象发生改变,各种促凋亡因子从孔道大量释放,最终引发细胞凋亡级联反应[23]。Wang等[34]研究发现,牦牛肉宰后成熟过程中线粒体膜电位显著降低,这与本试验结果一致。而本研究中,在日粮中添加酵母硒对线粒体膜电位和膜通透性均有所改善,且存在剂量效应,提示酵母硒饲喂可通过降低线粒体氧化损伤从而保护线粒体的结构和功能。近期也有研究发现低聚壳聚糖硒加入基础培养液中可通过抑制ROS的产生,显著增加猪肠上皮细胞线粒体膜电位,从而启动细胞内的抗氧化机制[35]。另外,本研究发现,日粮中添加酵母硒可显著抑制MPTP的开放程度,使胞浆中Cyt-c的还原水平显著增强。张彐宁等[36]研究发现,毛蕊异黄酮可显著降低促凋亡蛋白Cyt-c、Caspase-3及Caspase-9的表达,从而显著降低大鼠神经细胞的凋亡水平。这可能是由于酵母硒、毛蕊异黄酮等抗氧化物质可显著抑制促凋亡蛋白Cyt-c的释放进而延缓细胞凋亡的进程。此外,Chen等[37]研究发现,日粮中添加亚硒酸钠可能通过改善海兰褐蛋鸡的氧化应激降低鸡肉Caspase-3的活性,这与本试验发现酵母硒饲喂可显著降低宰后鸡肉Caspase-3及Caspase-9活性这一结果一致,说明加硒日粮通过还原Cyt-c,从而抑制了Caspase-9的激活,进而降低了下游细胞凋亡效应酶Caspase-3的活性。
内源性细胞凋亡酶已被证实可参与宰后肌肉的嫩化[38]。宰后成熟过程是肌肉向肉转化的过程,MFI可以作为反映肌细胞内部纤维及肌原纤维骨架蛋白完整程度的指标[39]。本研究中,在日粮中添加酵母硒可显著降低宰后鸡胸肉的MFI和增加剪切力,这与王琳琳等[40]在牦牛肉中注射茶多酚研究发现茶多酚通过抑制线粒体凋亡途径从而阻碍了肌肉的嫩化这一结果类似。这可能是由于酵母硒饲喂通过其他方式抑制了细胞凋亡酶的活力进而抑制了鸡肉肌原纤维的降解。然而也有研究指出,基础日粮中添加不同浓度的硒(亚硒酸钠形式添加)降低了宰后肉仔鸡腿肌及胸肌剪切力[41],与本研究中鸡肉嫩度发生的变化不同,这可能是由于所取鸡的类型及基础日粮的不同造成试验结果的差异。因此,酵母硒饲喂对宰后肉鸡鸡胸肉嫩度的影响机制还有待进一步研究。
综上,酵母硒饲喂不仅可提高宰后鸡肉的抗氧化能力,同时通过抑制线粒体途径细胞凋亡进而延缓了鸡肉的成熟。
4 结论肉鸡日粮中添加0.3和0.6 mg·kg-1的酵母硒均可显著提高GSH-Px活性及减弱线粒体的氧化损伤,进而保护了线粒体的结构和功能,0.6 mg·kg-1的酵母硒的效果更加显著。此外,本研究发现添加酵母硒延缓了细胞凋亡,一定程度上抑制了肌原纤维蛋白蛋白的降解,从而延缓了因内源酶作用下的鸡肉进一步嫩化,使鸡肉嫩度较好的保持在一个区间。
| [1] |
CAROLINE M, KEMP, et al. Tenderness-An enzymatic view[J]. Meat Sci, 2010, 84(2): 248-256. DOI:10.1016/j.meatsci.2009.06.008 |
| [2] |
STOJNEV S, RISTIC-PETROVIC A, JANKOVIC-VELICKOVIC L. Reactive oxygen species, apoptosis and cancer[J]. Vojnosanit Pregl, 2013, 70(7): 675-678. DOI:10.2298/VSP1307675S |
| [3] |
TWIDDY D, BROWN D G, ADRAIN C, et al. Pro-apoptotic proteins released from the mitochondria regulate the protein composition and Caspase-processing activity of the native Apaf-1/Caspase-9 apoptosome complex[J]. J Biol Chem, 2004, 279(19): 19665-82. DOI:10.1074/jbc.M311388200 |
| [4] |
ASHKENAZI A, DIXIT V M. Death receptors: Signaling and modulation[J]. Science, 1998, 281(5381): 1305-1308. DOI:10.1126/science.281.5381.1305 |
| [5] |
YAO P P. High glucose causes apoptosis of rabbit corneal epithelial cells involving activation of PERK-eIF2α-CHOP-caspase-12 signaling pathway[J]. Int J Ophthalmol, 2019, 12(12): 1815-1822. DOI:10.18240/ijo.2019.12.01 |
| [6] |
KEMP C M, PARR T, BARDSLEY R G, et al. Comparison of the relative expression of caspase isoforms in different porcine skeletal muscles[J]. Meat Sci, 2006, 73(3): 426-431. DOI:10.1016/j.meatsci.2005.12.009 |
| [7] |
CHEN L, FENG X C, LU F, et al. Effects of camptothecin, etoposide and Ca2+ on caspase-3 activity and myofibrillar disruption of chicken during postmortem ageing[J]. Meat Sci, 2011, 87(3): 165-174. DOI:10.1016/j.meatsci.2010.10.002 |
| [8] |
OUALI A, HERRERA-MENDEZ C H, COULIS G, et al. Meat tenderization and muscle cell death: Two highly related events[J]. Tehnologija Mesa, 2007, 48(1-2): 1-15. |
| [9] |
OOI H K, MA L. Modeling heterogeneous responsiveness of intrinsic apoptosis pathway[J]. BMC Syst Biol, 2013, 7(1): 1-18. DOI:10.1186/1752-0509-7-1 |
| [10] |
魏起超. 线粒体损伤对宰后牛肉嫩化的影响[D]. 北京: 中国农业科学院, 2021: 7-8. WEI Q C. Effect of mitochondrial damage on tenderization in postmortem beef muscles[D]. Beijing: Chinese Academy of Agricultural Sciences, 2021: 7-8. (in Chinese) |
| [11] |
王玉龙, 费兆生. 茶叶提取物对肉猪生产性能、肌肉品质及肌肉抗氧化指标的影响[J]. 畜牧与兽医, 2014, 46(12): 50-52. WANG Y L, FEN Z S. Effect of tea extract on production performance, muscle quality and muscle antioxidant indexes of pigs[J]. Animal Husbandry & Veterinary Medicine, 2014, 46(12): 50-52. (in Chinese) |
| [12] |
李月明. 补饲活性干酵母制剂对育肥牛生长性能、屠宰性能、肉质及抗氧化性能的影响[D]. 延边: 延边大学, 2020: 24-25. LI Y M. Effects of live yeast preparation supplementation on growth performance, slaughter performance, meat quality and antioxidant capacity of finishing beef cattle[D]. Yanbian: Yanbian University, 2020: 24-25. (in Chinese) |
| [13] |
高毅刚. 富硒锗酵母对延边黄牛肉贮藏期间品质影响研究[D]. 延边: 延边大学, 2017: 23. GAO Y G. Research on effect of Selenium-germanium enriched yeast on quality of yanbian cattle beef during storage[D]. Yanbian: Yanbian University, 2017: 23. (in Chinese) |
| [14] |
HOOD D A, MEMME J M, OLIVEIRA A N, et al. Maintenance of skeletal muscle mitochondria in health, exercise, and aging[J]. Annu Rev Physiol, 2019, 81: 19-41. DOI:10.1146/annurev-physiol-020518-114310 |
| [15] |
王琳琳. Cyt-c释放和介导宰后牦牛肉线粒体凋亡途径激活机制及对嫩度影响的研究[D]. 兰州: 甘肃农业大学, 2018: 21-27. WANG L L. Study on the effect of cytochrome c release and its mediation mechanism of mitochondrial apoptosis activation on yak meat tenderness during postmortem aging[D]. Lanzhou: Gansu Agricultural University, 2018: 21-27. (in Chinese) |
| [16] |
李文东, 韩玲, 宋仁德, 等. 快速冷却对宰后牦牛肉成熟过程中细胞凋亡酶活力与嫩度的影响[J]. 现代食品科技, 2019, 35(03): 73-79. LI W D, HAN L, SONG R D, et al. The Effect of rapid chilling on tenderness and apoptotic activity during yak meat postmortem Aging[J]. Modern Food Science and Technology, 2019, 35(03): 73-79. (in Chinese) |
| [17] |
孙忠军. 雏鸡口服亚硒酸钠机体抗氧化系统动态变化的研究[J]. 饲料博览, 1999, 11(6): 4-5. SUN Z J. Study on the dynamic changes of body's antioxidant system in chicks oral administration of sodium selenite[J]. Feed Review, 1999, 11(6): 4-5. (in Chinese) |
| [18] |
赵亚伟, 汤加勇, 贾刚, 等. 不同硒源对肉鸡生长性能、血清和肌肉硒含量、抗氧化能力及肉品质的影响[J]. 动物营养学报, 2021, 33(04): 2024-2032. ZHAO Y W, TANG J Y, JIA G, et al. Effects of different selenium sources on growth performance, serum and muscle selenium content, antioxidant capacity and meat quality of broilers[J]. Chinese Journal of Animal Nutrition, 2021, 33(04): 2024-2032. (in Chinese) |
| [19] |
ZHU Z D, REN Z J, FAN X T, et al. Cysteine protects rabbit spermatozoa against reactive oxygen species-induced damages[J]. Plos One, 2017, 12(7): e0181110. DOI:10.1371/journal.pone.0181110 |
| [20] |
LI J X, TONG C W C, XU D Q, et al. Changes in membrane fluidity and lipid peroxidation of skeletal muscle mitochondria after exhausting exercise in rats[J]. Eur J Appl Physiol Occup Physiol, 1999, 80(2): 113-117. DOI:10.1007/s004210050566 |
| [21] |
陈骋. 脂质氧化和抗氧化因子对牦牛肉肌红蛋白稳定性及高铁肌红蛋白还原能力的影响[D]. 兰州: 甘肃农业大学, 2016: 28. CHEN C. Effects of lipid oxidation and antioxidant factors on color stability and metmyoglobin reducing ability of yak muscle[D]. Lanzhou: Gansu Agricultural University, 2016: 28. (in Chinese) |
| [22] |
BORUTAITE V, BROWN G C. Mitochondrial regulation of caspase activation by cytochrome oxidase and tetramethylphenylenediamine via cytosolic cytochrome c redox state[J]. J Biol Chem, 2007, 282(43): 31124-31130. DOI:10.1074/jbc.M700322200 |
| [23] |
王琳琳, 马君义, 余群力, 等. 宰后牦牛肉细胞凋亡对肌肉内环境与嫩度的影响[J]. 农业机械学报, 2017, 48(7): 317-324. WANG L L, MA J Y, YU Q L, et al. Effects of apoptosis on muscle internal environment and tenderness during yak meat postmortem aging[J]. Transactions of the Chinese Society for Agricultural Machinery, 2017, 48(7): 317-324. (in Chinese) |
| [24] |
CULLER R D, SMITH G C, CROSS H R. Relationship of myofibril fragmentation index to certain chemical, physical and sensory characteristeristics of bovine longissimus muscle[J]. J Food Sci, 1978, 43(4): 1177-1180. DOI:10.1111/j.1365-2621.1978.tb15263.x |
| [25] |
何珍. 不同水平硒代甲硫氨酸羟基类似物对黄羽肉鸡肉品质及硒沉积的影响[D]. 雅安: 四川农业大学, 2019: 30. HE Z. Effects of different levels of 2-hydroxy-4 methylselenobutanoic acid supplementation on meat quality and selenium deposition of yellow broilers[D]. Ya'an: Sichuan Agricultural University, 2019: 30. (in Chinese) |
| [26] |
LU J, QU L, SHEN M M, et al. Effects of high-dose selenium-enriched yeast on laying performance, egg quality, clinical blood parameters, organ development, and selenium deposition in laying hens[J]. Poult Sci, 2019, 98(6). |
| [27] |
弓剑. 硒对奶牛乳腺抗氧化功能的影响及其机理研究[D]. 内蒙古农业大学, 2014: 108-109. GONG J. The Effect and underlying mechanism of Selenium on antioxidative function in mammary gland of dairy cows[D]. Inner Mongolia Agricultural University, 2014: 108-109. (in Chinese) |
| [28] |
ZENG H W. Selenium as an Essential Micronutrient: Roles in cell cycle and apoptosis[J]. Molecules, 2009, 14(3): 1263-1278. DOI:10.3390/molecules14031263 |
| [29] |
樊懿萱, 邓凯平, 澹台文静, 等. 多不饱和脂肪酸日粮中添加酵母硒对湖羊脂肪酸组成和抗氧化的影响[J]. 畜牧兽医学报, 2018, 49(8): 1661-1673. FAN Y X, DENG K P, TANTAI W J, et al. Effect of selenium yeast in containing PUFAs dietary on fatty acid composition and antioxidant capacity of Hu Lambs[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(8): 1661-1673. (in Chinese) |
| [30] |
ROTRUCK J T, POPE A L, GANTHER H E, et al. Selenium: biochemical role as a component of glutathione peroxidase[J]. Science, 1973, 179(4073): 588-590. |
| [31] |
寇庆, 梁咪娟, 陶亮亮. 酵母硒对肉鸡组织硒含量及抗氧化能力的影响[J]. 粮食与饲料工业, 2012(01): 48-50. KOU Q, LIANG M J, TAO L L, et al. Effect of selenium yeast on selenium content and antioxidant capacity of broiler tissues[J]. Cereal & Feed Industry, 2012(01): 48-50. (in Chinese) |
| [32] |
杨钰昆, 杨文飞, 常媛媛, 等. 硒对镉胁迫下酿酒酵母抗氧化活性的影响[J]. 食品科学, 2018, 22. YANG Y K, YANG W F, CHANG Y Y, et al. Effects of Selenium on antioxidant activity of saccharomyces cerevisiae under cadmium stress[J]. Food Science, 2018, 22. (in Chinese) |
| [33] |
FRANCESCO ADDABBO, MONICA MONTAGNANI, GOLIGORSKY MICHAEL S.. Mitochondria and reative oxygen species[J]. Hypertension, 2009, 47(4): 333-343. |
| [34] |
WANG L L, MA G Y, ZHANG Y B, et al. Effect of mitochondrial cytochrome c release and its redox state on the mitochondrial-dependent apoptotic cascade reaction and tenderization of yak meat during postmortem aging[J]. Food Res Int, 2018, 111: 488-497. |
| [35] |
傅春妮, 李元辉, 李鹏程, 等. 低聚壳聚糖硒抵抗玉米赤霉烯酮诱导猪肠上皮细胞氧化损伤和内质网应激的作用研究[J]. 动物营养学报, 2021, 33(09): 5226-5235. FU C N, LI Y H, LI P C, et al. Study on the effect of oligo-chitosan selenium against zearalenone-induced oxidative damage and endoplasmic reticulum stress in porcine intestinal epithelial cells[J]. Chinese Journal of Animal Nutrition, 2021, 33(09): 5226-5235. (in Chinese) |
| [36] |
张彐宁, 高维娟, 周晓红, 等. 毛蕊异黄酮通过调控细胞色素C/凋亡酶激活因子1凋亡信号通路减轻大鼠脑缺血/再灌注损伤[J]. 解剖学报, 2021, 52(4): 536-542. ZHANG J N, GAO W J, ZHOU X H, et al. Effect of calycosin in reducing cerebral ischemia/reperfusion injury in rats by regulating cytochrome C/apoptotic protease activating factor-1 apoptosis signal pathway[J]. Acta Anatomica Sinica, 2021, 52(4): 536-542. (in Chinese) |
| [37] |
CHEN M, LI X, FAN R, et al. Selenium antagonizes cadmium-induced apoptosis in chicken spleen but not involving Nrf2-regulated antioxidant response[J]. Ecotoxicol Environ Saf, 2017, 145: 503-510. |
| [38] |
OUALI A, HERRERA-MENDEZ C H, COULIS G, et al. Revisiting the conversion of muscle into meat and the underlying mechanisms[J]. Meat Sci, 2006, 74(1): 44-58. |
| [39] |
TAYLOR RICHARD G., GEESINK, GEERT H., THOMPSON, et al. Is Z-disk degradation responsible for postmortem tenderization?[J]. J Anim Sci, 1995, 73: 1351-1367. |
| [40] |
王琳琳, 陈炼红, 韩玲, 等. 茶多酚对宰后牦牛肉线粒体细胞凋亡和肌肉嫩度的影响[J]. 农业机械学报, 2019, 50(10): 352-359+366. WANG L L, CHEN L H, HAN L, et al. Effects of tea polyphenols on mitochondrial apoptosis and meat tenderness in post-mortem yak meat[J]. Transactions of the Chinese Society for Agricultural Machinery, 2019, 50(10): 352-359+366. (in Chinese) |
| [41] |
王丽赛, 廖秀冬, 冯艳忠, 等. 日粮硒水平对22~42日龄肉仔鸡生长性能及肉品质的影响[J]. 中国畜牧兽医, 2020, 47(07): 2063-2070. WANG L S, LIAO X D, FENG Y Z, et al. Effect of dietary Selenium level on growth performance and meat quality of broilers from 22 to 42 days of age[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(07): 2063-2070. (in Chinese) |
(编辑 范子娟)



