2. 西北农林科技大学动物科技学院,杨凌 712100;
3. 西藏自治区农牧科学院畜牧兽医研究所,拉萨 850000;
4. 西藏藏牧合创农牧科技有限公司,林芝 860000
2. College of Animal Science and Technology, Northwest A&F University, Yangling 712100, China;
3. Institute of Animal Husbandry and Veterinary Medicine, Tibet Academy of Agricultural and Animal Husbandry Sciences, Lhasa 850000, China;
4. Tibet Tibet-Animal Husbandry He Chuang Agricultural and Animal Husbandry Technology Limited Company, Linzhi 860000, China
藏猪在青藏高原的高山、峡谷、草地中经历了数万年的自然选择,具备适应野外低劣生存环境的能力[1]。藏猪是目前依然以放牧养殖为主要养殖手段的少数猪种之一,生存环境多样,食物来源广泛,但极易受到季节和人类活动的影响。长期以来,藏猪的食物主要为植物性的牧草、树叶、根茎等,纤维类物质含量较高,促使藏猪发育出了类似草食动物消化器官的发达大肠。藏猪盲肠[2]和结肠[3]内微生物含量丰富,多样性高,多种微生物与其优质特性特别是纤维降解特性紧密相关。研究发现,藏猪体内存在大量的纤维降解菌,通过培养得到了一系列高产纤维素酶的细菌[4]。
目前,还没有一个相对统一的指标来定义耐粗饲特性,已有研究多以动物对饲粮中纤维的降解能力来表示[5]。前期研究表明,放牧藏猪消化饲粮粗纤维的能力较舍饲养殖的猪强,并与肠道中纤维酶、半纤维素酶[6]以及粪便真菌[7]关系密切,但与粪便中细菌的关系还可进一步研究。本研究饲喂放牧藏猪、舍饲藏猪与DLY猪同一高纤维饲粮,比较不同猪对饲粮纤维表观消化率的差异,采用单分子实时测序技术,测定粪便细菌16S rRNA基因全长序列,初步了解放牧藏猪、舍饲藏猪与DLY猪粪便中细菌结构与多样性,剖析藏猪对饲粮纤维的消化与粪便中细菌群落的相关性,为最终揭示3个类型猪对饲粮纤维消化差异的机理以及深入开发藏猪资源提供多方面的技术资料。
1 材料与方法 1.1 试验动物1.1.1 放牧藏猪 生长于青藏高原典型藏猪放养场所(高寒草地、森林与河谷),150 d,全程放牧养殖,以摄食牧草、树叶等纤维含量高的食物为主。
1.1.2 舍饲藏猪与DLY猪 舍饲藏猪由西藏藏牧合创农牧科技有限公司提供,DLY猪由西藏林芝市巴宜区宇高农业生态有限公司提供。断奶后,将舍饲藏猪与DLY猪分别养殖于西藏农牧学院动物实验舍至150 d,全程饲喂不含抗生素的配合饲料。
1.2 试验设计试验采用单因素试验设计,设3个处理,分别为放牧藏猪组(GTP)、舍饲藏猪组(CTP)与DLY猪组(DLY),每组10个重复,每个重复1头猪。
1.3 试验饲粮试验各处理组均饲喂同一饲粮,饲粮配制以本课题组前期研究为基础,参考NY/T 65—2004猪饲养标准中“肉脂型生长肥育猪每千克饲粮养分含量(一型标准)”[8],饲粮组成与营养水平见表 1。
|
|
表 1 饲粮组成及营养水平(饲喂基础) Table 1 Composition and nutrient level of diet (as-fed basis) |
动物饲养试验在西藏农牧学院动物实验舍内进行,共计进行15 d,其中预饲期10 d,正式试验期5 d,每天08:00、12:00与18:00喂料3次,收集损失料并记录,自由采食与饮水。试验期间,实验舍温度维持在16~21 ℃,相对湿度维持在55%~70%。试验开始前对猪只进行免疫与驱虫,按照猪场常规饲养管理程序进行管理。
1.5 指标测定1.5.1 饲粮纤维表观消化率 在正式试验期内,按重复每天定时收集粪便,试验结束后制备得到分析样品。测定藏猪饲粮与粪便样品中性洗涤纤维[9]、酸性洗涤纤维[10]、酸性洗涤木质素[11]与盐酸不溶灰分[12]含量,计算半纤维素与纤维素的含量,采用指示剂法计算饲粮纤维表观消化率,公式为:
| $ \;\;\;\;\;\;\;\;半纤维素的含量(\%)=中性洗涤纤维的含量-\\酸性洗涤纤维的含量 $ |
| $ \;\;\;\;\;\;\;\;纤维素的含量(\%)=酸性洗涤纤维的含量-样\\品经72\%硫酸溶液处理后的残渣 $ |
| $ \;\;\;\;\;\;\;\;饲粮纤维的表观消化率(\%)=100\%-(饲粮中\\盐酸不溶灰分的含量/ 粪便中盐酸不溶灰分的含量)× \\(粪便中纤维的含量/饲粮中纤维的含量)×100\%。$ |
1.5.2 粪便细菌高通量测序 每个处理分别选取6头猪排出的干净粪便,采集内部粪样装入冻存管中,液氮速冻,-80 ℃冰箱中保存待测。将装有粪便样品的冻存管采用干冰冷冻运输至上海派森诺生物科技有限公司进行检测分析。提取细菌总DNA,检测提取DNA的数量和质量。采用正向引物27F(5′-AGAGTTTGATCMTGGCTCAG-3′)和反向引物1 492R(5′-ACCTTGTTACGACTT-3′)对细菌16S rRNA基因全长序列进行两步PCR扩增,并在第二步PCR中将样品特异性的16 bp Barcode插入正向引物和反向引物中。扩增体系为:将细菌基因组总DNA统一稀释到20 ng·μL-1,两步PCR的扩增体系(25 μL)均包括5 μL Q5反应缓冲液(5×),5 μL Q5高保真GC缓冲液(5×),0.25 μL Q5高保真DNA聚合酶(5 U·μL-1),2 μL dNTPs(2.5 mmol·L-1),1 μL正向引物(10 μmol· L-1),1 μL反向引物(10 μmol·L-1),2 μL DNA模板,8.75 μL ddH2O。扩增方法为:首先在98 ℃预变性2 min,然后分别做25/10循环,具体为98 ℃扩增30 s,55 ℃退火30 s,72 ℃延伸90 s,循环结束后分别在72 ℃延伸5 min。PCR扩增物进行纯化和定量后,制备测序文库。将等量聚合扩增子利用PacBio Sequel三代测序平台进行单分子实时测序。
1.6 数据统计与分析对PacBio测序的原始下机数据使用CCS软件进行处理获得原始fastq序列,对问题样本进行重测、补测。CCS序列按照Barcode信息,进行样本划分,并去除barcode序列;同时根据引物信息将反向互补序列转置为正向序列。按照改进后适用于PacBio的QIIME2 dada2分析流程[13]以及Vsearch软件的分析流程[14]进行序列去噪或OTU聚类,并进行深度设为最低样本序列量95%的抽平处理。采用QIIME2(2019.4)软件[15]的自编perl脚本通过对去除singleton后的特征表进行统计,实现各样本在门、纲、目、科、属、种六个分类水平上组成分布的可视化,用UNITE数据库(Release 8.0,https://unite.ut.ee/)[16]进行物种分类学注释与物种组成分析,将相对丰度大于1%的细菌群落与饲粮纤维表观消化率在派森诺云平台(https://www.genescloud.cn/,上海派森诺生物科技有限公司)进行Spearman相关性分析、RDA冗余分析与关联网络分析。
纤维表观消化率数据采用SPSS 21.0软件进行单因素方差分析,并采用Duncan’s法进行多重比较,P值小于0.05差异显著,P值大于0.05差异不显著。
2 结果 2.1 饲粮纤维表观消化率由图 1可见,放牧藏猪对纤维类营养物质的表观消化率显著高于舍饲藏猪与DLY猪(P < 0.05),其中半纤维素表观消化率分别比舍饲藏猪和DLY猪高12.77%和13.74%,纤维素表观消化率分别高24.49%和35.93%。以上数据说明,放牧养殖的藏猪对饲粮纤维类物质(半纤维素和纤维素)的消化能力更强;当藏猪舍饲养殖时,其对纤维类物质的消化率与DLY猪相比并没有明显的差异。

|
图 1 放牧藏猪、舍饲藏猪与DLY猪对饲粮纤维的表观消化率 Fig. 1 Apparent digestibility of dietary fibre of grazing Tibetan pigs, captive Tibetan pigs and DLY pigs |
通过高通量测序技术,对3个处理18个粪便样本的16S rRNA基因全长测序共获得了142 569条有效序列,其中放牧藏猪44 817条、舍饲藏猪50 531条、DLY猪47 221条,平均长度为1 588.21 bp。通过分析样本在门、纲、目、科、属、种6个分类水平的结果,共鉴定出15个门、26个纲、48个目、87个科、190个属、419个种,其中放牧藏猪共分为12个门、22个纲、39个目、67个科、145个属、315个种,舍饲藏猪共分为13个门、20个纲、33个目、58个科、134个属、285个种,DLY猪共分为13个门、22个纲、32个目、56个科、130个属、292个种。将相对丰度大于1%的细菌类群进行汇总与显著性统计,结果见图 2与表 2。

|
图 2 放牧藏猪、舍饲藏猪与DLY猪各分类水平主要细菌类群的相对丰度 Fig. 2 The relative abundances of major bacterial groups at different taxonomic levels of grazing Tibetan pigs, captive Tibetan pigs and DLY pigs |
|
|
表 2 放牧藏猪、舍饲藏猪与DLY猪各分类水平差异细菌类群组成分析 Table 2 Analysis of bacterial groups of the differences among various taxonomic levels of grazing Tibetan pigs, captive Tibetan pigs and DLY pigs |
由图 2可见,厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)是3个类型猪粪便中细菌的优势菌门,分别占放牧藏猪的38.62%、42.72%,舍饲藏猪的52.37%、38.40%,DLY猪的49.16%、43.76%。在纲水平相对丰度最高的3个类群分别是拟杆菌纲(Bacteroidia)、梭菌纲(Clostridia)、Negativicutes,其中放牧藏猪分别是40.85%、29.86%、7.35%,舍饲藏猪分别是35.84%、45.71%、3.62%,DLY猪分别是42.88%、38.99%、8.34%。在目水平,放牧藏猪相对丰度最高的3个类群分别是拟杆菌目(Bacteroidales)40.85%、梭菌目(Clostridiales)29.84%、螺旋体目(Spirochaetales)5.28%,舍饲藏猪分别是拟杆菌目(Bacteroidales)35.84%、梭菌目(Clostridiales)45.50%、乳杆菌目(Lactobacillales)3.04%,DLY猪分别是拟杆菌目(Bacteroidales)42.88%、梭菌目(Clostridiales)38.98%、Selenomonadales 4.83%。在科水平,放牧藏猪相对丰度最高的3个类群分别是普雷沃氏菌科(Prevotellaceae)23.58%、瘤胃菌科(Ruminococcaceae)9.04%、紫单胞菌科(Porphyromonadaceae)8.86%,舍饲藏猪分别是普雷沃氏菌科(Prevotellaceae)16.34%、瘤胃菌科(Ruminococcaceae)9.66%、拟杆菌科(Bacteroidaceae)9.26%,DLY猪分别是普雷沃氏菌科(Prevotellaceae)27.84%、瘤胃菌科(Ruminococcaceae)8.44%、拟杆菌科(Bacteroidaceae)7.78%。在属水平,放牧藏猪相对丰度最高的3个类群分别是普氏菌属(Prevotella)19.55%、拟杆菌属(Bacteroides)7.01%、密螺旋体属(Treponema)4.03%,舍饲藏猪分别是普氏菌属(Prevotella)14.13%、拟杆菌属(Bacteroides)9.26%、颤杆菌克属(Oscillibacter)6.94%,DLY猪分别是普氏菌属(Prevotella)24.74%、拟杆菌属(Bacteroides)7.78%、颤杆菌克属(Oscillibacter)6.90%。在种水平,放牧藏猪相对丰度最高的3个类群分别是Prevotella copri 4.17%、Prevotella buccalis 4.22%、Gemmiger formicilis 3.07%,舍饲藏猪分别是Oscillibacter valericigenes 5.29%、Eubacterium coprostanoligenes 5.69%、Bacteroides coprophilus 4.25%,DLY猪分别是Oscillibacter valericigenes 5.51%、Prevotella copri 8.15%、Prevotella buccalis 5.63%。
显著性分析表明(表 2),在门水平放牧藏猪变形菌门(Proteobacteria)、纤维杆菌门(Fibrobacteres)与变形菌门(Proteobacteria)显著高于舍饲藏猪与DLY猪(P < 0.05),而厚壁菌门(Firmicutes)则呈相反趋势,显著低于舍饲藏猪与DLY猪(P < 0.05),其余菌门无显著差异(P>0.05)。在纲水平,放牧藏猪纤维杆菌纲(Fibrobacteria)、丙型变形菌纲(Gammaproteobacteria)显著高于舍饲藏猪与DLY猪(P < 0.05),梭菌纲(Clostridia)显著低于舍饲藏猪与DLY猪(P < 0.05);舍饲藏猪梭菌纲(Clostridia)、δ变形菌纲(Deltaproteobacteria)显著高于放牧藏猪与DLY猪(P < 0.05),Negativicutes显著低于放牧藏猪与DLY猪(P < 0.05)。在目水平,放牧藏猪纤维杆菌目(Fibrobacterales)、气单胞菌目(Aeromonadales)显著高于舍饲藏猪与DLY猪(P < 0.05),梭菌目(Clostridiales)显著低于舍饲藏猪与DLY猪(P < 0.05);舍饲藏猪梭菌目(Clostridiales)、脱硫弧菌目(Desulfovibrionales)显著高于放牧藏猪与DLY猪,氨基酸球菌目(Acidaminococcales)显著低于放牧藏猪与DLY猪(P < 0.05);DLY猪Selenomonadales显著高于藏猪(P < 0.05)。在科水平,放牧藏猪纤维杆菌科(Fibrobacteraceae)、琥珀酸弧菌科(Succinivibrionaceae)显著高于舍饲藏猪与DLY猪(P < 0.05),颤螺菌科(Oscillospiraceae)、梭菌科(Clostridiaceae)显著低于舍饲藏猪与DLY猪(P < 0.05);舍饲藏猪优杆菌科(Eubacteriaceae)、Clostridiales Family XIII. Incertae Sedis、脱硫弧菌科(Desulfovibrionaceae)显著高于放牧藏猪与DLY猪(P < 0.05),普雷沃氏菌科(Prevotellaceae)、氨基酸球菌科(Acidaminococcaceae)显著低于放牧藏猪与DLY猪(P < 0.05);DLY猪Selenomonadaceae显著高于舍饲藏猪(P < 0.05),紫单胞菌科(Porphyromonadaceae)显著低于藏猪(P < 0.05)。在属水平,放牧藏猪拟普雷沃菌属(Alloprevotella)、纤维杆菌属(Fibrobacter)、Sphaerochaeta、琥珀酸弧菌属(Succinivibrio)显著高于舍饲藏猪与DLY猪(P < 0.05),颤杆菌克属(Oscillibacter)、梭菌属(Clostridium)、Intestinimonas、瘤胃梭菌属(Ruminiclostridium)显著低于舍饲藏猪与DLY猪(P < 0.05),瘤胃球菌属(Ruminococcus)显著低于舍饲藏猪(P < 0.05);舍饲藏猪优杆菌属(Eubacterium)、Anaerovorax、假丁酸弧菌属(Pseudobutyrivibrio)、脱硫弧菌属(Desulfovibrio)显著高于放牧藏猪与DLY猪(P < 0.05),普氏菌属(Prevotella)、考拉杆菌属(Phascolarctobacterium)显著低于放牧藏猪与DLY猪(P < 0.05);DLY猪月形单胞菌属(Selenomonas)显著高于藏猪(P < 0.05),卟啉单胞菌属(Porphyromonas)显著低于藏猪(P < 0.05),Sporobacter显著低于舍饲藏猪(P < 0.05)。在种水平,放牧藏猪Alloprevotella rava、Fibrobacter intestinalis、Succinivibrio dextrinosolvens相对丰度显著高于舍饲藏猪与DLY猪(P < 0.05),Oscillibacter valericigenes、Intestinimonas butyriciproducens、Oscillibacter ruminantium、Streptococcus alactolyticus相对丰度显著低于舍饲藏猪与DLY猪(P < 0.05);舍饲藏猪Eubacterium coprostanoligenes、[Ruminococcus] gnavus、Ruminococcus gauvreauii、Anaerovorax odorimutans、Pseudobutyrivibrio ruminis、Desulfovibrio piger相对丰度显著高于放牧藏猪与DLY猪(P < 0.05),Phascolarctobacterium succinatutens、Treponema porcinum相对丰度显著低于放牧藏猪与DLY猪(P < 0.05),Prevotella copri相对丰度显著低于放牧藏猪(P < 0.05);DLY猪Selenomonas bovis相对丰度显著高于藏猪(P < 0.05),Porphyromonas pasteri相对丰度显著低于藏猪(P < 0.05),Sporobacter termitidis相对丰度显著低于舍饲藏猪(P < 0.05)。
2.3 粪便细菌群落与饲粮纤维表观消化率的相关性Spearman相关性分析发现,在门水平(图 3),粪便纤维杆菌门(Fibrobacteres)与饲粮纤维素和半纤维素表观消化率呈显著正相关(P < 0.05),疣微菌门(Verrucomicrobia)与半纤维素表观消化率呈显著正相关(P < 0.05);厚壁菌门(Firmicutes)与饲粮纤维消化呈负相关,其中与半纤维素表观消化率呈显著负相关(P < 0.05)。

|
红色表示正相关,蓝色表示负相关;“×”表示未达到显著相关水平(P>0.05)。下图同 Red indicates positive correlation, blue indicates negative correlation. "×" means no significant correlation (P>0.05). The same as below 图 3 饲粮纤维表观消化率与门水平粪便细菌群落相对丰度的相关性 Fig. 3 Correlation between apparent digestibility of dietary fibre and relative abundance of faecal bacterial community at phylum level |
在属水平(图 4),琥珀酸弧菌属(Succinivibrio)与半纤维素的表观消化率呈显著正相关(P < 0.05),拟普雷沃菌属(Alloprevotella)与纤维素的表观消化率呈显著正相关(P < 0.05),纤维杆菌属(Fibrobacter)与半纤维素和纤维素的表观消化率呈显著正相关(P < 0.05);链球菌属(Streptococcus)、瘤胃梭菌属(Ruminiclostridium)、脱硫肠状菌属(Desulfotomaculum)和Intestinimonas与半纤维素的表观消化率呈显著负相关(P < 0.05),颤杆菌克属(Oscillibacter)与半纤维素和纤维素的表观消化率呈显著负相关(P < 0.05)。

|
图 4 饲粮纤维表观消化率与属水平粪便细菌群落相对丰度的相关性 Fig. 4 Correlation between apparent digestibility of dietary fibre and relative abundance of faecal bacterial community at genus level |
在种水平(图 5),Bacteroides plebeius、Succinivibrio dextrinosolvens与半纤维素的表观消化率呈显著正相关(P < 0.05),Alloprevotella rava与纤维素的表观消化率呈显著正相关(P < 0.05),Fibrobacter intestinalis与纤维素和半纤维素的表观消化率呈显著正相关(P < 0.05);Bacteroides coprophilus、Intestinimonas butyriciproducens、[Ruminococcus] gnavus、Ruminococcus gauvreauii、Lactobacillus reuteri、Streptococcus alactolyticus、Desulfotomaculum tongense与半纤维素表观消化率呈显著负相关(P < 0.05),Clostridium disporicum、Christensenella minuta与纤维素和半纤维素的表观消化率呈显著负相关(P < 0.05)。

|
图 5 饲粮纤维表观消化率与种水平粪便细菌群落相对丰度的相关性 Fig. 5 Correlation between apparent digestibility of dietary fibre and relative abundance of faecal bacterial community at species level |
通过RDA分析,研究了粪便细菌群落与饲粮纤维表观消化率的关系(图 6)。基于不同类型猪的RDA分析结果显示(图 6A)RDA1和RDA2共同解释了总体变化的11.36%,基于藏猪不同养殖环境的RDA分析结果显示(图 6B)RDA1和RDA2共同解释了总体变化的21.31%,基于相同养殖环境的不同猪种间的RDA分析结果显示(图 6C)RDA1和RDA2共同解释了总体变化的15.14%,基于猪种与环境交互作用间的RDA分析结果显示(图 6D)RDA1和RDA2共同解释了总体变化的17.21%。饲粮半纤维素与纤维素表观消化率间呈正相关关系;同一猪种不同养殖环境RDA分析表明,放牧养殖促进了藏猪对饲粮中纤维类物质的消化;不同品种猪间的RDA分析表明,藏猪具有更高的消化饲粮纤维的潜力;3个类型猪的RDA分析表明,放牧藏猪更能消化饲粮中的纤维类物质。
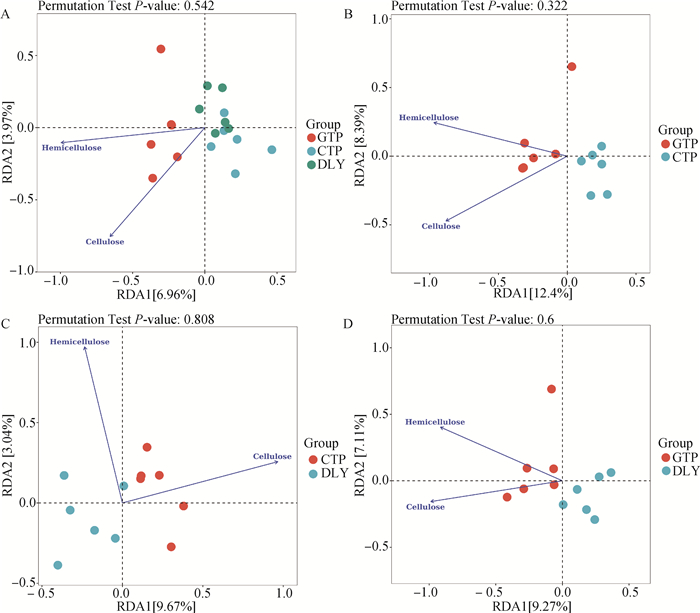
|
图 6 粪便细菌群落与饲粮纤维表观消化率的RDA分析 Fig. 6 Redundancy analysis of faecal bacterial community and apparent digestibility of dietary fibre |
根据OTU或各分类单元在不同样本中的丰度分布,可以寻找彼此之间呈现正相关或负相关的微生物类群,进而构建优势微生物类群的关联网络,探索它们彼此相关的生态学意义。在种水平,在|r|>0.7的阈值条件下,关联网络分析(图 7)共显示出6个不同的模块单元,34个节点。模块1包括Terrisporobacter mayombei、Intestinimonas butyriciproducens、Clostridium disporicum、Prevotella oris、Succinivibrio dextrinosolvens、Bacteroides coprophilus、Christensenella minuta、Fibrobacter intestinalis、Streptococcus alactolyticus、Oscillibacter valericigenes 10种细菌,17个边;模块2包括Prevotella loescheii、Selenomonas bovis、Treponema porcinum、Barnesiella viscericola、Desulfovibrio piger、Lactobacillus reuteri、Eubacterium coprostanoligenes 7种细菌,13个边;模块3包括Sporobacter termitidis、Treponema bryantii、Anaerovibrio lipolyticus、Prevotella copri、Akkermansia muciniphila、Porphyromonas pasteri 6种细菌,5个边;模块4包括Anaerovorax odorimutans、Parabacteroides distasonis 2种细菌,1个边;模块5包括Phascolarctobacterium succinatutens、Ruminococcus champanellensis、Gemmiger formicilis、Ruminococcus gauvreauii、[Ruminococcus] gnavus、Desulfotomaculum tongense、Alloprevotella rava 7种细菌,8个边;模块6包括Roseburia hominis、Pseudobutyrivibrio ruminis 2种细菌,1个边。与饲粮纤维降解相关的Succinivibrio dextrinosolvens、Alloprevotella rava、Fibrobacter intestinalis与其他细菌间均为负相关关系,Succinivibrio dextrinosolvens与Fibrobacter intestinalis间呈正相关关系。

|
图 7 粪便细菌群落种水平关联网络分析 Fig. 7 Analysis of association network of faecal bacterial community at species level |
饲粮纤维通常认为是饲料中不能被动物内源消化酶所消化的植物细胞壁内的物质[17],对饲粮中营养物质的消化呈负面作用[18]。饲料中的营养物质被机体分泌的各种消化酶类所消化,小肠是猪最主要的消化场所,蛋白质、脂类和碳水化合物大部分都在小肠内消化吸收,未被小肠消化的物质特别是纤维类物质进入大肠,被大肠内的微生物所利用[19]。地方猪种被认为具有较高的耐粗饲特性[5],但耐粗饲特性还没有统一的指标来衡量,对纤维的消化率是常用的指标之一。有研究表明,生长肥育期松辽黑猪对饲粮中粗纤维、中性洗涤纤维、酸性洗涤纤维的消化率分别为57.39%、60.15%、64.42%[20]。体重30~40 kg梅山猪对粗纤维含量为3%的饲粮中粗纤维的消化率为47.8%,显著高于长白猪的36.4%;对粗纤维含量为11%的饲粮中粗纤维的消化率为22.0%,高于长白猪的18.1%[21]。饲粮粗纤维水平为8%时,民猪对粗纤维的消化率为38%,显著高于哈白猪的13%[22]。二花脸猪对用7%的麸皮替代基础日粮后的饲粮纤维表观消化率显著高于大白猪[23]。以上研究和本试验的结果一致。本试验通过试验猪对饲料中纤维类物质(半纤维素和纤维素)消化率的研究发现,放牧养殖的藏猪具备更好地消化纤维的能力。
但也有研究表明,在限量饲喂,采食量均为700 g的情况下,梅山猪对含35%苜蓿草粉的高纤维饲粮中半纤维素的消化率显著低于瘦肉型猪种,对纤维素的消化率与瘦肉型猪种近似[24]。这与传统认为地方猪种消化纤维能力强的观点不一致,原因可能包含两个方面:一是限量饲喂并不一定能够完全反应猪的实际消化能力;二是猪对饲粮纤维的消化主要由微生物完成,相同饲养环境下,不同猪种肠道中的微生物群落相似度高,由此可推测微生物并不是决定饲粮纤维消化的唯一因素。这与本研究的结果是相符的,在本试验条件下,全阶段舍饲养殖的藏猪对饲粮纤维的消化率与DLY猪基本一致。
3.2 猪对饲粮纤维的消化与粪便细菌的相关性分析纤维素是植物细胞壁的主要结构成分,约占植物干重的35%~50%[25]。光合作用过程产生大量的植物生物量,从而产生纤维素,这些纤维素必须被存在于土壤、海洋和湖泊沉积物、水和动物肠道中的纤维素分解微生物降解。纤维素水解可在好氧和厌氧条件下发生,厌氧水解占全球纤维素降解的5%~10%[26],鉴于环境中存在纤维素生物量的巨大数量,这是相当可观的。大多数的纤维素分解微生物要么利用游离纤维素酶机制[27],即多种分泌的酶协同作用;要么利用与外壁(纤维素体)结合的纤维素分解酶复合物来消化纤维素[28]。通过无细胞酶机制进行纤维素水解的模型是基于需氧真菌里氏木霉的纤维素酶系统,厌氧细菌和真菌的“纤维素体”机制是基于纤维素分解梭状芽孢杆菌的机制[25]。纤维杆菌门(Fibrobacteres)目前包括一个正式属纤维杆菌属(Fibrobacter)和两个厌氧培养种(Fibrobacter succinate和Fibrobacter intestinalis),它们被认为是草食动物胃肠道中纤维素物质的主要降解菌[29]。Fibrobacter succinate主要存在于瘤胃,Fibrobacter intestinalis主要存在肠道中[30]。研究表明,对饲粮纤维消化率高的苏淮猪粪便中纤维杆菌属(Fibrobacter)显著高于低纤维消化率的苏淮猪[23]。本研究中,藏猪粪便中纤维杆菌门(Fibrobacteres)、纤维杆菌属(Fibrobacter)和Fibrobacter intestinalis的相对丰度为2.48%,远远高于舍饲藏猪和DLY猪的含量,说明纤维杆菌门(Fibrobacteres)内的细菌为藏猪提供了降解饲粮纤维的动力。
拟普雷沃菌属(Alloprevotella)是专性厌氧、无芽胞、无动力的革兰阴性杆菌,是产短链脂肪酸的菌属,发酵碳水化合物的终末代谢产物是中等水平的乙酸和大量的琥珀酸,在维持肠道上皮屏障和增强肠道免疫功能方面发挥着关键作用[31]。Alloprevotella rava是拟普雷沃菌属(Alloprevotella)下的种,在PYG肉汤培养基的终末代谢产物主要是琥珀酸和中等量的乙酸[32]。拟普雷沃菌属(Alloprevotella)与饲粮纤维的消化密切相关,在优良地方猪种苏姜猪[33]和金华猪[34]的盲肠微生物中含量丰富,为优势菌属,相对丰度随着饲粮纤维水平的升高而不断升高[34]。有研究表明,拟普雷沃菌属(Alloprevotella)与恩施黑猪和版纳微型猪生产性能呈显著正相关[35]。妊娠后期摄入高不可溶纤维饲粮,可以提高母猪粪便中拟普雷沃菌属(Alloprevotella)的相对丰度[36]。放牧藏猪粪便中拟普雷沃菌属(Alloprevotella)与Alloprevotella rava高于舍饲藏猪与DLY猪,说明其具有更高的纤维降解能力。
琥珀酸弧菌属(Succinivibrio)可发酵多种碳水化合物,主要的代谢终产物是乙酸和琥珀酸及少量的甲酸和乳酸[37],其模式种也是唯一种是Succinivibrio dextrinosolvens。饲粮中添加低分子壳聚糖[38]、果胶[39]和乳酸[40]可以增加断奶仔猪肠道中琥珀酸弧菌属(Succinivibrio)相对丰度;麦麸饲粮可增加生长猪粪便中琥珀酸弧菌属(Succinivibrio)的相对丰度[41];可溶性纤维饲粮可提高断奶仔猪结肠中琥珀酸弧菌属(Succinivibrio)相对丰度。以上研究说明,琥珀酸弧菌属(Succinivibrio)有利于猪对饲粮纤维的降解,这与本试验结果是一致的。但也有研究表明,与饲喂含有90%青粗饲料日粮的舍饲藏猪相比,全程饲喂精饲料的瘦肉型猪粪便中琥珀酸弧菌属(Succinivibrio)相对丰度更高[42];约克夏猪粪便中琥珀酸弧菌属(Succinivibrio)相对丰度比藏猪和荣昌猪更高[43],这与本研究是不一致的,这说明肠道微生物不仅受到饲粮结构的影响,环境因素也十分重要。
本试验中,在放牧藏猪粪便中发现了高丰度的拟普雷沃菌属(Alloprevotella)、纤维杆菌属(Fibrobacter)、琥珀酸弧菌属(Succinivibrio)及其分类水平下的细菌,与饲粮纤维素和半纤维素的表观消化率呈正相关,说明放牧藏猪具备高效降解饲粮中纤维物质的能力,并与肠道中以上细菌的存在密切相关。
4 结论 4.1藏猪在放牧养殖的条件下,具有较强消化纤维的能力,饲粮纤维类物质的消化率比舍饲养殖的猪要高10%以上。
4.2粪便细菌中,有1个门纤维杆菌门(Fibrobacteres),3个属拟普雷沃菌属(Alloprevotella)、纤维杆菌属(Fibrobacter)、琥珀酸弧菌属(Succinivibrio),3个种Alloprevotella rava、Fibrobacter intestinalis、Succinivibrio dextrinosolvens与饲粮纤维消化密切相关,可作为下一步藏猪源益生菌的开发对象。
| [1] |
YANG Y N, YUAN H N, YANG Q L, et al. Post-transcriptional regulation through alternative splicing in the lungs of Tibetan pigs under hypoxia[J]. Gene, 2022, 819: 146268. DOI:10.1016/j.gene.2022.146268 |
| [2] |
谭占坤, 商振达, 刘锁珠, 等. 西藏高原藏猪盲肠微生物群落结构与多样性的研究[J]. 畜牧兽医学报, 2020, 51(9): 2147-2155. TAN Z K, SHANG Z D, LIU S Z, et al. Study on the cecal microbial community structure and diversity of Tibetan pigs in Tibetan plateau[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(9): 2147-2155. (in Chinese) |
| [3] |
谭占坤, 池福敏, 商振达, 等. 西藏高原放牧藏猪结肠微生物的特异性研究[J]. 饲料研究, 2021, 44(8): 68-72. TAN Z K, CHI F M, SHANG Z D, et al. Colonic microbial specificity of grazing Tibetan pigs on Tibetan plateau[J]. Feed Research, 2021, 44(8): 68-72. (in Chinese) |
| [4] |
MENG F, MA L, JI S, et al. Isolation and characterization of Bacillus subtilis strain BY-3, a thermophilic and efficient cellulase-producing bacterium on untreated plant biomass[J]. Lett Appl Microbiol, 2014, 59(3): 306-312. DOI:10.1111/lam.12276 |
| [5] |
谭碧娥, 伍树松, 贺建华, 等. 地方猪耐粗饲和肉质性状形成的微生物代谢机制[J]. 动物营养学报, 2020, 32(7): 2941-2946. TAN B E, WU S S, HE J H, et al. Metabolic mechanism of coarse feeding tolerance and meat quality traits formation based on microbial metabolism in local pigs[J]. Chinese Journal of Animal Nutrition, 2020, 32(7): 2941-2946. (in Chinese) |
| [6] |
谭占坤, 刘瑶, 刘锁珠, 等. 藏猪肠道因子与饲粮粗纤维表观消化率的相关性研究[J]. 高原农业, 2021, 5(5): 465-471. TAN Z K, LIU Y, LIU S Z, et al. Study on the correlation between intestinal factors and apparent digestibility of dietary crude fiber in Tibetan pigs[J]. Journal of Plateau Agriculture, 2021, 5(5): 465-471. (in Chinese) |
| [7] |
谭占坤, 池福敏, 商振达, 等. 放牧藏猪、舍饲藏猪与商品猪粪便真菌群落组成及其与饲粮纤维消化的相关性研究[J]. 微生物学报, 2022, 62(1): 259-274. TAN Z K, CHI F M, SHANG Z D, et al. Fungal community in the feces of grazing Tibetan pigs, captive Tibetan pigs, and commercial pigs and its interaction with dietary fiber digestion[J]. Acta Microbiologica Sinica, 2022, 62(1): 259-274. (in Chinese) |
| [8] |
中华人民共和国农业部. NY/T 65-2004猪饲养标准[S]. 北京: 中国农业出版社, 2004. Ministry of Agriculture of the People's Republic of China. NY/T 65-2004 Feeding standard of swine[S]. Beijing: China Agriculture Press, 2004. (in Chinese) |
| [9] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 20806-2006饲料中中性洗涤纤维(NDF)的测定[S]. 北京: 中国标准出版社, 2007. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB/T 20806-2006 Determination of neutral detergent fiber in feedstuffs[S]. Beijing: Standards Press of China, 2007. (in Chinese) |
| [10] |
中华人民共和国农业部. NY/T 1459-2007饲料中酸性洗涤纤维的测定[S]. 北京: 农业出版社, 2008. Ministry of Agriculture of the People's Republic of China. NY/T 1459-2007 Determination of acid detergent fiber in feedstuff (ADF)[S]. Beijing: China Agriculture Press, 2008. (in Chinese) |
| [11] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 20805-2006饲料中酸性洗涤木质素(ADL)的测定[S]. 北京: 中国标准出版社, 2007. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB/T 20805-2006 Determination of acid detergent lignin in feedstuffs[S]. Beijing: Standards Press of China, 2007. (in Chinese) |
| [12] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 23742-2009饲料中盐酸不溶灰分的测定[S]. 北京: 中国标准出版社, 2009. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB/T 23742-2009 Animal feeding stuffs—Determination of ash insoluble in hydrochloric acid[S]. Beijing: Standards Press of China, 2009. (in Chinese) |
| [13] |
CALLAHAN B J, MCMURDIE P J, ROSEN M J, et al. DADA2:high-resolution sample inference from Illumina amplicon data[J]. Nat Methods, 2016, 13(7): 581-583. DOI:10.1038/nmeth.3869 |
| [14] |
ROGNES T, FLOURI T, NICHOLS B, et al. VSEARCH: A versatile open source tool for metagenomics[J]. PeerJ, 2016, 4: e2584. DOI:10.7717/peerj.2584 |
| [15] |
BOLYEN E, RIDEOUT J R, DILLON M R, et al. Reproducible, interactive, scalable and extensible microbiome data science using QIIME 2[J]. Nat Biotechnol, 2019, 37(8): 852-857. DOI:10.1038/s41587-019-0209-9 |
| [16] |
KÕLJALG U, NILSSON R H, ABARENKOV K, et al. Towards a unified paradigm for sequence-based identification of fungi[J]. Mol Ecol, 2013, 22(21): 5271-5277. |
| [17] |
彭健. 日粮纤维: 定义、成分、分析方法及加工影响(综述)[J]. 国外畜牧学(猪与禽), 1999(4): 8-11. PENG J. Dietary Fibre: definition, composition, analytical methods and processing effects (review)[J]. Animal Science Abroad(Pigs and Poultry), 1999(4): 8-11. (in Chinese) |
| [18] |
许振英. 猪与饲料纤维[J]. 养猪, 1990(3): 37-43. XU Z Y. Pig and feed fiber[J]. Swine Production, 1990(3): 37-43. (in Chinese) |
| [19] |
BURKEY T E, SKJOLAAS K A, MINTON J E. BOARD-INVITED review: porcine mucosal immunity of the gastrointestinal tract[J]. J Anim Sci, 2009, 87(4): 1493-1501. |
| [20] |
杨海天. 日粮纤维水平对不同遗传基础育肥猪生长性能及肉品质的影响[D]. 长春: 吉林农业大学, 2019. YANG H T. Effects of dietary fiber levels on growth performance and meat quality of different genetically based finishing pigs[D]. Changchun: Jilin Agricultural University, 2019. (in Chinese) |
| [21] |
KEMP B, DEN HARTOG L A, KLOK J J, et al. The digestibility of nutrients, energy and nitrogen in the Meishan and Dutch Landrace pig[J]. J Anim Physiol Anim Nutr, 1991, 65(1-5): 263-266. |
| [22] |
徐孝义. 东北民猪与哈白猪日粮养分消化性的比较研究(摘要)[J]. 黑龙江畜牧兽医, 1985(12): 33-34. XU X Y. Comparative study on nutrient digestibility of diets between northeast Min-pigs and Harbin white pigs (Abstract)[J]. Heilongjiang Animal Science and Veterinary Medicine, 1985(12): 33-34. (in Chinese) |
| [23] |
牛清. 基于16S rRNA基因测序技术鉴别与猪纤维消化相关的肠道微生物[D]. 南京: 南京农业大学, 2019. NIU Q. Identification of pig gut microbiota for fiber digestibility by 16S rRNA gene sequencing[D]. Nanjing: Nanjing Agricultural University, 2019. (in Chinese) |
| [24] |
YEN J T, VAREL V H, NIENABER J A. Metabolic and microbial responses in western crossbred and Meishan growing pigs fed a high-fiber diet[J]. J Anim Sci, 2004, 82(6): 1740-1755. |
| [25] |
LYND L R, WYMAN C E, GERNGROSS T U. Biocommodity engineering[J]. Biotechnol Prog, 1999, 15(5): 777-793. |
| [26] |
JENKINSON D S, ADAMS D E, WILD A. Model estimates of CO2 emissions from soil in response to global warming[J]. Nature, 1991, 351(6324): 304-306. |
| [27] |
WILSON D B. Three microbial strategies for plant cell wall degradation[J]. Ann N Y Acad Sci, 2008, 1125(1): 289-297. |
| [28] |
BAYER E A, BELAICH J P, SHOHAM Y, et al. The cellulosomes: multienzyme machines for degradation of plant cell wall polysaccharides[J]. Ann Rev Microbiol, 2004, 58: 521-554. |
| [29] |
RANSOM-JONES E, JONES D L, MCCARTHY A J, et al. The Fibrobacteres: an important phylum of cellulose-degrading bacteria[J]. Microb Ecol, 2012, 63(2): 267-281. |
| [30] |
AMANN R I, LIN C Z, KEY R, et al. Diversity among Fibrobacter isolates: towards a phylogenetic classification[J]. Syst Appl Microbiol, 1992, 15(1): 23-31. |
| [31] |
DOWNES J, DEWHIRST F E, TANNER A C R, et al. Description of Alloprevotella rava gen.nov., sp. nov., isolated from the human oral cavity, and reclassification of Prevotella tannerae Moore et al.1994 as Alloprevotella tannerae gen. nov., comb. nov[J]. Int J Syst Evol Microbiol, 2013, 63(Pt 4): 1214-1218. |
| [32] |
肖晓蓉, 李燕, 肖丽英. 2009—2012年发现的人口腔细菌新种属简介[J]. 华西口腔医学杂志, 2013, 31(2): 217-220. XIAO X R, LI Y, XIAO L Y. The novel species and genus discovered and nominated from the human oral cavity in 2009—2012[J]. West China Journal of Stomatology, 2013, 31(2): 217-220. (in Chinese) |
| [33] |
张君胜, 徐盼, 陶勇, 等. 不同生长性能苏姜猪保育猪肠道菌群差异分析[J]. 微生物学通报, 2020, 47(12): 4240-4249. ZHANG J S, XU P, TAO Y, et al. Analysis on the difference of intestinal microflora of Sujiang piglets with different growth performance[J]. Microbiology China, 2020, 47(12): 4240-4249. (in Chinese) |
| [34] |
任敏敏, 杨华, 项云, 等. 饲粮纤维水平对金华猪生长性能、盲肠菌群结构和短链脂肪酸含量的影响[J]. 动物营养学报, 2020, 32(6): 2575-2585. REN M M, YANG H, XIANG Y, et al. Effects of dietary fiber levels on growth performance, microbial community structure and short-chain fatty acid content in cecum of Jinhua pigs[J]. Chinese Journal of Animal Nutrition, 2020, 32(6): 2575-2585. (in Chinese) |
| [35] |
唐诗. 宿主基因型与肠道微生物互作对猪生长和脂肪沉积性状的影响机制研究[D]. 武汉: 华中农业大学, 2021. TANG S. Interaction between host genetic variants and gut microbiota and its effect on growth and fat deposition traits in pigs[D]. Wuhan: Huazhong Agricultural University, 2021. (in Chinese) |
| [36] |
刘阳. 妊娠后期高可溶或不可溶纤维摄入对母猪繁殖性能和围产期免疫功能及肠道菌群的影响[D]. 雅安: 四川农业大学, 2019. LIU Y. Effects of dietary soluble or insoluble fiber intake in late gestation on reproductive performance, immune function and intestinal microbiota of sows around parturition[D]. Ya'an: Sichuan Agricultural University, 2019. (in Chinese) |
| [37] |
王庆昭, 赵学明. 琥珀酸发酵菌种研究进展[J]. 生物工程学报, 2007, 23(4): 570-576. WANG Q Z, ZHAO X M. The research progress of succinic acid fermentation strains[J]. Chinese Journal of Biotechnology, 2007, 23(4): 570-576. (in Chinese) |
| [38] |
YU T, WANG Y, CHEN S C, et al. Low-molecular-weight chitosan supplementation increases the population of Prevotella in the cecal contents of weanling pigs[J]. Front Microbiol, 2017, 8: 2182. |
| [39] |
XU R Y, LU Y, WANG J, et al. Effects of the different dietary fibers on luminal microbiota composition and mucosal gene expression in pig colons[J]. J Funct Foods, 2019, 59: 71-79. |
| [40] |
WANG X F, TSAI T, WEI X Y, et al. Effect of lactylate and Bacillus subtilis on growth performance, peripheral blood cell profile, and gut microbiota of nursery Pigs[J]. Microorganisms, 2021, 9(4): 803. |
| [41] |
LYU Z Q, WANG L, WANG J R, et al. Oat bran and wheat bran impact net energy by shaping microbial communities and fermentation products in pigs fed diets with or without xylanase[J]. J Anim Sci Biotechnol, 2020, 11(1): 99. |
| [42] |
杨伟平. 藏猪肠道细菌群落组成与纤维素分解菌的研究[D]. 杨凌: 西北农林科技大学, 2015. YANG W P. A study on the bacteria community and the cellulolytic bacterium in Tibetan pigs[D]. Yangling: Northwest A&F University, 2015. (in Chinese) |
| [43] |
DIAO H, YAN H L, XIAO Y, et al. Intestinal microbiota could transfer host Gut characteristics from pigs to mice[J]. BMC Microbiol, 2016, 16(1): 238. |
(编辑 范子娟)



