2. 内蒙古农业大学动物科学学院,呼和浩特 010018
2. College of Animal Science, Inner Mongolia Agricultural University, Hohhot 010018, China
我国是羊肉生产大国,占全世界生产总量的24%,其次是澳大利亚(8%)和新西兰(5%)[1]。与其他畜产品(肉和奶)相比,绵羊、山羊肉及其相关制品因具有独特营养成分、感官特性而深受消费者市场的欢迎,但同时也具有特殊的风味即膻味,致使部分消费者难以接受而拒绝消费[2]。众多研究结果指向,挥发性的4-烷基支链脂肪酸:4-甲基辛(MOA)、4-甲基壬酸(MNA)、4-乙基辛酸(EOA)被认为是羊肉膻味的主要贡献者[3-5]。羊肉膻味受品种、性别、年龄以及日粮等诸多因素的影响,但日粮因素往往比遗传因素更能直接对羊肉膻味产生影响[3]。与放牧条件下采食黑麦草和三叶草的公羊羔羊相比,舍饲条件下采食浓缩饲料(苜蓿颗粒或玉米)的公羊羔羊皮下脂肪中的MOA和MNA浓度更高[6],这也是舍饲肉羊风味下降,膻味程度加剧的主要原因。舍饲条件下肉羊饲粮中谷物类等浓缩饲料的比例显著增加,肉羊瘤胃微生物能够发酵谷物中的淀粉产生大量的丙酸,正常情况下丙酸可被用于糖异生途径,当丙酸的产生量超过肝的代谢阈值时,过量的丙酸作为前体物合成丙二酰辅酶A和甲基-丙二酰辅酶A,脂肪酸合成酶通常情况下利用乙酰辅酶A为起始底物合成支链脂肪酸,同时也可利用甲基-丙二酰辅酶A合成支链脂肪酸[7]。对于羊肉膻味的研究目前的瓶颈主要在于与膻味相关物质在羊肉所占的比例仅以mg·kg-1来计量,用常规的检测和分析方法很难对其进行准确分析,并且检测成本较高[8]。目前针对舍饲肉羊肾周脂肪膻味代谢组学的特征研究较少,因此本试验重点解析不同膻味水平舍饲肉羊肾周脂肪代谢组学特征,以期为膻味物质代谢产物标记物的筛选及进一步研究沙葱醇提物调控膻味的途径奠定基础。
1 材料与方法 1.1 试验材料沙葱粉的制备流程:新鲜沙葱采摘自甘肃省民勤县,运回实验室除去杂草,洗净烘干(65 ℃),粉碎备用。沙葱水提物和沙葱醇提物参照刘旺景等[9]方法为实验室自制。
1.2 试验设计及动物饲养管理选取3月龄体重相近((23.67±3.43)kg),健康、体况良好的小尾寒羊公羔60只,随机分为4组,每组15只。对照组饲喂基础日粮(CK),试验组以每只羊计,每天分别在基础日粮中添加沙葱粉(AMR)10 g,沙葱水提物(AWE)3.4 g和沙葱醇提物(AFE)2.8 g。本试验中沙葱粉添加量参考卢媛[10]试验所得的舍饲肉羊最适沙葱粉添加剂量,沙葱水提物和沙葱醇提物的添加剂量根据沙葱水提物和沙葱醇提物的提取率换算所得。基础日粮参照NRC(2007)营养需要量进行配制,其组成及营养水平见表 1。试验持续75 d,其中预试期15 d,正试期60 d,基础日粮每日于07:00和19:00分两次等量饲喂,根据剩料量调整饲喂量,控制每个圈舍剩料量为饲喂量的10%,饲喂期间保证羊只自由采食和饮水,期间4组肉羊的饲养条件和环境均一致。
|
|
表 1 基础日粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (dry matter basis) |
正试期结束后从每组挑选6只体重相近的小尾寒羊进行屠宰(n=24),屠宰前24 h内禁止采食,2 h内禁止饮水。屠宰1 h后取背部皮下脂肪(6-7腰椎肌肉上方的脂肪组织)、尾部脂肪(中央位置)、肾周脂肪和大网膜脂肪(中央位置)20~30 g分装于冻存管中放在-80 ℃条件下保存,用于3种支链脂肪酸(MOA、MNA和EOA)的含量及代谢组学特征的检测。
1.3.1 3种支链脂肪酸的检测 3种支链脂肪酸的定性主要由相应标准物的保留时间进行确定。采用气相色谱-质谱联用法(gas chromatography-mass spectrometry analysis)检测各脂肪组织中3种支链脂肪酸的含量,具体参照Kaffarnik等[8]的方法。根据各组支链脂肪酸的含量选择极高膻味水平组(HLOF)样本和极低膻味水平组(LLOF)样本,进行后续的代谢组学特征分析。
1.3.2 代谢组学特征分析1.3.2.1 样品前处理 根据支链脂肪酸的检测结果,选择HLOF样本和LLOF样本进行代谢组学特征分析,具体方法:将各组所屠宰的6只羊的组织样本混合,每组制备6个重复样本。分别从每个重复样本中称取60 mg,加入内标(L-2-氯苯丙氨酸,0.3 mg·mL-1;Lyso PC17:0,0.01 mg·mL-1,均为甲醇配置)各20 μL和600 μL的甲醇:水(V∶V=4∶1);加入两个小钢珠,在-20 ℃放置2 min预冷,加入研磨机(60 Hz, 2 min);超声提取10 min;-20 ℃静置30 min;离心10 min(13 000 r·min-1,4 ℃),用注射器吸取200 μL上清液,使用0.22 μm的有机相针孔过滤器过滤后,转移到LC进样小瓶,-80 ℃下保存,直到进行LC-MS分析。质控样本(QC)由所有样本的提取液等体积混合制备而成,每个QC体积与样本相同。
1.3.2.2 LC-MS分析条件 试验分析仪器为ACQUITY UPLC超高效液相串联AB Triple TOF 5600高分辨质谱仪组成的液-质联用系统。色谱条件,色谱柱:ACQUITY UPLC BEH C18(100 mm× 2.1 mm, 1.7 μm);柱温:45 ℃;流动相:A-水(含0.1%甲酸),B-乙腈/甲醇(2/3)(v/v)(含0.1%甲酸);流速:0.4 mL·min-1;进样体积:5 μL。质谱条件:离子源,ESI;样品质谱信号采集分别采用正负离子扫描模式。
1.4 数据处理与分析对照组和试验组小尾寒羊各部位脂肪组织中支链脂肪酸的含量采用SAS 9.2软件中的ANOVA程序进行单因素方差分析,P>0.1为差异不显著,0.05≤P<0.1有差异趋势,P<0.05为差异显著,差异显著时采用Duncan氏法进行多重比较。UNIFI 1.8.1. 软件用于原始数据的采集经Progenesis QI v2.3软件处理后,利用偏最小二乘-判别分析(PLS-DA)和正交偏最小二乘法分析(OPLS-DA)来区分各组间代谢轮廓的总体差异,找到组间的差异代谢物。OPLS-DA分析中,变量权重值(variable important in projection,VIP)可用来衡量各代谢物的表达模式对各组样本分类判别的影响强度和解释能力,一般以VIP>1的代谢物被认为是差异代谢物。进一步利用T检验验证组间差异代谢物是否具有显著性。筛选的标准为OPLS-DA模型第一主成分的VIP值>41,T检验的P值<0.05根据VIP值对差异代谢物表达量进行可视化分析。利用差异代谢物的KEGG ID进行通路富集分析,获得代谢通路富集结果。
2 结果 2.1 日粮添加沙葱及其提取物对舍饲肉羊各部位脂肪组织中3种支链脂肪酸的影响由表 2可知,AMR、AWE和AFE组肾周脂肪中MOA(P<0.001)、MNA(P=0.044)和EOA(P<0.001)的含量显著低于CK组,其中,AFE组肾周脂肪中MOA的含量最低为2.31 μg·g-1;AMR、AWE和AFE组尾部脂肪中MOA、MNA和EOA的含量与CK组相比无显著性差异(P>0.05);AMR、AWE和AFE组背部皮下脂肪中MOA(P<0.001)和EOA(P<0.001)的含量显著低于CK组,4组间MNA的含量无显著性差异(P>0.05);AMR、AWE和AFE组大网膜脂肪中MOA(P<0.001)和EOA(P=0.002)的含量显著低于CK组,另外,AMR、AWE和AFE组大网膜脂肪中MNA(P=0.062)的含量与CK组相比有显著降低的趋势。综上所述,沙葱及其提取物对肾周脂肪中3种支链脂肪酸含量的影响最为显著,并且沙葱醇提物对改善肾周脂肪膻味效果最佳,因此选择CK组肾周脂肪为极高膻味水平组(HLOF)样本,选择AFE组肾周脂肪为极低膻味水平组(LLOF)样本,进行后续的代谢组学特征分析。
|
|
表 2 日粮中添加沙葱及其提取物对舍饲肉羊不同部位脂肪组织中3种支链脂肪酸含量的影响 Table 2 Effect of dietary supplementation with Allium mongolicum Regel and its extracts on the concentrations of three branched-chain fatty acids in the different adipose tissues of captive meat sheep |
2.2.1 PLS-DA分析和OPLS-DA分析 偏最小二乘-判别分析(PLS-DA)是一种有监督的判别统计方法,该方法运用偏最小二乘回归建立代谢物表达量与样本分组之间的关系模型,来实现对样品类别的预测。参数R2X (cum)能对模型有效性进行评判,除了参数R2X (cum)能对模型有效性进行评判外,还包括解释率R2Y (cum)和预测率Q2 (cum),PLS-DA模型能更好地解释和预测两组样本之间的差异,代表模型预测能力越好,由图 1(左)可知,该模型解释率和预测率良好。正交偏最小二乘方-判别分析OPLS-DA是有监督的判别分析统计方法,由图 1(右)可知两组样本在OPLS-DA得分图上具有显著的差异,该模型解释率和预测率良好。

|
图 1 小尾寒羊肾周脂肪(CK组vs. AFE组)PLS-DA得分图和OPLS-DA得分图 Fig. 1 PLS-DA and OPLS-DA score plot of perirenal adipose tissue samples (CK group vs. AFE group) in Small-tailed Han sheep |
2.2.2 OPLS-DA模型的响应排序检验 为防止模型过拟合,采用7次循环交互验证(7-fold cross validation)和200次响应排序检验(response permutation testing,RPT)的方法来考察模型的质量。使用RPT检验时,一般要求这种情况的Q2小于0。由图 2可知,R2=0.82,Q2=-0.077,模型不存在过拟合现象。

|
图 2 Permutation图 Fig. 2 Graph of Permutation |
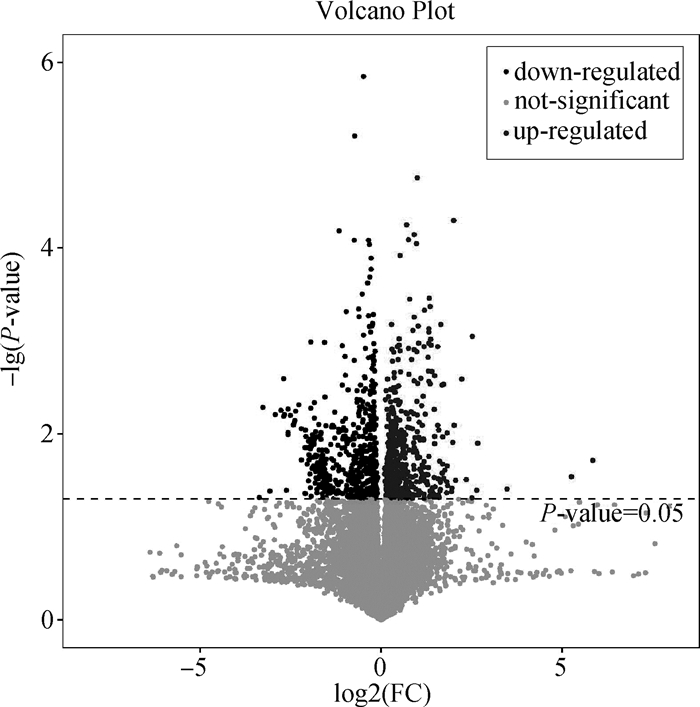
2.2.3 单变量统计分析 利用火山图对CK组(HLOF)和AFE组(LLOF)代谢物表达量的变异进行可视化,有利于筛选差异代谢产物,如图 3所示,其中红色圆点代表在试验组中显著上调的差异代谢产物(P<0.05),蓝色圆点代表显著下调的差异代谢产物(P<0.05),灰色点代表不显著的差异代谢产物(P>0.05)。采用多维分析和单维分析相结合的办法,来筛选组间差异代谢产物。筛选的标准为OPLS-DA模型第一主成分的VIP值>1,T检验的P值<0.05。共筛选出差异代谢物共94个,其中56个代谢物下调,38个代谢物上调。差异代谢物的分类见图 4,由图可知,脂类和类脂类分子占比55%、有机杂环类占比13%、有机酸及其衍生物占比10%、苯甲酸盐类化合物占比6%、有机氮化合物占比4%、有机硫化合物占比3%、有机氧化合物占比1%、其他化合物占比8%。
|
图 3 小尾寒羊肾周脂肪(HLOF组vs. LLOF组)差异代谢物火山图 Fig. 3 Volcano map of different metabolites of perirenal adipose tissue samples (HLOF group vs. LLOF group) in Small-tailed Han sheep |

|
图 4 小尾寒羊肾周脂肪(HLOF组vs. LLOF组)差异代谢物分类图 Fig. 4 Classification of the significantly varying metabolites of perirenal adipose tissue samples (HLOF group vs. LLOF group) in Small-tailed Han sheep |
2.2.4 差异代谢物的筛选 为了更直观地展示样本之间的关系及代谢物在不同样本之间的表达差异,本研究对所有显著差异代谢物表达量进行层次聚类(Hierarchical Clustering),根据VIP值对top50差异代谢物表达量进行可视化分析,结果如图 5。横坐标表示样本名称,纵坐标表示差异代谢物,每个试验组6个生物学重复。左侧的树状结构表示差异代谢物之间的相似度聚类关系。颜色从绿到红表示代谢物的表达丰度从低到高,即颜色越红表示差异代谢物的表达丰度越高。由图可知,正、负离子模式下Top-50代谢物被分为两类,一类代谢物的表达量上调,而另一类代谢物的表达量下调。极低膻味组(LLOF)TOP-50差异代谢物中表达量上调的代谢物为19个,按物质分类判定其中,甘油磷脂类化合物4个,分别为:[PI(16:0/22:4(7Z, 10Z, 13Z, 16Z)), PI(18:1(9Z)/20:4(5Z, 8Z, 11Z, 14Z)), PS(18:0/18:1(9Z)), PI(18:1(9Z)/20:3(8Z, 11Z, 14Z))]、脂肪酰基5个,分别为:[二十四烷酸(Tetracosanoic acid), 二十二烷酸(Behenic acid), (S)-2-乙酰乳酸((S)-2-Acetolactate), 2-amino-2, 3, 7-trideoxy-D-lyxo-hept-6-ulosonic acid, 3Z, 6Z, 9Z, 12Z, 15Z-Tricosapentaene];甘油糖脂3个,分别为[DG(18:0/20:4(5Z, 8Z, 11Z, 14Z)/0:0), DG(18:0/20:4(8Z, 11Z, 14Z, 17Z)/0:0), PS(18:0/18:1(9Z))];鞘磷脂2个分别为[C16二氢(神经)鞘氨醇(C16 Sphinganine), (3’-sulfo)Galbeta-Cer(d18:1/16:0(2OH))];有机氮化合物1个为N, N-Dimethylaniline;丙烯醇脂类1个为叶绿醇(Phytol);苯甲酸盐1个为非尔氨酯(Felbamate);未分类化合物2个,分别为[Xestoaminol C, 苯甲烃铵(Benzalkonium)]。表达量下调的代谢物为31个,其中,甘油磷脂类化合物7个,分别[LysoPE(22:5(7Z, 10Z, 13Z, 16Z, 19Z)/0:0), PI(20:1(11Z)/0:0), (4E, 8E, 10E-d18:3)sphingosine, 1-Oleoylglycerophosphoserine, PC(16:0/16:0), PS(O-16:0/20:2(11Z, 14Z)), PC(20:2(11Z, 14Z)/18:0)];脂肪酰基4个,分别为[蓖麻油酸(Ricinoleic acid), Linoleamide, Cer(d18:0/14:0), Ethyl 9-hexadecenoate];有机酸及其衍生物4个,分别为[N-Arachidonoyl tyrosine, D-4’-Phosphopantothenate, L-2-Amino-3-(1-pyrazolyl) propanoic acid, 1-(Malonylamino)cyclopropanecarboxylic acid];有机杂环类化合物3个,分别为[咪唑丙烯酸(Urocanic acid), Isoniazid, N-Methyl-1H-indole-3-propanamide];苯甲酸盐3个,分别为[2-(4-Hydroxyphenyl)ethanol, 乙基苯酚(4-Ethylphenol), m-Chlorohippuric acid];丙烯醇脂类1个为[雷公藤红素(Celastrol)];鞘磷脂1个[4E, 14Z-Sphingadiene];有机氮化合物1个为[组氨醇(L-Histidinol)];有机氧化合物1个[Adlupone];有机硫化合物1个为[二丁基二硫化物(Dibutyl disulfide)]、其它类化合物5个,分别为[4-羟基-6-甲基吡喃-2-酮(4-Hydroxy-6-methylpyran-2-one), 7-氯犬尿酸(7-Chlorokynurenic acid), PC(16:1(9Z)/20:3(5Z, 8Z, 11Z)), PC(16:1(9Z)/20:3(8Z, 11Z, 14Z)), 4-氨基-5-羟甲基-2-甲基嘧啶(4-Amino-5-hydroxymethyl-2-methylpyrimidine)]。

|
图 5 HLOF组与LLOF组TOP-50差异代谢物热图 Fig. 5 Top-50 differential metabolites thermogram between HLOF group and LLOF group |
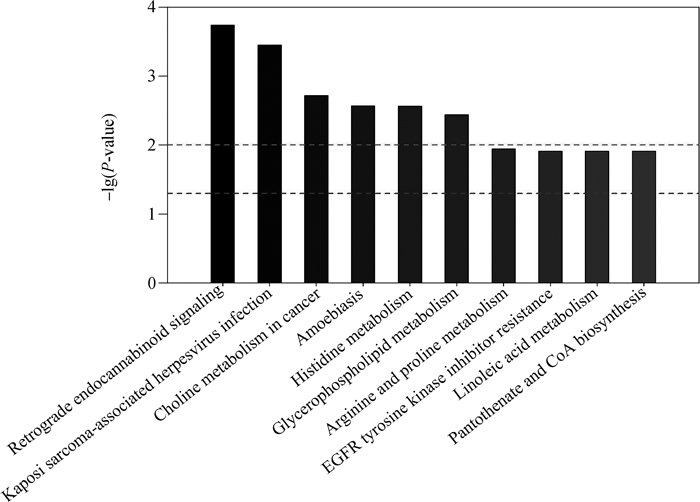
2.2.5 代谢通路富集分析 基于KEGG数据库对差异代谢物进行代谢通路富集分析。代谢通路中P值为该代谢通路富集的显著性。红线示意P值为0.01,蓝线示意P值为0.05,条柱的顶端高于蓝线时,其所代表的信号通路具有显著性。由图 6可知,差异代谢物主要涉及的代谢通路包括:逆行内源性大麻素信号转导(Retrograde endocannabinoid signaling)、卡波西肉瘤相关疱疹病毒感染(Kaposi sarcoma-associated herpesvirus infection)、癌症中的胆碱代谢(Choline metabolism in cancer)、阿米巴类感染(Amoebiasis)、组氨酸代谢(Histidine metabolism)、甘油磷脂代谢(Glycerophospholipid metabolism)、精氨酸和脯氨酸代谢(Arginine and proline metabolism)、EGFR酪氨酸激酶抑制剂耐药(EGFR tyrosine kinase inhibitor resistance)、亚油酸代谢(Linoleic acid metabolism)和泛酸和辅酶A生物合成(Pantothenate and CoA biosynthesis)。
|
图 6 TOP-10代谢通路富集图 Fig. 6 Top-10 metabolic pathway enrichment map |
代谢通路中P值为该代谢通路富集的显著性,选择显著性富集pathway进行气泡图绘制。由图 7分析可知,在TOP-10代谢通路中,富集到Retrograde endocannabinoid signaling代谢通路的代谢物有3个,分别是磷脂酰胆碱(下调),二酰甘油(上调)和磷脂酰乙醇胺(下调);富集到Kaposi sarcoma-associated herpesvirus infection代谢通路的代谢物有2个,分别是二酰甘油(上调)和磷脂酰乙醇胺(下调);富集到Choline metabolism in cancer通路的代谢物有2个,分别是磷脂酰胆碱(下调)和二酰甘油(上调);富集到Amoebiasis代谢通路的代谢物有2个,分别是二酰甘油(上调)和磷脂酰丝氨酸(上调);富集到Histidine metabolism通路的代谢物有3个,分别是尿酸(下调)、L-组氨酸(下调)和1-甲基组胺(下调);富集到Glycerophospholipid metabolism通路的代谢物有3个,分别是磷脂酰胆碱(下调),磷脂酰乙醇胺(下调)和磷脂酰丝氨酸(上调);富集到Arginine and proline metabolism代谢通路的代谢物有3个,分别是N-乙酰-L-谷氨酸5-半醛(上调),1-吡咯啉-2-羧酸盐(上调)和4-(L-γ-谷氨酸氨基)丁酸酯(上调);富集到EGFR酪氨酸激酶抑制剂耐药(EGFR tyrosine kinase inhibitor resistance)代谢通路的代谢物有1个,是二酰甘油(上调);富集到亚油酸代谢(Linoleic acid metabolism)通路的代谢物有2个,分别是磷脂酰胆碱(下调)和9-顺式,11-反癸二烯酸酯(下调);富集到Pantothenate and CoA biosynthesis代谢通路的代谢物有2个,分别是D-4′-磷酸泛酸盐(下调)和(S)-2-羟基-2-甲基-3-氧代丁酸酯(上调)。

|
图 7 TOP-20差异代谢物气泡图 Fig. 7 Top-20 bubble chart of differential metabolites |
2.2.6 主要差异代谢产物与3种支链脂肪酸含量的相关性分析 由表 3可知,MOA与尿酸([ρ]=0.68, P=0.001)、L-组氨酸([ρ]=0.70, P=0.012)、1-甲基组胺([ρ]=0.57, P=0.033)、磷脂酰胆碱([ρ]=0.62, P=0.035)、磷脂酰乙醇胺([ρ]=0.54, P=0.044)、9-顺式, 11-反癸二烯酸酯([ρ]=0.50, P=0.001)呈显著正相关,与二酰甘油([ρ]=-0.49, P=0.016)、磷脂酰丝氨酸([ρ]=-0.64, P=0.029)呈显著负相关,与其他代谢产物均无显著相关性。EOA与尿酸([ρ]=0.61, P=0.016)、L-组氨酸([ρ]=0.72, P=0.023)、1-甲基组胺([ρ]=0.68, P=0.026)、磷脂酰胆碱([ρ]=0.58, P=0.018)、磷脂酰乙醇胺([ρ]=0.61, P=0.001)、9-顺式, 11-反癸二烯酸酯([ρ]=0.47, P=0.022)呈显著正相关,与二酰甘油([ρ]=-0.45, P=0.029)、磷脂酰丝氨酸([ρ]=-0.58, P=0.031)呈显著负相关,与其他代谢产物均无显著相关性。MOA与尿酸([ρ]=0.59, P=0.049)、L-组氨酸([ρ]=0.50, P=0.056)、1-甲基组胺([ρ]=0.56, P=0.058)、磷脂酰胆碱([ρ]=0.67, P=0.014)、磷脂酰乙醇胺([ρ]=0.49, P=0.016)、9-顺式, 11-反癸二烯酸酯([ρ]=0.45, P=0.029)、4-(L-γ-谷氨酸氨基)丁酸酯([ρ]=0.36, P=0.026)呈显著正相关,与二酰甘油([ρ]=-0.51, P=0.004)、磷脂酰丝氨酸([ρ]=-0.57, P=0.033)呈显著负相关,与其他代谢产物均无显著相关性。
|
|
表 3 肾周脂肪主要差异代谢物与3种支链脂肪酸含量的相关性分析 Table 3 Correlation analysis between main differential metabolites and the contents of three branched-chain fatty acids in perirenal adipose tissue |
羊肉中致膻物质的发现和探究一直是肉羊和食品领域研究的热点问题。Wong等[11-12]首次报道引起羊肉特殊风味的物质主要是3种支链脂肪酸,即MOA、EOA和MNA,同时也指出,碳链长度在7~9之间不同酸(如:辛酸及其异构体、2-甲基辛酸、6-甲基辛酸、壬酸、4, 6-二甲基辛酸、壬酸及其异构体和8-甲基壬酸)的组合也会产生类似于羊肉膻味的不良气味。3种支链脂肪酸的合成途径中,丙酸是重要的前体物之一,Berthelot等[13]研究发现,饲粮中添加丙酸盐能够显著提高绵羊体脂中支链脂肪酸的沉积量,试验证实了丙酸是合成奇数碳脂肪酸和甲基支链脂肪酸的重要前体物。Young等[14]研究发现,饲粮中谷物添加比例增加时,羔羊肌内脂肪和体脂中也将沉积更多的支链脂肪酸。众所周知,瘤胃微生物发酵谷物中的碳水化合物产生大量的丙酸,产生的丙酸被瘤胃上皮细胞吸收进入门静脉,而后被运送到肝,其中一部分丙酸可被氧化或用于糖异生为机体提供能量,但随着肝中丙酸供应量的不断增加,肝对丙酸的提取量由85%降低至75%,导致丙酸在外周组织中的可利用比例增加3倍[15],多余的丙酸被转化为丙二酰辅酶A和琥珀酸的中间体甲基丙二酰辅酶A。在脂肪酸的合成中,脂肪酸合成酶通常使用丙二酰辅酶A作为从头合成直链脂肪酸,可利用甲基-丙二酰辅酶A或乙基-丙二酰辅酶A取代丙二酰辅酶A作为脂肪酸从头合成的前体物,生成甲基-或者乙基支链脂肪酸[7]。由此看来,丙酸的生成量是影响支链脂肪酸合成的重要物质基础,本课题组前期研究发现,沙葱及其提取物能够有效降低绵羊肌内脂肪中支链脂肪酸的含量,改善羊肉膻味[16-17],同时进一步研究发现,沙葱及其提取物能够改变绵羊瘤胃发酵类型,丰富瘤胃液菌群的多样性[18],对丙酸生成量的影响可能是降低羊肉膻味的原因之一。另外在支链脂肪酸的合成中,提高丙二酰辅酶A脱羧酶的活性能够降低组织对丙二酰辅酶A的摄取和利用,从而使甲基-丙二酰辅酶A的可用性成比例增加,增加支链脂肪酸的合成量[19],由此推测,沙葱及其提取物中的活性成分可能降低丙二酰辅酶A脱羧酶的活性,避免脂肪酸合成底物中丙二酸辅酶A被该酶提前降解,因此,降低甲基-丙二酰辅酶A或乙基-丙二酰辅酶A参与合成支链脂肪酸的几率。
组织中支链脂肪酸除了来自于脂肪酸的从头合成,还可来源于小肠吸收的食物、微生物代谢和支链氨基酸的降解[3], 支链脂肪酸合成途径中的丙二酰辅酶A是异亮氨酸和缬氨酸的降解产物,支链氨基酸的降解是通过支链氨基酸转移酶的脱氨基作用开始的,降解产物支链酮酸随后在线粒体中代谢,在支链酮酸脱氢酶复合物作用下生成酰基辅酶A[20],有研究表明,在支链脂肪酸合成的同时,支链氨基酸的分解代谢同步上调,其分解代谢产物为三羧酸循环和乙酰辅酶A的的产生提供碳源[21],因此,支链氨基酸的代谢影响着支链脂肪酸的合成,这为探究沙葱及其提取物降低绵羊体脂支链脂肪酸合成机理提供新的思路。Wallace等[7]研究发现,肝和大脑中甲基-支链脂肪酸的含量低于脂肪组织,这表明支链脂肪酸的合成具有组织特异性。Alves等[22]报道,极端恶劣条件下达马拉肥尾羊会动员尾部储存的脂肪来维持机体能量需求,长此以往尾部形成独特的局部脂肪代谢机制,同时检测发现,尾部脂肪中含有高水平的支链脂肪酸,本研究发现沙葱及其提取物对尾部脂肪中MOA、MNA和EOA的含量没有显著性影响,提示小尾寒羊这种耐粗饲、适应能力强的物种可能同样存在局部脂肪代谢机制,更深层次的机制有待进一步探究。
3.2 不同膻味水平下舍饲肉羊肾周脂肪的代谢组学分析差异代谢物筛选中共筛选出差异代谢物共94个,其中56个代谢物下调,38个代谢物上调。在差异代谢物分类中,发现这些差异代谢物主要分为脂类和类脂类分子(55%)、有机杂环类化合物(13%)以及有机酸类化合物(10%),且TOP-50化合物中,上调和下调最为显著的化合物分类均为甘油磷脂类化合物和脂肪酰基类化合物。说明沙葱醇提取物主要参与机体脂类代谢过程,进而影响与膻味合成相关的代谢产物的生成。有研究表明,羊膻味相关物质4-烷基支链脂肪酸在羊机体中的合成和沉积与机体对脂肪的利用具有较大的相关性,瘤胃微生物降解饲粮中的大部分脂类,利用降解后产物如一些支链氨基酸和支链脂肪酸最终合成4-烷基支链脂肪酸[23],表明4-烷基支链脂肪的合成与脂肪酸和氨基酸的代谢相关。Sañudo等[24]研究发现,羊背最长肌的膻味强度与脂肪中沉积的硬脂酸、亚麻酸和油酸含量呈正相关,同时硬脂酸的合成途径也提示其与亚麻酸和油酸代谢相关,因为亚麻酸进入机体后最终氢化产物为硬脂酸,而蛋白分解梭状芽孢杆菌能够将共轭亚油酸转化为反式油酸而后经还原酶氢化生成硬脂酸[25]。最新研究表明,羊体脂脂肪组织中4-烷基支链脂肪酸的沉积量与十七烷酸(C17:0)的含量呈正相关,同时C17:0也可作为评判羊膻味的等级的生物标记物[26]。综上所述,KEGG代谢通路主要关注组氨酸代谢通路、甘油磷脂代谢通路、精氨酸和脯氨酸代谢通路和亚油酸代谢通路。
氨基酸是机体生命活动中的重要组成成分,是蛋白质合成和分解的单位和产物,氨基酸通过脱氨和转氨作用分解为α-酮酸进而合成糖类、脂类和一些非必需氨基酸,部分氨基酸为4-烷基支链脂肪酸的合成提供支链碳架结构[21]。本研究发现,LLOF组与HLOF组相比差异代谢产物尿酸、L-组氨酸和1-甲基组胺三者均表达下调,尿酸和1-甲基组胺为L-组氨酸代谢的下游产物参与组氨酸代谢,提示沙葱醇提物可能通过调控组氨酸代谢途径中相关代谢产物的表达,进而影响4-烷基支链脂肪酸的合成。磷脂酰胆碱(卵磷脂)是一种内源性的小半抗原分子,广泛存在于各组织中,它是甘氨酸、丝氨酸和苏氨酸代谢途径中胆碱的前体物,是甘油磷脂代谢途径中胆碱和胞苷二磷酸胆碱的中间产物,也是亚油酸代谢途径中亚油酸盐合成的前体物,而9-顺式,11-反癸二烯酸酯是亚油酸的下游产物[27]。在亚油酸代谢途径中磷脂酰胆碱和9-顺式,11-反癸二烯酸酯表达丰度下调,提示沙葱提取物可能参与调控肾周脂肪中的亚油酸代谢途径,降低亚油酸含量,导致膻味物质硬脂酸的合成量下降。磷脂酰乙醇胺(脑磷脂)同样参与甘氨酸、丝氨酸和苏氨酸代谢途径,在甘油磷脂代谢途径中,是通过磷酯酰丝氨酸的脱羧作用形成的,在动物中,它是通过CDP乙醇胺和1, 2-甘油二酯的反应生成的[28]。磷脂酰胆碱、磷脂酰乙醇胺和磷脂酰丝氨酸都是细胞膜的重要组成成分,如人类红细胞膜上就有磷脂酰胆碱(占19%)、鞘磷脂(占8%)、磷脂酰乙醇胺(占16%)和磷脂酰丝氨酸(占10%),同样在低等生物中,甲基支链脂肪酸在控制细胞膜的流动性等方面发挥着十分重要的作用,并有助于其神经发育[29]。相关性研究发现,3种支链脂肪酸含量与组氨酸代谢通路中的尿酸和1-甲基组、L-组氨酸;与甘油磷脂代谢通路中的磷脂酰胆碱,磷脂酰乙醇胺和磷脂酰丝氨酸;与EGFR酪氨酸激酶抑制剂耐药代谢通路中的二酰甘油;与亚油酸代谢通路中的9-顺式,11-反癸二烯酸酯显著相关。Xue等[30]研究发现,沙葱提取物的摄入并没有直接调节脂质代谢,而是能够通过影响绵羊脂肪组织的甲基化水平和lncRNA的表达间接调控动物机体能量代谢、信号通路和细胞增殖等相关过程,而这些都是脂质代谢的上游调节通路,这可能是3种支链脂肪酸与上述通路中的代谢产物显著相关,但相关性不强的主要原因。李树颖等[31]研究发现,黄芪多糖对小鼠细胞氨基酸代谢途径具有调节作用。沙葱及其提取物对舍饲肉羊肾周脂肪组织中氨基酸的调节可能与黄芪多糖具有构效相似性。综上所述,沙葱醇提物可能通过调控舍饲肉羊机体脂肪酸及氨基酸代谢通路,调控相关代谢产物的合成,进而影响4-烷基支链脂肪酸的合成,从而改善羊肉膻味。
4 结论本试验条件下,沙葱及其提取物能够改善除尾部脂肪外其它部位脂肪组织中(肾周脂肪、背部皮下脂肪和大网膜脂肪)3种支链脂肪酸,其中沙葱醇提物对降低肾周脂肪中3种支链脂肪酸的沉积效果最佳。代谢组学研究发现,沙葱醇提物可能通过调控舍饲肉羊机体脂肪酸及氨基酸代谢通路,调控相关代谢产物的合成,进而影响4-烷基支链脂肪酸的合成,从而改善羊肉膻味。
| [1] |
PULINA G, MILÁN M J, LAVÍN M P, et al. Invited review: current production trends, farm structures, and economics of the dairy sheep and goat sectors[J]. J Dairy Sci, 2018, 101(8): 6715-6729. DOI:10.3168/jds.2017-14015 |
| [2] |
POLOWSKY P, COUDÉ B, JIMÉNEZ-MAROTO L A, et al. Flavor and sensory characteristics of Non-bovine species milk and their dairy products[M]//PARK Y W, MIN D, HAENLEIN G F W, et al. Handbook of Milk of Non-Bovine Mammals. 2nd ed. Chichester: John Wiley & Sons, Ltd, 2017: 595-623.
|
| [3] |
WATKINS P J, JABOREK J R, TENG F, et al. Branched chain fatty acids in the flavour of sheep and goat milk and meat: A review[J]. Small Rumin Res, 2021, 200: 106398. DOI:10.1016/j.smallrumres.2021.106398 |
| [4] |
TENG F, REIS M G, BROADHURST M, et al. Factors affecting levels of volatile 4-alkyl branched-chain fatty acids in sheep milk from 2 contrasting farming systems in New Zealand[J]. J Dairy Sci, 2020, 103(3): 2419-2433. DOI:10.3168/jds.2019-17192 |
| [5] |
TENG F, REIS M G, YAN L, et al. Structural characteristics of triacylglycerols contribute to the distinct in vitro gastric digestibility of sheep and cow milk fat prior to and after homogenization[J]. Food Res Int, 2020, 130: 108911. DOI:10.1016/j.foodres.2019.108911 |
| [6] |
YOUNG O A, LANE G A, PRIOLO A, et al. Pastoral and species flavour in lambs raised on pasture, lucerne or maize[J]. J Sci Food Agric, 2003, 83(2): 93-104. DOI:10.1002/jsfa.1282 |
| [7] |
WALLACE M, GREEN C R, ROBERTS L S, et al. Enzyme promiscuity drives branched-chain fatty acid synthesis in adipose tissues[J]. Nat Chem Biol, 2018, 14(11): 1021-1031. DOI:10.1038/s41589-018-0132-2 |
| [8] |
KAFFARNIK S, PREUß S, VETTER W. Direct determination of flavor relevant and further branched-chain fatty acids from sheep subcutaneous adipose tissue by gas chromatography with mass spectrometry[J]. J Chromatogr A, 2014, 1350: 92-101. DOI:10.1016/j.chroma.2014.05.034 |
| [9] |
刘旺景, 李书仪, 唐德富, 等. 日粮添加沙葱及其提取物对羊肉膻味脂肪酸沉积及贮藏期肉品质的影响[J/OL]. 食品科学, 2021: 1-12. (2021-07-27)[2022-01-14]. http://kns.cnki.net/kcms/detail/11.2206.TS.20210727.0921.016.html. LIU W J, LI S Y, TANG D F, et al. Adding Allium mongolicum regel and its extracts to lamb feed: influence on the flavor and odor fatty acids deposition and meat quality during storage time[J/OL]. Food Science, 2021: 1-12. (2021-07-27)[2022-01-14]. http://kns.cnki.net/kcms/detail/11.2206.TS.20210727.0921.016.html. (in Chinese) |
| [10] |
卢媛. 沙葱、地椒风味活性成分及其对绵羊瘤胃发酵和羊肉风味的影响[D]. 呼和浩特: 内蒙古农业大学, 2002: 32-35. LU Y. Analysis of active compounds relative to meat flavour in allium mongolicum and thymus mongolicus and its effects on the rumen fermentation and meat composition for sheep[D]. Hohhot: Inner Mongolia Agricultural University, 2002: 32-35. (in Chinese) |
| [11] |
WONG E, NIXON L N, JOHNSON C B. Volatile medium chain fatty acids and mutton flavor[J]. J Agric Food Chem, 1975, 23(3): 495-498. DOI:10.1021/jf60199a044 |
| [12] |
WONG E, JOHNSON C B, NIXON L N. The contribution of 4-methyloctanoic (hircinoic) acid to mutton and goat meat flavour[J]. New Zeal J Agric Res, 1975, 18(3): 261-266. DOI:10.1080/00288233.1975.10423642 |
| [13] |
BERTHELOT V, BAS P, SCHMIDELY P, et al. Effect of dietary propionate on intake patterns and fatty acid composition of adipose tissues in lambs[J]. Small Rumin Res, 2001, 40(1): 29-39. DOI:10.1016/S0921-4488(00)00217-0 |
| [14] |
YOUNG O A, LANE G A, PRIOLO A, et al. Pastoral and species flavour in lambs raised on pasture, lucerne or maize[J]. J Sci Food Agric, 2003, 83(2): 93-104. DOI:10.1002/jsfa.1282 |
| [15] |
BERTHELOT V, PIERZYNOWSKI S G, SAUVANT D, et al. Hepatic metabolism of propionate and methylmalonate in growing lambs[J]. Livest Prod Sci, 2002, 74(1): 33-43. DOI:10.1016/S0301-6226(01)00281-0 |
| [16] |
LIU W J, DING H, ERDENE K, et al. Effects of flavonoids from Allium mongolicum Regel as a dietary additive on meat quality and composition of fatty acids related to flavor in lambs[J]. Can J Anim Sci, 2019, 99(1): 15-23. DOI:10.1139/cjas-2018-0008 |
| [17] |
LIU W J, AO C J. Effect of dietary supplementation with Allium mongolicum Regel extracts on growth performance, carcass characteristics, and the fat color and flavor-related branched-chain fatty acids concentration in ram lambs[J]. Anim Biosci, 2021, 34(7): 1134-1145. DOI:10.5713/ajas.20.0246 |
| [18] |
赵亚星, 敖长金, 包志碧, 等. 沙葱及其提取物对肉羊瘤胃发酵及微生物区系的影响[J]. 动物营养学报, 2019, 31(5): 2313-2322. ZHAO Y X, AO C J, BAO Z B, et al. Effects of Allium monogolium regel and its extracts on rumen fermentation and microflora of sheep[J]. Chinese Journal of Animal Nutrition, 2019, 31(5): 2313-2322. DOI:10.3969/j.issn.1006-267x.2019.05.038 (in Chinese) |
| [19] |
BUCKNER J S, KOLATTUKUDY P E, ROGERS L. Synthesis of multimethyl-branched fatty acids by avian and mammalian fatty acid synthetase and its regulation by malonyl-CoA decarboxylase in the uropygial gland[J]. Arch Biochem Biophys, 1978, 186(1): 152-163. DOI:10.1016/0003-9861(78)90474-5 |
| [20] |
OVERMYER K A, EVANS C R, QI N R, et al. Maximal oxidative capacity during exercise is associated with skeletal muscle fuel selection and dynamic changes in mitochondrial protein acetylation[J]. Cell Metab, 2015, 21(3): 468-478. DOI:10.1016/j.cmet.2015.02.007 |
| [21] |
GREEN C R, WALLACE M, DIVAKARUNI A S, et al. Branched-chain amino acid catabolism fuels adipocyte differentiation and lipogenesis[J]. Nat Chem Biol, 2016, 12: 15-21. DOI:10.1038/nchembio.1961 |
| [22] |
ALVES S P, BESSA R J B, QUARESMA M A G, et al. Does the fat tailed damara ovine breed have a distinct lipid metabolism leading to a high concentration of branched chain fatty acids in tissues?[J]. PLoS One, 2013, 8(10): e77313. DOI:10.1371/journal.pone.0077313 |
| [23] |
BUCCIONI A, DECANDIA M, MINIERI S, et al. Lipid metabolism in the rumen: New insights on lipolysis and biohydrogenation with an emphasis on the role of endogenous plant factors[J]. Anim Feed Sci Technol, 2012, 174(1-2): 1-25. DOI:10.1016/j.anifeedsci.2012.02.009 |
| [24] |
SAÑUDO C, ENSER M E, CAMPO M M, et al. Fatty acid composition and sensory characteristics of lamb carcasses from Britain and Spain[J]. Meat Sci, 2000, 54(4): 339-346. DOI:10.1016/S0309-1740(99)00108-4 |
| [25] |
MCKAIN N, SHINGFIELD K J, WALLACE R J. Metabolism of conjugated linoleic acids and 18:1 fatty acids by ruminal bacteria: products and mechanisms[J]. Microbiology, 2010, 156(2): 579-588. DOI:10.1099/mic.0.036442-0 |
| [26] |
WATKINS P J, FRANK D. Heptadecanoic acid as an indicator of BCFA content in sheep fat[J]. Meat Sci, 2019, 151: 33-35. DOI:10.1016/j.meatsci.2019.01.005 |
| [27] |
胡小中. 磷脂酰胆碱的生理功能和作用机理[J]. 粮油食品科技, 2011, 19(4): 42-44. HU X Z. Physiological function of phosphatidylcholine and its possible mechanism of action[J]. Science and Technology of Cereals, Oils and Foods, 2011, 19(4): 42-44. DOI:10.3969/j.issn.1007-7561.2011.04.016 (in Chinese) |
| [28] |
金昱龙, 童观珍, 梁丽敏. 磷脂酰乙醇胺的制备及应用研究进展[J]. 农产品加工, 2021(8): 67-69. JIN Y L, TONG G Z, LIANG L M. The research progress on preparations and application of phosphatidylethanolamine[J]. Farm Products Processing, 2021(8): 67-69. (in Chinese) |
| [29] |
KNIAZEVA M, ZHU H H, SEWELL A K, et al. A Lipid-TORC1 pathway promotes neuronal development and foraging behavior under both fed and fasted conditions in C. elegans[J]. Dev Cell, 2015, 33(3): 260-271. DOI:10.1016/j.devcel.2015.02.015 |
| [30] |
XUE J D, LV Q, KHAS E, et al. Tissue-specific regulatory mechanism of lncRNAs and methylation in sheep adipose and muscle induced by Allium mongolicum regel extracts[J]. Sci Rep, 2021, 11: 9186. DOI:10.1038/s41598-021-88444-9 |
| [31] |
李树颖, 李科, 秦雪梅, 等. 基于LC-MS代谢组学技术的注射用黄芪多糖活性成分调控巨噬细胞代谢研究[J]. 中草药, 2020, 51(6): 1575-1585. LI S Y, LI K, QIN X M, et al. Study on active constituents of Astragalus polysaccharides for injection to regulate metabolism of macrophages based on LC-MS metabolomics[J]. Chinese Traditional and Herbal Drugs, 2020, 51(6): 1575-1585. (in Chinese) |
(编辑 范子娟)



