2. 中国农业科学院兰州畜牧与兽药研究所,兰州 730050
2. Lanzhou Institute of Husbandry and Pharmaceutical Sciences of CAAS, Lanzhou 730050, China
孕酮(progesterone, P4)和雌二醇(oestrogen, E2)是妊娠建立和维持所需的重要类固醇激素,同时P4和E2也控制着子宫植入窗口期的开始和结束[1-3]。在黄体期P4分泌增加,能够抑制子宫内膜上皮细胞(endometrial epithelium cells, EEC)的增殖,并诱导间质细胞分化并改变其生理形态和功能[4]。也可调节干扰素刺激因子和组织蛋白酶L等下游因子,激活MAPK和PI3K通路,促进子宫腺体的发育[5-6]。E2也是子宫中必需的调节激素,E2能够通过胰岛素样生长因子受体激活PI3K/Akt信号通路,促进上皮细胞增殖,提供营养,调节子宫功能[7]。而在敲除雌激素受体(ERα和ERβ)的雌性动物中出现卵巢损伤、子宫发育不良和胚胎植入率下降[5]。
双氢睾酮(dihydrotestosterone, DHT)是由睾酮(testosterone, T)在5α-还原酶(5α-red1和5α-red2)不可逆地催化生成的一种重要类固醇激素,具有与雄激素受体(androgen receptor, AR)更高的亲和力,因此被认为是比T更有效的雄激素[8]。研究表明,DHT增强了P4诱导的人类子宫蜕膜化细胞的超微结构变化,并增加了猪卵巢中ERα的表达和子宫中ERβ的表达[9-10]。此外,在人子宫内膜基质细胞中,DHT和P4发挥相似作用,均以浓度依赖的方式促进细胞凋亡发生,并且DHT和P4的这种促凋亡反应可被E2拮抗[11]。细胞凋亡是由B细胞淋巴瘤蛋白2(B cell lymphoma protein 2, Bcl-2)和半胱天冬酶家族控制,并由Bcl-2相关X蛋白(Bcl-2-associated X protein, Bax)/ Bcl比率决定细胞凋亡敏感性[12]。在对黄体退化的研究中发现,DHT显著减少了Bax和半胱天冬酶3(caspase 3, CASP3)的表达,抑制黄体细胞凋亡[13]。然而,DHT是否通过影响反刍动物EEC的凋亡而影响子宫生理功能,尚未见系统报道。
因此,本试验以小尾寒羊为研究对象,检测不同子宫时期DHT合成酶及受体表达,并用不同浓度的DHT(10-10~10-7 mol·L-1)和AR抑制剂氟他胺(flutamide, Flu)处理体外培养的绵羊EEC,检测P4和E2水平、合成酶及受体的表达。同时检测相关凋亡因子表达。为阐明DHT是否通过调节P4、E2和细胞凋亡影响子宫功能提供新数据。
1 材料与方法 1.1 主要试剂和抗体牛血清白蛋白(BSA,SW3015)、TRIzol(R1100)和RIPA裂解液(R0010)均购于Solarbio公司,显影液、定影液和ECL发光液均购于Beyotime公司,胎牛血清(FBS)和DMEM/F12培养基(SH30023.01)均购于Hyclone公司,两步法反转录试剂盒购于Promega公司,DHT和Flu标准品购于Sigma公司,P4(TY98251)和E2(TY98241)ELISA试剂盒购于上海颖心。抗体:5α-red1(bs-11308R)、5α-red2(bs-6700R)、类固醇合成急性调节蛋白(StAR,bs-3570R)、细胞色素P450侧链裂解酶(P450 scc,bs-10099R)、芳香化酶(P450arom,bs-0114M)、孕酮受体(PGR,bs-23376R)、G蛋白偶联雌激素受体(GPER,bs-1380R)、活化半胱天冬酶3(Act-CASP3,bs-0081R)、β-actin(bs-0061R)以及二抗(bs-0295G-HRP和bs-40296G-HRP)均购于北京Bioss;ERα(ab-66102)、ERβ(ab-3576)、AR(ab-3509)均购于英国Abcam;Bax(T40051)、Bcl-2(T45006)均购于上海Abmart。
1.2 样品收集小尾寒羊,年龄约1.5岁,体重约25~35 kg。在当地屠宰场收集卵泡期(n=8)、黄体期(n=6)和妊娠期(n=5)的正常子宫,放置在35~37 ℃含有青霉素和链霉素的磷酸盐缓冲生理盐水(PBS)中运回实验室。在冰上用手术刀分离不同时期的子宫角,PBS清洗3次,-80 ℃下储存。
1.3 子宫内膜上皮细胞培养与处理根据文献[14],体外培养卵泡期绵羊子宫内膜上皮细胞。使用DMEM/F12培养基培养,48 h更换1次,直到细胞密度约85%~90%。处理前添加不含FBS的DMEM/F12培养基12 h。为研究DHT对P4和E2相关蛋白及子宫凋亡的影响,将终浓度为10-10~10-7 mol·L-1的DHT和10-8mol·L-1 Flu加入无血清DMEM/F12培养基中24 h。
1.4 酶联免疫吸附试验(ELISA)根据ELISA试剂盒说明书,检测经Flu和不同浓度DHT处理的上皮细胞上清液中P4和E2的浓度,上清液通过0.45 mm过滤器过滤。试剂盒最低检测浓度P4小于0.1 ng·mL-1,E2小于1.0 pg·mL-1,板内变异系数小于10%、板间变异系数小于15%。P4含量以ng·mL-1表示,E2含量以pg·mL-1表示。
1.5 细胞鉴定与细胞免疫荧光用免疫荧光法检测细胞角蛋白18、5α-还原酶和AR在绵羊子宫内膜上皮细胞中的表达。将培养的内膜细胞固定在载玻片上后,PBS洗涤,并用5 mL 4%(V/V)多聚甲醛固定,并在-20 ℃下保存。使用时,在4 ℃下用PBS洗涤,用0.1%(V/V)曲拉通处理30 min,然后用5%(V/V)BSA孵育30 min。一抗孵育(角蛋白18和5α-还原酶,1∶300;AR,1∶200)。阴性对照用2%的BSA代替一级抗体孵育。使用FITC偶联的山羊抗兔IgG抗体进行检测(1∶200),然后使用1 μg·mL-1 4, 6-二氨基-2-苯基吲哚(DAPI)进行核重复染色拍照。
1.6 总RNA提取及qRT-PCR通过TRIzol处理组织和细胞沉淀样品,释放总RNA。用微量核酸分析仪测定吸光度A260 nm/A280 nm值,电泳检测RNA纯度和完整性。使用prime script RT试剂盒和gDNA橡皮擦反向转录获得cDNA。检测不同部位和培养细胞中5α-red1、5α-red2、AR、StAR、P450 scc、3β羟基类固醇脱氢酶(3β-HSD)、P450arom、PGR、ERα、ERβ、Bax、Bcl-2和CASP3,以β-actin为参考基因。设定条件为95 ℃ 300 s,95 ℃ 5 s,60 ℃ 30 s,共45个循环。结果由2-ΔCt计算得出[15]。引物序列见表 1。
|
|
表 1 目的基因与内参基因引物序列 Table 1 Primers sequence of target genes and house-keeping gene |
向样品中加入RIPA蛋白裂解液和蛋白酶抑制剂PMSF,充分裂解,12 000×g,4 ℃离心15 min。提取总蛋白,并使用BCA蛋白检测试剂盒检测蛋白浓度。然后将收集的蛋白质上清液加入5×蛋白上样缓冲液中,充分混合,在98 ℃变性15 min,-20 ℃储存。使用实验室改良的Western blot技术[13],该技术使用SDS-PAGE分离蛋白质,并转移到PVDF膜。用1×TBST冲洗,5%脱脂奶粉的TBST密封1 h。经一抗4 ℃孵育24 h,其中5α-red1、5α-red2、StAR、P450 scc、P450arom、PGR、GPER和Act CASP3均为1∶500配制,ERα、ERβ和AR均为1∶1 000配制,Bax和Bcl-2均为1∶1 500配制,以β-actin(1∶4 000)为内参,膜与辣根过氧化物酶(HRP)标记的二抗(1∶4 000)37 ℃共孵育1 h。用增强化学发光溶液检测免疫复合物,并用ImageJ定量表达。
1.8 数据分析使用SPSS 24.0软件(美国IBM公司)进行统计分析。所有数据均以“平均值±标准误(Mean±SEM)”表示,并进行正态性和同方差检验、单因素方差分析和邓肯多重检验。如果P<0.05,则差异显著。
2 结果 2.1 体外培养的EEC的鉴定及5α-red1、5α-red2和AR的表达和定位如图 1所示,通过免疫荧光染色检测细胞角蛋白18的表达,结果显示细胞角蛋白18在细胞质中表达。5α-red1、5α-red2和AR在EEC的细胞质和细胞核中表达。
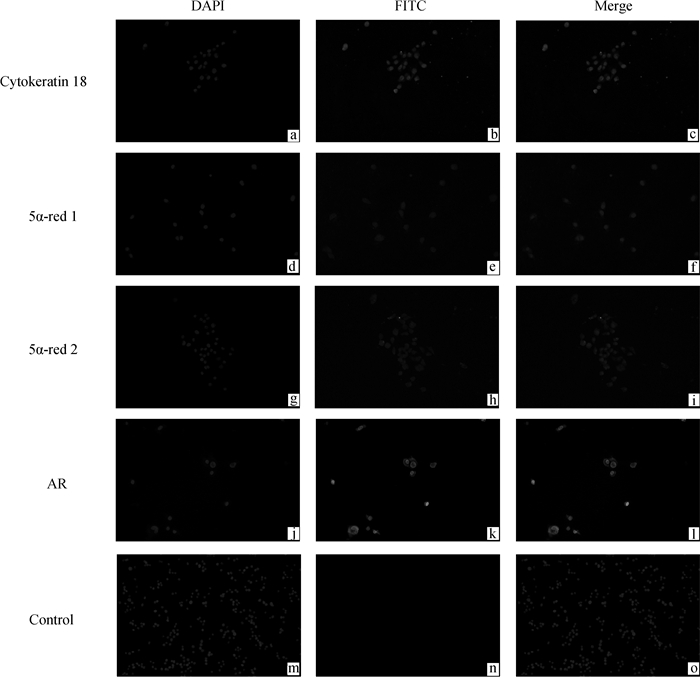
|
a~c. Cytokeratin 18的表达;d~i. DHT合成酶5α-red1和5α-red2的表达;j~l. AR的表达;m~o.阴性对照 a-c. Expression of cytokeratin 18; d-i. Expression of DHT synthetase 5α-red1 and 5α-red2; j-l. Expression of AR; m-o. Negative control 图 1 绵羊子宫内膜上皮细胞鉴定及DHT合成酶和雄激素受体AR的免疫荧光分析(200×) Fig. 1 Sheep EEC identification and DHT synthetase and AR immunofluorescence analysis(200×) |
DHT合成酶5α-red1、5α-red2和AR在子宫不同阶段的表达水平如图 2A~C。5α-red1、5α-red2和AR在妊娠子宫中的mRNA及蛋白表达明显低于卵泡期子宫和黄体期子宫(P<0.05)。
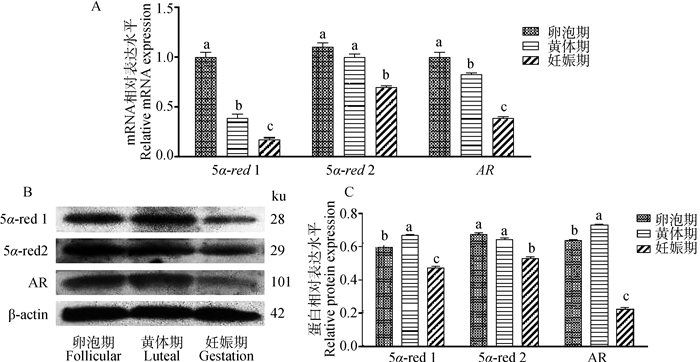
|
A.5α-red1、5α-red2和AR相对mRNA水平;B.5α-red1、5α-red2和AR蛋白质免疫印迹;C.5α-red1、5α-red2和AR的相对蛋白水平。不同小写字母之间差异显著(P<0.05),相同字母之间差异不显著(P>0.05), 下同 A.Relative mRNA levels of 5α-red1, 5α-red2 and AR; B.Western blot of 5α-red1, 5α-red2 and AR; C.Relative protein levels of 5α-red1, 5α-red2 and AR. There was significant difference between different lowercase letters (P < 0.05), and there was no significant difference between the same letters (P > 0.05), the same as below 图 2 绵羊子宫不同时期5α-red1、5α-red2和AR表达 Fig. 2 Expression of 5α-red1, 5α-red2 and AR in sheep uterus at different stages |
为了检测DHT是否通过AR发挥作用,添加不同浓度DHT(10-10~10-7 mol·L-1)体外培养绵羊子内膜上皮细胞。结果如图 3,在10-8~10-7 mol·L-1时,AR mRNA的表达显著高于对照组和10-10mol·L-1组(P<0.05)。在10-8~10-7 mol· L-1时,AR蛋白表达显著高于对照组和10-10~10-9 mol·L-1组(P<0.05)。

|
A.AR相对mRNA水平;B.AR蛋白质印迹;C.AR的相对蛋白水平 A. AR relative mRNA levels; B. AR Western blot; C. AR relative protein levels 图 3 DHT对体外培养的绵羊子宫内膜上皮细胞中AR表达的影响 Fig. 3 Effect of DHT on AR expression of sheep EEC in vitro |
在DHT(10-8~10-7mol·L-1)时,P4水平显著升高(P<0.05,图 4A)。对照组和处理组(10-10~ 10-7 mol·L-1)的P4平均浓度分别为(12.66±0.54)、(12.93±0.29)、(13.32±0.32)、(14.95±0.44)和(16.03±0.31) ng·mL-1。此外,还检测P4合成酶StAR、P450 scc、3β-HSD和PGR的表达(图 4B~D)。结果发现,StAR蛋白和mRNA的表达以浓度依赖的方式增加,P450 scc蛋白和mRNA的表达也上调,在10-7 mol·L-1 DHT时最为显著(P<0.05)。DHT对3β-HSD mRNA表达的上调在10-8 mol·L-1时最为显著(P<0.05)。PGR mRNA表达在10-10~10-9和10-7 mol·L-1 DHT上调,而PGR蛋白表达在10-10~10-8 mol·L-1 DHT上调,但在10-7 mol·L-1 DHT下调(P<0.05)。

|
A.孕酮水平;B.StAR、P450 scc、3β-HSD和PGR的相对mRNA水平;C.StAR、P450 scc和PGR的蛋白质免疫印迹;D.StAR、P450 scc和PGR的相对蛋白水平 A.P4 levels; B.Relative mRNA levels of StAR, P450 scc, 3β-HSD and PGR; C. Western blot of StAR, P450 scc and PGR; D. StAR, P450 scc and PGR relative protein levels 图 4 DHT对EEC中P4合成和PGR表达的影响 Fig. 4 Effects of DHT on P4 synthesis and PGR expression in EEC |
为探索DHT对P4的影响是否由AR介导,添加了10-8 mol·L-1 Flu。结果显示,添加Flu的处理组较DHT处理组的P4水平显著降低(P<0.05,图 5A)。对照组和处理组的P4平均浓度分别为(13.59±0.39)、(14.95±0.44)、(13.74±0.35)和(13.13±0.10) ng·mL-1。StAR、P450 scc、3β-HSD和PGR的表达,如图 5B~D所示。在mRNA表达方面,添加10-8 mol·L-1 DHT和10-8 mol·L-1 Flu显著抑制StAR、P450 scc、3β-HSD和PGR的表达(P<0.05)。然而,蛋白表达中,只有StAR的表达被Flu阻断(P<0.05),P450 scc和PGR的表达并未减少,反而P450 scc的表达在添加10-8mol·L-1 DHT和10-8mol·L-1 Flu时表达增加(P<0.05)。
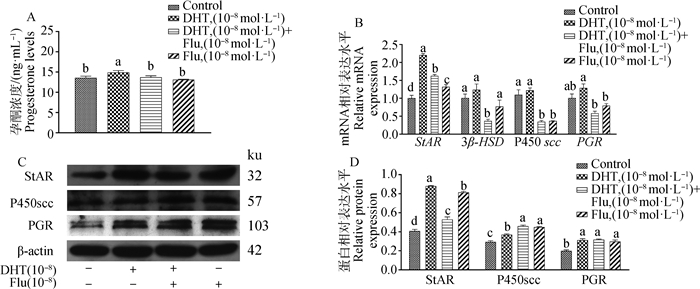
|
A.孕酮水平;B.StAR、P450 scc、3β-HSD和PGR的相对mRNA水平;C.StAR、P450 scc和PGR的蛋白质免疫印迹;D.StAR、P450 scc和PGR的相对蛋白水平 A.P4 levels; B.Relative mRNA levels of StAR, P450 scc, 3β-HSD and PGR; C. Western blot of StAR, P450 scc and PGR; D. StAR, P450 scc and PGR relative protein levels 图 5 添加Flu对EEC中P4合成和PGR表达的影响 Fig. 5 Effects of addition of Flu on P4 synthesis and PGR expression in EEC |
结果表明,10-8~10-7 mol·L-1 DHT时,E2水平显著降低,在10-8 mol·L-1 DHT时最显著(P<0.05,图 6A)。对照组和处理组的E2平均浓度分别为(155.30±4.23)、(151.18±2.37)、(143.62±0.57)、(121.75±2.54)和(130.38±3.69) pg·mL-1。添加10-10~10-7 mol·L-1 DHT可降低P450arom和ERα mRNA和蛋白质的表达,且差异显著(P<0.05)。然而,DHT促进了ERβ和GPER的表达,在10-9~10-7 mol·L-1 DHT时显著上调(P<0.05)。

|
A.雌二醇水平;B. P450arom、ERα、ERβ和GPER的相对mRNA水平;C. P450arom、ERα、ERβ和GPER的蛋白质免疫印迹;D. P450arom、ERα、ERβ和GPER的相对蛋白水平 A.E2 levels; B.Relative mRNA levels of P450arom, ERα, ERβ and GPER; C.Western blot of P450arom, ERα, ERβ and GPER; D.P450arom, ERα, ERβ and GPER relative protein levels 图 6 DHT对EEC中E2合成及雌激素受体表达的影响 Fig. 6 Effects of DHT on E2 synthesis and oestrogen receptor expression in EEC |
添加Flu结果显示,E2水平的降低被阻止,且差异显著(P<0.05,图 7A)。对照组和处理组的E2水平分别为(157.09±1.25)、(120.23±0.51)、(140.02± 0.14)、(141.70±3.05) pg·mL-1。P450arom、ERα、ERβ和GPER的表达如图 7B~D所示。结果表明,10-8 mol·L-1 DHT降低了P450arom和ERα mRNA和ERα蛋白质的表达。这种下降被10-8mol·L-1 Flu部分阻断(P<0.05),也部分阻断了ERβ mRNA和GPER蛋白表达的增加(P<0.05)。

|
A.雌二醇水平;B. P450arom、ERα、ERβ和GPER的相对mRNA水平;C. P450arom、ERα、ERβ和GPER的蛋白质免疫印迹;D. P450arom、ERα、ERβ和GPER的相对蛋白水平 A.E2 levels; B.Relative mRNA levels of P450arom, ERα, ERβ and GPER; C.Western blot of P450arom, ERα, ERβ and GPER; D.P450arom, ERα, ERβ and GPER relative protein levels 图 7 添加Flu对EEC中E2合成和雌激素受体表达的影响 Fig. 7 Effects of addition of Flu on E2 synthesis and oestrogen receptor expression in EEC |
为探索DHT对绵羊子宫内膜上皮细胞体外凋亡的影响,相关凋亡因子Bax、Bcl-2、CASP3和Act-CASP3的表达如图 8A~C。结果表明,随着DHT浓度的增加(10-10~10-7 mol·L-1),Bax mRNA和蛋白表达增加,CASP3 mRNA和Act-CASP3蛋白表达增加(P<0.05)。10-10和10-9 mol·L-1 DHT分别增加Bcl-2的mRNA和蛋白表达。但10-9和10-7 mol·L-1 DHT降低了Bcl-2 mRNA表达(P<0.05)。10-10~10-7mol·L-1 DHT上调Bax/Bcl-2比值。凋亡敏感性增加。
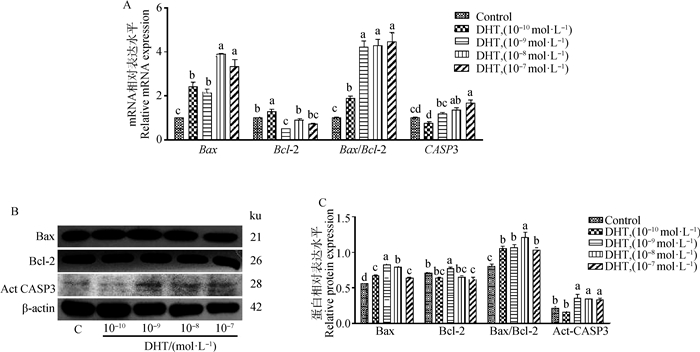
|
A.Bax、Bcl-2、Bax/Bcl-2和CASP3相对mRNA水平;B.Bax、Bcl-2和Act-CASP3的蛋白质免疫印迹;C.Bax、Bcl-2和Act-CASP3的相对蛋白水平 A. Relative mRNA levels of Bax, Bcl-2, Bax/Bcl-2 and CASP3; B. Western blot of Bax, Bcl-2 and Act-CASP3; C. Relative protein levels of Bax, Bcl-2, and Act-Casp3 图 8 不同浓度DHT对EEC中相关凋亡因子的影响 Fig. 8 Effects of different concentrations of DHT on apoptosis-related factors of EEC |
为检测DHT对凋亡的影响是否由AR介导,添加Flu检测体外培养的绵羊EEC的凋亡相关因子变化(图 9A~C)。结果显示,10-8mol·L-1 Flu部分阻断了10-8 mol·L-1 DHT对Bax、CASP3和Act-CASP3 mRNA和蛋白表达的增加(P<0.05),而对Bcl-2的mRNA和蛋白表达没有影响。Bax/Bcl-2的表达被10-8 mol·L-1 Flu部分阻断,显著低于10-8mol·L-1 DHT(P<0.05)。
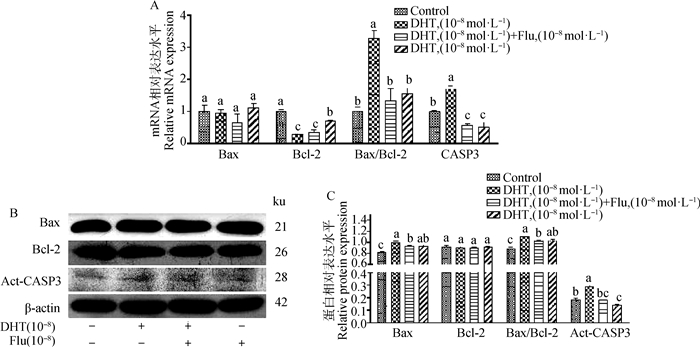
|
A.Bax、Bcl-2、Bax/Bcl-2和CASP3相对mRNA水平;B.Bax、Bcl-2和Act-CASP3的蛋白质免疫印迹;C.Bax、Bcl-2、和Act-CASP3的相对蛋白水平 A. Relative mRNA levels of Bax, Bcl-2, Bax/Bcl-2 and CASP3; B. Western blot of Bax, Bcl-2 and Act-CASP3; C. Relative protein levels of Bax, Bcl-2, and Act-CASP3 图 9 添加Flu对EEC中相关凋亡因子的影响 Fig. 9 Effects of Flu addition on apoptosis-related factors of EEC |
DHT参与调节子宫功能[16-18]。本研究中,5α-red1、5α-red2和AR在绵羊EEC中表达,这与人、猪、大鼠和小鼠的结果一致[19-22],表明绵羊子宫内膜细胞能够合成和利用DHT。在绵羊子宫不同时期DHT合成酶和AR表达存在差异。妊娠期子宫中DHT合成和AR表达最低。这表明DHT可能在不同阶段发挥不同的生物学作用,例如黄体退化[13]。已有证据表明,DHT在小鼠子宫中调节子宫内膜周期,并严格控制G1/S和G2/M细胞,触发转率级联,调控子宫细胞生长[16]。此外,本试验还检测了DHT对EEC中AR的影响。结果显示,高浓度DHT可能通过配体-受体效应促进AR的表达。在雌性动物中,缺乏AR可能会导致多种妊娠疾病,如子宫内膜异位症和反复流产[23]。这些证据充分表明DHT通过AR影响子宫功能。
DHT和P4在子宫中可能发挥相似的生物学功能,P4的生物学作用需要其特异性受体PGR介导[11, 24-25]。本试验发现,DHT可促进P4合成酶StAR和P450 scc基因和蛋白的表达,这可能会增加子宫中P4的浓度,从而发挥生理作用。研究表明,子宫内的P4可拮抗E2,促进膜细胞凋亡,并降低子宫重量[11]。同时,AR抑制剂Flu可以阻断P4合成酶的增加,表明DHT至少部分通过AR介导调节P4合成。此外,DHT也显著增加PGR的蛋白表达,但在高浓度下抑制了这种增加,这与DHT处理子宫内膜外植体和体外Ishikawa细胞的结果一致[26]。Flu阻断了PGR的上调,表明DHT对PGR的上调也部分依赖于AR的介导作用。研究表明,P4和PGR的增加能够有效的减弱子宫收缩,从而减少因子宫过度蠕动而引起的子宫内膜异位症,还可促进胚胎植入[27]。此外,DHT对P4的调节可能是宫内腺体形成的一个重要机制[28]。这些证据表明,DHT在子宫中能够调节P4合成,进而调控子宫的正常生理环境。
E2也是调节子宫内环境的重要参与者,能够调节子宫内膜增殖、分化、脱落和再生周期[29-32]。DHT影响E2的合成,在本试验中,DHT减少P450arom的合成可被Flu阻断,表明至少部分通过AR介导,E2浓度与此结果一致。研究表明,DHT可以拮抗E2诱导的子宫内膜细胞增殖和蜕膜化[11]。结合本试验可推测,DHT和P4可能在促进子宫细胞凋亡中发挥类似的作用。此外,DHT对ERα和ERβ有调控作用,DHT增加了子宫中的ERβ,但降低了ERα的表达,这与猪的结果相似[10]。在对AR和ER的基因分析中显示,AR和ER可能共享类似的控制基因片段或上游调节器或串扰效应[28, 33-34]。这部分解释了DHT对ERβ的促进作用,并且DHT也可能通过ERβ介导发挥作用。此外,DHT增加颗粒细胞中的ERα和ERβ,但下调E2合成酶P450arom的表达[35]。结合本试验,推测认为在子宫中DHT发挥生物学功能不仅通过基因组和非基因组途径,还通过其它途径。DHT上调GPER,这种上调没有被Flu阻断,这表明DHT上调GPER可能不是由AR介导的。
细胞凋亡受Bcl-2家族和caspase家族调控[36-38]。在本试验中,DHT增加了Bax的表达,降低了Bcl-2的水平,增加了Bax/Bcl-2的比率。这表明DHT促进子宫内膜细胞凋亡。在子宫内膜基因组分析中,DHT可通过伴侣蛋白HSP105和叉头框蛋白1促进细胞凋亡[16, 19]。但在黄体细胞中,DHT抑制了黄体细胞凋亡,这种差异可能和参与不同生理功能有关[13, 39]。在本试验中,DHT还上调Act-CASP3蛋白和CASP3基因的表达。而在添加Flu后,Bax、Act-CASP3和CASP3的表达下调,表明AR至少部分参与介导。推测,这种DHT在子宫中促进细胞凋亡,可能与防止子宫内膜异常增生有关。有趣的是,在去卵巢小鼠中,DHT增加了子宫重量、子宫内膜和子宫肌层的横截面积[28]。此外,DHT可以恢复类固醇耗尽的子宫功能[40]。DHT这种促进或抑制凋亡的生物学作用是否与卵巢切除有关,DHT是否在子宫中部分代替P4和E2发挥作用,值得今后进一步研究。
4 结论DHT的合成和AR的表达在绵羊子宫的不同阶段存在差异。此外,DHT至少部分通过AR调控P4和E2合成、受体表达以及EEC凋亡,并参与子宫生理功能的调节。本研究为雄激素参与调节子宫功能机制提供新的数据和基础。
| [1] |
LESSEY B A, YOUNG S L. What exactly is endometrial receptivity?[J]. Fertil Steril, 2019, 111(4): 611-617. DOI:10.1016/j.fertnstert.2019.02.009 |
| [2] |
SPENCER T E, BAZER F W. Biology of progesterone action during pregnancy recognition and maintenance of pregnancy[J]. Front Biosci, 2002, 7(4): d1879-d1898. DOI:10.2741/A886 |
| [3] |
KOBAYASHI R, TERAKAWA J, OMATSU T, et al. The window of implantation is closed by estrogen via insulin-like growth factor 1 pathway[J]. J Reprod Infertil, 2017, 18(2): 231-241. |
| [4] |
GEBRIL M, HIROTA Y, AIKAWA S, et al. Uterine epithelial progesterone receptor governs uterine receptivity through epithelial cell differentiation[J]. Endocrinology, 2020, 161(12): bqaa195. DOI:10.1210/endocr/bqaa195 |
| [5] |
BAZER F W, SONG G, KIM J, et al. Uterine biology in pigs and sheep[J]. J Anim Sci Biotechnol, 2012, 3(1): 23. DOI:10.1186/2049-1891-3-23 |
| [6] |
GRIFFITHS R M, PRU C A, BEHURA S K, et al. AMPK is required for uterine receptivity and normal responses to steroid hormones[J]. Reproduction, 2020, 159(6): 707-717. DOI:10.1530/REP-19-0402 |
| [7] |
GREGG RICHARDS R, KLOTZ D M, BUSH M R, et al. E2-induced degradation of uterine insulin receptor substrate-2: requirement for an IGF-I-stimulated, proteasome-dependent pathway[J]. Endocrinology, 2001, 142(9): 3842-3849. DOI:10.1210/endo.142.9.8370 |
| [8] |
SWERDLOFF R S, DUDLEY R E, PAGE S T, et al. Dihydrotestosterone: biochemistry, physiology, and clinical implications of elevated blood levels[J]. Endocr Rev, 2017, 38(3): 220-254. DOI:10.1210/er.2016-1067 |
| [9] |
KAJIHARA T, TANAKA K, OGURO T, et al. Androgens modulate the morphological characteristics of human endometrial stromal cells decidualized in vitro[J]. Reprod Sci, 2014, 21(3): 372-380. DOI:10.1177/1933719113497280 |
| [10] |
CÁRDENAS H, POPE W F. Estrogen receptors in the uterus and ovarian follicles of gilts treated with dihydrotestosterone[J]. Domest Anim Endocrinol, 2005, 29(3): 523-533. DOI:10.1016/j.domaniend.2005.03.001 |
| [11] |
WEN J D, ZHU H, MURAKAMI S, et al. Regulation of A Disintegrin and metalloproteinase with thrombospondin repeats-1 expression in human endometrial stromal cells by gonadal steroids involves progestins, androgens, and estrogens[J]. J Clin Endocrinol Metab, 2006, 91(12): 4825-4835. DOI:10.1210/jc.2006-1567 |
| [12] |
SIDDIQUI W A, AHAD A, AHSAN H. The mystery of BCL2 family: Bcl-2 proteins and apoptosis: an update[J]. Arch Toxicol, 2015, 89(3): 289-317. DOI:10.1007/s00204-014-1448-7 |
| [13] |
XIAO L F, SONG L L, HU J J, et al. Dihydrotestosterone synthesis in the sheep corpus luteum and its potential mechanism in luteal regression[J]. J Cell Physiol, 2019, 234(9): 15182-15193. DOI:10.1002/jcp.28159 |
| [14] |
DE CLERCQ K, HENNES A, VRIENS J. Isolation of mouse endometrial epithelial and stromal cells for in vitro decidualization[J]. J Vis Exp, 2017(121): 55168. |
| [15] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the Method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [16] |
IVANGA M, LABRIE Y, CALVO E, et al. Fine temporal analysis of DHT transcriptional modulation of the ATM/Gadd45 g signaling pathways in the mouse uterus[J]. Mol Reprod Dev, 2009, 76(3): 278-288. DOI:10.1002/mrd.20949 |
| [17] |
GIBSON D A, SIMITSIDELLIS I, COLLINS F, et al. Endometrial intracrinology: oestrogens, androgens and endometrial disorders[J]. Int J Mol Sci, 2018, 19(10): 3276. DOI:10.3390/ijms19103276 |
| [18] |
KHATUN M, MELTSOV A, LAVOGINA D, et al. Decidualized endometrial stromal cells present with altered androgen response in PCOS[J]. Sci Rep, 2021, 11(1): 16287. DOI:10.1038/s41598-021-95705-0 |
| [19] |
KAJIHARA T, TOCHIGI H, PRECHAPANICH J, et al. Androgen signaling in decidualizing human endometrial stromal cells enhances resistance to oxidative stress[J]. Fertil Steril, 2012, 97(1): 185-191. DOI:10.1016/j.fertnstert.2011.10.017 |
| [20] |
POPE W F, CÁRDENAS H. Androgens in female pig reproduction: actions mediated by the androgen receptor[J]. Soc Reprod Fertil Suppl, 2006, 62: 55-67. |
| [21] |
GISELA S B, VIRGINIA A M, GABRIELA A A, et al. Androgen receptor and uterine histoarchitecture in a PCOS rat model[J]. Mol Cell Endocrinol, 2020, 518: 110973. DOI:10.1016/j.mce.2020.110973 |
| [22] |
CHOI J P, ZHENG Y, SKULTE K A, et al. Development and characterization of uterine glandular epithelium specific androgen receptor knockout mouse model[J]. Biol Reprod, 2015, 93(5): 120. |
| [23] |
CHANG C, LEE S O, WANG R S, et al. Androgen receptor (AR) physiological roles in male and female reproductive systems: lessons learned from AR-knockout mice lacking AR in selective cells[J]. Biol Reprod, 2013, 89(1): 21. |
| [24] |
BAZER F W, BURGHARDT R C, JOHNSON G A, et al. Interferons and progesterone for establishment and maintenance of pregnancy: interactions among novel cell signaling pathways[J]. Reprod Biol, 2008, 8(3): 179-211. DOI:10.1016/S1642-431X(12)60012-6 |
| [25] |
HIROTA Y. Progesterone governs endometrial proliferation-differentiation switching and blastocyst implantation[J]. Endocr J, 2019, 66(3): 199-206. DOI:10.1507/endocrj.EJ18-0431 |
| [26] |
BABAYEV S N, PARK C W, KELLER P W, et al. Androgens upregulate endometrial epithelial progesterone receptor expression: potential implications for endometriosis[J]. Reprod Sci, 2017, 24(10): 1454-1461. DOI:10.1177/1933719117691145 |
| [27] |
OPPELT P G, WEBER M, MUELLER A, et al. Comparison of dienogest and progesterone effects on uterine contractility in the extracorporeal perfusion model of swine uteri[J]. Acta Obstet Gynecol Scand, 2018, 97(11): 1293-1299. DOI:10.1111/aogs.13428 |
| [28] |
SIMITSIDELLIS L, GIBSON D A, COUSINS F L, et al. A role for androgens in epithelial proliferation and formation of glands in the mouse uterus[J]. Endocrinology, 2016, 157(5): 2116-2128. DOI:10.1210/en.2015-2032 |
| [29] |
HEWITT S C, CARMONA M, FOLEY K G, et al. Peri- and postpubertal estrogen exposures of female mice optimize uterine responses later in life[J]. Endocrinology, 2020, 161(8): bqaa081. DOI:10.1210/endocr/bqaa081 |
| [30] |
VASQUEZ Y M. Estrogen-regulated transcription: Mammary gland and uterus[J]. Steroids, 2018, 133: 82-86. DOI:10.1016/j.steroids.2017.12.014 |
| [31] |
MIYAMOTO T, SHIOZAWA T. Two-sided role of estrogen on endometrial carcinogenesis: stimulator or suppressor?[J]. Gynecol Endocrinol, 2019, 35(5): 370-375. DOI:10.1080/09513590.2018.1549219 |
| [32] |
FITZGERALD H C, DHAKAL P, BEHURA S K, et al. Self-renewing endometrial epithelial organoids of the human uterus[J]. Proc Natl Acad Sci USA, 2019, 116(46): 23132-23142. DOI:10.1073/pnas.1915389116 |
| [33] |
SOMMER A, HAENDLER B. Androgen receptor and prostate cancer: molecular aspects and gene expression profiling[J]. Curr Opin Drug Discov Devel, 2003, 6(5): 702-711. |
| [34] |
GESERICK C, MEYER H A, HAENDLER B. The role of DNA response elements as allosteric modulators of steroid receptor function[J]. Mol Cell Endocrinol, 2005, 236(1-2): 1-7. DOI:10.1016/j.mce.2005.03.007 |
| [35] |
DUAN H W, GE W B, YANG S S, et al. Dihydrotestosterone regulates oestrogen secretion, oestrogen receptor expression, and apoptosis in granulosa cells during antral follicle development[J]. J Steroid Biochem Mol Biol, 2021, 207: 105819. DOI:10.1016/j.jsbmb.2021.105819 |
| [36] |
KALE J, OSTERLUND E J, ANDREWS D W. BCL-2 family proteins: changing partners in the dance towards death[J]. Cell Death Differ, 2018, 25(1): 65-80. DOI:10.1038/cdd.2017.186 |
| [37] |
BASU A. The interplay between apoptosis and cellular senescence: Bcl-2 family proteins as targets for cancer therapy[J]. Pharmacol Ther, 2022, 230: 107943. DOI:10.1016/j.pharmthera.2021.107943 |
| [38] |
CZABOTAR P E, LESSENE G, STRASSER A, et al. Control of apoptosis by the BCL-2 protein family: implications for physiology and therapy[J]. Nat Rev Mol Cell Biol, 2014, 15(1): 49-63. DOI:10.1038/nrm3722 |
| [39] |
ADAMS J, LIU Z L, REN Y A, et al. Enhanced inflammatory transcriptome in the granulosa cells of women with polycystic ovarian syndrome[J]. J Clin Endocrinol Metab, 2016, 101(9): 3459-3468. DOI:10.1210/jc.2015-4275 |
| [40] |
SIMITSIDELLIS I, ESNAL-ZUFIAURRE A, KELEPOURI O, et al. Selective androgen receptor modulators (SARMs) have specific impacts on the mouse uterus[J]. J Endocrinol, 2019, 242(3): 227-239. DOI:10.1530/JOE-19-0153 |
(编辑 孟培)



