奶牛作为重要的经济动物,是我国畜牧业的重要组成部分。随着人民生活水平的提高,人们对牛奶及乳制品的需求也日益增加。乳脂是牛奶中重要的营养物质之一,是衡量牛乳品质的关键指标。乳脂的主要成分是甘油三酯(triacylglycerol,TAG),占乳脂肪的95%~98%[1]。奶牛乳脂的合成受到环境、激素和细胞因子等众多因素的影响,激素及信号转导系统可以促进乳腺的发育,对于泌乳的启动和维持至关重要[2-5]。此外,在泌乳期间多基因的共同作用对牛奶的品质有重要的调控作用,如固醇调节元件结合蛋白(sterol regulatory element binding proteins,SREBPs)和过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors,PPARs)等在调控乳脂合成关键基因表达和促进奶牛乳脂合成过程中起着重要的作用[6-8]。
特异性蛋白SP1(specificity protein 1,SP1)是一种进化上高度保守的转录因子,C端含有3个串联的Cys2His2型锌指结构域。该结构域特异性地识别GC盒(GGGGCGGGG)与GT盒(GGTGTGGG),参与几乎所有细胞功能,包括细胞增殖、凋亡、分化和新生物的转化等[9-11]。通过对基因序列特征及其表达的研究发现,湖羊SP1基因可抑制人卵巢颗粒细胞增殖、诱导其凋亡[12]。Zhu等[13]通过对西农萨能奶山羊的SP1基因序列和表达信息分析,发现SP1在调节脂质合成下游基因的表达及脂肪酸代谢中发挥重要作用。张广杰等[14]克隆了广西巴马小型猪SP1基因序列并测序,SP1蛋白结构预测结果未发现信号肽和跨膜区,是非外分泌型蛋白,主要在细胞内活动。王凤等[15]发现,SP1基因的差异表达对小尾寒羊尾部前体脂肪细胞分化和脂质沉积具有正向调控作用。先前的研究发现,胰岛素通过SP1调节SREBP-1c的转录,响应胰岛素诱导的脂肪生成,这对SP1调节脂质代谢提供了一个有力依据[16]。SP1靶向乳脂球-EGF因子8(milk fat globule-EGF factor 8,MFG-E8)5′端结合位点,正向调节MFG-E8启动活性,在减轻炎症和维持组织稳态方面起着重要作用[17]。奶牛乳腺上皮细胞的乳脂合成对乳品质的提高至关重要,SP1作为调控基因表达普遍存在的转录因子,探究奶牛SP1基因的结构及其对乳脂合成的影响,对于揭示奶牛乳脂合成的调控机制具有重要意义。大量研究表明,转录因子SP1在细胞生长和代谢中起到关键作用,但其对奶牛乳脂合成的调控研究还鲜有报道。
本研究通过多种生物信息学软件分析SP1蛋白的理化性质与结构特征,采用PCR方法构建SP1重组过表达载体。利用实时荧光定量PCR和Western blot技术检测不同时期奶牛乳腺组织SP1的表达情况。分离并纯化奶牛乳腺上皮细胞,通过在细胞中过表达和干扰SP1,检测SP1表达对TAG合成的影响。本研究为SP1的蛋白结构和功能的相适应性及其对奶牛乳脂合成的调控提供了理论依据。
1 材料与方法 1.1 试验材料本研究选取6头健康的泌乳早期荷斯坦奶牛(第3胎次,52~54月龄产犊),其中3头母牛在从妊娠期开始到泌乳,第90天屠宰,3头在干奶第30天屠宰。放血后在无菌环境下去除结缔组织和脂肪组织,将乳腺实体组织剪成约1 cm3的小块置于液氮中速冻,然后-80 ℃保存,用于后续RNA和蛋白质的提取。对于细胞培养,将新鲜泌乳期奶牛乳腺组织置于D-hanks平衡盐溶液中,立即送往实验室进行细胞分离培养。
1.2 主要试剂与仪器TRIzol Reagent(15596026,Invitrogen)、Prime ScriptTM RT reagent Kit(RR037A,TaKaRa); Prime STAR HS DNA Polymerase(R010A,TaKaRa); Ace Q®qPCR SYBR®Green Master Mix kit(Q111-02,Vazyme); PCR产物纯化回收试剂盒(AE0201-A,SparkJade); 大肠杆菌DH5α感受态细胞购自擎科生物技术有限公司。
冷冻离心机(5418R,Eppendorf); 荧光定量PCR仪(Applied Biosystems 7500 Realtime PCR system,USA); PCR仪(Mastercycler nexus,Eppendoff); 生物样本低温快速制备系统(BSH-C2,GeneReady); NanoDrop One/Onec (ND-ONE-W,Thermo Fisher)。
1.3 引物设计根据GenBank上查找到的奶牛SP1基因序列(NM_001078027.1),采用Primer Premier 5.0软件分别设计扩增SP1基因CDS区全长引物及荧光定量PCR引物,详见表 1。引物经过Blast特异性比对后,送由擎科生物公司合成。
|
|
表 1 引物信息 Table 1 Primers information |
TRIzol法提取泌乳期奶牛乳腺组织总RNA,用琼脂糖凝胶电泳和NanoDrop检测RNA的质量及浓度。再根据PrimeScript RT Reagent Kit说明书对得到的RNA进行反转录,反应体系:5×Prime Script Buffer 4 μL,Oligo(dT)(50 μmol·L-1)和Random 6 mers(100 μmol·L-1)各1 μL,总RNA 1 μg,PrimeScript RT Enzyme 1 μL,加入ddH2O至20 μL。将混合物置于37 ℃孵育15 min,85 ℃ 5 s反转录酶变性灭活,得到的cDNA产物-20 ℃保存。
PCR扩增体系:cDNA模板1 μL,PrimeSTAR HS DNA Polymerase 1 μL,上、下游引物(10 mmol·L-1) 各1 μL,dNTP(2.5 mmol·L-1)4 μL,加ddH2O至50 μL。反应程序:98 ℃预变性5 min; 98 ℃变性10 s,60 ℃退火15 s,72 ℃延伸3 min,共32个循环。取5 μL PCR产物用1.0%琼脂糖凝胶电泳检测。对PCR产物进行纯化回收,将纯化后的PCR产物与pcDNA3.1(+)载体分别用Hind Ⅲ和Xho Ⅰ进行双酶切,胶回收产物25 ℃连接2 h,构建重组质粒,并将其转化大肠杆菌DH5α感受态细胞中,37 ℃震荡培养1 h。将转化产物均匀涂布在带有Amp抗性的LB琼脂平板上,37 ℃过夜培养。挑取单菌落接种在带有Amp抗性的LB液体培养基中,37 ℃震荡培养过夜。菌液送交擎科生物公司测序,测序结果用DNAMAN软件进行序列比对。将正确的菌液(记作:pcDNA3.1-SP1)提质粒备用。
1.5 SP1基因的生物信息学分析NCBI(https://www.ncbi.nlm.nih.gov/)数据库中查找并获得不同物种SP1基因序列:牛(NM_ 001078027.1)、猪(XM_005652567.3)、马(XM_023643655.1)、兔(XM_008256514.2)、小鼠(NM_013672.2)、大鼠(NM_012655.2)、猕猴(NM_001266924.1)、山羊(NM_001285760.1)、斑马鱼(NM_212662.2)、人(NM_001251825.2),利用Mega 7.0软件进行同源性比对并构建系统进化树。
利用ExPASy网站(https://web.expasy.org/protscale/)在线分析预测中国荷斯坦奶牛SP1蛋白的亲水性和理化性质; 利用NCBI上的Conserved Domains程序(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测中国荷斯坦牛SP1蛋白的保守结构域; 采用NPS@SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)和SWISS-MODEL(https://swissmodel.expasy.org/) 在线软件分别预测中国荷斯坦奶牛SP1蛋白二级结构和三级结构; 利用STRING(htps:/string-db.org/)在线预测与SP1可能相互作用的蛋白质。
1.6 实时荧光定量PCR检测SP1基因的mRNA表达TRIzol法提取不同时期奶牛乳腺组织总RNA,反转录成cDNA。利用实时荧光定量PCR检测不同时期荷斯坦奶牛乳腺组织中SP1基因的表达水平。采用Applied Biosystems 7500 Real-time PCR system仪器和Ace Q®qPCR SYBR®Green Master Mix kit试剂盒进行实时荧光定量PCR反应。反应体系20 μL:Ace Q®qPCR SYBR®Green Master Mix 10 μL; 上、下游引物(10 μmol·L-1)各0.4 μL; 模板DNA 2 μL,加ddH2O至20 μL。反应程序为:95 ℃预变性3 min; 95 ℃变性10 s,60 ℃退火30 s,40个循环,进行3次独立试验,并对结果进行统计学分析。以β-actin的CT值为内参,SP1基因表达量的计算方法为2-ΔΔCT,ΔCT=CTSP1-CTβ-actin。
1.7 奶牛乳腺上皮细胞的培养与鉴定泌乳期奶牛乳腺实体组织经过清洗、消毒处理后,采用组织块法分离乳腺上皮细胞。将剪碎的乳腺组织以适当密度均匀接种于预铺鼠尾胶原的细胞培养瓶中,倒置于含5% CO2,37 ℃培养箱中培养,待组织块牢固地贴在瓶底时,加入含20%胎牛血清的DMEM/F12完全培养液,同时添加青霉素(100 U·mL-1)和链霉素(100 μg·mL-1)。观察组织块周围爬出细胞的状况,待细胞铺满培养瓶底时轻轻吹掉组织块,并根据细胞对胰蛋白酶的敏感性不同,对细胞进行纯化。将1×105个纯化后的细胞接种至35 mm玻底培养皿中,用4%多聚甲醛固定后加入5% BSA的PBST溶液封闭1 h,然后用角蛋白18(Keratin 18,CK18)抗体(兔源,1∶100稀释,ABclonal)4 ℃孵育过夜,清洗一抗后用FITC标记山羊抗兔的二抗(1∶200稀释,ABclonal)孵育1 h,用1 μg·mL-1的DAPI标记细胞核,激光共聚焦显微镜观察CK18在细胞中的表达。
1.8 细胞转染将2×105个纯化后的乳腺上皮细胞接种于6孔板中,待细胞生长至70%融合单层时,更换成无血清的培养液,每孔加入2.5 μg的pcDNA3.1-SP1质粒及5 μL Lipofectamine 2000的混合物,对照组转染pcDNA3.1(+)空载体; 对于基因沉默,每孔加入10 μL SP1 siRNA(20 μmol·L-1)及5 μL Lipofectamine 2000的混合物,对照组每孔加入10 μL Negative control(20 μmol·L-1)。转染后6 h换成完全培养基继续在37 ℃、CO2培养箱中培养48 h,进行后续检测。SP1 siRNA干扰片段序列为(sense): 5′-GCGUUUCUGCAGCUACCUUGA-3′; Negative control序列为(sense): 5′-UUCUCCGAAC-GUGUCACGUTT-3′。
1.9 Western blot检测SP1蛋白的表达取20 mg不同时期的奶牛乳腺组织加入200 μL RIPA裂解液,用组织破碎仪低温匀浆,充分裂解后,12 000 r·min-1离心10 min,取上清备用; 对不同处理的奶牛乳腺上皮细胞,加入适量的细胞裂解液低温裂解细胞,12 000 r·min-1离心10 min,取上清备用。采用BCA浓度测定试剂盒测定乳腺组织或细胞的总蛋白浓度。然后取20 μg蛋白样品经10% SDS-PAGE凝胶电泳分离,并转移到NC膜。5%脱脂乳封闭1 h后分别与SP1和β-actin特异性抗体(均为兔源,1∶1 000稀释,ABclonal)4 ℃孵育过夜。将NC膜用TBST冲洗3次后,用HRP标记的山羊抗兔的二抗在37 ℃孵育1 h,TBST洗3次,采用化学发光检测系统对印迹进行检测。采用Image J软件对条带进行灰度分析,与内参β-actin进行比较,分析SP1蛋白的表达情况。
1.10 SP1表达对TAG合成的影响细胞分别转染SP1基因过表达质粒和RNAi,48 h后细胞用裂解液低温裂解约10 min,短暂离心后收集上清,采用TAG检测试剂盒(E1003,普利莱)测定不同处理组奶牛乳腺上皮细胞中TAG含量; 相应细胞样品的蛋白浓度由BCA浓度检测试剂盒测定,每个处理重复3次。
1.11 数据处理与统计分析采用GraphPad Prism 6软件对数据进行统计分析,试验数据以“平均值±标准误”表示。不同处理的两组数据之间采用t检验进行统计检验。“*”代表P < 0.05,表示统计学差异显著; “**”代表P < 0.01,表示统计学差异极显著; P>0.05表示差异不显著。
2 结果 2.1 SP1基因克隆提取奶牛乳腺组织总RNA反转录为cDNA,通过PCR扩增SP1基因CDS区,经过1.0%琼脂糖凝胶电泳后得到清晰明亮的条带,大小与实际(2 361 bp)相符(图 1)。将PCR产物与pcDNA3.1(+) 载体通过酶切、连接并转化至大肠杆菌DH5α感受态细胞中,挑取单菌落测序。测序结果通过DNAMAN软件对比结果显示该基因片段与预期序列一致,成功克隆出奶牛SP1基因。
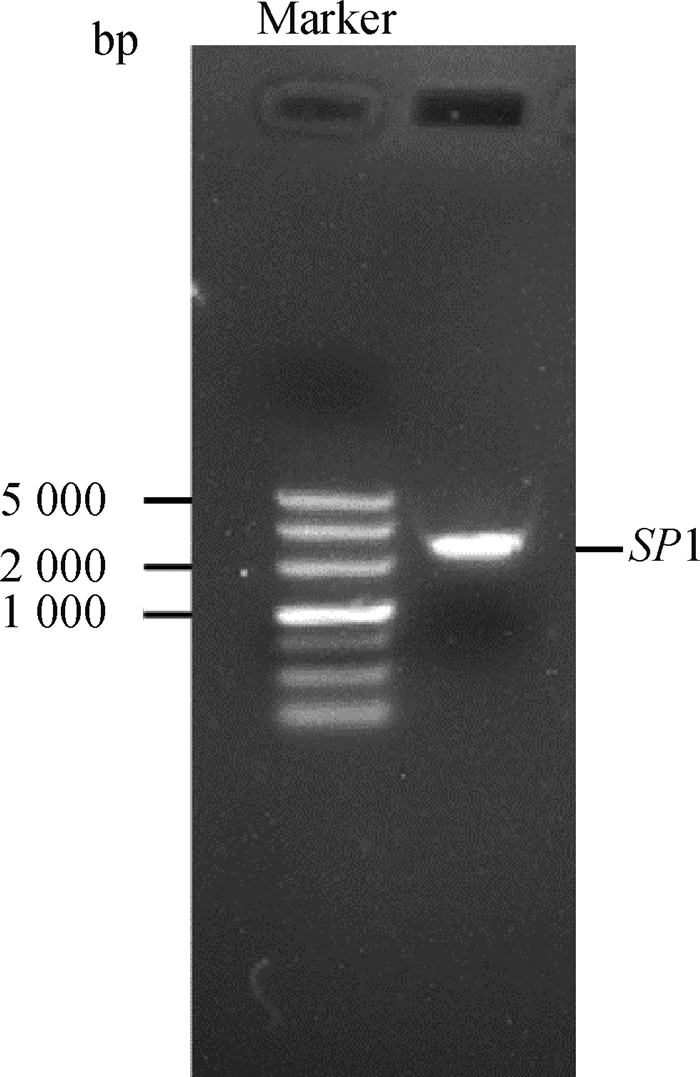
|
图 1 SP1基因CDS区PCR扩增结果 Fig. 1 PCR amplification results of SP1 gene CDS region |
根据NCBI已发布的各物种基因序列,通过Mega7.0软件对不同物种SP1序列进行同源性比对,结果显示中国荷斯坦奶牛SP1基因与马、猪、兔、猕猴、小鼠、大鼠、人的同源性分别为95.43%、95.43%、91.65%、94.29%、90.07%、91.55%、88.65%。其中,奶牛SP1序列与山羊的相似度最高为98.94%;与斑马鱼的相似度最低为40.35%。使用Mega 7.0软件构建系统进化树,结果如图 2所示,奶牛SP1序列同源性与山羊最近,与斑马鱼最远。

|
图 2 SP1基因系统进化树 Fig. 2 The phylogenetic tree of SP1 gene |
通过ExPASy-ProtParam网站对SP1蛋白分析发现,该蛋白分子质量为80 902.17 u,等电点为6.94,不稳定指数为53.09,属于不稳定蛋白。SP1基因共编码786个氨基酸,其中丝氨酸(Ser)含量最高(13.0%),色氨酸(Trp)含量最低(0.5%)(表 2)。带负电氨基酸(Asp + Glu)42个,带正电氨基酸(Arg + Lys)41个。预测的溶解度(归一化后)为0.504,该蛋白属于可溶性蛋白。
|
|
表 2 中国荷斯坦牛SP1蛋白氨基酸组成 Table 2 Amino acid composition of SP1 protein in China Holstein dairy cows |
疏水性分析对于预测蛋白质的二级结构和空间结构都具有重要的指导意义。利用Protscale软件在线分析奶牛SP1蛋白氨基酸序列的亲疏水性。如图 3A所示,亲水性氨基酸大于疏水性氨基酸,总平均亲疏水性为-0.438,说明SP1是亲水性蛋白。通过NCBI的Conserved Domains程序预测中国荷斯坦牛SP1蛋白保守结构域发现,该蛋白包含一个超家族结构域,为SP1-4N超家族结构域,位于第58~628位氨基酸处。在627~656、657~686、687~714位氨基酸区段包含3个C2H2锌指结构(图 3B)。使用NPS@SOPMA和SWISS-MODEL分别预测中国荷斯坦牛SP1蛋白的二级结构和三级结构发现,该蛋白二级结构包括α-螺旋(17.68%)、延伸链(20.87%)、无规则卷曲(52.29%)、β-转角(9.16%),如图 3C所示,不同二级结构在氨基酸序列中的位置,柱的宽窄代表上述蛋白质二级结构的比例大小。利用SWISS-MODEL在线预测奶牛SP1蛋白的三级结构(图 3D),发现三级结构的预测结果包含上述预测得到的二级结构单元。
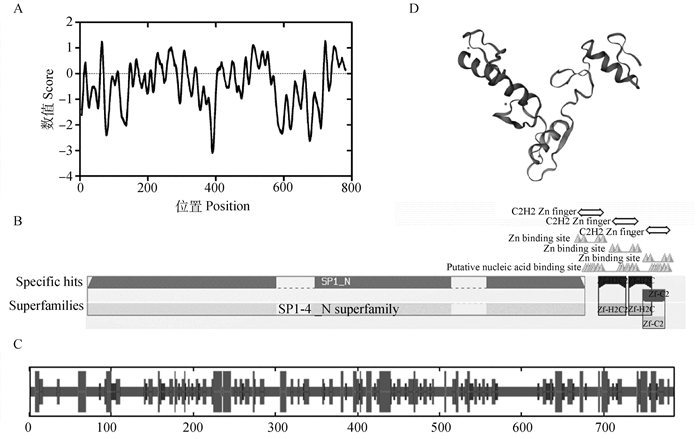
|
A.奶牛SP1蛋白疏水性预测; B.奶牛SP1蛋白保守结构域预测; C.奶牛SP1蛋白二级结构预测; D.奶牛SP1蛋白三级结构预测 A. Hydrophobicity prediction of SP1 protein in dairy cow; B. Conserved domain prediction of SP1 protein in dairy cow; C. Secondary structure prediction of SP1 protein in dairy cow; D. Tertiary structure prediction of SP1 protein in dairy cow 图 3 SP1蛋白结构分析 Fig. 3 Analysis of SP1 protein structure |
通过STRING网站分析与奶牛SP1蛋白相互作用的蛋白质。结果显示,SP1蛋白与组蛋白去乙酰化酶1(Histone deacetylase 1,HDAC1)、转录因子AP-1(transcription factor AP-1,AP-1)、细胞肿瘤抗原p53(tumor protein 53,TP53)、雌激素受体α(estrogen receptor α,ERα)、CREB结合蛋白(recombinant CREB binding protein,CREBBP)、MYC原癌基因蛋白(MYC proto-oncogene,MYC)、转录因子RELA(transcription factor p65,p65)、视网膜母细胞瘤相关蛋白(retinoblastoma protein 1,RB1)和TATA盒结合蛋白(TATA-binding protein,TBP)等蛋白存在相互作用(图 4)。其中,与E1A结合蛋白P300(recombinant E1A binding protein P300,EP300)的结合分值最高,为0.998。该结果暗示SP1在细胞增殖和代谢、信号转导、基因表达调控等途径发挥重要作用。
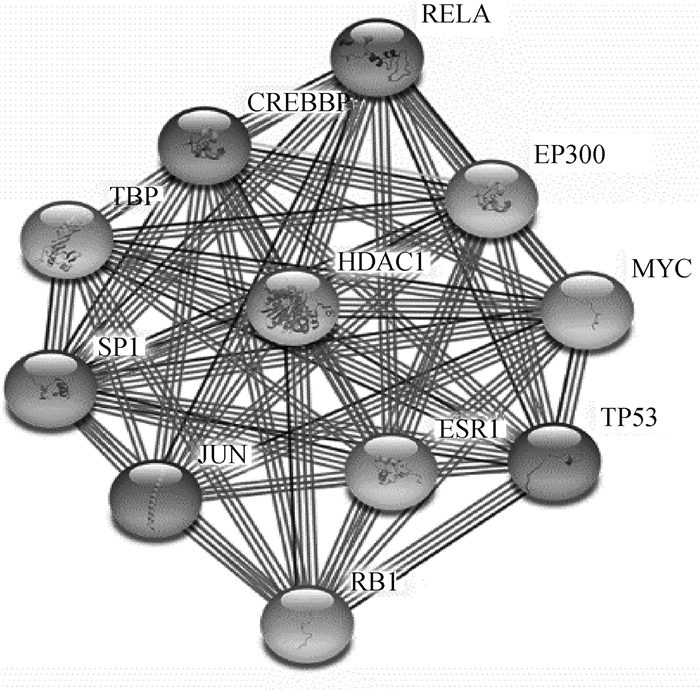
|
图 4 SP1蛋白质相互作用网络分析 Fig. 4 Analysis of SP1 protein interaction network |
为比较SP1基因在奶牛不同生理时期乳腺组织中的表达,采用荧光定量PCR方法分别检测了3头泌乳期和3头干奶期奶牛乳腺组织中SP1基因mRNA的表达。结果如图 5A所示,SP1 mRNA在泌乳期奶牛乳腺组织中的表达显著高于干奶期(P < 0.01)。随后采用Western blot方法检测不同生理时期奶牛乳腺组织中SP1蛋白水平的表达变化,以β-actin为内参。图 5B和5C结果显示,SP1蛋白在泌乳期奶牛乳腺组织中的表达显著高于干奶期(P < 0.01),暗示SP1可能在奶牛乳腺泌乳过程中发挥作用。
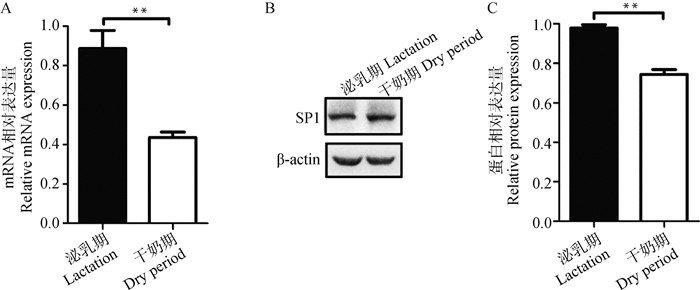
|
A. 荧光定量PCR检测不同时期乳腺组织SP1 mRNA的相对表达; B. Western blot检测不同时期乳腺组织SP1蛋白的表达; C. 乳腺组织SP1蛋白相对表达量。*.P < 0.05;**.P < 0.01,下同 A. The relative mRNA expression of SP1 in mammary tissue at different physiology stages was detected by fluorescence quantification PCR; B. The expression of SP1 protein in mammary tissue at different physiology stages was detected by Western blot; C. Relative expression level of SP1 protein in mammary tissue. *. P < 0.05; **. P < 0.01; the same as below 图 5 不同时期奶牛乳腺组织中SP1的表达 Fig. 5 Expression of SP1 in mammary gland tissue of dairy cows at different physiology stages |
原代培养的奶牛乳腺上皮细胞如图 6A所示,在相差显微镜下观察,培养第5天时组织块周围爬出大量成纤维细胞; 培养第10天可见少量乳腺上皮细胞呈现岛屿状生长; 培养第15天可见大量乳腺上皮细胞。CK18是上皮细胞的标志性蛋白,通过免疫荧光的方法检测细胞中CK18的表达情况来判定乳腺上皮细胞的纯化程度,结果如图 6B所示,图中浅灰色细丝状为FITC标记的CK18,灰色椭圆形为DAPI标记的细胞核。CK18在乳腺上皮细胞的胞质中表达,表明已获得纯化的奶牛乳腺上皮细胞。
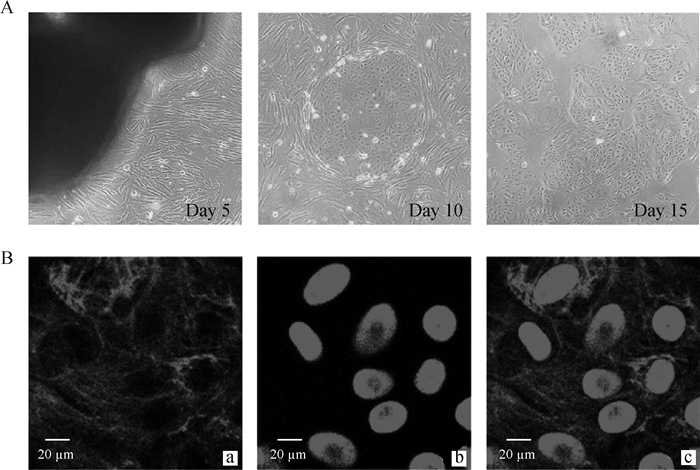
|
A.相差显微镜观察奶牛乳腺上皮细胞(200×); B.激光共聚焦显微镜观察乳腺上皮细胞中CK18的表达:a.FITC标记的CK18,浅灰色细丝状; b.DAPI标记的细胞核,灰色椭圆形; c. a和b的合成图 A. Cultured bovine mammary epithelial cells were observed by phase contrast microscope (200×); B. The expression of CK18 was observed by confocal laser microscopy: a. FITC-labeled cytokeratin 18, grey filamentous; b. DAPI-labeled nucleus, grey oval; c. Merge of a and b 图 6 奶牛乳腺上皮细胞的培养及鉴定 Fig. 6 Culture and identification of bovine mammary epithelial cells |
为研究SP1基因对奶牛乳腺上皮细胞乳脂合成的影响,本研究将牛pcDNA3.1-SP1过表达质粒和SP1 RNAi干扰片段分别转染奶牛乳腺上皮细胞。Western blot结果显示,pcDNA3.1-SP1转染的奶牛乳腺上皮细胞中SP1的表达极显著高于对照组(图 7A和7B,P < 0.001);SP1过表达显著提高细胞中TAG含量(图 7C,P < 0.01)。相反,将SP1 RNAi片段转染至奶牛乳腺上皮细胞中,极显著降低了细胞中SP1的表达(图 7D和7E,P < 0.001);TAG的合成显著下降(图 7F,P < 0.01)。以上结果表明SP1能够正向调节奶牛乳腺上皮细胞中乳脂的合成。

|
A. Western blot检测NC组和SP1过表达组SP1蛋白水平; B. SP1过表达后蛋白相对表达量; C. SP1过表达对TAG合成的影响; D. Western blot检测NC组和SP1敲降组SP1蛋白水平; E. SP1敲降后蛋白相对表达量; F. SP1敲降对TAG合成的影响 A. Western blot assays were used to evaluate the protein levels of SP1 in NC group and overexpression group; B. The relative expression level of SP1 in control and SP1 overexpressed cells; C. Effect of SP1 overexpression on TAG synthesis; D. Western blot assays were used to evaluate the protein levels of SP1 in NC group and SP1 knockdown group; E. The relative expression level of SP1 in control and SP1 knockdown cells; F. Effect of SP1 knockdown on TAG synthesis 图 7 SP1对奶牛乳腺上皮细胞中乳脂合成的影响 Fig. 7 Effect of SP1 on milk fat synthesis in bovine mammary epithelial cells |
全球对优质牛奶的需求正在增长,乳脂的合成过程受到环境、激素、细胞因子等多因素调控。乳腺上皮细胞是乳腺合成乳脂的最基本结构和功能单位,乳脂从头合成并分泌的过程首先在乙酰CoA羧化酶(acetyl-CoA carboxylase,ACC)和脂肪酸合酶(fatty acid synthase,FASN)的作用下合成并延长脂肪酸C链,随后由分化抗原蔟36(cluster of differentiation 36,CD36)等参与脂肪酸的转运。最近研究发现,乳腺中脂肪、蛋白质和乳糖合成所涉及的蛋白质编码基因的转录和转录后调控被用来提高牛奶合成效率,并提出包括一些重要转录因子(例如Spot14、ChREBP和SP1)的转录网络模型。通过乳脂、蛋白质和乳糖调节之间的相互作用来控制牛乳的合成,为研究乳脂合成基因的表达调控提供了理论依据[18]。SP1作为重要的转录因子,参与几乎所有的细胞功能,也成为疾病或肿瘤的治疗靶点[19]。本试验初步探究了奶牛乳腺中转录因子SP1的结构及其对乳脂合成的调控作用,对提高乳脂合成分泌具有重要的试验价值。
由于蛋白质的结构决定其功能,SP1蛋白的结构特征和理化性质在中国荷斯坦奶牛中尚未见报道。本研究通过对奶牛SP1基因的同源性及序列分析发现,SP1基因在不同物种间高度保守,且与山羊的同源性最高。氨基酸序列分析结果显示,SP1属于亲水性可溶蛋白,其DNA结合区位于C末端,主要由3个典型的Cys2His2型锌指结构组成。先前的研究发现,SP1通过调控转录相关因子的表达,控制RNA聚合酶Ⅲ介导的基因转录,为其调控下游众多基因的表达创造条件[20]。SP1通过结合基因调控区的GC/GT盒以及与其他蛋白质相互作用,发挥对基因转录的增强或抑制作用。SP1也可直接与转录起始复合物中TBP相关因子TAF4等蛋白相互作用,从而通过招募基本转录装置或促进其装配而激活基因转录[21]。在启动子处,SP1招募组蛋白去乙酰化酶和乙酰化酶来实现对该处组蛋白的乙酰化状态的动态调节,从而激活或者抑制基因表达[22-23]。SP1蛋白序列的分析对揭示其与DNA结合模式及调控基因表达的分子机制具有重要意义,为后期探究奶牛SP1蛋白功能提供了理论基础。本研究中蛋白质结构预测结果显示,奶牛SP1蛋白富含无规则卷曲(52.29%),这通常作为蛋白质分子行使功能和构象变化的重要区域,对研究SP1在奶牛乳腺中对基因表达的调控方式以及SP1与其他蛋白质之间相互作用的模式具有重要意义。通过STRING蛋白相互作用数据库分析发现,奶牛SP1蛋白与AP-1、p65、MYC、ERα、CREBBP、TBP等关键转录因子或转录调控因子存在相互作用,该结果暗示SP1在细胞增殖和代谢、信号转导、基因表达调控等途径中发挥重要作用,也为探究SP1调控奶牛乳脂合成的机制提供了理论依据。
SP1基因作为广泛性转录因子,几乎存在于所有细胞中,参与机体生理与病理的多种调控过程。SP1基因敲除小鼠会出现发育异常现象,如发育滞后、畸形、死胎等。在小鼠卵巢中SP1的缺失导致卵泡和卵母细胞在青春期前发生大规模丢失,导致卵巢早衰的发生,SP1通过调节小鼠颗粒前细胞发育来控制原始卵泡发生[24]。一些研究已经证明, SP1通过调节乳脂合成过程中的众多基因表达,参与调节人类、大鼠和山羊的脂肪酸合成。在小鼠中,约50%的SREBP1基因靶标被转录因子SP1占据,协同调节基因转录[25]。SP1在维持山羊乳腺上皮细胞乳脂滴合成方面发挥重要作用,SP1的异常表达可以抑制山羊TAG的积累以及与TAG合成和脂滴形成相关的基因的表达[26]。研究发现,水牛脂蛋白脂肪酶(lipoprteinlipase,LPL)基因中的一个SNP允许转录因子SP1的结合,导致基因过表达(约2.5倍),暗示SP1通过对脂质代谢关键基因的表达调控乳脂代谢[27]。最近研究发现,SP1与脂肪酸延长酶7(elongation of very long chain fatty acids protein,ELOVL7)启动子-143~+128位置碱基对的GC/GT盒特异相互作用,在乳腺上皮细胞中激活ELOVL7的表达[28]。本研究发现,泌乳期奶牛乳腺组织中SP1的表达量显著高于干奶期,暗示SP1在奶牛泌乳过程中可能发挥着重要的调控作用。在泌乳期奶牛乳腺上皮细胞中过表达或干扰SP1,细胞中TAG的合成与SP1的表达呈正相关。前期研究发现,在C57BL/6 J小鼠中SP1的表达减弱了microRNA-199a-3p对肝脂肪生成的影响,促进TAG的积累和产脂基因的表达,暗示SP1在维持小鼠肝TAG稳态中发挥潜在调控作用[29]。在脂肪细胞分化过程中,SP1可与PPARγ相互作用控制甘油三酯脂肪酶(adipose triglyceride lipase,ATGL)的转录[30]。在大鼠肝中,SP1过表达增加地塞米松诱导的脂肪生成基因(ACC1、FASN)的表达和TAG的合成,暗示SP1介导产脂基因表达及TAG合成的调节[31]。通过抑制SP1与启动子区域的结合,抑制SREBP1和SREBP2及其下游靶基因ACC和FASN的表达,在调节肿瘤细胞增殖和脂质代谢中发挥重要作用[32]。因此,SP1的表达与乳脂合成密切相关,SP1可能通过与乳脂合成关键转录因子结合调控下游基因表达,或直接结合在乳脂合成关键基因的启动子区,影响基因表达及TAG合成。尽管SP1在调节反刍动物的脂肪代谢中起着重要作用,本研究初步探究了奶牛SP1基因结构及对乳脂合成的影响,但其对奶牛乳脂合成的调节机制还有待进一步研究。
4 结论本研究对奶牛SP1基因序列进行了生物信息学分析,SP1基因在不同物种中高度保守。PCR克隆得到中国荷斯坦奶牛SP1基因CDS序列,成功构建了SP1基因的过表达载体。实时荧光定量PCR和Western blot结果显示,SP1在泌乳期奶牛乳腺组织中高表达。分离纯化得到了奶牛乳腺上皮细胞,SP1基因过表达显著促进TAG合成,SP1基因沉默显著抑制TAG合成,提示其在奶牛乳腺上皮细胞中可以正向调控乳脂合成。该结果为深入研究SP1对泌乳奶牛乳脂合成调控机制提供了理论依据。
| [1] |
王影, 文亮, 母童, 等. 荷斯坦牛高、低乳脂率牛乳代谢组分析[J]. 畜牧兽医学报, 2022, 53(5): 1396-1408. WANG Y, WEN L, MU T, et al. Metabolomic analysis of milk from Holstein cows with high and low milk fat percentage[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(5): 1396-1408. (in Chinese) |
| [2] |
母晓佳, 李大彪. 激素及细胞因子调控奶牛乳腺上皮细胞增殖和泌乳的研究进展[J]. 中国细胞生物学学报, 2021, 43(5): 1061-1067. MU X J, LI D B. Research progress of hormone and cytokine regulating proliferation and lactation of bovine mammary epithelial cells[J]. Chinese Journal of Cell Biology, 2021, 43(5): 1061-1067. (in Chinese) |
| [3] |
SCIASCIA Q, PACHECO D, MCCOARD S A. Increased milk protein synthesis in response to exogenous growth hormone is associated with changes in mechanistic (mammalian) target of rapamycin (mTOR)C1-dependent and independent cell signaling[J]. J Dairy Sci, 2013, 96(4): 2327-2338. DOI:10.3168/jds.2012-6267 |
| [4] |
姚志兰, 崔平福, 宗佳丽, 等. 奶牛泌乳启动调控激素的研究进展[J]. 畜牧与兽医, 2018, 50(8): 129-132. YAO Z L, CUI P F, ZONG J L, et al. A review of research on hormones regulating initiation of lactating in dairy cow[J]. Animal Husbandry & Veterinary Medicine, 2018, 50(8): 129-132. (in Chinese) |
| [5] |
谢佳喜, 朱河水, 杨国宇, 等. 牛乳腺脂肪合成关键酶基因在乳汁体细胞中的表达研究[J]. 畜牧兽医学报, 2011, 42(8): 1081-1087. XIE J X, ZHU H S, YANG G Y, et al. The expression of the related fatty acid synthesis key enzyme genes in bovine somatic cell[J]. Acta Veterinaria et Zootechnica Sinica, 2011, 42(8): 1081-1087. (in Chinese) |
| [6] |
KADEGOWDA A K G, BIONAZ M, PIPEROVA L S, et al. Peroxisome proliferator-activated receptor-γ activation and long-chain fatty acids alter lipogenic gene networks in bovine mammary epithelial cells to various extents[J]. J Dairy Sci, 2009, 92(9): 4276-4289. DOI:10.3168/jds.2008-1932 |
| [7] |
XU H F, LUO J, ZHANG X Y, et al. Activation of liver X receptor promotes fatty acid synthesis in goat mammary epithelial cells via modulation of SREBP1 expression[J]. J Dairy Sci, 2019, 102(4): 3544-3555. DOI:10.3168/jds.2018-15538 |
| [8] |
焦蓓蕾, 田茂, 杨春生, 等. 奶牛乳脂合成及其关键基因的调控作用[J]. 中国牛业科学, 2021, 47(2): 36-42. JIAO B L, TIAN M, YANG C S, et al. Milk fat synthesis and its influence factor in dairy cow[J]. China Cattle Science, 2021, 47(2): 36-42. DOI:10.3969/j.issn.1001-9111.2021.02.009 (in Chinese) |
| [9] |
O'CONNOR L, GILMOUR J, BONIFER C. The role of the ubiquitously expressed transcription factor Sp1 in tissue-specific transcriptional regulation and in disease[J]. Yale J Biol Med, 2016, 89(4): 513-525. |
| [10] |
VELLINGIRI B, IYER M, SUBRAMANIAM M D, et al. Understanding the role of the transcription factor Sp1 in ovarian cancer: from theory to practice[J]. Int J Mol Sci, 2020, 21(3): 1153. DOI:10.3390/ijms21031153 |
| [11] |
曾家豫, 王琦琦, 李强, 等. 转录因子Sp1在DNA损伤修复中的作用及其与肿瘤治疗的研究进展[J]. 现代肿瘤医学, 2022, 30(7): 1302-1307. ZENG J Y, WANG Q Q, LI Q, et al. Research progress on the role of transcription factor Sp1 in DNA damage repair and its relation to tumor therapy[J]. Modern Oncology, 2022, 30(7): 1302-1307. (in Chinese) |
| [12] |
姚一龙, 李隐侠, 安外尔·热合曼, 等. 湖羊Sp1基因CDS区克隆及其对颗粒细胞增殖和凋亡的影响[J]. 畜牧兽医学报, 2017, 48(11): 2098-2106. YAO Y L, LI Y X, REHEMAN A, et al. Cloning of Sp1 gene CDS region of Hu sheep and its effect on proliferation and apoptosis of granulosa cells[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(11): 2098-2106. DOI:10.11843/j.issn.0366-6964.2017.11.011 (in Chinese) |
| [13] |
ZHU J J, SUN Y T, LUO J, et al. Specificity protein 1 regulates gene expression related to fatty acid metabolism in goat mammary epithelial cells[J]. Int J Mol Sci, 2015, 16(1): 1806-1820. DOI:10.3390/ijms16011806 |
| [14] |
张广杰, 崔悦悦, 邱庆庆, 等. 广西巴马小型猪SP1基因克隆测序及其真核表达载体的构建[J]. 南方农业学报, 2018, 49(2): 360-366. ZHANG G J, CUI Y Y, QIU Q Q, et al. Clone sequencing of gene SP1 in Guangxi Bama mini pig and construction of its eukaryotic expression vector[J]. Journal of Southern Agriculture, 2018, 49(2): 360-366. DOI:10.3969/j.issn.2095-1191.2018.02.24 (in Chinese) |
| [15] |
王凤, 赵弼时, 刘旭莹, 等. 小尾寒羊SP1基因克隆及其对前体脂肪细胞分化的影响[J]. 中国畜牧兽医, 2021, 48(5): 1544-1557. WANG F, ZHAO B S, LIU X Y, et al. Cloning of SP1 gene and its effect on preadipocytes differentiation in small-tailed Han sheep[J]. China Animal Husbandry & Veterinary Medicine, 2021, 48(5): 1544-1557. (in Chinese) |
| [16] |
DENG X, ZHANG W W, O-SULLIVAN I, et al. FoxO1 inhibits sterol regulatory element-binding protein-1c (SREBP-1c) gene expression via transcription factors Sp1 and SREBP-1c[J]. J Biol Chem, 2012, 287(24): 20132-20143. DOI:10.1074/jbc.M112.347211 |
| [17] |
WANG X, BU H F, LIU S X, et al. Molecular mechanisms underlying the regulation of the MFG-E8 gene promoter activity in physiological and inflammatory conditions[J]. J Cell Biochem, 2015, 116(9): 1867-1879. |
| [18] |
OSORIO J S, LOHAKARE J, BIONAZ M. Biosynthesis of milk fat, protein, and lactose: roles of transcriptional and posttranscriptional regulation[J]. Physiol Genomics, 2016, 48(4): 231-256. |
| [19] |
SAFE S, SHRESTHA R, MOHANKUMAR K, et al. Transcription factors specificity protein and nuclear receptor 4A1 in pancreatic cancer[J]. World J Gastroenterol, 2021, 27(38): 6387-6398. |
| [20] |
PENG F X, ZHOU Y, WANG J, et al. The transcription factor Sp1 modulates RNA polymerase Ⅲ gene transcription by controlling BRF1 and GTF3C2 expression in human cells[J]. J Biol Chem, 2020, 295(14): 4617-4630. |
| [21] |
HIBINO E, HOSHINO M. A novel mode of interaction between intrinsically disordered proteins[J]. Biophys Physicobiol, 2020, 17: 86-93. |
| [22] |
RAVI V, JAIN A, KHAN D, et al. SIRT6 transcriptionally regulates global protein synthesis through transcription factor Sp1 independent of its deacetylase activity[J]. Nucleic Acids Res, 2019, 47(17): 9115-9131. |
| [23] |
ZHENG Z J, ZHANG S T, CHEN J Q, et al. The HDAC2/SP1/miR-205 feedback loop contributes to tubular epithelial cell extracellular matrix production in diabetic kidney disease[J]. Clin Sci (Lond), 2022, 136(3): 223-238. |
| [24] |
CAI H, LIU B Y, WANG H R, et al. SP1 governs primordial folliculogenesis by regulating pregranulosa cell development in mice[J]. J Mol Cell Biol, 2020, 12(3): 230-244. |
| [25] |
SEO Y K, CHONG H K, INFANTE A M, et al. Genome-wide analysis of SREBP-1 binding in mouse liver chromatin reveals a preference for promoter proximal binding to a new motif[J]. Proc Natl Acad Sci U S A, 2009, 106(33): 13765-13769. |
| [26] |
ZHU J J, LUO J, XU H F, et al. Short communication: altered expression of specificity protein 1 impairs milk fat synthesis in goat mammary epithelial cells[J]. J Dairy Sci, 2016, 99(6): 4893-4898. |
| [27] |
GU M, COSENZA G, GASPA G, et al. Sequencing of lipoprotein lipase gene in the Mediterranean river buffalo identified novel variants affecting gene expression[J]. J Dairy Sci, 2020, 103(7): 6374-6382. |
| [28] |
CHEN S, HU Z G, HE H, et al. Fatty acid elongase7 is regulated via SP1 and is involved in lipid accumulation in bovine mammary epithelial cells[J]. J Cell Physiol, 2018, 233(6): 4715-4725. |
| [29] |
CHENG Y, HUANG L, PING J, et al. MicroRNA-199a-3p attenuates hepatic lipogenesis by targeting Sp1[J]. Am J Transl Res, 2017, 9(4): 1905-1913. |
| [30] |
ROY D, FARABAUGH K T, WU J, et al. Coordinated transcriptional control of adipocyte triglyceride lipase (Atgl) by transcription factors Sp1 and peroxisome proliferator-activated receptor γ (PPARγ) during adipocyte differentiation[J]. J Biol Chem, 2017, 292(36): 14827-14835. |
| [31] |
ZHAO N N, YANG S, JIA Y M, et al. Maternal betaine supplementation attenuates glucocorticoid-induced hepatic lipid accumulation through epigenetic modification in adult offspring rats[J]. J Nutr Biochem, 2018, 54: 105-112. |
| [32] |
CHAKRABORTY P K, XIONG X H, MUSTAFI S B, et al. Role of cystathionine beta synthase in lipid metabolism in ovarian cancer[J]. Oncotarget, 2015, 6(35): 37367-37384. |
(编辑 郭云雁)



