2. 宁夏畜牧工作站,银川 750000
2. Ningxia Animal Husbandry Workstation, Yinchuan 750000, China
我国肉羊饲养数量较多,但每年仍需从新西兰和澳大利亚等国家大量进口羊肉[1],表明我国的羊肉产量并不能满足居民的需求。在羊产业发展过程中,通过提高母羊产羔数来提高羊肉年产量是解决我国羊肉供需不平衡的有效策略之一。近年来,研究人员针对绵羊的繁殖性状进行了大量研究。FecB是绵羊中鉴定出的第一个高繁殖力主效基因。1950年,澳大利亚的相关人员从选育出的比普通绵羊群体产羔率高出30%的群体中首次发现FecB基因并进行研究。1982年,FecB正式被国际绵羊和山羊遗传学命名委员会命名FecB。Souza等[2]研究发现,FecB基因来源于骨形态发生蛋白受体1B (bone morphogenetic protein receptor type 1B,BMPR1B),该基因外显子第746位A突变为G即为FecB,g.A746G突变的存在降低了颗粒细胞对BMP4刺激AMH产生的反应,进而促进母体排卵[3]。研究表明,绵羊BMPR-1B基因的FecB等位基因以剂量依赖性提高排卵率,进而提高产羔数[4-5]。
在FecB基因的检测技术探索早期,学术界常采用PCR-Sanger测序法进行绵羊的FecB基因分型,但这种测序方法在批量使用时成本较高,且结果的判断对测序公司的业务水平依赖过大。刘秋月等[6]建立了检测FecB突变的SNaPshot和TaqMan探针法,其中SNaPshot法在使用过程中假阴性和假阳性结果出现的频次较高,准确度低,TaqMan探针法可进行大批量的高效检测,也是近年来广泛应用于检测绵羊FecB突变的技术,但成本较高且探针合成周期较长。Zhou等[7]利用TaqMan探针法检验FecB突变,并统计分析了不同基因型群体的产羔率,发现FecB突变显著影响绵羊的繁殖性能。荧光定量PCR技术是一种新型核酸定量技术,具有高灵敏度、高特异性以及可定量分析等优点,被广泛应用于不同研究的多个领域[8],是基因检测的重要工具。在PCR扩增过程中,引物的特异性严重影响扩增的效率,借助这一特性,开发基于荧光qPCR技术检测FecB基因型的方法,以期实现FecB突变简便易行、廉价有效及批量化的检测。
产羔、肉和毛皮是绵羊的3大重要经济性状,其中产羔数性状在生产性能中所占权重最大。产羔数对养羊业经济效益的贡献可达到74%~96%,产双羔所获的经济效益是产单羔的1.6倍以上[9]。目前,作为广泛认知的绵羊多羔主效基因FecB无疑成为了提高绵羊高繁性能的热点。我国学者已对很多地方绵羊品种进行了FecB检测,至少发现9个品种存在FecB突变[10-13],但该突变主要存在于小尾寒羊和湖羊中,而滩羊、巴美肉羊等群体中FecB突变的存在率很低。因此,开发一种简单快速、高精准度、成本低廉的绵羊FecB分型方法用于对繁殖力较低群体进行高繁个体的筛选势在必行。本研究根据FecB基因的核苷酸序列设计两对特异性扩增引物,建立了基于荧光qPCR进行FecB突变分型的方法,与之前的多种FecB检测方法相比,具有简便、准确、高效和低成本等优势,并通过该技术筛选我国优质的地方绵羊品种滩羊中的FecB突变个体,组建优质的FecB突变高繁滩羊群体,为我国地方绵羊品种的种质创新和繁殖性能提升奠定基础。
1 材料与方法 1.1 材料1.1.1 样本采集 85只已知FecB基因型的健康、适繁雌性滩羊基因组DNA样本由本实验室保存,其中包含25个BB型,38个B+型,22个++型。
采用颈静脉采血法,使用含有EDTA2K抗凝剂的采血管在宁夏吴忠市红寺堡区天源良种羊繁育养殖有限公司收集939个滩羊血液样本,冻存后带回实验室。采用血液基因组提取试剂盒提取滩羊基因组DNA,溶于无酶水中,-20 ℃保存备用。
1.1.2 主要仪器和试剂 台式离心机(5424R,Eppendorf公司),核酸定量仪(Maestro Nano,MaestroGen公司),实时荧光定量PCR仪(LightCycler96,Roche公司),冰箱(DW-40 W255,海尔公司)。
血液基因组DNA提取试剂盒(CW0542,北京康为世纪生物科技有限公司),2×SYBR FAST qPCR Master Mix(A301-05,Gen Star公司),KOD-Plus-Neo(TOYOBO,KOD-401))高保真酶,琼脂糖,DL500 DNA marker(TaKaRa,3590A)。
1.2 方法1.2.1 引物设计与合成 以NCBI数据库中FecB基因的核苷酸序列为参照,设计PP1、PP2和PP3引物(表 1)并委托陕西中科羽瞳生物科技有限公司合成。PP1的反向引物3′端与++型的基因位点相匹配,命名为++型引物;PP2反向引物的3′端和BB型的基因位点相匹配,命名为BB型引物;PP1和PP2共用同一条上游引物。BB型代表FecB基因CDS区第746位碱基发生A至G的突变(g.A746G),导致FecB蛋白第249的谷氨酰胺突变为精氨酸(p.Q249R),++型代表FecB基因的CDS区第746位碱基未发生改变,仍为A。PP3的扩增产物包含FecB突变位点,命名为PCR-Sanger测序引物。
|
|
表 1 引物序列 Table 1 Primer sequences |
1.2.2 qPCR法检测FecB基因型 分别以939只待测或85只已知FecB基因型的滩羊血液基因组DNA为模板在体系1和体系2中进行qPCR扩增并采集荧光信号,其中体系1采用++型引物,即PP1,体系2采用BB型引物,即PP2。反应体系中待测样品基因组DNA 1 μL(30~50 ng·μL-1),SYBR FAST qPCR Master Mix 5 μL,10 μmol·L-1的正向引物0.3 μL,10 μmol·L-1反向引物0.3 μL,去离子水3.4 μL,总体系为10 μL。体系1和体系2同时按照如下程序进行扩增:95 ℃预变性10 min;95 ℃变性30 s,60 ℃退火60 s,40个循环。
1.2.3 TaqMan探针法检测FecB基因型 以85个已知FecB基因型的滩羊基因组DNA为模板,使用TaqMan探针法检测FecB基因型,详细操作步骤见参考文献[14-15]。
1.2.4 PCR-Sanger法检测FecB基因型 以85个已知FecB基因型的滩羊血液基因组DNA为模板,使用PCR-Sanger测序引物和高保真酶进行PCR扩增,扩增体系中待测样品基因组DNA 2 μL(30~50 ng·μL-1),2 mmol·L-1 dNTPs 2.5 μL,25 mmol·L-1 MgSO4 3 μL,10 μmol·L-1的正向引物1 μL,10 μmol·L-1反向引物1 μL,10×PCR Buffer for KOD-Plus-Neo 2.5 μL,KOD-Plus-Neo 0.5 μL,去离子水12.5 μL,总体系为25 μL。扩增程序为95 ℃预变性2 min;98 ℃变性10 s,62 ℃退火30 s(每个循环下降0.2 ℃),68 ℃延伸25 s,共34个循环,68 ℃延伸5 min,4 ℃保存。产物经25 g·L-1琼脂糖凝胶电泳鉴定合格后送上海生工生物工程股份有限公司使用FecB-F引物进行Sanger测序。
1.2.5 产羔率的统计 对939只滩羊群体中的584只不同FecB基因型母羊在发情后通过人工授精的方式进行配种,记录不同FecB基因型母羊妊娠及产羔数据。
1.3 数据统计及分析所有数据使用Excel 2016进行初步整理。等位基因频率按如下公式计算:B等位基因频率=(2× BB基因型个体数量+ B+型个体数量)/(2×群体数量),+等位基因频率=(2×++基因型个体数量+B+型个体数量)/(2×群体数量)。不同FecB基因型母羊群体产羔率采用卡方检验进行统计分析。
2 结果 2.1 基于荧光qPCR的滩羊FecB基因分型在qPCR进行过程中,每扩增一次采集一次荧光信号。随着反应的进行,体系1和2中扩增产物不断累积,荧光信号强度呈比例增加,根据体系1和2中荧光信号达到阈值的先后顺序判定待测样品的FecB基因型。当体系1的荧光信号强度先达到阈值时,判定待测样品FecB基因为++型(即FecB正常型)(图 1a);当体系1和2的荧光信号同时达到阈值时,判定待测样品FecB基因为B+型(即FecB突变杂合型)(图 1b);当体系2的荧光信号强度先达到阈值时,判定待测样品FecB基因为BB型(即FecB纯合突变型)(图 1c)。
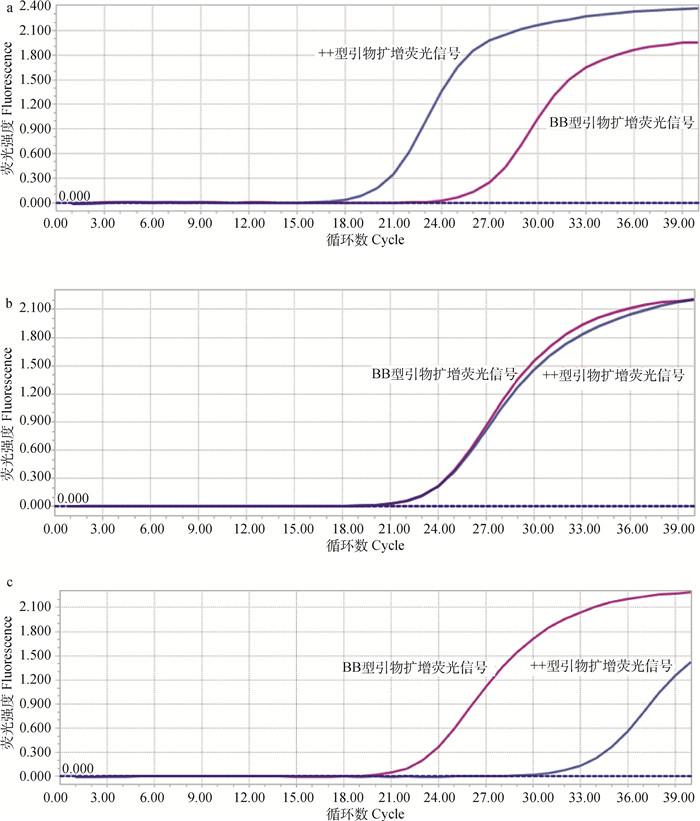
|
a. ++型荧光信号强度曲线;b. B+型荧光信号强度曲线;c. BB型荧光信号强度曲线 a. qPCR fluorescence signal intensity curve of ++ genotype samples; b. qPCR fluorescence signal intensity curve of B+ genotype samples; c. qPCR fluorescence signal intensity curve of BB genotype samples 图 1 不同基因型样品的qPCR荧光信号强度曲线 Fig. 1 qPCR fluorescence signal intensity curves of different genotype samples |
对85只已知FecB基因型的滩羊血液基因组DNA分别使用PCR-Sanger测序、TaqMan探针和荧光定量qPCR技术进行检测,结果显示PCR-Sanger测序法对BB型、B+型及++型的检测准确率分别为100%、94.7%和100%;TaqMan探针法对BB型、B+型及++型的检测准确率分别为96.0%、97.4%和100%;qPCR法对BB型、B+型及++型的检测准确率均为100%(表 2),表明本研究建立的荧光qPCR技术对绵羊FecB基因进行分型时准确率更高。
|
|
表 2 比较3种不同检测方法的准确率 Table 2 Comparison of accuracy of 3 detection methods |
由于FecB突变可以提高绵羊产羔数,将其用于育种能带来巨大的经济效益。目前已证实该突变存在于各种高繁殖力绵羊中,主要包括印度的Bonpala绵羊[16],澳大利亚的Booroola Merino绵羊,伊朗的Kalehkoohi绵羊[17],中国的湖羊[18]、小尾寒羊[19]和策勒黑羊[20]等。对939只滩羊使用荧光定量qPCR技术进行FecB突变鉴定,结果显示584只雌性滩羊中存在3只FecB纯合突变(p.Q249R)个体,35只FecB杂合突变个体,546只野生型个体;355只雄性滩羊中存在3只FecB纯合突变个体,22只FecB杂合突变个体,330只野生型个体。因此,在检测的滩羊自然群体中FecB纯合突变率仅为0.64%(6/939),杂合突变率为6.07%(57/939),野生型为93.29%(876/939);B等位基因的频率仅为0.04,+等位基因频率为0.96(表 3)。
|
|
表 3 FecB基因分布情况 Table 3 Genotype and allele frequency of FecB gene |
在584只不同FecB基因型的雌性滩羊自然发情后通过人工授精的方式配种并记录产羔数据,结果显示3只BB型母羊全部妊娠,共获得5只羔羊,产羔率达166.67%;35只B+型母羊中32只妊娠,获得49只羔羊,产羔率为153.12%;546只++型母羊中501只妊娠,获得530只羔羊,产羔率仅为105.78%,卡方检验结果表明,BB型及B+型母羊群体的产羔率极显著高于++型母羊群体(P < 0.01),BB型及B+型母羊群体间的产羔率无显著差异(P=0.65)(表 4)。
|
|
表 4 不同FecB基因型母羊群体的产羔率 Table 4 Lambing rate of ewes with different FecB genotypes |
家畜的产仔数是一个具有巨大经济价值的数量性状,受到遗传背景、饲养环境、饲料等多种因素的影响,其中遗传背景最重要,不同绵羊品种间的繁殖力差异显著。携带FecB基因的绵羊群体具有较高繁殖力,可以大幅提高养殖户或企业的经济效益[21]。据不完全统计,世界上绵羊品种产羔率超过200%以上的仅有10余个。其中布鲁拉美利奴优秀绵羊种群的平均产羔率可达350%,我国也拥有以多羔著称的湖羊和小尾寒羊等高繁殖力绵羊品种,其平均产羔率在250%以上,但国内其他大部分品种以产单羔为主[22]。滩羊属于我国典型的低繁殖力绵羊品种,成年母羊通常每年一胎且每胎单羔,严重制约着滩羊产业的发展,因此提高滩羊的繁殖效率是推动滩羊产业效益倍增的重要前提[23]。由于绵羊产羔性状的遗传力仅为0.1左右[24],传统选择方法受到性别和年龄的制约,所以利用常规育种技术改良产羔性状很难在短期内获得较大突破。因此,利用现代分子育种技术快速提高羊群产羔数是养羊业迅速发展的重要保障。
3.1 FecB突变检测技术差异PCR-RFLP和PCR-SSCP是两种最先应用于FecB基因型检测的方法,两者均需要先提取DNA,再利用特异性引物扩增包含FecB突变位点的目标产物。两者的不同在于RFLP法需要利用限制性内切酶对所得PCR产物进行酶切,然后进行琼脂糖凝胶电泳检测,根据条带大小判定FecB基因突变情况。SSCP法需将所得PCR产物变性或进行聚丙烯酰胺凝胶电泳,最后根据条带位置来判定FecB基因是否突变。显然两者都需要大量的人工操作,不能进行大批量检测且效率低。SNaPshot检测技术通过单碱基延伸技术结合测序结果判断FecB基因突变情况,但检测结果会出现假阳性或假阴性[6]。近年来,TaqMan探针法在检测基因突变中广泛使用,在PCR反应系统中加入2种带有不同荧光基团的探针与目的等位基因配对,根据所检测到的荧光值来判断FecB基因的突变类型。TaqMan探针法具有快速、高效率、操作简便等优点,但因为合成探针价格昂贵,所以检测成本较高。PCR-Sanger测序法分型具有高准确率、快速等优势,但PCR产物易受污染,且Sanger测序成本高[25]。因此,借助引物特异性影响扩增效率的基本原理,本研究开发的基于荧光qPCR技术检测FecB基因型的方法与PCR-RFLP和PCR-SSCP法相比假阳性率低,操作简单,与TaqMan探针法相比仅需合成3条引物,所以大大降低了检测成本,同时兼具快速高效、简单精准的特点。因此,基于荧光qPCR技术检测FecB基因型的方法可节省大量科研资源,具有广阔的应用前景。
3.2 荧光qPCR检测技术的应用产羔性状是绵羊产羔、肉、毛皮这3大重要经济性状之一,其所占权重最大,对养羊业经济效益的贡献可达到74%~96%,据不完全统计,产双羔群体所获得的经济效益是产单羔群体的1.6倍以上[9]。FecB基因通过提高雌性绵羊的排卵数而直接影响产羔数[3-4],因此通过分子选育在羊群中固定该基因可为养羊业带来巨大的经济效益。在中国的地方绵羊品种中,至少9个品种存在FecB基因突变[10-13]。随着种业振兴战略的布局,优良高繁母羊的选配及核心群组建需大批量地筛选FecB基因突变绵羊,且当前高繁母羊新品种的育种大部分集中在筛选不同绵羊FecB位点的分子标记,本研究建立的荧光qPCR检测FecB基因突变的方法为此提供了牢实可靠的技术支撑。
3.3 滩羊FecB基因多态性与产羔数的关系国内外学者研究发现,绵羊的产羔数受主效基因和微效多基因共同控制,目前已经定位到的主要基因包括骨形态发生蛋白15、BMPR-1B(即FecB)、糖基化酶β-1,4-N-乙酰半乳糖胺转移酶2、生长分化因子9基因和促卵泡激素受体等,这些基因分别影响着不同绵羊品种的产羔性状[26]。研究发现,上述基因中BMPR-IB基因突变体对绵羊多胎的影响远大于其他基因[5],多数多胎绵羊群体中FecB突变是提高繁殖力的“主效基因”[4, 18, 27-29]。柳淑芳等[30]研究发现,湖羊和阿勒泰羊中FecB位点的BB基因型个体的产羔数比++基因型个体平均多1.174只,B+基因型个体的产羔数比++基因型个体平均多1.016只。Davis等[31]研究发现,FecB与绵羊产羔数呈显著或极显著相关(P < 0.05或P < 0.01),因此FecB可用于绵羊人工选育中改善其繁殖力的分子标记。本研究对滩羊不同FecB基因型群体母羊的产羔数分析发现,BB和B+基因型母羊群体的产羔率显著高于++基因型母羊群体,这些结果与在湖羊、小尾寒羊等绵羊品种上研究结果一致[32-33]。本研究中,BB与B+基因型母羊群体产羔率无显著性差异,这一结果与BB基因型的母羊样本数量较少有很大的关系。综上,FecB突变影响着滩羊产羔数,未来可作为提高滩羊繁殖力的重要分子标记,提升滩羊产业的提质增效[34]。Gootwine等[35]发现BB型绵羊出生重明显低于B+和++型且断奶后生长较缓慢,但FecB基因对此生长性能的影响会随着羔羊月龄的增长而减弱[36]。因此,要注重实际生产过程中FecB突变携带羔羊的早期饲养管理。
4 结论本研究建立了检测绵羊FecB突变简便易行、廉价有效且可批量操作的荧光qPCR方法。利用此技术,在939只滩羊群体中筛选到63只FecB突变滩羊,构建了高繁滩羊核心群,并证实滩羊的FecB突变可显著提高母羊的产羔率。为筛选低繁殖力绵羊品种的FecB突变,加快本品种高繁殖力核心群的构建,打好绵羊种业振兴翻身仗奠定坚实基础。
| [1] |
刘瑶. 我国羊肉产业现状及未来发展趋势[J]. 中国饲料, 2019(17): 112-117. LIU Y. Present situation and future development trend of mutton industry in China[J]. China Feed, 2019(17): 112-117. (in Chinese) |
| [2] |
SOUZA C J H, MACDOUGALL C, CAMPBELL B K, et al. The Booroola (FecB) phenotype is associated with a mutation in the bone morphogenetic receptor type 1 B (BMPR1B) gene[J]. J Endocrinol, 2001, 169(2): R1-R6. DOI:10.1677/joe.0.169r001 |
| [3] |
ESTIENNE A, PIERRE A, DI CLEMENTE N, et al. Anti-Müllerian hormone regulation by the bone morphogenetic proteins in the sheep ovary: deciphering a direct regulatory pathway[J]. Endocrinology, 2015, 156(1): 301-313. DOI:10.1210/en.2014-1551 |
| [4] |
WILSON T, WU X Y, JUENGEL J L, et al. Highly prolific Booroola sheep have a mutation in the intracellular kinase domain of bone morphogenetic protein IB receptor (ALK-6) that is expressed in both oocytes and granulosa cells[J]. Biol Reprod, 2001, 64(4): 1225-1235. DOI:10.1095/biolreprod64.4.1225 |
| [5] |
MULSANT P, LECERF F, FABRE S, et al. Mutation in bone morphogenetic protein receptor-IB is associated with increased ovulation rate in Booroola Mérino ewes[J]. Proc Natl Acad Sci U S A, 2001, 98(9): 5104-5109. DOI:10.1073/pnas.091577598 |
| [6] |
刘秋月, 胡文萍, 贺小云, 等. 绵羊多羔主效基因FecB高通量检测方法的建立及应用[J]. 畜牧兽医学报, 2017, 48(1): 39-51. LIU Q Y, HU W P, HE X Y, et al. Establishment of high-throughput molecular detection methods for ovine high fecundity major gene FecB and their application[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(1): 39-51. (in Chinese) |
| [7] |
ZHOU S W, YU H H, ZHAO X E, et al. Generation of gene-edited sheep with a defined Booroola fecundity gene (FecBB) mutation in bone morphogenetic protein receptor type 1B (BMPR1B) via clustered regularly interspaced short palindromic repeat (CRISPR)/CRISPR-associated (Cas) 9[J]. Reprod Fertil Dev, 2018, 30(12): 1616-1621. DOI:10.1071/RD18086 |
| [8] |
安钢力. 实时荧光定量PCR技术的原理及其应用[J]. 中国现代教育装备, 2018(21): 19-21. AN G L. The principle and application of real-time fluorescent quantitative PCR[J]. China Modern Educational Equipment, 2018(21): 19-21. (in Chinese) |
| [9] |
NOTTER D R. Genetic improvement of reproductive efficiency of sheep and goats[J]. Anim Reprod Sci, 2012, 130(3-4): 147-151. DOI:10.1016/j.anireprosci.2012.01.008 |
| [10] |
潘章源, 狄冉, 刘秋月, 等. 绵羊多羔主效基因BMPR1B的研究进展[J]. 家畜生态学报, 2015, 36(5): 1-6. PAN Z Y, DI R, LIU Q Y, et al. Advances in ovine prolificacy gene BMPR1B[J]. Journal of Domestic Animal Ecology, 2015, 36(5): 1-6. DOI:10.3969/j.issn.1673-1182.2015.05.001 (in Chinese) |
| [11] |
孙红霞, 田秀娥, 王永军. BMPR-IB、BMP15和GDF9基因作为滩羊繁殖性状主效候选基因的研究[J]. 西北农业学报, 2009, 18(5): 17-21, 70. SUN H X, TIAN X E, WANG Y J. BMPR-IB, BMP15 and GDF9 as candidate genes for prolific trait in tan sheep[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2009, 18(5): 17-21, 70. DOI:10.3969/j.issn.1004-1389.2009.05.004 (in Chinese) |
| [12] |
王启贵, 钟发刚, 李辉, 等. 绵羊产羔性状主效基因检测研究[J]. 遗传, 2005, 27(1): 80-84. WANG Q G, ZHONG F G, LI H, et al. Detection of major gene on litter size in sheep[J]. Hereditas (Beijing), 2005, 27(1): 80-84. (in Chinese) |
| [13] |
朱二勇. BMPR-IB基因作为新疆几种绵羊多胎性能候选基因的研究[D]. 乌鲁木齐: 新疆农业大学, 2006. ZHU E Y. Study on bone morphogenetic protein receptor IB as a candidate gene for fecundity in several sheep breeds in Xinjiang[D]. Urumqi: Xinjiang Agricultural University, 2006. (in Chinese) |
| [14] |
储明星, 刘秋月, 狄冉, 等. 利用Taqman MGB探针检测绵羊FecB基因多态性的方法: 中国, 105176982A[P]. 2015-12-23. CHU M X, LIU Q Y, DI R, et al. Method for detecting sheep FecB gene polymorphism by using Taqman MGB probes: CN, 105176982A[P]. 2015-12-23. (in Chinese) |
| [15] |
储明星, 狄冉, 叶素成, 等. 绵羊多胎主效基因FecB分子检测方法的建立与应用[J]. 农业生物技术学报, 2009, 17(1): 52-58. CHU M X, DI R, YE S C, et al. Establishment of molecular detection methods for high prolificacy major gene FecB in sheep and its application[J]. Journal of Agricultural Biotechnology, 2009, 17(1): 52-58. DOI:10.3969/j.issn.1674-7968.2009.01.010 (in Chinese) |
| [16] |
ROY J, POLLEY S, DE S, et al. Polymorphism of fecundity genes (FecB, FecX, and FecG) in the Indian Bonpala sheep[J]. Anim Biotechnol, 2011, 22(3): 151-162. DOI:10.1080/10495398.2011.589239 |
| [17] |
MAHDAVI M, NANEKARANI S, HOSSEINI S D. Mutation in BMPR-IB gene is associated with litter size in Iranian Kalehkoohi sheep[J]. Anim Reprod Sci, 2014, 147(3-4): 93-98. DOI:10.1016/j.anireprosci.2014.04.003 |
| [18] |
GUAN F, LIU S R, SHI G Q, et al. Polymorphism of FecB gene in nine sheep breeds or strains and its effects on litter size, lamb growth and development[J]. Anim Reprod Sci, 2007, 99(1-2): 44-52. DOI:10.1016/j.anireprosci.2006.04.048 |
| [19] |
CHU M X, LIU Z H, JIAO C L, et al. Mutations in BMPR-IB and BMP-15 genes are associated with litter size in Small Tailed Han sheep (Ovis aries)[J]. J Anim Sci, 2007, 85(3): 598-603. DOI:10.2527/jas.2006-324 |
| [20] |
柏雪梅, 薛亚欣, 邢凤, 等. 策勒黑羊和多浪羊FecB基因多态性及其与产羔数的相关性研究[J]. 黑龙江畜牧兽医, 2020(1): 7-10. BAI X M, XUE Y X, XING F, et al. Association of FecB gene polymorphism with litter size in Cele Black sheep and Duolang sheep[J]. Heilongjiang Animal Science and Veterinary Medicine, 2020(1): 7-10. (in Chinese) |
| [21] |
周明亮, 庞倩, 陈明华, 等. 我国绵羊FecB基因的研究进展[J]. 草学, 2021(4): 68-72. ZHOU M L, PANG Q, CHEN M H, et al. Research progress of FecB gene in Sheep in China[J]. Journal of Grassland and Forage Science, 2021(4): 68-72. DOI:10.3969/j.issn.2096-3971.2021.04.013 (in Chinese) |
| [22] |
CHU M X, JIA L H, ZHANG Y J, et al. Polymorphisms of coding region of BMPR-IB gene and their relationship with litter size in sheep[J]. Mol Biol Rep, 2011, 38(6): 4071-4076. DOI:10.1007/s11033-010-0526-z |
| [23] |
张坤. 宁夏4个绵羊群体繁殖相关基因SNP的检测与分析[D]. 银川: 宁夏大学, 2018. ZHANG K. Detection and analysis of reproduction related gene SNP in four sheep populations in Ningxia[D]. Yinchuan: Ningxia University, 2018. (in Chinese) |
| [24] |
陶林, 潘林香, 王金文, 等. 鲁中肉羊育种中FecB突变应用效果分析[J]. 中国畜牧杂志, 2020, 56(3): 47-50. TAO L, PAN L X, WANG J W, et al. Analysis of the application effects of FecB mutation in breeding of Luzhong mutton sheep[J]. Chinese Journal of Animal Science, 2020, 56(3): 47-50. (in Chinese) |
| [25] |
刘元珍. 意大利蜜蜂(Apis mellifera ligustica)幼虫抗白垩病相关SNP分子标记的验证与应用[D]. 福州: 福建农林大学, 2016. LIU Y Z. Confirmation and application of Chalkbrood resistance-associated SNP molecular markers in Honey Bee, Apis mellifera ligustica[D]. Fuzhou: Fujian Agriculture and Forestry University, 2016. (in Chinese) |
| [26] |
PRAMOD R K, SHARMA S K, KUMAR R, et al. Genetics of ovulation rate in farm animals[J]. Vet World, 2013, 6(11): 833-838. DOI:10.14202/vetworld.2013.833-838 |
| [27] |
MIAO X Y, LUO Q M, ZHAO H J, et al. Ovarian proteomic study reveals the possible molecular mechanism for hyperprolificacy of Small Tail Han sheep[J]. Sci Rep, 2016, 6(1): 27606. DOI:10.1038/srep27606 |
| [28] |
任艳玲, 沈志强, 李敏, 等. 洼地绵羊FecB基因多态性与其产羔数关系的研究[J]. 中国畜牧兽医, 2011, 38(7): 159-162. REN Y L, SHEN Z Q, LI M, et al. Association of polymorphisms in the FecB gene with litter size in Wadi Sheep[J]. China Animal Husbandry & Veterinary Medicine, 2011, 38(7): 159-162. (in Chinese) |
| [29] |
JIA C L, LI N, ZHAO X B, et al. Association of single nucleotide polymorphisms in exon 6 region of BMPRIB gene with litter size traits in sheep[J]. Asian Austral J Anim, 2005, 18(10): 1375-1378. |
| [30] |
柳淑芳, 姜运良, 杜立新. BMPR-IB和BMP15基因作为小尾寒羊多胎性能候选基因的研究[J]. 遗传学报, 2003, 30(8): 755-760. LIU S F, JIANG Y L, DU L X. Studies of BMPR-IB and BMP15 as candidate genes for fecundity in little tailed Han sheep[J]. Acta Genetica Sinica, 2003, 30(8): 755-760. (in Chinese) |
| [31] |
DAVIS G H, MONTGOMERY G W, ALLISON A J, et al. Segregation of a major gene influencing fecundity in progeny of Booroola sheep[J]. New Zeal J Agric Res, 1982, 25(4): 525-529. |
| [32] |
喇永富, 李发弟, 杨勤, 等. FecB基因在5个中国地方绵羊品种中的多态性及其与产羔数的关联分析[J]. 中国草食动物科学, 2020, 40(2): 12-17. LA Y F, LI F D, YANG Q, et al. Genetic polymorphism of FecB gene and effect in five Chinese local sheep breeds[J]. China Herbivore Science, 2020, 40(2): 12-17. (in Chinese) |
| [33] |
孙渭博. 不同繁殖力绵羊BMPR-IB基因多态性及其与胎产羔数相关性研究[D]. 兰州: 甘肃农业大学, 2020. SUN W B. Study on the correlation between BMPR-IB gene polymorphism and litter size in sheep of different fertility[D]. Lanzhou: Gansu Agricultural University, 2020. (in Chinese) |
| [34] |
马丽娜, 于洋. 滩羊多胎基因(FecB)TaqMan探针SNP分型与产羔数的关联研究[J]. 畜牧与饲料科学, 2017, 38(3): 20-22. MA L N, YU Y. Correlation analysis between fecundity gene (FecB) SNP genotyping by TaqMan probe and litter size in Tan Sheep[J]. Animal Husbandry and Feed Science, 2017, 38(3): 20-22. (in Chinese) |
| [35] |
GOOTWINE E, ROZOV A, BOR A, et al. Carrying the FecB (Booroola) mutation is associated with lower birth weight and slower post-weaning growth rate for lambs, as well as a lighter mature bodyweight for ewes[J]. Reprod Fertil Dev, 2006, 18(4): 433-437. |
| [36] |
张也, 艾日夏提·地里夏提, 刘志强, 等. FecB基因对杜泊羊和湖羊杂交后代产羔率与生长性能的影响[J]. 中国草食动物科学, 2021, 41(2): 69-72. ZHANG Y, DILIXIATI A, LIU Z Q, et al. Effects of FecB gene on lambing rate and growth performance of Dorper and Hu Sheep hybrids[J]. China Herbivore Science, 2021, 41(2): 69-72. (in Chinese) |
(编辑 郭云雁)



