2. 河南省家禽育种国际联合实验室, 郑州 450046;
3. 河南省鸡种质资源创新与利用重点实验室, 郑州 450046
2. International Joint Research Laboratory for Poultry Breeding of Henan, Zhengzhou 450046, China;
3. Henan Key Laboratory for Innovation and Utilization of Chicken Germplasm Resources, Zhengzhou 450046, China
脂类代谢与家禽生产密切相关,对饲料转化率、肉蛋品质及产蛋性能等重要经济性状都有很大的影响[1-4]。就鸡而言,肝作为脂质代谢的中心场所,在雌激素的作用下,产蛋期鸡肝脂质代谢极为旺盛,合成大量的以甘油三酯(triglyceride,TG)和胆固醇(cholesterol,TC)为主的中性脂肪。这些中性脂肪经组装形成极低密度脂蛋白(very low density lipoprotein, VLDL)后分泌进入血液循环并被输送至卵巢,在膜受体介导的内吞作用下转运进入生长中的卵母细胞形成蛋黄[5-6]。如果TG等脂类物质在肝细胞内代谢紊乱,会导致蛋鸡营养代谢性疾病—脂肪肝的发生(fatty liver syndrome, FLS),使产蛋水平明显下降,并可进一步发展为脂肪肝出血性综合征(fatty liver hemorrhagic syndrome, FLHS)[7-8],从而影响肝的正常功能,甚至引起肝细胞破裂,最终导致肝内出血而死亡,给蛋鸡产业带来重大经济损失[9-10]。因此,研究鸡肝脂质代谢对蛋禽生产具有重要的意义。
在哺乳动物,VLDL的组装是在载脂蛋白B(apolipoprotein B,ApoB)以及微粒体甘油三酯转运蛋白(microsomal triglyceride-transfer protein,MTTP)等分子的协同作用下完成,其中MTTP是VLDL组装和分泌的限速因素[11]。抑制MTTP是治疗高脂血症和降低动脉粥样硬化风险的重要途径[12-13]。人MTTP基因突变会导致肝内的脂蛋白不能正常装配和转运,肝细胞内合成的脂质分子不能转运出细胞,细胞内脂质堆积,导致血浆中没有ApoB脂蛋白,形成无β-脂蛋白血症[14-16]。试验证明,改变MTTP活性对VLDL的形成有直接的影响[17]。然而,在家禽上,Ivessa等[18]研究表明,MTTP不是产蛋鸡合成富含ApoB脂蛋白时所必需的转运蛋白,VLDL水平的显著变化与MTTP表达水平并无相关性,表明MTTP不是鸡肝VLDL组装和分泌的关键因子[11, 18]。因此,鸡肝VLDL组装和分泌机理依然不清。
本课题组前期通过对产蛋高峰期(30周龄)与产蛋前期(20周龄)鸡肝转录组测序数据分析发现,鸡基因组中存在一个微粒体甘油三酯转运蛋白样新基因,命名为MTTP-like基因(MTTPL)。该基因在产蛋高峰期鸡肝中的表达量显著高于产蛋前期[19]。因此推测,MTTPL可能在鸡肝中发挥重要生物学功能。本研究对MTTPL进行了序列克隆以及生物学特性分析;对MTTPL进行亚细胞定位;比较分析了鸡MTTPL和MTTP的时空表达规律;最后通过在体和离体试验研究雌激素对MTTPL和MTTP表达的调控机制,这这些研究结果将为进一步揭示MTTPL在鸡肝脂质代谢中的生物学功能奠定重要基础。
1 材料与方法 1.1 试验动物及样品采集由河南农业大学家禽种质资源场提供的1日龄、1周龄、10周龄和30周龄卢氏绿壳蛋鸡各8只。颈部放血后,分别采集肝、小肠、腹脂、脾、肺、肾、胸肌、心、肌胃、腺胃、胰腺和卵巢12个组织,DEPC水冲洗后放入1.5 mL无RNA酶的离心管中,迅速放入液氮中冷冻,-80 ℃保存用于后续试验。
随机选取体重相近健康的10周龄海兰褐蛋鸡80只,分成3个试验组和1个对照组,每组20只鸡,饲养在相同的环境中,按照蛋鸡饲养标准饲喂,自由采食和饮水。经过1周预试验后,对3个试验组分别进行肌肉(胸肌)注射0.5、1和2 mg·kg-1体重浓度的17β-雌二醇(Sigma,美国),对照组注射等剂量17β-雌二醇的溶剂,分别处理12和24 h后,每个处理时间点每组随机选8只鸡,采集肝组织样本,放入液氮中冷冻,-80 ℃保存备用。
1.2 鸡胚肝原代细胞培养及雌激素处理参照改良的Fischer和Marks[20]方法分离和培养鸡胚肝原代细胞[21]。待细胞融合80%时,以5×105cells·mL-1的细胞密度接种于6孔板中,于37 ℃、5% CO2的培养箱中培养。细胞融合度达到80%左右,用无血清培养基替代完全培养基,饥饿处理6 h后替换成完全培养基。对照组用等量溶剂无水乙醇处理,试验组用溶于无水乙醇的1、50和100 nmol· L-1 17β-雌二醇分别处理12 h后,收集细胞,根据上述试验结果选取最佳雌激素反应浓度与雌激素的不同受体拮抗剂MPP(methyl-piperidino-pyrazole,ERα高度选择拮抗剂)、ICI182780(ERα和ERβ受体拮抗剂)(Sigma,美国)和Tamoxifen(ERα和ERβ拮抗剂(Sigma,美国)分别组合处理细胞,等剂量无水乙醇处理细胞作为对照,处理12 h,收集细胞-80 ℃保存,每个处理3个生物学重复,试验独立重复3次。
1.3 总RNA提取及cDNA合成参照RNAiso Plus(TaKaRa)试剂盒说明书分别提取组织和细胞中的总RNA。用NanoDrop2000紫外分光光度计检测RNA浓度和纯度,RNA OD260 nm/OD280 nm比值在1.8~2.0之间为合格RNA,等体积稀释至相同浓度,按照反转录试剂盒(TaKaRa)说明书反转录合成第一链cDNA,-20 ℃保存备用。
1.4 MTTPL基因引物设计及序列克隆以GenBank上发布的鸡MTTPL基因(XM_001232866.4)预测序列为模板,利用Primer3.0在线软件(http://primer3.ut.ee/)设计分段克隆引物,序列送上海生物工程科技服务有限公司合成引物,具体引物序列如表 1所示。以反转录获得的30周龄鸡肝组织cDNA为模板,鸡MTTPL基因分为4段扩增,即MTTPL-1、MTTPL-2、MTTPL-3、MTTPL-4。PCR扩增反应体系为25 μL:2×pfu MasterMix 12.5 μL, 第一链cDNA体积1 μL,浓度10 μmol·L-1的上、下游引物各0.5 μL,然后加双蒸水至总体积25 μL。采用降落PCR反应程序: 94 ℃预变性5 min;94 ℃预变性30 s,68 ℃(-1 ℃/每个循环)退火30 s,72 ℃延伸30 s,18个循环;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸30 s,25个循环;72 ℃终延伸10 min,4 ℃保存备用。根据试剂盒说明书纯化回收目的片段PCR产物,回收纯化后的PCR产物送上海生工技术有限公司测序,将测序后的各段序列进行拼接,利用DNAMAN对MTTPL CDS序列进行分析。
|
|
表 1 克隆引物信息 Table 1 Information of primer sequence used for gene clone |
MTTP和vitellogenin(VTG)为脂质转运家族的主要成员,为探讨MTTPL与MTTP和VTG的进化关系,从NCBI数据库中下载人、鼠、鸡、火鸡、草雀、扬子鳄、中华龟、蜥蜴、爪蛙、腔棘鱼和斑马鱼等物种的MTTPL、MTTP和VTG氨基酸序列,利用Gblock[22](http://www.phylogeny.fr/one_task.cgi?task_type=gblocks)和MEGA 6.0[23]软件构建系统发育树。利用SMART在线软件(http://smart.embl-heidelberg.de/)和TMpred(http://www.ch.embnet.org/software/TMPRED_form.html)软件预测鸡的MTTPL、MTTP和人MTTP蛋白的结构域。以人MTTP三维结构[24]为比对模板,利用SWISS MODEL(https://swissmodel.expasy.org/interactive)和Pymol软件预测蛋白质三维空间结构。
1.6 pcDNA3.1-MTTPL-EGFP重组质粒构建及细胞爬片制作在上游引物引入保护碱基、Hind III内酶切位点、kozaka序列、目的基因序列,下游引物引入保护碱基、EcoR I酶切位点、His标签和目的基因反向互补序列,利用PCR克隆获得带有Kozak序列及His标签的MTTPL CDS全长序列扩增片段,利用内切酶双酶切后用T4连接酶连接至被Hind III和EcoR I内切酶线性化的pcDNA3.1-EGFP载体上,然后转化至DH5α感受态细胞中,涂板后挑选阳性单克隆,经PCR鉴定后提取pcDNA3.1-EGFP-MTTPL重组质粒,经测序、双酶切鉴定后备用。DsRed-λ质粒(河南农业大学动物医学院赠送)是细胞内质网标签蛋白载体,用以标记活细胞内质网。
鸡LMH细胞系培养至融合度为80%时,将酒精浸泡后并烧干的盖玻片置于6孔板中,将细胞悬液(细胞密度约每孔1~2×104细胞)滴加在冷却后的盖玻片上,摇匀后置37 ℃、5% CO2培养箱中培养过夜。再将2 μg pcDNA3.1-MTTPL-EGFP、2 μg DsRed-λ与4 μL lipofectamine 2000共转染LMH细胞系,用无血清培养基培养6 h后,再替换成完全培养基培养24 h,对细胞爬片进行细胞核DAPI染色后,清洗爬片,然后在75%的酒精中浸泡消毒,将酒精烧干,冷却后在载玻片上滴加10 μL左右的抗荧光淬灭封片液,将爬片轻轻覆盖在封片液上,将封好的细胞爬片置于通风处晾干,在激光共聚焦显微镜下进行单细胞成像拍照,进行MTTPL亚细胞定位分析。
1.7 实时荧光定量PCR(real-time quantitative PCR)根据克隆的MTTPL基因CDS序列,以及NCBI数据库公布的鸡MTTP、ApoB、GAPDH的mRNA序列为模板,按照扩增片段横跨至少一个外显子的原则设计实时荧光定量PCR(real-time quantitative PCR,qPCR)引物,引物信息见表 2。
|
|
表 2 荧光定量PCR引物信息 Table 2 The primers information for qPCR |
实时荧光定量反应采用SYBR Green I染料法,GAPDH作为内参基因,PCR反应体系:2×SYBR© Green I PCR mix 5 μL, cDNA模板1 μL,10 μmol·L-1浓度的上、下游引物分别加0.5 μL,加双蒸水至总反应体积10 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环。
1.8 数据分析参考2-ΔCt法[25]计算基因在组织中的相对表达量,即:目的基因相对表达量=任意值*2-ΔCt,ΔCt=目的基因平均Ct值-内参基因平均Ct值,目的基因相对表达量=1 000*2-ΔCt。利用SPSS24.0处理数据,采用one-way ANOVA进行差异显著性分析。利用Graphpad Prism 9.0作图,数据以“均值±标准差”形式表示,P≤0.05表示差异显著,P≤0.01表示差异极显著。
2 结果 2.1 鸡MTTPL CDS克隆及蛋白质三维结构分析利用PCR扩增和测序技术得到MTTPL1-4片段序列,然后拼接得到MTTPL CDS区长度为2 646 bp,可编码881个氨基酸残基,在GenBank数据库中基因注释号为KT899704。
根据MTTPL CDS序列推测其蛋白序列,利用软件预测鸡MTTPL和MTTP蛋白的三维结构,然后分别与已知的人MTTP蛋白三维结构进行比对分析,结果如图 1所示,预测的鸡MTTPL和MTTP蛋白质三维结构与人MTTP三维结构相似度偏差分别为0.090、0.064。功能结构区域与人MTTP一致,包括C端、中间区域和N端,且不存在结构变异。

|
A.鸡MTTPL与人MTTP三维结构比对图;B.鸡MTTP与人MTTP三维结构比对图 A. Three-dimensional structure comparison between chicken MTTPL and human MTTP; B. Three-dimensional structure comparison between chicken MTTP and human MTTP 图 1 鸡MTTPL和MTTP蛋白分别与人MTTP三维结构比对分析 Fig. 1 Three-dimensional structure comparisons analysis of chicken MTTPL and MTTP proteins with human MTTP |
利用各物种MTTPL、MTTP和VTG氨基酸序列进行系统进化树分析。采用NJ法,模型选取JTT模型,Bootstrap选择2 000次重复。结果显示,MTTPL、MTTP和VTG由同一个祖先进化而来,其中MTTPL和MTTP与VTG归到平行的二个大分支中,而MTTPL和MTTP归到两个小分支中(图 2)。

|
图 2 不同物种间MTTPL、MTTP和VTG系统发育树 Fig. 2 The phylogenetic trees of MTTPL, MTTP and VTG among different species |
利用内切酶Hind III和EcoR I对构建的pcDNA3.1-MTTPL-EGFP过表达载体进行双酶切验证,结果如图 3所示,酶切后目的片段大小与预期相一致。然后将MTTPL过表达载体与细胞内质网标签蛋白质粒DsRed-λ共转染鸡肝LMH细胞系后,激光共聚焦显微镜对细胞爬片进行单细胞成像拍照分析(图 4),结果显示MTTPL蛋白在细胞中的位置与内质网标签质粒DsRed-λ标记的位置融合,表明MTTPL蛋白定位于细胞内质网中。

|
1.重组质粒双酶切产物;2. DNA相对分子质量标准的片段长度和对应分子量 1. The double enzyme digestion of recombinant plasmid; 2. The fragments length and corresponding molecular weight of DNA marker 图 3 pcDNA3.1-MTTPL-EGFP过表达载体双酶切凝胶电泳 Fig. 3 Double enzyme digestion gel electrophoresis of pcDNA3.1-MTTPL-EGFP overexpression vector |

|
A. DsRed-λ标记的内质网;B. EGFP标记的MTTPL蛋白;C. DAPI标记细胞核;D. A、B、C的融合图 A. Endoplasmic reticulum labeled by DsRed-λ; B. MTTPL protein labeled by EGFP; C. Nucleus labeled by DAPI; D. Merged image of A, B and C images 图 4 MTTPL亚细胞定位 Fig. 4 Subcellular localization of MTTPL |
组织表达结果显示(图 5),鸡MTTPL在肝和肾中相对高丰度表达;MTTP基因在肝、十二指肠和肾相对高丰度表达。在不同周龄鸡肝中的表达检测结果显示(图 6),随着日龄的增长,MTTPL和ApoB的表达量显著上升(P < 0.05),而MTTP在1日龄、1周龄和10周龄时表达量显著上调(P < 0.05),在10周龄和30周龄之间MTTP表达量无显著变化(P>0.05)。

|
图 5 MTTPL和MTTP在30周龄鸡不同组织中的表达 Fig. 5 The expression distribution of MTTPL and MTTP in different tissues of chickens at the age of 30 weeks |

|
不同的小写字母表示组间差异显著(P≤0.05),相同的小写字母表示组间差异不显著(P>0.05)。下同 The different lowercase letters mean significant difference between groups (P≤0.05), and the same lowercase letter indicates no significant difference between groups (P > 0.05). The same as below 图 6 MTTPL和MTTP在不同生长期鸡肝中的表达规律 Fig. 6 The spatio-temporal expression of MTTPL and MTTP in liver tissue of chickens |
不同浓度17β-雌二醇处理10周龄青年母鸡12和24 h后,采集肝组织,提取RNA并反转录为cDNA。qPCR分析显示,与对照组相比,雌激素处理12和24 h后均显著上调鸡肝组织雌激素应答基因ApoB mRNA的表达水平(P < 0.05),且这种上调表达呈17β-雌二醇剂量依赖性(图 7A、7B);MTTPL mRNA表达的雌激素调控模式与ApoB的雌激素应答模式相同(图 7C、7D);17β-雌二醇处理12 h后,0.5和1 mg·kg-1浓度处理下,MTTP的表达量没有显著变化(P>0.05),2 mg·kg-1浓度时可显著抑制MTTP的表达(P < 0.05)。17β-雌二醇处理24 h后,MTTP的表达量在0.5 mg·kg-1浓度处理时无显著变化(P>0.05),而在1和2 mg·kg-1浓度的17β-雌二醇作用下显著下调(P < 0.05,图 7E、7F)。

|
A, C, E.表示17β-雌二醇处理鸡12 h后;B, D, F.表示17β-雌二醇处理鸡24 h A, C, E. Chickens treated with 17β-estradiol for 12 h; B, D, F. Chickens treated with 17β-estradiol for 24 h 图 7 不同浓度雌激素处理对鸡肝ApoB、MTTPL和MTTP基因表达的影响 Fig. 7 The effects of different concentrations estrogen on ApoB, MTTPL and MTTP expression in chicken liver |
不同浓度的17β-雌二醇处理鸡胚肝原代细胞12 h后,提取RNA并反转录为cDNA。利用qPCR检测ApoB、MTTPL和MTTP的表达情况。结果显示(图 8),与对照组相比,50和100 nmol·L-1的17β-雌二醇可显著上调ApoB的表达量(P < 0.05);不同浓度的17β-雌二醇处理后均可显著上调MTTPL的表达量(P < 0.05),而MTTP的表达没有显著变化(P>0.05)。
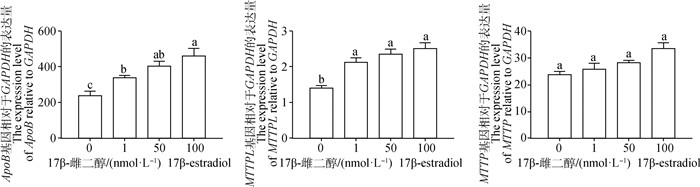
|
图 8 雌激素对鸡胚肝原代细胞MTTPL和MTTP表达的影响 Fig. 8 Effects of estrogen on the expression of MTTPL and MTTP in chicken embryo primary hepatocytes |
利用不同类型的雌激素受体拮抗剂与100 nmol·L-1雌激素共转染鸡胚肝原代细胞,利用qPCR分析各组MTTPL基因的表达水平。结果显示(图 9),与对照组相比,雌激素单独处理时,MTTPL的表达量显著升高(P < 0.05)。与雌激素处理组相比,雌激素与ERα受体的高度选择性拮抗剂MPP共处理组MTTPL的相对表达量显著下调(P < 0.05),与对照组相比无显著差异(P>0.05),说明阻断ERα抗体可抑制雌激素对MTTPL的调控作用。与MPP和雌激素共处理组相比,雌激素与ERα和ERβ受体的共同拮抗剂ICI182780和Tamoxifen分别共处理细胞时,MTTPL的相对表达量均没有发生显著变化(P>0.05),表明同时阻断ERα和ERβ受体相对于仅阻断ERα时,MTTPL的表达量没有发生显著变化(P>0.05),说明雌激素对MTTPL表达的调控主要通过ERα介导实现。

|
Control.对照组;E2.17β-雌二醇;MPP+E2.ERα拮抗剂MPP和17β-雌二醇共处理细胞;ICI+E2.ERα和ERβ拮抗剂ICI182780和17β-雌二醇共处理细胞;TAM+E2.ERα和ERβ拮抗剂GPR30兴奋剂Tamoxifen和17β-雌二醇共处理细胞 Control. The control group; E2. 17β-estradiol; MPP+E2. The antagonist of ERα MPP and 17β-estradiol co-treated cells; ICI+E2. The antagonist of ERα and ERβ ICI182780 and 17β-estradiol co-treated cells; TAM+E2. The antagonist of ERα and ERβ and GPR30 stimulant Tamoxifen and 17β-estradiol co-treated cells 图 9 雌激素不同受体拮抗剂对鸡MTTPL表达的影响 Fig. 9 Effects of estrogen receptor antagonists on expression of chicken MTTPL |
本研究克隆了鸡MTTPL基因CDS,全长序列2 646 bp,可编码881个氨基酸。系统进化分析发现MTTPL与VTG和MTTP同源。VTG、MTTP和ApoB是脂质转运蛋白家族的主要成员[26],具有脂质结合位点[27-29]。暗示MTTPL可能是LLTPs家族的新成员之一,且具有LLTPs家族成员类似的生物学功能。相关研究表明,人MTTPα亚基具有漏斗状的脂质结合腔,脂质结合位点被包围在由MTTPα C端结构域的2个β折叠形成的β-夹层里[24]。鸡MTTPL和MTTP三维结构与人MTTPα亚基三维结构相似度偏差都较小,功能结构区域都包括C端脂质结合区域、α螺旋结构和N端β折叠结构,且不存在结构变异。同时鸡MTTPL定位于细胞内质网中,与人MTTP细胞定位相同。综上分析,暗示MTTPL可能具有与人MTTP相似的生物学功能。
研究表明,哺乳动物MTTP是一种将磷脂和三酰基甘油转移到新生ApoB中用于组装VLDL必不可少的脂质转移蛋白[30],在肝主要参与富含ApoB脂蛋白的组装和分泌[31-32]。肝作为鸡脂质代谢的重要器官,产蛋期肝合成大量的脂肪酸经组装形成VLDL经血液循环运输到快速生长的卵泡中沉积形成卵黄[33-34]。MTTPL和MTTP都在肝中高丰度表达,与10周龄鸡相比,MTTP在产蛋高峰期鸡肝中表达量无显著变化,而MTTPL的表达量显著上调,暗示MTTPL可能在鸡肝脂质代谢中发挥重要作用。
鸡产蛋期肝VLDL的形成受雌激素调控,雌激素可促进鸡肝中ApoB及其他卵黄前体物的合成[35]。研究报道,鸟类对内源性或外源性雌激素都非常敏感,这一现象可能与雌性卵黄发生过程中对脂质合成的需求有关[36]。不同剂量雌激素肌肉注射青年鸡(10周龄),血清中TG、TC和VLDL浓度均显著升高[21]。无论在体试验还是离体试验,用雌激素处理后,肝内和肝原代细胞内MTTPL的表达量都显著升高,与ApoB的表达变化一致[37],而MTTP的表达量无显著变化。前期的有关研究也表明,鸡MTTP不受雌激素调控,可能不是肝脂质代谢的必需脂质转运蛋白。可见,MTTPL基因可能在鸡肝脂质代谢过程中发挥关键作用。雌激素主要通过雌激素受体(ER)发挥生物学功能,ER主要包括核受体ERα和ERβ[38-39]。特异性拮抗剂能够阻断雌激素受体的作用,从而抑制雌激素对靶基因的调控[40]。本研究中,雌激素可显著上调MTTPL的表达,当阻断ERα时,MTTPL的表达水平显著下降,同时阻断ERα和ERβ与仅阻断ERα相比,MTTPL的表达水平没有显著变化。这表明雌激素主要通过与ERα受体结合调控MTTPL的表达。综上分析表明,鸡产蛋期在雌激素的诱导下,MTTPL可能在肝脂质代谢中发挥着重要的作用,但其生物学功能还需进一步深入研究。
4 结论综上所述,鸡MTTPL位于内质网中,与人和鸡MTTP拥有共同的祖先,且具有与人MTTP相似的功能结构域;MTTPL和MTTP均在肝中相对高表达,MTTPL在产蛋期鸡肝的表达显著高于产蛋前期,而MTTP无显著变化。雌激素可通过与ERα受体结合调控鸡MTTPL的表达,而MTTP不受雌激素调控。表明MTTPL可能在鸡产蛋期肝脂质代谢中发挥重要作用。
| [1] |
MOREIRA G C M, BOSCHIERO C, CESAR A S M, et al. A genome-wide association study reveals novel genomic regions and positional candidate genes for fat deposition in broiler chickens[J]. BMC Genomics, 2018, 19(1): 374. DOI:10.1186/s12864-018-4779-6 |
| [2] |
ZHU L Y, YANG A, MU Y, et al. Effects of dietary cottonseed oil and cottonseed meal supplementation on the structure, nutritional composition of egg yolk and gossypol residue in eggs[J]. Poult Sci, 2019, 98(1): 381-392. DOI:10.3382/ps/pey359 |
| [3] |
TIAN W H, WANG Z, WANG D D, et al. Chromatin interaction responds to breast muscle development and intramuscular fat deposition between Chinese indigenous chicken and fast-growing broiler[J]. Front Cell Dev Biol, 2021, 9: 782268. DOI:10.3389/fcell.2021.782268 |
| [4] |
GLOUX A, DUCLOS M J, BRIONNE A, et al. Integrative analysis of transcriptomic data related to the liver of laying hens: From physiological basics to newly identified functions[J]. BMC Genomics, 2019, 20(1): 821. DOI:10.1186/s12864-019-6185-0 |
| [5] |
SCHNEIDER W J. Lipid transport to avian oocytes and to the developing embryo[J]. J Biomed Res, 2016, 30(3): 174-180. |
| [6] |
CARTER A M T. Thomson Flynn and the monotreme egg from oocyte maturation to germ layer formation[J]. J Morphol, 2021, 282(7): 1015-1023. DOI:10.1002/jmor.21319 |
| [7] |
王吉峰, 李海贤. 胆汁酸对蛋鸡脂肪代谢的影响[J]. 饲料广角, 2006(13): 16-17. WANG J F, LI H X. Influence of gall acid on fat metabolism of layer[J]. Feed China, 2006(13): 16-17. DOI:10.3969/j.issn.1002-8358.2006.13.006 (in Chinese) |
| [8] |
MENG J C, MA N, LIU H L, et al. Untargeted and targeted metabolomics profiling reveals the underlying pathogenesis and abnormal arachidonic acid metabolism in laying hens with fatty liver hemorrhagic syndrome[J]. Poult Sci, 2021, 100(9): 101320. DOI:10.1016/j.psj.2021.101320 |
| [9] |
ROZENBOIM I, MAHATO J, COHEN N A, et al. Low protein and high-energy diet: A possible natural cause of fatty liver hemorrhagic syndrome in caged White Leghorn laying hens[J]. Poult Sci, 2016, 95(3): 612-621. DOI:10.3382/ps/pev367 |
| [10] |
赵芹, 张海军, 武书庚, 等. 吡咯喹啉醌对高能低蛋白质饲粮蛋鸡生产性能、蛋品质、血浆脂质代谢及抗氧化能力的影响[J]. 动物营养学报, 2014, 26(4): 885-892. ZHAO Q, ZHANG H J, WU S G, et al. Effects of qyrroloquinoline quinine on performance, egg quality, plasma lipid metabolism and antioxidant ability of laying hens fed high-energy low-protein diets[J]. Chinese Journal of Animal Nutrition, 2014, 26(4): 885-892. DOI:10.3969/j.issn.1006-267x.2014.04.008 (in Chinese) |
| [11] |
LIU Z, LI Q H, LIU R R, et al. Expression and methylation of microsomal triglyceride transfer protein and acetyl-CoA carboxylase are associated with fatty liver syndrome in chicken[J]. Poult Sci, 2016, 95(6): 1387-1395. DOI:10.3382/ps/pew040 |
| [12] |
HUSSAIN M M, BAKILLAH A. New approaches to target microsomal triglyceride transfer protein[J]. Curr Opin Lipidol, 2008, 19(6): 572-578. DOI:10.1097/MOL.0b013e328312707c |
| [13] |
IQBAL J, JAHANGIR Z, AL-QARNI A A. Microsomal triglyceride transfer protein: from lipid metabolism to metabolic diseases[M] // JIANG X C. Lipid Transfer in Lipoprotein Metabolism and Cardiovascular Disease. Singapore: Springer, 2020, 1276: 37-52.
|
| [14] |
LEO E D, LANCELLOTTI S, PENACCHIONI J Y, et al. Mutations in MTP gene in abeta-and hypobeta-lipoproteinemia[J]. Atherosclerosis, 2005, 180(2): 311-318. DOI:10.1016/j.atherosclerosis.2004.12.004 |
| [15] |
WINTHER M, SHPITZEN S, YAACOV O, et al. In search of a genetic explanation for LDLc variability in an FH family: Common SNPs and a rare mutation in MTTP explain only part of LDL variability in an FH family[J]. J Lipid Res, 2019, 60(10): 1733-1740. DOI:10.1194/jlr.M092049 |
| [16] |
DAI D L, WEN F Q, ZHOU S M, et al. Association of MTTP gene variants with pediatric NAFLD: A candidate-gene-based analysis of single nucleotide variations in obese children[J]. PLoS One, 2017, 12(9): e0185396. DOI:10.1371/journal.pone.0185396 |
| [17] |
SUNDARAM M, YAO Z M. Recent progress in understanding protein and lipid factors affecting hepatic VLDL assembly and secretion[J]. Nutr Metab, 2010, 7(1): 35. DOI:10.1186/1743-7075-7-35 |
| [18] |
IVESSA N E, REHBERG E, KIENZLE B, et al. Molecular cloning, expression, and hormonal regulation of the chicken microsomal triglyceride transfer protein[J]. Gene, 2013, 523(1): 1-9. DOI:10.1016/j.gene.2013.03.102 |
| [19] |
LI H, WANG T A, XU C L, et al. Transcriptome profile of liver at different physiological stages reveals potential mode for lipid metabolism in laying hens[J]. BMC Genomics, 2015, 16(1): 763. DOI:10.1186/s12864-015-1943-0 |
| [20] |
FISCHER P W F, MARKS G S. Chick embryo liver cells maintained in serum-free waymouth MD 705/1 medium[J]. TCA Manual, 1976, 2(4): 449-452. DOI:10.1007/BF00918339 |
| [21] |
李艳敏, 李翠翠, 郑航, 等. 雌激素通过ER-α调控CYP2C8在鸡肝中的表达[J]. 畜牧兽医学报, 2016, 47(12): 2362-2369. LI Y M, LI C C, ZHENG H, et al. Expression of CYP2C8 is regulated by estrogen through ER-α in liver of chicken[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(12): 2362-2369. DOI:10.11843/j.issn.0366-6964.2016.12.005 (in Chinese) |
| [22] |
DEREEPER A, AUDIC S, CLAVERIE J M, et al. BLAST-EXPLORER helps you building datasets for phylogenetic analysis[J]. BMC Evol Biol, 2010, 10: 8. DOI:10.1186/1471-2148-10-8 |
| [23] |
TAMURA K, STECHER G, PETERSON D, et al. MEGA6:molecular evolutionary genetics analysis version 6.0[J]. Mol Biol Evol, 2013, 30(12): 2725-2729. DOI:10.1093/molbev/mst197 |
| [24] |
BITEROVA E I, ISUPOV M N, KEEGAN R M, et al. The crystal structure of human microsomal triglyceride transfer protein[J]. Proc Natl Acad Sci U S A, 2019, 116(35): 17251-17260. DOI:10.1073/pnas.1903029116 |
| [25] |
SCHMITTGEN T D, LIVAK K J. Analyzing real-time PCR data by the comparative CT method[J]. Nat Protoc, 2008, 3(6): 1101-1108. DOI:10.1038/nprot.2008.73 |
| [26] |
ZENG X Y, WAN H F, ZHONG J Y, et al. Large lipid transfer proteins in hepatopancreas of the mud crab Scylla paramamosain[J]. Comp Biochem Physiol Part D Genomics Proteomics, 2021, 38: 100801. DOI:10.1016/j.cbd.2021.100801 |
| [27] |
ANDERSON T A, LEVITT D G, BANASZAK L J. The structural basis of lipid interactions in lipovitellin, a soluble lipoprotein[J]. Structure, 1998, 6(7): 895-909. DOI:10.1016/S0969-2126(98)00091-4 |
| [28] |
ARSHAD R, MENG Y Q, QIU N, et al. Phosphoproteomic analysis of duck egg yolk provides novel insights into its characteristics and biofunctions[J]. J Sci Food Agric, 2022, 102(3): 1165-1173. DOI:10.1002/jsfa.11453 |
| [29] |
GHANEM K, JOHNSON A L. Proteome profiling of chicken ovarian follicles immediately before and after cyclic recruitment[J]. Mol Reprod Dev, 2021, 88(8): 571-583. DOI:10.1002/mrd.23522 |
| [30] |
SIRWI A, HUSSAIN M M. Lipid transfer proteins in the assembly of apoB-containing lipoproteins[J]. J Lipid Res, 2018, 59(7): 1094-1102. DOI:10.1194/jlr.R083451 |
| [31] |
WALSH M T, HUSSAIN M M. Targeting microsomal triglyceride transfer protein and lipoprotein assembly to treat homozygous familial hypercholesterolemia[J]. Crit Rev Clin Lab Sci, 2017, 54(1): 26-48. DOI:10.1080/10408363.2016.1221883 |
| [32] |
HUSSAIN M M, RAVA P, WALSH M, et al. Multiple functions of microsomal triglyceride transfer protein[J]. Nutr Metab (Lond), 2012, 9: 14. DOI:10.1186/1743-7075-9-14 |
| [33] |
WU H X, LI H, HOU Y Y, et al. Differences in egg yolk precursor formation of Guangxi Ma chickens with dissimilar laying rate at the same or various ages[J]. Theriogenology, 2022, 184: 13-25. DOI:10.1016/j.theriogenology.2022.02.020 |
| [34] |
SUN D D, JIN Y, ZHAO Q Y, et al. Modified EMR-lipid method combined with HPLC-MS/MS to determine folates in egg yolks from laying hens supplemented with different amounts of folic acid[J]. Food Chem, 2021, 337: 127767. DOI:10.1016/j.foodchem.2020.127767 |
| [35] |
EVANS M I, SILVA R, BURCH J B. Isolation of chicken vitellogenin I and Ⅲ cDNAs and the developmental regulation of five estrogen-responsive genes in the embryonic liver[J]. Genes Dev, 1988, 2(1): 116-124. DOI:10.1101/gad.2.1.116 |
| [36] |
DENG Y, YUAN J S, QIU J M, et al. Oestrogen promotes lipids transportation through oestrogen receptor α in hepatic steatosis of geese in vitro[J]. J Anim Physiol Anim Nutr, 2022, 106(3): 552-560. DOI:10.1111/jpn.13590 |
| [37] |
KIRCHGESSNER T G, HEINZMANN C, SVENSON K L, et al. Regulation of chicken apolipoprotein B: Cloning, tissue distribution, and estrogen induction of mRNA[J]. Gene, 1987, 59(2-3): 241-251. DOI:10.1016/0378-1119(87)90332-5 |
| [38] |
PAECH K, WEBB P, KUIPER G G J M, et al. Differential ligand activation of estrogen receptors ERα and ERβ at AP1 sites[J]. Science, 1997, 277(5331): 1508-1510. DOI:10.1126/science.277.5331.1508 |
| [39] |
KUMAR V, CHAMBON P. The estrogen receptor binds tightly to its responsive element as a ligand-induced homodimer[J]. Cell, 1988, 55(1): 145-156. DOI:10.1016/0092-8674(88)90017-7 |
| [40] |
HARRINGTON W R, SHENG S B, BARNETT D H, et al. Activities of estrogen receptor alpha- and beta-selective ligands at diverse estrogen responsive gene sites mediating transactivation or transrepression[J]. Mol Cell Endocrinol, 2003, 206(1-2): 13-22. DOI:10.1016/S0303-7207(03)00255-7 |
(编辑 郭云雁)



