2. 天津科技大学生物工程学院, 天津 300457
2. College of Biotechnology, Tianjin University of Science and Technology, Tianjin 300457, China
细菌感染会对禽畜养殖行业造成巨大的经济损失,目前,普遍采取抗生素作为抑菌剂进行防治,由于长期使用抗生素,会产生耐药菌株[1],导致抗生素不断加大使用量,造成“超级细菌”的产生,严重威胁到公共卫生安全和养殖业的健康发展[2]。中药防治禽畜疾病具有悠久的历史,而且中药具有无残留或低残留、低毒副作用、不易形成耐药性等优势,因此,从中草药中寻找到一种能够替代抗生素作为抑菌剂的方法具有重要意义。
板蓝根(Isatis indigotica)是中国著名的传统中药,又名菘蓝、北板蓝、大蓝根及大青根等,其为十字花科植物菘蓝的干燥根,入药前需要炮制,被作为药材记录在《神农本草经》中已有上千年历史[3],其性寒,味先甘后苦,具有清热解毒、凉血利咽之功效[3-4],在临床中应用广泛。现代药理研究证实,其主要对常见的大肠杆菌、金黄色葡萄球菌、链球菌、枯草杆菌[5-6]等多种强感染性的病原微生物具有不同程度的抑制效果。板蓝根抑菌药效成分复杂、作用靶点多,但目前的研究中缺乏对板蓝根抑菌作用的整体认识。
近年来,随着网络药理学的不断发展,越来越多的研究人员将网络药理学和中医药研究联系起来[7],从传统的寻找单一靶点转变为从系统层次和生物网络的整体角度研究,分析具有多成分、多途径和多靶点协同作用等特点[8]的中药中大多数成分的变化,更重要的是确定中药作用靶标,并对中药的分子机制进行分析,阐述了多靶点与多成分间复杂网状相互作用关系[9]。所以,本研究通过网络药理学揭示板蓝根抑菌的药效成分及其作用分子机制,从而为板蓝根抑菌作用的深入研究提供理论基础。
1 材料与方法 1.1 数据库平台网络药理学研究所用网络数据库平台网址见表 1。
|
|
表 1 本文所用数据库及网址 Table 1 Databases and their URL used in this article |
1.2.1 菌株 大肠杆菌Escherichia coli CVCC1515来源于本课题组。
1.2.2 药品和试剂 豆甾醇(纯度≥98%)、LB培养基、5×蛋白上样缓冲液购自北京索莱宝科技有限公司, SDS-PAGE凝胶快速配制试剂盒购自美国BIO-RAD公司, 未预染蛋白Marker购自Thermofisher Scientific公司。
1.2.3 仪器 MultiskanTM Skyhigh酶标仪(Thermofisher Scientific公司), SDS-PAGE蛋白电泳仪(BIO-RAD公司), 凝胶成像系统(美国Bio-Rad公司), 低温高速离心机(Tokyo公司), 落地式超净工作台(Airtech公司)。
1.3 方法1.3.1 板蓝根药效成分-靶点网络图的构建 通过数据库TCMSP搜索板蓝根的化学成分和潜在作用靶点,筛选口服生物利用度(OB)≥30%和化合物类药性(DL)≥0.18的药效成分,将靶点导入Uniprot数据库进行标准化处理。利用Cytoscape_3.7.0软件构建板蓝根药效成分-潜在作用靶点网络图。
1.3.2 抑菌靶点搜集 以“抑菌(antibacterial)”作为检索关键词,利用GeneCards和OMIM数据库搜索相关靶点,获取并筛选抑菌靶点。
1.3.3 抑菌靶点筛选 通过Venny 2.1软件绘制韦恩图,对板蓝根抑菌靶点进行可视化处理,并利用Cytoscape_3.7.0软件构建“药物-成分-疾病-靶点”的可视化网络图。
1.3.4 蛋白互作网络的构建 将板蓝根药效成分的抑菌靶点导入STRING数据库中,选择“human”物种,进行PPI预测分析,构建关键靶点互作网络。
1.3.5 GO功能和KEGG通路富集分析 将所有板蓝根抑菌关键靶点输入至DAVID在线分析数据库,以P≤0.01为前提进行GO分析和KEGG通路分析,根据GO富集分析前10条绘制富集数量统计柱状图,选取KEGG富集分析前20条信号通路绘制富集显著性气泡图。
1.3.6 分子对接 选取抑菌关键靶点并在PBD数据库中查找对应分辨率较高的蛋白, 并下载3D结构式。从Pu bchem数据库中下载相应药效成分3D结构。通过Autodock Tools 1.5.7软件对蛋白质进行除去水分子和加氢等操作,将处理后的关键靶点和药效成分结构导入Autodock Tools 1.5.7软件中进行分子对接验证试验,结合能越小代表对接越稳定,若结合能<0 kJ·mol-1,表示蛋白质与小分子能够自发地结合;结合能≤-20.93 kJ·mol-1,则表示结合活性良好,选取结合能≤-20.93 kJ·mol-1的蛋白质-小分子对接,通过PyMol 2.4软件构建3D示意图。
1.3.7 抑菌试验 设置空白对照组和药物处理组(1.00、0.5.00、0.25 mg·mL-1),大肠杆菌终浓度1×106CFU·mL-1,37 ℃共培养12 h,取菌液稀释至10-6个·mL-1,取100 μL稀释菌液涂布于LB平板培养基,37 ℃培养24 h,记录菌落数。
| $ \begin{array}{l} \;\;\;\;抑菌率 = \left( {空白对照菌落数—试验组菌落数} \right)/\\ 空白对照菌落数 \times 100\% \end{array} $ |
1.3.8 SDS-PAGE法检测目的蛋白含量 设置空白对照组和豆甾醇处理组(1.00、0.50、0.25 mg·mL-1),大肠杆菌终浓度1×106CFU·mL-1,37 ℃、200 r·min-1条件下共培养12 h,每组各取3 mL菌液,5 000 r·min-1离心10 min,用无菌PBS重悬菌液至相同浓度,加入5×蛋白上样缓冲液,100 ℃煮沸5 min,12 000 r·min-1离心1 min,取上清进行SDS-PAGE电泳[10]。
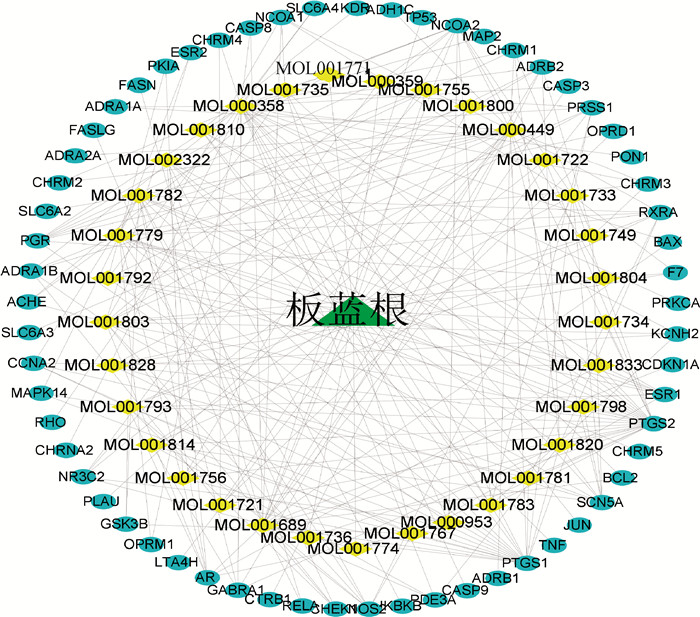
2 结果 2.1 板蓝根药效成分—靶点网络图的构建运用TCMSP在线数据库筛选得到33个符合条件的药效成分,包括黄酮类、甾体类化合物、吲哚类化合物、生物碱等(表 2)。通过Cytoscape_3.7.0软件对板蓝根33个药效成分和61个药效成分作用靶点进行映射(图 1),化学成分的degree值越高,说明该化学成分作用靶点越多,为关键成分,发现β-谷甾醇(27)、豆甾醇(23)、金合欢素(19)、清风藤碱(15)、甜橙黄酮(15)等可能为抑菌关键药效成分。
|
|
表 2 板蓝根主要活性成分 Table 2 The main active ingredients of Isatis indigotica |
|
绿色三角代表板蓝根,黄色菱形代表板蓝根的药效成分,蓝色椭圆形代表板蓝根潜在作用靶点 The green triangle represents Isatis indigotica, the yellow diamond represents the effective active ingredients of Isatis indigotica, and the blue oval represents the potential target of Isatis indigotica 图 1 板蓝根药效成分-靶点网络图 Fig. 1 Active ingredients - target network of Isatis indigotica |
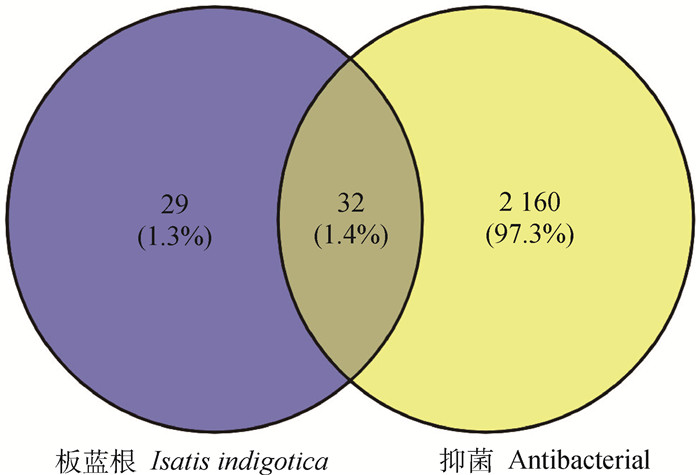
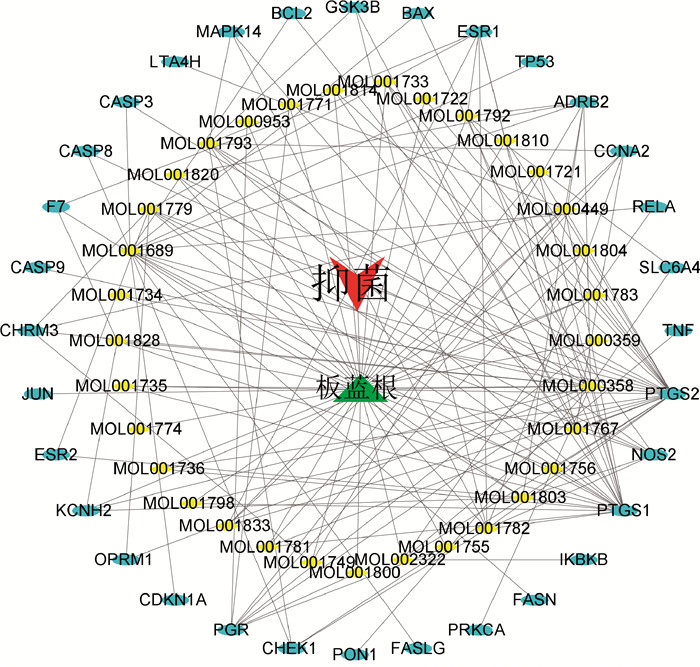
通过GeneCards和OMIM在线数据库获得2 192个靶点。板蓝根靶点与抑菌靶点取交集后得到32个交集靶点(图 2)。利用Cytoscape_3.7.0软件构建“药物-成分-疾病-靶点”的可视化网络图(图 3),作用靶点越多的药效成分,其在生理生化作用中越关键。
|
图 2 板蓝根与抑菌交集靶点韦恩图 Fig. 2 Venn diagram of intersection targets of Isatis indigotica and antibacterial |
|
红色的V形代表抑菌,绿色三角形代表板蓝根,黄色菱形代表板蓝根药效成分,蓝色椭圆代表交集靶点 The red V shape represents bacteriostasis, the green triangle represents Isatis indigotica, the yellow diamond represents the effective active ingredients of Isatis indigotica, and the blue ellipse represents the intersection target 图 3 “药物-成分-疾病-靶点”网络图 Fig. 3 "Drugs-Ingredients-Diseases-Targets" network diagram |
把32个交集靶点输入STRING数据库进行PPI分析,其中,一个靶点上的连线越多,则这一靶点蛋白等级越高。靶点之间的连线越多,可以说明靶点蛋白之间的结合度越高,除去游离靶点CHRM3和KCNH2后,剩余30个靶点进行PPI分析(表 3)。
|
|
表 3 板蓝根抑菌STRING网络关键靶点 Table 3 Key Antibacterial targets of STRING network of Isatis indigotica |
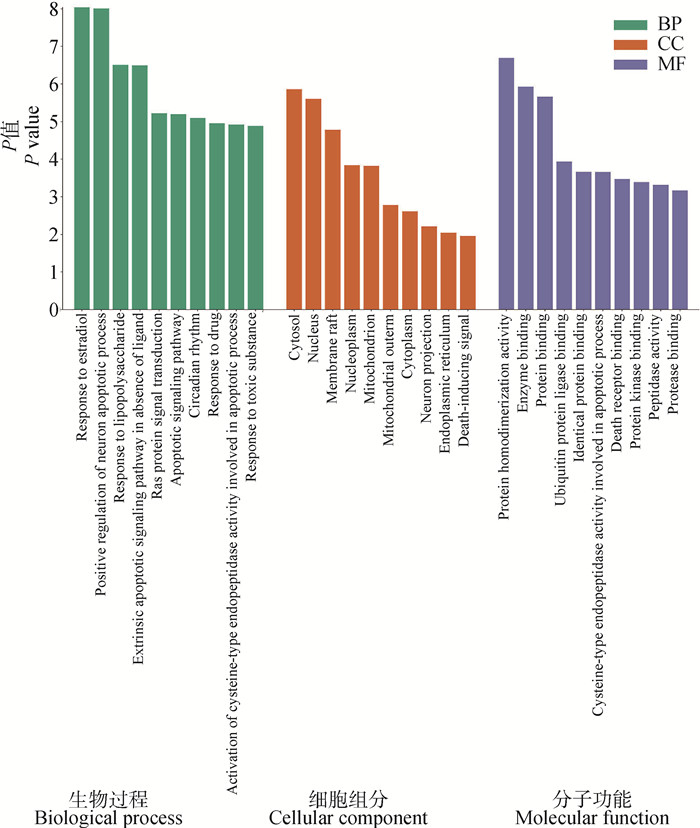
通过DAVID在线分析数据库对板蓝根关键抑菌靶点进行GO功能富集分析,共获取126条GO条目,分别选取前10个分析条目绘制柱状图(图 4)。生物过程主要涉及对雌二醇的反应、凋亡信号通路、神经元凋亡过程的正调控、没有配体的外源性凋亡信号通路、对有毒物质的反应等86个;细胞组分主要分布于细胞质、核、膜筏、核质、线粒体等11个;分子功能主要体现在蛋白质同源二聚化活性、酶结合、蛋白结合、泛素蛋白连接酶结合、参与细胞凋亡过程的半胱氨酸型内肽酶活性等29个。KEGG通路分析共获得TNF信号通路、NOD受体信号通路、TOLL样受体信号通路等59个通路,选取KEGG富集显著性统计前20条通路绘制气泡图(图 5)。
|
图 4 板蓝根抑菌靶点的GO分析 Fig. 4 GO analysis of antibacterial targets of Isatis indigotica |

|
图 5 板蓝根抑菌关键靶点KEGG通路富集分析 Fig. 5 KEGG pathway enrichment analysis of key antibacterial targets of Isatis indigotica |
“药物-成分-疾病-靶点”网络图中选取degree值排名前3的核心药效成分与抑菌关键靶点CASP3、PTGS2编码的蛋白分子进行对接(表 4),所有组合对接结合能均 < 0 kJ·mol-1,表明蛋白质与小分子能够自发结合。其中, 结合能≤-20.93 kJ·mol-1的蛋白质-小分子对接结果3D示意图见图 6。
|
|
表 4 板蓝根核心药效成分与抑菌关键靶点的结合能 Table 4 Binding energy of core active ingredients in Isatis indigotica with core antibacterial targets |

|
图 6 PTGS2和CASP3与板蓝根核心药效成分分子对接3D图(结合能≤-20.93 kJ·mol-1) Fig. 6 Molecular docking 3D diagram of PTGS2 and CASP3 with core active ingredients in Isatis indigotica(binding energy≤-20.93 kJ·mol-1) |
通过分子对接预测筛选出核心药效成分,采用菌落计数法验证β-谷甾醇、豆甾醇、金合欢素对大肠杆菌的抑菌作用,因β-谷甾醇和金合欢素的溶解性差,易析出,未能获得试验数据。通过菌落计数法证明豆甾醇对大肠杆菌的抑菌作用呈剂量依赖关系(图 7)。
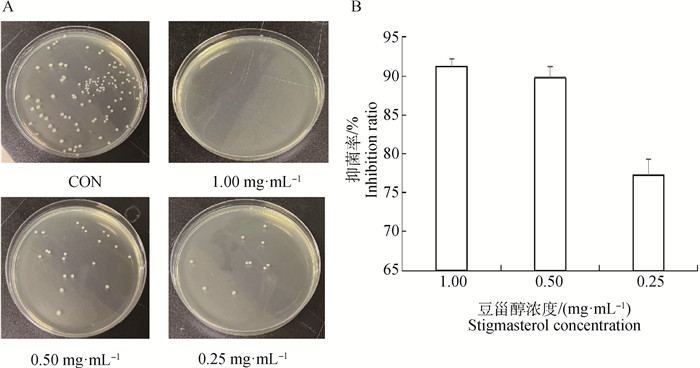
|
A. 抑菌试验;B.抑菌率 A. Bacteriostatic test; B. Antibacterial rate 图 7 豆甾醇对大肠杆菌的抑制作用 Fig. 7 Antibacterial effect of stigmasterol on Escherichia coli |
采用SDS-PAGE法验证豆甾醇对目的蛋白PTGS2(74 ku)和CASP3(17 ku)表达的影响。结果表明,豆甾醇处理组与对照组相比,豆甾醇能够下调大肠杆菌胞内PTGS2和CASP3蛋白的表达量,且呈剂量依赖关系(图 8),可见,豆甾醇处理组的大肠杆菌胞内的CASP3和PTGS2可能被分泌到了胞外,说明豆甾醇通过调控CASP3和PTGS2关键靶点实现抑菌作用,与分子对接的预测结果一致。
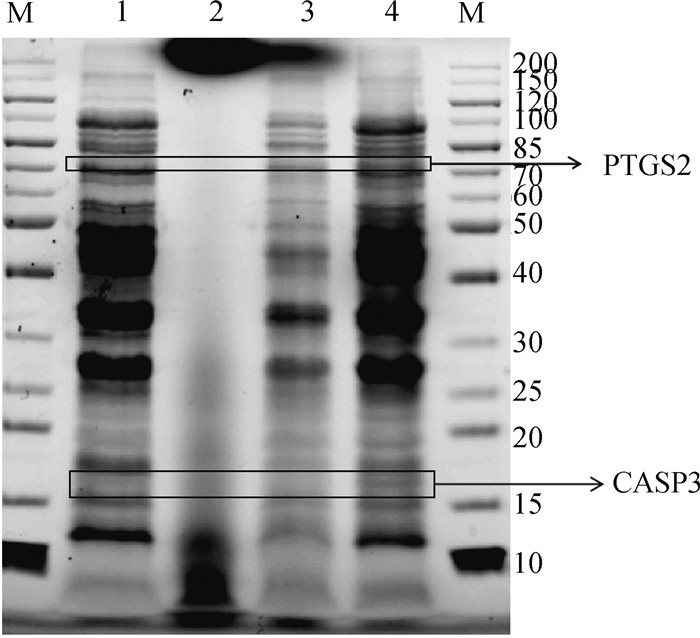
|
M.Marker;1.空白对照组;2~4.豆甾醇高、中、低剂量组 M. Marker; 1. The blank control; 2, 3, 4. Stigmasterol with high, medium and low dose 图 8 豆甾醇对大肠杆菌菌体蛋白表达量的影响 Fig. 8 Effect of stigmasterol on protein expression of Escherichia coli |
板蓝根是清热解毒的代表药物[4],具有抗菌、抗病毒、增强机体免疫力等功效。现代药理学研究证明,板蓝根具有广谱的抑菌活性,发现其对鸡白痢沙门菌[2]、肺炎双球菌[11]等革兰阴性菌有较强的抑菌能力。但其具体抗菌作用成分和作用机制尚未知。
本研究通过网络药理学思路筛选了33个药效成分。金合欢素、异牡荆素、高车前素、甜橙黄酮、花旗松素、新橙皮苷等是黄酮类化合物,对许多病原微生物(革兰阴性菌和革兰阳性菌、真菌)具有不同程度抑制效果[12];其中,金合欢素可抑制金黄色葡萄球菌中膜相关蛋白SrtA的活性,结果能够影响该细菌的蛋白A (SpA) 与细胞壁的组装,并减少金黄色葡萄球菌的结合,从而达到抑菌的效果[13];有研究发现,高车前素具有抑制黄曲菌、红色毛藓菌等真菌的能力[14]。扶桑甾醇、谷甾醇、β-谷甾醇、胆固醇、豆甾醇等甾体类化合物,具有抗菌作用[15];其中,β-谷甾醇能够增加抗菌肽的表达、与细胞结合位点结合等方法达到抑菌效果[16]。β-谷甾醇能一定程度抑制金黄色葡萄球菌、芽胞杆菌等[17]。依靛蓝酮、羟基靛玉红等吲哚类化合物,对革兰阴性菌、革兰阳性菌、真菌和植物病菌均具有一定抑制能力[18]。基于此,推测板蓝根可以通过这33种药效成分及其相应的抑菌靶点起到抑菌作用。
PPI蛋白互作网络分析结果表明,肿瘤坏死因子(tumor necrosis factor,TNF)、肿瘤蛋白P53(tumor protein P53,TP53)、胱天蛋白酶3(apoptosis-related cysteine peptidase,CASP3)、转录因子AP-1(transcription factor AP-1, JUN)、人前列腺素内过氧化物合酶2(prostaglandin-endoperoxide synthase 2,PTGS2)等互作频率较大,为板蓝根抑菌关键靶点。其中, TNF是板蓝根抑菌最关键的靶点,TNF可通过激活T细胞免疫活性参与免疫应答,具有杀伤转化细胞和某些病毒感染的细胞的能力[19]。在接受TNF-α受体阻滞剂的风湿性关节炎患者中出现严重甚至具有致命性的军团菌和李斯特菌感染的风险[20]。TP53是影响细胞生长、迁移和损伤修复的关键感应因子,其与先天性抗病毒免疫、抗增殖作用及病毒的复制与转录都有关[21-23]。CASP3为caspase级联激活下游重要成分[24],是执行细胞凋亡的核心蛋白,在细胞凋亡早期阶段,CASP3被激活时,由两个大亚基(17 ku)和两个小亚基组成。PTGS2为前列腺素生物合成中的核心成分,能够参与细胞凋亡、氧化应激等多种生理病理过程,其既是一种过氧化物酶也是一种双环氧合酶,能够将二十二碳五烯酸酯转化为13R-HDPA,13R-HDPA经过加工修饰能够激活巨噬细胞吞噬作用在细菌感染期间[25]。由此推测,板蓝根可能通过这些抑菌靶点发挥抑菌作用。
GO和KEGG富集分析结果表明,板蓝根抑菌涉及多方面生物学过程和多条信号通路,根据P值得到TNF信号通路、NOD受体信号通路、TOLL样受体信号通路等主要信号通路。TNF是一种多功能的促炎信号因子,其与细胞膜上特异性受体结合,参与免疫调节细胞的激活、功能和分化[26],具有调控防止恶性细菌感染、免疫系统、细胞凋亡等作用[19-20]。TOLL样受体为免疫系统里的关键蛋白,特异性识别病原微生物上的受体,激活一系列先天性免疫应答,进而调控炎症因子、趋化因子的表达[27],细胞因子也通过调控各种炎症和抑菌基因,包括趋化因子、免疫细胞的募集和激活,达到消灭金黄色葡萄球菌的目的[28]。NOD受体信号通路是一种关键的先天免疫系统,其属于模式识别受体的特定家族,能够识别多种病原微生物并激活先天性免疫反应,其中,NOD1、2能够检测从内体区室中逸出的细菌肽聚糖片段的胞质存在,从而调控NF-κB和MAPK的激活、细胞因子的产生和细胞凋亡[29-31]。推测板蓝根主要通过这些通路起到抑菌作用。分子对接结果表明,板蓝根核心药效成分与关键靶点均能够自发结合,其中, 大部分组合拥有良好的结合活性(结合能≤-20.93 kJ·mol-1),表明了板蓝根药效成分能够通过调控上述抑菌关键靶点起到抑菌作用,本研究通过SDS-PAGE法发现,与对照组相比,豆甾醇药物处理组大肠杆菌(CVCC1515)胞内PTGS2和CASP3的蛋白表达量随着药物浓度的升高而下降,表明豆甾醇药物处理组大肠杆菌(CVCC1515)胞内PTGS2和CASP3的蛋白被分泌到胞外,胞外的PTGS2和CASP3的蛋白表达量随药物浓度的增加而增大,该结果与车蕾[32]的研究结果相同,在车蕾[32]的研究中,用高氧液处理细菌生长,通过实时定量PCR发现试验组中CASP3和SOD基因显著升高,说明高氧液的作用是通过氧抑制作用,使细菌程序性死亡增加实现的。综上所述,板蓝根具有一定的抑菌作用,验证了上述网络药理学预测结果的可靠性。
4 结论板蓝根主要通过豆甾醇调控CASP3、PTGS2等靶点,基因功能富集于细胞凋亡、转录调控等参与癌症途径、TNF信号通路发挥抑菌作用。
| [1] |
CHEN C C, LI J Y, ZHANG H X, et al. Effects of a probiotic on the growth performance, intestinal flora, and immune function of chicks infected with Salmonella pullorum[J]. Poult Sci, 2020, 99(11): 5316-5323. DOI:10.1016/j.psj.2020.07.017 |
| [2] |
张仕泓, 王少林. 动物源产气荚膜梭菌耐药性研究进展[J]. 畜牧兽医学报, 2021, 52(10): 2762-2771. ZHANG S H, WANG S L. Research progress on antimicrobial resistance of Clostridium perfringens of animal origins[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(10): 2762-2771. DOI:10.11843/j.issn.0366-6964.2021.010.007 (in Chinese) |
| [3] |
马毅敏, 李娜, 刘承伟, 等. 板蓝根不同提取部位抗炎镇痛活性比较研究[J]. 中草药, 2014, 45(17): 2517-2521. MA Y M, LI N, LIU C W, et al. Comparative studies on anti-inflammatory and analgesic activities of different fractions from Isatidis radix[J]. Chinese Traditional and Herbal Drugs, 2014, 45(17): 2517-2521. DOI:10.7501/j.issn.0253-2670.2014.17.017 (in Chinese) |
| [4] |
郑汝, 梁锦丽. 板蓝根不同提取部位抗菌活性的实验性研究[J]. 海峡药学, 2010, 22(4): 32-34. ZHENG R, LIANG J L. Experimental study on the antibacterial activity of different extracts from Radix isatis[J]. Strait Pharmaceutical Journal, 2010, 22(4): 32-34. DOI:10.3969/j.issn.1006-3765.2010.04.013 (in Chinese) |
| [5] |
冯永智, 徐永康, 牟嘉林. 常见中草药对大肠杆菌抑制效果研究现状[J]. 吉林畜牧兽医, 2020, 41(3): 75, 77. FENG Y Z, XU Y K, MU J L. Research status of common Chinese herbal medicine's inhibitory effect on Escherichia coli[J]. Jilin Animal Husbandry and Veterinary Medicine, 2020, 41(3): 75, 77. (in Chinese) |
| [6] |
杨元娟, 杨元梅, 夏之宁. 板蓝根注射液抗菌活性的研究[J]. 中国医药指南, 2008, 6(10): 19-21. YANG Y J, YANG Y M, XIA Z N. Study on the antibacterial activity of Radix isatidis injection[J]. Guide of Chinese Medicine, 2008, 6(10): 19-21. DOI:10.3969/j.issn.1671-8194.2008.10.009 (in Chinese) |
| [7] |
张彦琼, 李梢. 网络药理学与中医药现代研究的若干进展[J]. 中国药理学与毒理学杂志, 2015, 29(6): 883-892. ZHANG Y Q, LI S. Progress in network pharmacology for modern research of traditional Chinese medicine[J]. Chinese Journal of Pharmacology and Toxicology, 2015, 29(6): 883-892. DOI:10.3867/j.issn.1000-3002.2015.06.002 (in Chinese) |
| [8] |
WANG L, ZHOU G B, LIU P, et al. Dissection of mechanisms of Chinese medicinal formula Realgar-Indigo naturalis as an effective treatment for promyelocytic leukemia[J]. Proc Natl Acad Sci U S A, 2008, 105(12): 4826-4831. DOI:10.1073/pnas.0712365105 |
| [9] |
XU G Y, LV X, FENG Y B, et al. Study on the effect of active components of Schisandra chinensis on liver injury and its mechanisms in mice based on network pharmacology[J]. Eur J Pharmacol, 2021, 910: 174442. DOI:10.1016/j.ejphar.2021.174442 |
| [10] |
张子越. 马齿苋水煎液体外抑制大肠杆菌和痢疾杆菌的作用机制的研究[D]. 泰安: 山东农业大学, 2020. ZHANG Z Y. Study on the mechanism of purslane decoction in inhibiting E. coliand dysenteryn in vitr[D]. Taian: Shandong Agricultural University, 2020. (in Chinese) |
| [11] |
彭爱红. 板蓝根药理活性成分及临床应用进展[J]. 中国当代医药, 2010, 17(12): 13-14. PENG A H. The pharmacologically active components of Radix isatidis and its clinical application progress[J]. China Modern Medicine, 2010, 17(12): 13-14. DOI:10.3969/j.issn.1674-4721.2010.12.006 (in Chinese) |
| [12] |
文开新, 王成章, 严学兵, 等. 黄酮类化合物生物学活性研究进展[J]. 草业科学, 2010, 27(6): 115-122. WEN K X, WANG C Z, YAN X B, et al. Research progress of flavonoids biological activity[J]. Pratacultural Science, 2010, 27(6): 115-122. DOI:10.3969/j.issn.1001-0629.2010.06.019 (in Chinese) |
| [13] |
BI C W, DONG X Y, ZHONG X B, et al. Acacetin protects mice from Staphylococcus aureus bloodstream infection by inhibiting the activity of Sortase A[J]. Molecules, 2016, 21(10): 1285. DOI:10.3390/molecules21101285 |
| [14] |
陈春林, 王健, 戈悦欣, 等. 高车前素药理作用研究进展[J]. 宜春学院学报, 2019, 41(12): 17-20. CHEN C L, WANG J, GE Y X, et al. Research progress on pharmacological actions of hispidulin[J]. Journal of Yichun University, 2019, 41(12): 17-20. DOI:10.3969/j.issn.1671-380X.2019.12.004 (in Chinese) |
| [15] |
陈慧敏, 戴岳, 夏玉凤. 生物碱类化合物与药物相互作用的研究现状[J]. 中国临床药理学杂志, 2021, 37(18): 2523-2526. CHEN H M, DAI Y, XIA Y F. Research status of the interaction between alkaloids and drugs[J]. The Chinese Journal of Clinical Pharmacology, 2021, 37(18): 2523-2526. (in Chinese) |
| [16] |
陈元堃, 曾奥, 罗振辉, 等. β-谷甾醇药理作用研究进展[J]. 广东药科大学学报, 2021, 37(1): 148-153. CHEN Y K, ZENG A, LUO Z H, et al. Advances on pharmacology of β-sitosterol[J]. Journal of Guangdong Pharmaceutical University, 2021, 37(1): 148-153. (in Chinese) |
| [17] |
ODODO M M, CHOUDHURY M K, DEKEBO A H. Structure elucidation of β-sitosterol with antibacterial activity from the root bark of Malva parviflora[J]. Springerplus, 2016, 5(1): 1210. DOI:10.1186/s40064-016-2894-x |
| [18] |
漆亚云, 胡伟男, 孟娇, 等. 吲哚类化合物抑菌活性研究进展[J]. 化学研究与应用, 2019, 31(7): 1225-1233. QI Y Y, HU W N, MENG J, et al. Research advance on antibacterial activity of indole compounds[J]. Chemical Research and Application, 2019, 31(7): 1225-1233. DOI:10.3969/j.issn.1004-1656.2019.07.001 (in Chinese) |
| [19] |
MONTFORT A, COLACIOS C, LEVADE T, et al. The TNF paradox in cancer progression and immunotherapy[J]. Front Immunol, 2019, 10: 1818. DOI:10.3389/fimmu.2019.01818 |
| [20] |
KROESEN S, WIDMER A F, TYNDALL A, et al. Serious bacterial infections in patients with rheumatoid arthritis under anti-TNF-alpha therapy[J]. Rheumatology (Oxford), 2003, 42(5): 617-621. DOI:10.1093/rheumatology/keg263 |
| [21] |
PETITJEAN A, ACHATZ M I W, BORRESEN-DALE A L, et al. TP53mutations in human cancers: functional selection and impact on cancer prognosis and outcomes[J]. Oncogene, 2007, 26(15): 2157-2165. DOI:10.1038/sj.onc.1210302 |
| [22] |
GUDKOV A V, KOMAROVA E A. p53 and the carcinogenicity of chronic inflammation[J]. Cold Spring Harb Perspect Med, 2016, 6(11): a026161. DOI:10.1101/cshperspect.a026161 |
| [23] |
王媛, 白贵斌, 王娟, 等. p53信号通路在MTB感染肺泡Ⅱ型上皮细胞系A549中的免疫调控作用[J]. 西北农林科技大学学报: 自然科学版, 2019, 47(8): 8-16. WANG Y, BAI G B, WANG J, et al. Effect of p53 signaling pathway on AEC Ⅱ line A549 infected with Mycobacterium tuberculosis (MTB)[J]. Journal of Northwest A&F University: Natural Science Edition, 2019, 47(8): 8-16. (in Chinese) |
| [24] |
LAUNAY O, ROSENBERG A R, REY D, et al. Long-term immune response to hepatitis B virus vaccination regimens in adults with human immunodeficiency virus 1: secondary analysis of a randomized clinical trial[J]. JAMA Intern Med, 2016, 176(5): 603-610. DOI:10.1001/jamainternmed.2016.0741 |
| [25] |
PARK Y, HONG H, JANG B. Transcriptional and translational regulation of COX-2 expression by cadmium in C6 glioma cells[J]. Int J Mol Med, 2012, 30(4): 960-966. DOI:10.3892/ijmm.2012.1052 |
| [26] |
TORREY H, BUTTERWORTH J, MERA T, et al. Targeting TNFR2 with antagonistic antibodies inhibits proliferation of ovarian cancer cells and tumor-associated Tregs[J]. Sci Signal, 2017, 10(462): eaaf8608. DOI:10.1126/scisignal.aaf8608 |
| [27] |
YIN Q Y, ZHAO B, QIU Y Y, et al. Research progress of mechanisms and drug therapy for atherosclerosis on toll-like receptor pathway[J]. J Cardiovasc Pharmacol, 2019, 74(5): 379-388. DOI:10.1097/FJC.0000000000000738 |
| [28] |
苏鑫, 宫晓燕. 新扶正除疫颗粒对金葡球菌所致急性上呼吸道感染小鼠肺组织TNF-α、IL-6含量的影响研究[J]. 时珍国医国药, 2016, 27(2): 315-316. SU X, GONG X Y. The effect of Xinfuzheng Chuye Granules on the content of TNF-α and IL-6 in lung tissue of mice with acute upper respiratory tract infection caused by Staphylococcus aureus[J]. Lishizhen Medicine and Materia Medica Research, 2016, 27(2): 315-316. (in Chinese) |
| [29] |
WU W D, LI L P, LIU Y, et al. Multiomics analyses reveal that NOD-like signaling pathway plays an important role against Streptococcus agalactiae in the spleen of tilapia[J]. Fish Shellfish Immunol, 2019, 95: 336-348. DOI:10.1016/j.fsi.2019.10.007 |
| [30] |
MARTÍNEZ I, OLIVEROS J C, CUESTA I, et al. Apoptosis, toll-like, RIG-I-like and NOD-like receptors are pathways jointly induced by diverse respiratory bacterial and viral pathogens[J]. Front Microbiol, 2017, 8: 276. |
| [31] |
WATANABE T, KITANI A, MURRAY P J, et al. NOD2 is a negative regulator of toll-like receptor 2-mediated T helper type 1 responses[J]. Nat Immunol, 2004, 5(8): 800-808. DOI:10.1038/ni1092 |
| [32] |
车蕾. 高氧液抑制根管内常见致病菌的实验研究[D]. 西安: 中国人民解放军空军军医大学, 2018. CHE L. Experimental study of hyperoxia solution on the inhibition of common pathogenic bacteria in root canal[D]. Xi'an: Air Force Medical University, 2018. (in Chinese) |
(编辑 白永平)



