鸡球虫病是由几种艾美耳球虫寄生鸡肠道引起的一种全球寄生虫病,该病每年都会给世界各地的养禽业带来巨大的经济损失。鸡感染球虫后会呈现精神萎靡、被毛蓬乱、食欲不振、粪便带血等症状,严重时会死亡[1]。在几种艾美耳球虫中,柔嫩艾美耳球虫(Eimeria tenella)是最具致病性的虫株之一[2]。
目前,对球虫病的控制主要依赖于药物防治和使用强毒或减毒活卵囊疫苗进行免疫预防[3]。长期以来,大规模使用抗球虫药物一直是一种高效的控制方法,然而,由于长期及不合理地使用抗球虫药物,球虫几乎对所使用过的抗球虫药物都产生了耐药性,且对新药产生耐药性的时间缩短,耐药性的程度日趋严重,并由单一的抗性变为对多种药物的交叉耐药性[4]。在美国等市场,随着大众对“永远不使用抗生素”的食品需求的增长,离子载体类抗球虫药物使用进一步减少,这促使40%以上的生产者每年将疫苗接种纳入一个或多个生产周期[3]。球虫活疫苗主要有强毒疫苗和弱毒疫苗两种,强毒疫苗感染毒力较强,使用不当易导致鸡群感染球虫,严重时可能导致球虫病的暴发,与强毒疫苗相比,弱毒疫苗由于采用一定方法使球虫毒力显著降低,提高了疫苗的安全性,但弱毒疫苗的研发需要花费更多的资金,同时弱毒疫苗的稳定性和毒力返强也是需要解决的问题[5]。球虫活疫苗在蛋鸡和种鸡中应用较为广泛,肉鸡由于饲养周期较短,接种疫苗产生免疫力需要一定时间,且疫苗接种后短期内可能出现接种副反应对鸡群生产性能产生较大影响,因此在肉鸡生产中主要还是使用抗球虫药对该病进行防治[3]。基于这些原因研究鸡球虫耐药性产生的机制变得尤为重要,虽然各国学者对球虫耐药性产生原因进行了探索,但是耐药性形成的分子机制至今不明。
对鸡球虫及其他顶复门原虫的耐药性研究发现部分基因在耐药株中的表达与敏感株相比存在明显的差异。如Mok等[6]对恶性疟原虫进行转录组分析,发现与对青蒿素敏感的疟原虫相比,抗青蒿素疟原虫体内参与未折叠蛋白反应通路的两个主要伴侣复合物——活性氧化应激复合体和T-复合蛋白1环复合体表达增加。在疟原虫受到青蒿素作用后,主要通过这些伴侣复合物的上调表达,以加速去除细胞质和内质网中毒性蛋白的积累或者恢复这些蛋白的正确折叠,从而减轻青蒿素对虫体的损害[7],但其分子机制目前还不清楚。青蒿素抗鸡E. tenella的作用与微线蛋白(microneme, MIC)有关[8]。Doliwa等[9]采用差异凝胶电泳(DIGE)结合质谱的方法来鉴定在弓形虫磺胺嘧啶耐药菌株中差异表达的蛋白,获得68个差异表达蛋白,耐药株中过表达蛋白为44%,敏感株中过表达蛋白为56%。除此之外,有研究发现, 与敏感株相比,对磺胺嘧啶耐药的弓形虫体内棒状体激酶家族蛋白(ROP2A)上调表达,烯醇化酶2(enolase 2)和膜骨架蛋白(IMC1)下调表达[9]。Bhandari等[10]通过对10株耐锑和4株敏感利什曼原虫临床分离株中的表面抗原-2(PSA-2) 基因的表达情况进行研究,发现在临床分离的耐药株中,PSA-2基因表达显著升高(1.5倍)。Chen等[11]利用cDNA微阵列技术对柔嫩艾美耳球虫莫能菌素耐药株和马杜拉霉素耐药株与敏感株的基因表达进行比较分析,发现莫能菌素耐药株与敏感株相比有318个基因上调表达,57个基因下调表达;马杜拉霉素耐药株有133个基因上调表达,408个基因下调表达。
为深入研究鸡球虫耐药性产生的机制,本实验室前期利用柔嫩艾美耳球虫药物敏感株(DS)成功诱导出柔嫩艾美耳球虫地克珠利耐药株(DZR)和马杜拉霉素耐药株(MRR)[12],随后对诱导的耐药株和敏感株进行了转录组测序分析,结果发现,柔嫩艾美耳球虫含HD域蛋白(HD domain-containing protein, EtHDCP)在耐药株(DZR、MRR)中的mRNA转录水平显著高于DS[13]。HD结构域是一种保守结构域,该结构域包含一对组氨酸和天冬氨酸(HD)的保守残基,它们的活性位点与金属离子结合,主要执行磷酸水解酶的活性[14]。迄今为止,已经鉴定出几种HD结构域蛋白,包括环核苷酸磷酸二酯酶(cNMPPDEs)、脱氧鸟苷三磷酸水解酶(dGTPase)、tRNA核苷酸转移酶、dNTP三磷酸水解酶(dNTPase)、大肠杆菌5′-脱氧核糖核苷酸酶YfbR和严紧反应四磷酸鸟苷(ppGpp)水解酶/合成酶(SpoT/RelA);在真核生物和细菌古生菌中,研究发现一些含HD结构域的蛋白质可能参与了信号转导、核苷酸代谢等[15]。为了分析柔嫩艾美耳球虫含HD域蛋白的功能特性以及与药物的关系,本研究克隆了柔嫩艾美耳球虫EtHDCP、表达并纯化了重组蛋白rEtHDCP,通过荧光定量PCR(qPCR)、Western blot、间接免疫荧光定位和体外抑制试验对该基因的分子特性和功能进行了初步研究。
1 材料与方法 1.1 实验动物、细胞和质粒1日龄三黄鸡购自上海奉贤区某养殖场,严格控制饲养环境确保无球虫存在。8周龄新西兰大白兔购自上海甲干生物科技有限公司,6周龄BALB/c小鼠购自上海灵畅生物科技有限公司。鸡胚成纤维细胞(DF-1)和原核表达载体pGEX-4T-2均由中国农业科学院上海兽医研究所动物原虫病创新团队保存提供。
1.2 虫株柔嫩艾美耳球虫药物敏感虫株为本实验室保存的DS,该虫株于20世纪80年代分离自上海市某鸡场[16]。DZR和MRR均由DS通过药物诱导获得[12],利用10日龄无球虫雏鸡对虫株进行大量繁殖、收集孢子化卵囊于2.5%的重铬酸钾中保存。
在无球虫环境下饲养1日龄三黄鸡1周,经检查确定雏鸡未被球虫感染后,口服接种柔嫩艾美耳球虫孢子化卵囊5×104个·羽-1,7 d后从盲肠中收集未孢子化卵囊(unsporulated oocysts,UO)并进行纯化[17],孢子化卵囊(sporulated oocysts,SO)可通过UO体外氧化获得。纯化后的SO利用玻璃珠通过涡旋振荡进行体外脱囊,用胆汁和胰蛋白酶配制消化液消化孢子囊使子孢子(sporozoites,SZ)逸出,随后对SZ进行纯化和收集[18]。第二代裂殖子(second generation merozoites,SM)在鸡接种SO后112 h可从其盲肠黏膜中收集纯化获得[19]。
1.3 试剂RNase-free DNase I、Trizol、2×Taq PCR Master Mix、SYBR green Ⅰ荧光染料(TaKaRa);DNA胶回收试剂盒、DL2000(DNA Marker)、质粒小提试剂盒、BCA蛋白浓度测定试剂盒(天根);RNA Easy Mini Kit、QIA quick PCR Purification Kit(QIAGEN);pGEM®-T-Easy Vector、T4 DNA连接酶(Promega);M-MLV反转录试剂盒(Invitrogen);限制性核酸内切酶:BamHⅠ和SalⅠ(美国NEB);VybrantTM CFDA SE Cell Tracer Kit(Invitrogen)。
1.4 cDNA模板的制备和基因克隆取适量实验室保存的柔嫩艾美耳球虫敏感株孢子化卵囊,根据Trizol说明书上的步骤提取卵囊总RNA,随后对总RNA进行琼脂糖凝胶电泳鉴定其完整性,并用紫外分光光度计检测其浓度和纯度。经检测符合要求后,将提取的总RNA按照M-MLV Reverse Transcriptase说明书步骤反转录为单链cDNA第一链[20]。根据EtHDCP基因(GenBank登录号:XM_013378851.1)的编码区(462 bp)序列,用Primer5.0引物设计软件进行特异性引物的设计,其中,上游引物:5′-GCGGATCCATGAGCGGAGAAGAAAG-3(BamHⅠ),下游引物:5′-GCGTCGACTTAAAAACTTGAAAATTTGAA-3′(SalⅠ)。以cDNA为模板,用上述所设计的引物对其进行PCR扩增[20]。将PCR产物胶回收后与pGEM-T-easy载体进行连接,并转化至大肠杆菌(E. coli)TOP10感受态细胞进行蓝白斑筛选,于37 ℃培养13 h后挑取白色单菌落进行PCR鉴定,并送上海生工生物科技有限公司测序。
1.5 生物信息学分析将测序结果与EtHDCP全长序列进行BLAST相似性分析(http://www.ncbi.nlm.nih.gov/BLAST/),使用ExPASy网站上的ProtParam(http://web.expasy.org/protparam/)工具预测EtHDCP的相对分子质量和理论等电点。采用SignalP4.0(http//www.cbs.dtu.dk/services/SignalP)和TMHMM服务器(http://www.cbs.dtu.dk/services/TMHMM-2.0/)分析EtHDCP基因编码的蛋白有无信号肽和跨膜结构。随后利用Motifscan(http://myhits.isb-sib.ch/cgi-bin/motifscan)对氨基酸序列含有的功能结构域进行分析。
1.6 重组蛋白的表达、纯化和多克隆抗体的制备从测序正确的菌液中提取重组质粒pGEM-EtHDCP,将pGEM-EtHDCP和原核表达载体pGEX-4T-2双酶切后进行1%的琼脂糖凝胶电泳,随后回收目的片段进行连接。连接成功的重组表达质粒重命名为pGEX-4T-EtHDCP,经PCR鉴定结合测序结果将确定正确的重组质粒后转化至大肠杆菌BL21感受态细胞中。将含重组质粒pGEX-4T-EtHDCP的大肠杆菌菌液用1.0 mmol·L-1 IPTG在37 ℃条件下于180 r·min-1的摇床中培养8 h进行蛋白的诱导表达,在加入IPTG后立即摇匀菌液并取出1 mL于4 ℃冰箱暂存作为0 h的对照。菌液培养结束取出1 mL诱导了8 h的菌液,用于分析蛋白的表达情况,剩下的菌液离心后用灭菌PBS重悬并在冰浴的条件下进行超声(超声功率设置为300 W,以“启动5 s,停止3 s”的方式超声30 min),随后通过SDS-PAGE分析重组蛋白的表达形式[21]。在发现重组蛋白以包涵体的形式表达后对其进行切胶纯化,并通过SDS-PAGE鉴定其纯度,利用BCA蛋白浓度测定试剂盒测定蛋白浓度后置于-80 ℃条件下储存备用[22]。将纯化后的重组蛋白与弗氏完全佐剂乳化后,首次免疫新西兰大白兔和BALB/c小鼠。并用纯化后的重组蛋白和弗氏不完全佐剂对上述动物进行4次加强免疫。每只新西兰大白兔每次免疫的蛋白剂量为200 μg,每只BALB/c小鼠每次免疫的蛋白剂量为50 μg。免疫结束后一周收集试验所需的动物血清[23]。
1.7 重组EtHDCP(rEtHDCP)蛋白的反应原性分析取适量纯化后的重组蛋白进行SDS-PAGE并转印至PVDF膜上,随后置于5%脱脂奶粉中于4 ℃条件下过夜封闭。封闭结束后用PBS洗膜3次,随后分别用兔抗子孢子全蛋白血清(1∶100稀释)、抗GST标签单克隆抗体(1∶5 000稀释)以及健康兔血清(1∶100稀释)作为一抗于37 ℃孵育2 h,用PBS洗膜3次,然后用HRP-conjugated Affinipure Goat Anti-Rabbit IgG(H+L)或HRP-conjugated Affinipure Goat Anti-Mouse(1∶10 000稀释)作为二抗在室温条件下于脱色摇床上缓慢轻摇孵育45 min,用PBS洗膜3次后再用显影液孵育2 min, 于ChemiDocTM Touch Imaging System成像系统中进行成像。兔抗子孢子全蛋白血清以及健康兔血清均由实验室保存、提供[24]。
1.8 利用实时荧光定量PCR检测EtHDCP在DS四个不同发育阶段中的转录水平为研究基因EtHDCP在DS 4个不同发育阶段的转录水平差异,分别提取处于4个不同阶段(UO、SO、SZ、SM)的总RNA,然后去除基因组DNA,将虫体总RNA反转录成cDNA后用DNA纯化试剂盒对其进行纯化,将得到的终产物作为qPCR的模板[25]。上游引物:5′-GATCATTCTTTCGGAGTTGCATTTC-3′,下游引物:5′-CGTTCGTATTCTTCCCAGAGTTCGC-3′,扩增片段长度269 bp;用18S RNA作为内参,其上游引物:5′-TGTAGTGGAGTCTTGGTGATTC-3′,下游引物:5′-CCTGCTGCCTTCCTTAGATG-3′, 扩增片段长度207 bp。利用TaKaRa荧光定量PCR试剂盒通过ABI 7500定量PCR仪对EtHDCP在虫体四个不同发育阶段的转录水平进行分析,每个反应重复3次,最终的试验数据用2-ΔΔCt的统计学方法进行计算以获得相对mRNA的转录水平。
1.9 利用Western blot分析EtHDCP在DS 4个不同发育阶段和不同虫株的翻译水平取适量纯化后的敏感株4个阶段的虫体(UO、SO、SZ、SM)于离心管中,加入RIPA强裂解液对虫体进行裂解,同时加入少许蛋白酶抑制剂抑制裂解虫体过程中释放出来的蛋白酶,防止提取的蛋白被其降解,随后加入与虫体等体积的玻璃珠将离心管于涡旋振荡器进行振荡,按照振荡2 min,冰浴30 s的方法间或振荡60 min。之后于离心机中4 ℃条件下12 000 r·min-1离心10 min。上清即为提取的可溶全蛋白,取少量进行SDS-PAGE分析,检测蛋白的质量,并用BCA试剂盒检测浓度。根据蛋白浓度上样,使4个阶段虫体蛋白的含量一致,随后进行转膜、封闭,用兔抗EtHDCP多克隆抗体作为一抗进行孵育,并用鼠抗α-Tubulin作为内参,然后用相应抗性的二抗进行孵育。照膜后,用Image J软件对条带进行灰度分析。利用同样方法处理不同耐药株和敏感株孢子化卵囊,分析EtHDCP在敏感株和不同耐药株SO阶段的蛋白翻译水平。
1.10 EtHDCP的间接免疫荧光定位提前将细胞飞片置于6孔板中,并于每孔中接种1.8×105个DF-1细胞,随后放入37 ℃、5%CO2细胞培养箱中过夜培养,次日收集纯化子孢子并以3∶1的比例接入细胞于41 ℃、5%CO2细胞培养箱中进行孵育,在子孢子入侵DF-1细胞2、12、24、48、60、72和84 h后各取出一个细胞板,用4%细胞固定液室温固定30 min,并用PBS洗涤数次。之后用1% Triton X-100在室温条件下进行通透30 min,PBS洗涤数次后,用2%胎牛血清白蛋白(BSA)4 ℃封闭过夜。兔抗rEtHDCP多克隆血清(1∶100稀释)作为一抗37 ℃孵育2 h,随后洗去一抗,加入FITC标记的山羊抗兔IgG(1∶500稀释)避光孵育1 h,洗涤数次后用10 μg·mL-1DAPI室温标记10 min,洗涤数次后,用抗荧光淬灭剂封闭细胞飞片,并用荧光显微镜进行观察。用相同的方式处理没有入侵DF-1细胞的子孢子和裂殖子。
1.11 兔抗rEtHDCP多克隆抗体对子孢子入侵DF-1细胞的影响试验前1 d,24孔板的每孔中接种2.0×105个DF-1细胞,置于37 ℃、5%CO2细胞培养箱中培养。提取新鲜的子孢子用标记液(CFDASE细胞增殖与示踪检测试剂)进行标记15 min(CFDA SE是一种可对活细胞进行荧光标记的细胞染色试剂,无毒性,不影响细胞活性),随后将其悬浮于含10%胎牛血清和1%双抗的DMEM培养基中, 用50、100、200、300、400 μg·mL-1的兔抗rEtHDCP多克隆抗体IgG37 ℃孵育2 h,用同样浓度的健康兔IgG作为阴性对照,预留不用任何IgG孵育的标记虫体入侵DF-1细胞作为空白对照(通过流式细胞仪可获得未经抗体作用的子孢子入侵率,抗体作用的子孢子入侵抑制率需要利用该数据进行计算)。孵育后的子孢子用含5%胎牛血清和3%双抗的DMEM培养基重悬并加入到细胞中于41 ℃、5%CO2细胞培养箱中入侵8 h。最后使用流式细胞仪进行检测并计算子孢子的入侵率[入侵抑制率=(1-抗体作用的子孢子入侵率/未经抗体作用的子孢子入侵率)×100%]。
2 结果 2.1 EtHDCP基因的克隆和生物信息学分析以DS虫株的cDNA第一链为模板,设计特异性引物对其进行PCR扩增,通过1%琼脂糖凝胶电泳获得与目标序列(462 bp)大小一致的扩增条带。随后将回收的目的条带与克隆载体pGEM-T-easy进行连接构建重组质粒pGEM-T-EtHDCP,将其转化至大肠杆菌E.coli TOP10感受态细胞并经蓝白斑筛选后送公司测序。序列经BLAST分析发现该序列编码的氨基酸与已知柔嫩艾美耳球虫HD结构域蛋白(HD-domain containing protein,GenBank:XM_013378851.1)的相似性为100%,与卡耶塔环孢子虫(Cyclospora cayetanensis)、布氏艾美耳球虫(Eimeria brunetti)的HD结构域蛋白的相似性分别为61%和71%,据此推测该蛋白属于HDc超家族。由上述比对结果可知该基因成功克隆,并将其命名为EtHDCP。对其进行生物信息学分析,结果显示,该基因编码153个氨基酸,分子量为17.3 ku,预测等电点为5.8,其编码的蛋白无信号肽和跨膜结构域。蛋白质结构预测结果显示该基因编码的蛋白含有1个N-糖基化位点,6个酪蛋白激酶Ⅱ磷酸化位点,1个N-肉豆蔻酰化位点,2个蛋白激酶C磷酸化位点,1个细胞附着序列和1个双核定位信号(图 1)。

|
星号. 终止密码子;单横线. N-糖基化位点;绿色字体. 酪蛋白激酶Ⅱ磷酸化位点;灰色阴影. N-肉豆蔻酰化位点;双横线. 蛋白激酶C磷酸化位点;红色字体. 细胞附着序列;波浪线. 双核定位信号 Sterisk. Stop codon; Transverse line. N-glycosylation site; Green. Casein kinase Ⅱ phosphorylation site; Gray. N-myristoylation site; Double-line. Protein kinase C phosphorylation site; Red. Cell attachment sequence; Wavy line. Bipartite nuclear localization signal 图 1 EtHDCP基因cDNA核苷酸序列及其氨基酸序列的生物信息学分析 Fig. 1 Bioinformatic analysis of EtHDCP cDNA and deduced amino acids |
将鉴定正确的重组表达质粒pGEX-4T-EtHDCP转化至大肠杆菌BL21感受态细胞,用IPTG进行诱导表达,通过SDS-PAGE对重组蛋白的表达情况进行分析,结果显示成功诱导表达了重组蛋白rEtHDCP,并且该蛋白以包涵体的形式进行表达(图 2A、B)。随后利用切胶的方式纯化rEtHDCP,通过SDS-PAGE对纯化后的蛋白进行检测,结果表明通过该方式可获得较纯的rEtHDCP融合蛋白(图 2C)。

|
A. 重组蛋白的成功表达;B. 重组蛋白表达形式分析;C. 重组蛋白的纯化;D. 多克隆抗体的制备; M. 蛋白质相对分子质量标准; 1. 纯化后的EtHDCP重组蛋白; 2. 纯化后的多克隆抗体 A. Successful expression of recombinant protein; B. Analysis of expression forms of recombinant protein; C. The purification of recombinant protein; D. The preparation of polyclonal antibodies; M. Protein marker; 1. Purified EtHDCP; 2. Purified polyclonal antibody 图 2 EtHDCP重组蛋白的表达、纯化以及多克隆抗体的制备 Fig. 2 The expression and purification of EtHDCP recombinant protein and preparation of polyclonal antibody |
用纯化后的rEtHDCP免疫动物并收集血清,随后利用Protein A+G Agarose从兔抗血清中纯化出多克隆抗体。并用SDS-PAGE对纯化效果进行检测(图 2D),结果显示纯化出的多克隆抗体有大、小两条主要条带(分别为55和25 ku),即为IgG的重链和轻链,说明IgG纯化成功。
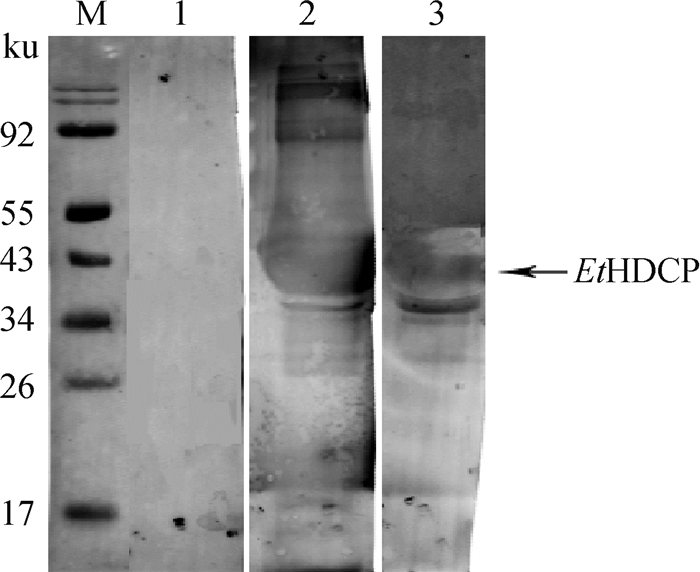
2.3 重组蛋白的反应原性分析以健康兔血清、兔抗子孢子全蛋白血清以及GST标签单克隆抗体为一抗对纯化的rEtHDCP蛋白进行鉴定,结果显示,以健康兔血清孵育的重组蛋白没有条带出现,而用兔抗子孢子全蛋白血清和GST标签单克隆抗体孵育的重组蛋白在43 ku处均出现了条带(图 3),说明rEtHDCP反应原性良好。
|
M. 蛋白质相对分子质量标准;A. EtHDCP;1. 以阴性兔血清为一抗孵育;2. 以GST标签单抗为一抗孵育;3. 以兔抗子孢子血清为一抗孵育 M. Protein marker; A. EtHDCP; lane 1. Rabbit IgG as first antibody; lane 2. GST-tag monoclonal antibody as first antibody; lane 3. Anti-sporozoite polyclonal sera as first antibody 图 3 重组蛋白抗体的反应原性分析 Fig. 3 Reactionogenicity of recombinant protein |
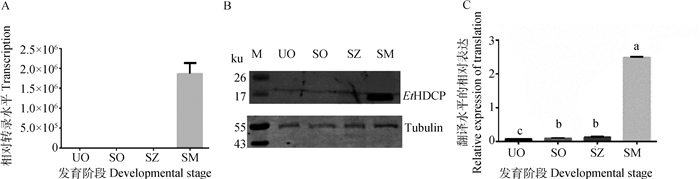
利用实时荧光定量PCR技术以基因18S rRNA为内参,对EtHDCP在柔嫩艾美耳球虫敏感株不同发育阶段(UO、SO、SZ、SM)的转录水平进行分析。结果显示该基因在SM阶段的转录水平最高,而其他三个阶段的转录水平都极低(图 4A)。
|
A. EtHDCP在柔嫩艾美耳球虫4个发育阶段的转录水平;B、C. EtHDCP在柔嫩艾美耳球虫4个发育阶段的翻译水平[Western blot(M.蛋白质相对分子质量标准)及其灰度分析]。柱上字母不同表示差异显著(P<0.05) A. Transcription levels of EtHDCP in four developmental stages of E.tenella; B, C. Translation levels of EtHDCP in four developmental stages of E. tenella, Western blot (M. Protein marker) and its gray scale analysis. Different letters on the column indicate significant difference (P < 0.05) 图 4 EtHDCP在柔嫩艾美耳球虫4个发育阶段的转录水平和翻译水平 Fig. 4 Transcription and translation levels of EtHDCP in 4 developmental stages of E.tenella |
通过Western blot对天然EtHDCP在柔嫩艾美耳球虫4个不同发育阶段的虫体全蛋白进行检测,以鼠抗α-Tubulin作为试验所用内参。天然EtHDCP蛋白大小在17 ku左右,结果显示EtHDCP蛋白在SM阶段的翻译水平最高,而其在另外3个阶段的表达量都很低(图 4B、C,其中, 图 4C为图 4B的灰度值分析结果),与qPCR结果一致。
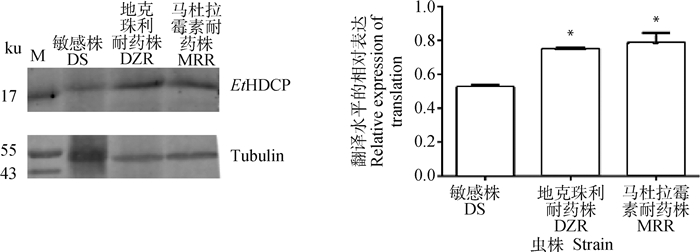
2.5 EtHDCP在柔嫩艾美耳球虫敏感株和不同耐药株中的翻译水平提取DS、DZR、MRR孢子化卵囊全蛋白进行SDS-PAGE电泳,随后将其转印至PVDF膜并用鼠抗rEtHDCP多克隆抗体血清(1∶100稀释)作为一抗进行孵育,以稀释后的IRDye 680RD Donky anti-Mouse IgG作为二抗(1∶5 000稀释)进行孵育,并用鼠抗α-Tubulin作为试验所用内参。通过Image J软件对Western blot结果进行灰度分析,发现EtHDCP蛋白与DS相比,在DZR、MRR中均为上调表达(图 5)。
|
*.P < 0.05 图 5 敏感株和耐药株EtHDCP基因的蛋白翻译水平(Western blot及其灰度分析) Fig. 5 Protein translation levels of EtHDCP gene in sensitive strain and drug-resistant strains (Western blot and its gray scale analysis) |
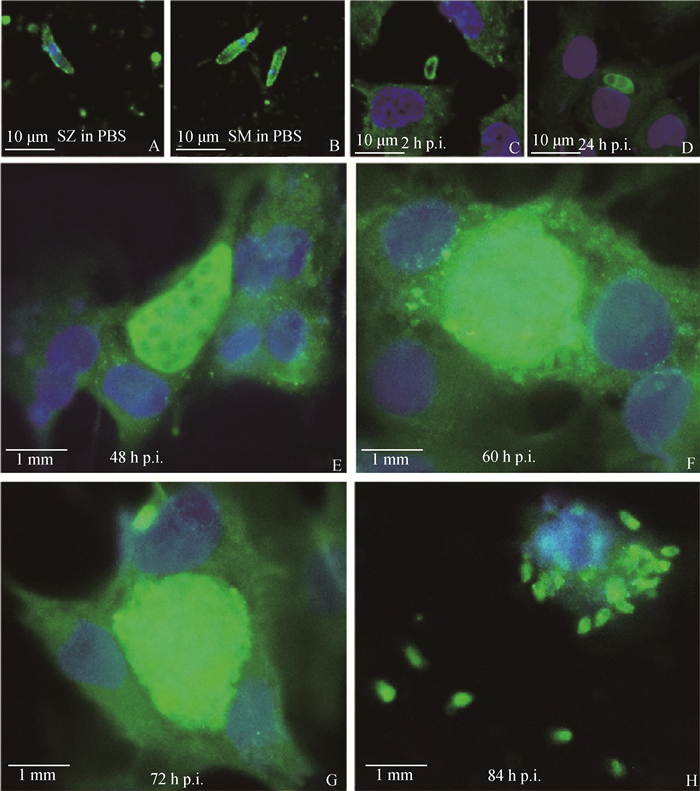
依次用兔抗rEtHDCP多克隆抗体血清(1∶100稀释)、FITC标记的山羊抗兔荧光二抗(1∶500稀释)孵育封闭固定好的细胞爬片,并用DAPI核染色液(1∶500稀释)进行标记,随后用荧光显微镜观察处理好的细胞爬片,分析EtHDCP蛋白在柔嫩艾美耳球虫SZ、SM以及SZ体外入侵DF-1细胞后不同发育阶段的定位情况(用健康兔血清作为阴性对照)。结果如图 6所示:该蛋白广泛分布于SZ表面以及SM的表面和细胞质;当SZ入侵DF-1细胞2 h后,蛋白也主要位于虫体表面,随着虫体在细胞内进一步发育为滋养体、未成熟裂殖体、成熟裂殖体和第一代裂殖子(24、48、60、72和84 h),荧光强度增强。表明虫体入侵细胞后在细胞内生长发育的过程中EtHDCP的表达量升高。
|
A. 重悬于PBS的子孢子;B. 重悬于PBS的裂殖子;C. 子孢子入侵DF-1细胞2 h;D. 子孢子入侵DF-1细胞24 h发育为滋养体;E. 子孢子入侵DF-1细胞48 h发育为未成熟裂殖体;F. 子孢子入侵DF-1细胞60 h发育为未成熟裂殖体;G. 子孢子入侵DF-1细胞72 h发育为成熟裂殖体;H. 子孢子入侵DF-1细胞84 h发育为第一代裂殖子;I. 健康兔IgG孵育的子孢子 A. Sporozoites (SZ) in PBS; B. Second generation merozoites (SM) in PBS; C. At 2 hpi, intracellular sporozoites (iSZ); D. At 24 hpi, trophozoites; E. At 48 hpi, immature Schizonts; F. At 60 hpi, immature schizonts; G. At 72 hpi, mature schizonts; H. At 84 hpi, first generation Merozoites; I. SZ incubated with healthy rabbit IgG 图 6 间接免疫荧光试验检测EtHDCP在不同发育阶段的分布 Fig. 6 Indirect immunofluorescence assay for detection of distribution of EtHDCP at different stages of development |
结果显示,随着抗体浓度的增加,兔IgG对子孢子入侵DF-1细胞无明显作用,其抑制率在0左右。而抗rEtHDCP多克隆抗体对子孢子入侵DF-1细胞有明显的抑制作用,其抑制率随着抗体浓度的增加而增加,在抗体浓度为400 μg·mL-1时可达到40%(图 7)。
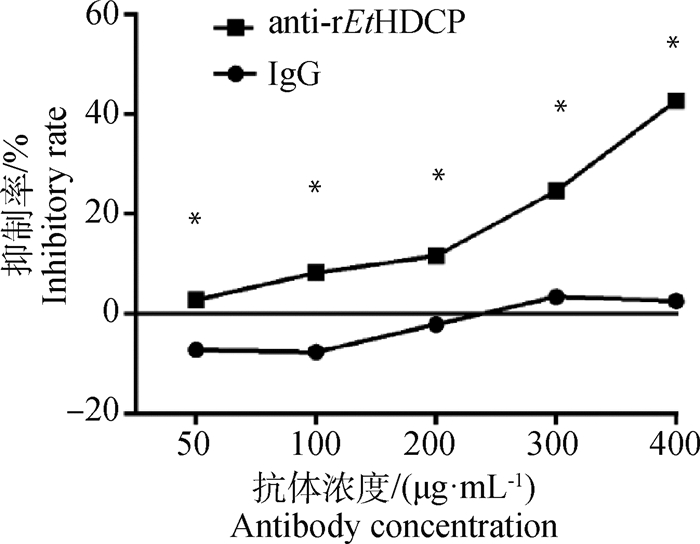
|
*.P < 0.05 图 7 抗rEtHDCP多克隆抗体对子孢子侵入细胞的抑制试验 Fig. 7 Inhibition of sporozoite invasion in vitro by anti-rEtHDCP |
为了做好球虫耐药性的检测和球虫病的防治工作,使得深入了解球虫耐药性产生的机制变得尤为重要。为此,实验室前期对DS、DZR、MRR进行了转录组测序分析,结果显示,与DS相比,EtHDCP在耐药株中上调表达[log2Ratio(DZR/DS)为5.98,log2 Ratio(MRR/DS)为5.64][13],该基因在耐药株中的差异表达可能与其对抗球虫药产生耐药有关。细胞抑制剂脱氧胞苷类似物阿糖胞苷(Ara-C)是一种可有效治疗急性髓系白血病(AML)的化学疗法抗癌药物,Schneider等[26]指出含有相同HD结构域的新型肿瘤抑制因子无菌α基序和含HD结构域的蛋白1(SAMHD1)能去除阿糖胞苷活性形式的磷酸盐残留物,从而将其逆转成失活状态;此外研究人员还发现,抑制SAMHD1能有效地增加阿糖胞苷抗性AML细胞对阿糖胞苷化疗的敏感性。这提示EtHDCP可能与SAMHD1具有类似的功能,该基因在耐药株中的高表达可能是药物作用的结果。
本研究成功克隆了EtHDCP基因,通过对其生物信息学分析发现,EtHDCP含有1个N-糖基化位点,6个酪蛋白激酶Ⅱ磷酸化位点,1个N-肉豆蔻酰化位点,2个蛋白激酶C磷酸化位点,1个细胞附着序列和1个双核定位信号。细胞膜表面蛋白的N-糖基化参与调控肿瘤细胞的增殖、迁移、侵袭以及免疫逃逸等功能[27]。酪蛋白激酶Ⅱ(CKII)是一种普遍存在的丝氨酸/苏氨酸蛋白激酶,其在体内通过对底物的磷酸化在细胞增殖分化和凋亡、信号的转导等过程中发挥着重要作用[28]。N-肉豆蔻酰基转移酶(NMT)是一种细胞溶质单体酶, 主要参与二级信号转导、囊泡转运、病毒成熟和肿瘤形成等一些重要的生物学过程[29]。蛋白激酶C(PKC)是一种重要的信号转导酶,起着将细胞表面配体-受体相互作用产生的信号传递到细胞核的作用;PKC的激活将触发其下游不同信号级联反应,调节细胞的增殖、分化、凋亡、转化等功能[30]。EtHDCP蛋白存在的糖基化位点、酰化位点以及磷酸化位点,提示着该蛋白通过翻译后修饰发挥重要功能,可能在虫体的增殖、对宿主细胞的入侵以及逃逸宿主的免疫等过程中发挥着重要的作用。
Western blot分析发现EtHDCP在两个耐药株中的蛋白翻译水平均高于DS,与转录组测序的结果一致,这可能是EtHDCP参与球虫抵抗外界的药物压力所造成的。据报道酿酒酵母中含有多个HD结构域蛋白,包括30, 50-环核苷酸磷酸二酯酶2(PDE2)、DNA损伤诱导氰化酰胺水合酶DDI2和DDI3,PDE2通过控制酵母细胞胞外cAMP的水平来保护细胞,DDI2或DDI3参与解毒和/或利用环境中有毒的腈化合物氰酰胺[15]。有研究发现,在AML异种移植小鼠模型中,与缺乏SAMHD1功能的小鼠相比,Ara-C对SAMHD1功能良好的小鼠治疗效果更好[31]。此外,使用以SAMHD1为靶点的慢病毒蛋白X(Vpx)在原发性AML细胞中耗尽SAMHD1,增加了Ara-C的敏感性[32]。结合本试验结果,推测可能是由于虫体内EtHDCP的高表达影响了相关水解反应的发生,加速了细胞内药物的水解,从而提高球虫对药物的耐受力。
q-PCR和Western blot分析显示,EtHDCP在第二代裂殖子阶段高表达,而在其他发育阶段表达量相对较低,荧光定位也显示虫体在细胞内的裂殖生殖发育阶段荧光强度增强。裂殖生殖是在鸡肠上皮细胞内完成发育的,裂殖子从裂殖体中释放的过程会对肠上皮细胞造成损伤,释放出来的裂殖子会进入新的肠上皮细胞再次进行裂殖生殖,如此周而复始可以进行多次裂殖生殖,导致肠上皮细胞受到严重破坏。因此作者推测EtHDCP在裂殖子阶段的大量表达可能与其进行裂殖生殖和逃逸宿主免疫有关。有研究发现在许多肿瘤细胞中CKII存在转录和翻译水平的增高,以及激酶活性的增加,与已报道的CKII促进细胞生长和抑制细胞凋亡的作用一致[28]。由于EtHDCP蛋白含有CKII磷酸化位点,推测裂殖子可能通过CKII对高表达的EtHDCP蛋白进行底物磷酸化促进了其在宿主体内完成裂殖生殖过程。除此之外,EtHDCP蛋白中的N-糖基化位点,蛋白激酶C磷酸化位点都与细胞增殖有关,它们可能通过蛋白的翻译后修饰作用也参与了虫体的裂殖生殖过程。有研究表明,N-糖基化结构可以与凝集素结合,影响T细胞的激活、信号传导和存活,如半乳糖凝集素能够结合相关的N-糖基化受体,通过影响T细胞的激活、信号传导和存活从而实现肿瘤细胞的免疫逃逸[33]。有学者发现程序性死亡配体1(PD-L1)在N35、N192、N200和N219位点发生N-糖基化,这一代谢过程能够通过拮抗糖原合成酶激酶-3β(GSK3β)与PD-L1的结合,阻止PD-L1降解来提高自身稳定性[33]。由于EtHDCP蛋白中含有N-糖基化位点,作者推测该蛋白可能通过N-糖基化作用完成对宿主的免疫逃逸。
间接免疫荧光定位发现该蛋白主要定位在子孢子和裂殖子的表面以及裂殖子的胞质内,而且随着虫体在细胞内进一步发育为滋养体和裂殖体,荧光强度增强,表明虫体入侵细胞后在细胞内生长发育的过程中EtHDCP的表达量升高,与q-PCR和Western blot试验结果一致。经Signal P和TMEMM预测发现该蛋白无信号肽和跨膜区。Kopeckova等[34]通过对致病细菌中甘油醛-3-磷酸脱氢酶(GAPDH)的多样性定位和蛋白质结合能力进行研究发现,GAPDH可在细菌表面或细菌细胞外检测到,并与宿主蛋白相互作用,而GAPDH序列缺乏任何已知的胞外溶解转运识别基序(如N端信号序列、六肽排序基序或C端疏水尾),推测该蛋白定位于除细胞质外的其他部位是通过翻译后修饰完成的。作者推测缺乏信号肽和跨膜区的EtHDCP可能也是通过翻译后修饰的方式实现其在虫体表面的定位。除此之外,Péroval等[35]通过研究发现,柔嫩艾美耳球虫热休克蛋白90在子孢子表面、纳虫空泡以及蛋白复合物中均有检测到,而该蛋白也没有信号肽和跨膜区,该蛋白最初与宿主细胞相互作用产生了一连串的事件,从而帮助虫体入侵宿主细胞,EtHsp90可能在信号传递的级联过程中发挥作用,允许其与顶端分泌蛋白结合并以异复合物的形式维持分泌。因此,作者推测EtHDCP也可能和EtHsp90具有类似的机制,通过与其他分泌蛋白结合在入侵过程中完成自身的释放,体外抑制试验也证实EtHDCP参与了子孢子入侵宿主细胞的过程。然而EtHDCP的具体分泌机制尚不清楚,需要进一步研究。
通过体外抑制试验发现抗rEtHDCP多克隆抗体可明显抑制球虫子孢子对DF-1细胞的入侵。姜连连等[36]首次报道了柔嫩艾美耳球虫顶膜抗原1(Et AMA1),荧光定位发现该蛋白定位在子孢子的顶端和表面,体外抑制试验显示抗Et AMA1多克隆抗体处理过的子孢子对DF-1细胞的入侵率下降了70%,表明Et AMA1对球虫入侵宿主细胞起重要的作用。于钰等[37]研究发现当子孢子入侵DF-1细胞后,柔嫩艾美耳球虫丝氨酸/苏氨酸蛋白磷酸酶(EtSTP)位于子孢子的表面和带虫空泡膜(PV)上,且在耐药株高表达,抗rEtSTP多克隆抗体能显著降低子孢子入侵DF-1细胞。刘桂玲等[38]通过对柔嫩艾美球虫表面抗原10(EtSAG10)进行研究,发现兔抗rEtSAG10对子孢子入侵DF-1细胞的抑制率随着抗体浓度的增加而增加,在抗体浓度为400 μg·mL-1时入侵抑制率可达60%。相比之下,兔IgG对入侵没有明显的抑制作用。因此作者推测抗rEtHDCP多克隆抗体可能与定位在虫体表面的EtHDCP蛋白发生反应,破坏了该蛋白对虫体的保护作用,从而抑制了其对宿主细胞的入侵。
4 结论克隆柔嫩艾美耳球虫EtHDCP基因,表达获得重组蛋白rEtHDCP并对其分子特性和基本功能进行了探究。EtHDCP定位在子孢子和裂殖子的表面以及裂殖子的胞质内,并且在裂殖子阶段高表达,其在耐药株(DZR和MRR)中的表达水平显著高于敏感株。此外,体外抑制试验显示抗rEtHDCP多克隆抗体可明显抑制子孢子对宿主细胞的入侵。这些结果表明EtHDCP可能在虫体的发育、耐药性的产生以及其对宿主细胞的入侵过程中发挥了重要的作用。
| [1] |
戴爱琴. 鸡球虫病的防治[J]. 当代畜禽养殖业, 2021(3): 46-47. DAI A Q. Control of coccidiosis in chickens[J]. Modern Animal Husbandry, 2021(3): 46-47. DOI:10.3969/j.issn.1005-5959.2021.03.017 (in Chinese) |
| [2] |
WILLIAMS R B. Anticoccidial vaccines for broiler chickens: pathways to success[J]. Avian Pathol, 2002, 31(4): 317-353. DOI:10.1080/03079450220148988 |
| [3] |
SOUTTER F, WERLING D, TOMLEY F M, et al. Poultry coccidiosis: design and interpretation of vaccine studies[J]. Front Vet Sci, 2020, 7: 101. DOI:10.3389/fvets.2020.00101 |
| [4] |
CHAPMAN H D, JEFFERS T K. Vaccination of chickens against coccidiosis ameliorates drug resistance in commercial poultry production[J]. Int J Parasitol: Drugs Drug Resist, 2014, 4(3): 214-217. DOI:10.1016/j.ijpddr.2014.10.002 |
| [5] |
高海霞. 肉鸡球虫疾病活疫苗防治研究进展[J]. 中国动物保健, 201, 23(3): 95-96. GAO H X. Research progress of live vaccine against coccidiosis in broilers[J]. China Animal Health, 201, 23(3): 95-96. (in Chinese) |
| [6] |
MOK S, ASHLEY E A, FERREIRA P E, et al. Population transcriptomics of human malaria parasites reveals the mechanism of artemisinin resistance[J]. Science, 2015, 347(6220): 431-435. DOI:10.1126/science.1260403 |
| [7] |
HALDAR K, BHATTACHARJEE S, SAFEUKUI I. Drug resistance in Plasmodium[J]. Nat Rev Microbiol, 2018, 16(3): 156-170. DOI:10.1038/nrmicro.2017.161 |
| [8] |
莫平华, 马庆涛, 纪小霞, 等. 青蒿素对鸡柔嫩艾美耳球虫第二代裂殖子微线基因mRNA转录及鸡盲肠组织结构的影响[J]. 畜牧兽医学报, 2014, 45(5): 833-838. MO P H, MA Q T, JI X X, et al. Effects of artemisinin treatment on microneme genes transcription in second-generation merozoites and pathological changes of caecum in chickens infected by Eimeria tenella[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(5): 833-838. (in Chinese) |
| [9] |
DOLIWA C, XIA D, ESCOTTE-BINET S, et al. Identification of differentially expressed proteins in sulfadiazine resistant and sensitive strains of Toxoplasma gondii using difference-gel electrophoresis (DIGE)[J]. Int J Parasitol: Drugs Drug Resist, 2013, 3: 35-44. DOI:10.1016/j.ijpddr.2012.12.002 |
| [10] |
BHANDARI V, KUMAR D, VERMA S, et al. Increased parasite surface antigen-2 expression in clinical isolates of Leishmania donovani augments antimony resistance[J]. Biochem Biophys Res Commun, 2013, 440(4): 646-651. DOI:10.1016/j.bbrc.2013.09.113 |
| [11] |
CHEN T, ZHANG W, WANG J M, et al. Eimeria tenella: analysis of differentially expressed genes in the monensin-and maduramicin-resistant lines using cDNA array[J]. Exp Parasitol, 2008, 119(2): 264-271. DOI:10.1016/j.exppara.2008.02.010 |
| [12] |
韩红玉, 赵其平, 陈兆国, 等. 柔嫩艾美耳球虫地克珠利抗药株和马杜拉霉素抗药株的实验室诱导[J]. 中国兽医学报, 2004, 24(2): 138-140. HAN H Y, ZHAO Q P, CHEN Z G, et al. Experimental induction of drug-resistant strains of Eimeria tenella to diclazuril and maduramycin[J]. Chinese Journal of Veterinary Science, 2004, 24(2): 138-140. DOI:10.3969/j.issn.1005-4545.2004.02.012 (in Chinese) |
| [13] |
XIE Y X, HUANG B, XU L Y, et al. Comparative transcriptome analyses of drug-sensitive and drug-resistant strains of Eimeria tenella by RNA-sequencing[J]. J Eukaryot Microbiol, 2020, 67(4): 406-416. DOI:10.1111/jeu.12790 |
| [14] |
谢雨翔, 韩红玉, 赵其平, 等. 柔嫩艾美耳球虫2个抗药株的抗药性评估[J]. 中国动物传染病学报, 2016, 24(6): 50-55. XIE Y X, HAN H Y, ZHAO Q P, et al. Resistant assessment of maduramicin resistant strain and diclazuril resistant strain of Eimeria tenella[J]. Chinese Journal of Animal Infectious Diseases, 2016, 24(6): 50-55. (in Chinese) |
| [15] |
YANG J S, WANG F, YANG D, et al. Structural and biochemical characterization of the yeast HD domain containing protein YGK1 reveals a metal-dependent nucleoside 5'-monophosphatase[J]. Biochem Biophys Res Commun, 2018, 501(3): 674-681. DOI:10.1016/j.bbrc.2018.05.047 |
| [16] |
黄兵, 赵其平, 吴薛忠, 等. 柔嫩艾美耳球虫纯种的初步确定和致病性研究[J]. 上海畜牧兽医通讯, 1993(5): 18-20. HUANG B, ZHAO Q P, WU X Z, et al. Preliminary identification of pure species and pathogenicity of Eimeria tender[J]. Shanghai Journal of Animal Husbandry and Veterinary Medicine, 1993(5): 18-20. (in Chinese) |
| [17] |
HAN H Y, LIN J J, ZHAO Q P, et al. Identification of differentially expressed genes in early stages of Eimeria tenella by suppression subtractive hybridization and cDNA microarray[J]. J Parasitol, 2010, 96(1): 95-102. DOI:10.1645/GE-2221.1 |
| [18] |
MISKA K B, FETTERER R H, BARFIELD R C. Analysis of transcripts expressed by Eimeria tenella oocysts using subtractive hybridization methods[J]. J Parasitol, 2004, 90(6): 1245-1252. DOI:10.1645/GE-309R |
| [19] |
刘立恒, 李俊, 徐立新, 等. 柔嫩艾美耳球虫第二代裂殖子的分离纯化[J]. 畜牧与兽医, 2006, 38(12): 38-40. LIU L H, LI J, XU L X, et al. Separation and purification of Eimeria tenella second genesation merozoites[J]. Animal Husbandry & Veterinary Medicine, 2006, 38(12): 38-40. DOI:10.3969/j.issn.0529-5130.2006.12.015 (in Chinese) |
| [20] |
于钰. 柔嫩艾美耳球虫丝氨酸/苏氨酸磷酸蛋白酶和ASNA1同源ATP酶特性研究[D]. 上海: 上海师范大学, 2020: 10-11. YU Y. Molecular characterization of serine/threonine protein phosphatase and ATPase ASNA1 homolog of Eimeria tenella[D]. Shanghai: Shanghai Normal University, 2021: 10-11. (in Chinese) |
| [21] |
陈婷. 柔嫩艾美耳球虫耐药相关基因特性初步研究及耐药株与敏感株全基因组重测序分析[D]. 北京: 中国农业科学院, 2018: 30-31. CHEN T. The primary research of resistance related genes from Eimeria tenella and analysis of drug-resistant strains and sensitive strain by whole genome resequencing[D]. Beijing: Chinese Academy of Agricultural Sciences, 2018: 30-31. (in Chinese) |
| [22] |
姚亚文. 基于基因组重测序筛选柔嫩艾美耳球虫盐霉素耐药的候选基因及耐药相关基因特性研究[D]. 北京: 中国农业科学院, 2021: 37. YAO Y W. Screening of candidate genes of salinomycin resistance Eimeria tenella based on whole genome resequencing and analysis of the characteristics of drug resistance-related genes[D]. Beijing: Chinese Academy of Agricultural Sciences, 2021: 37. (in Chinese) |
| [23] |
王海霞. 柔嫩艾美耳球虫盐霉素耐药株的诱导及耐药相关基因特性的初步分析[D]. 北京: 中国农业科学院, 2020: 54. WANG H X. Induction of salinomycin resistant strain of Eimeria tenella and rreliminary analysis of the characteristics of drug resistance related genes[D]. Beijing: Chinese Academy of Agricultural Sciences, 2020: 54. (in Chinese) |
| [24] |
HAN H Y, KONG C L, DONG H, et al. Molecular characterization and functional analysis of subunit 7 of eukaryotic initiation factor 3 from Eimeria tenella[J]. Experiment Parasitol, 2015, 154: 118-126. DOI:10.1016/j.exppara.2015.04.002 |
| [25] |
赵焕之. 柔嫩艾美耳球虫CDPK3互作蛋白的筛选及两个蛋白特性的初步研究[D]. 北京: 中国农业科学院, 2019: 37-38. ZHAO H Z. Screening the interacting proteins of EtCDPK3 and primary study on the function of two proteins[D]. Beijing: Chinese Academy of Agricultural Sciences, 2019: 37-38. (in Chinese) |
| [26] |
SCHNEIDER C, OELLERICH T, BALDAUF H M, et al. SAMHD1 is a biomarker for cytarabine response and a therapeutic target in acute myeloid leukemia[J]. Nat Med, 2017, 23(2): 250-255. DOI:10.1038/nm.4255 |
| [27] |
吉致, 吴冰蕊, 魏湲颜, 等. N-糖基化在肿瘤细胞逃逸CD8+T细胞中的意义和机制[J]. 生命的化学, 2021, 41(2): 317-324. JI Z, WU B R, WEI Y Y, et al. The significance and mechanism of N-glycosylation in tumor cells escaping from CD8+T cells[J]. Chemistry of Life, 2021, 41(2): 317-324. (in Chinese) |
| [28] |
柏学, 李彩虹, 佟红娜, 等. 人源酪蛋白激酶Ⅱ催化亚基的构建及表达纯化[J]. 现代生物医学进展, 2020, 20(7): 1201-1205. BAI X, LI C H, TONG H N, et al. Construction, expression and purification of human casein kinase Ⅱ catalytic subunit[J]. Progress in Modern Biomedicine, 2020, 20(7): 1201-1205. (in Chinese) |
| [29] |
盛春泉, 朱杰, 张万年, 等. N-肉豆蔻酰基转移酶家族的进化踪迹分析研究[J]. 药学学报, 2007, 42(2): 157-165. SHENG C Q, ZHU J, ZHANG W N, et al. Evolutionary trace analysis of N-myristoyltransferase family[J]. Acta Pharmaceutica Sinica, 2007, 42(2): 157-165. (in Chinese) |
| [30] |
陈杨, 李经历, 苏珊珊, 等. 蛋白激酶C在肺部疾病中的研究进展[J]. 中国呼吸与危重监护杂志, 201, 20(6): 452-456. CHEN Y, LI J L, SU S S, et al. Research progress of protein kinase C in pulmonary disease[J]. Chinese Journal of Respiratory and Critical Care Medicine, 201, 20(6): 452-456. (in Chinese) |
| [31] |
RASSIDAKIS G Z, HEROLD N, MYRBERG I H, et al. Low-level expression of SAMHD1 in acute myeloid leukemia (AML) blasts correlates with improved outcome upon consolidation chemotherapy with high-dose cytarabine-based regimens[J]. Blood Cancer J, 2018, 8(11): 98. DOI:10.1038/s41408-018-0134-z |
| [32] |
HEROLD N, RUDD S G, LJUNGBLAD L, et al. Targeting SAMHD1 with the Vpx protein to improve cytarabine therapy for hematological malignancies[J]. Nat Med, 2017, 23(2): 256-263. DOI:10.1038/nm.4265 |
| [33] |
MÉNDEZ-HUERGO S P, BLIDNER A G, RABINOVICH G A. Galectins: emerging regulatory checkpoints linking tumor immunity and angiogenesis[J]. Curr Opin Immunol, 2017, 45: 8-15. DOI:10.1016/j.coi.2016.12.003 |
| [34] |
KOPECKOVA M, PAVKOVA I, STULIK J. Diverse localization and protein binding abilities of glyceraldehyde-3-phosphate dehydrogenase in pathogenic bacteria: the key to its multifunctionality?[J]. Front Cell Infect Microbiol, 2020, 10: 89. DOI:10.3389/fcimb.2020.00089 |
| [35] |
PÉROVAL M, PÉRY P, LABBÉ M. The heat shock protein 90 of Eimeria tenella is essential for invasion of host cell and schizont growth[J]. Int J Parasitol, 2006, 36(10-11): 1205-1215. DOI:10.1016/j.ijpara.2006.04.006 |
| [36] |
JIANG L L, LIN J J, HAN H Y, et al. Identification and characterization of Eimeria tenella apical membrane antigen-1 (AMA1)[J]. PLoS One, 2012, 7(7): e41115. DOI:10.1371/journal.pone.0041115 |
| [37] |
YU Y, ZHAO Q P, ZHU S H, et al. Molecular characterization of serine/threonine protein phosphatase of Eimeria tenella[J]. J Eukaryot Microbiol, 2020, 67(5): 510-520. DOI:10.1111/jeu.12798 |
| [38] |
LIU G L, ZHU S H, ZHAO Q P, et al. Molecular characterization of surface antigen 10 of Eimeria tenella[J]. Parasitol Res, 2019, 118(10): 2989-2999. DOI:10.1007/s00436-019-06437-0 |
(编辑 白永平)



