2. 中国农业大学动物医学院, 农业农村部动物流行病学重点实验室, 北京 100193
2. Key Laboratory of Animal Epidemiology of the Ministry of Agriculture and Rural Affairs, College of Veterinary Medicine, China Agricultural University, Beijing 100193, China
弓形虫和新孢子虫是两种亲缘关系十分接近的胞内寄生的顶复亚门原虫,均可造成孕畜的生殖障碍以及新生仔畜的运动、神经障碍[1],并给全球畜牧养殖业带来巨大的经济损失。由于二者在形态特征、生活史、宿主范围、临床症状等方面高度相似,直至1988年Dubey等对新孢子虫进行命名,才将其与弓形虫分开[2]。
生产中,弓形虫和新孢子虫共感染的现象非常常见。Lindsay等[3]发现新孢子虫Nc1株免疫的小鼠能对弓形虫TS-4弱毒株感染产生抵抗力;弓形虫Pru、VEG虫株免疫小鼠,也对新孢子虫Nc1株的再感染有一定抵抗作用[4],这说明弓形虫和新孢子虫之间存在一定程度的交叉免疫保护现象。弓形虫和新孢子虫存在很多相似的蛋白[5-6],二者之间存在多种交叉反应抗原,这些交叉反应抗原可以诱导宿主对弓形虫或新孢子虫的感染产生类似的免疫应答[7],这种交叉免疫保护作用很可能是基于交叉反应抗原产生的。找到具有交叉保护作用的抗原是防控这两种寄生虫病的关键环节。
凌慧芳[8]分别将结合了抗弓形虫蛋白IgG抗体、抗新孢子虫蛋白IgG抗体的Protein A/G与弓形虫虫体蛋白共同孵育,对免疫沉淀富集物进行质谱分析,获得弓形虫和新孢子虫的交叉反应蛋白662种,包括致密颗粒蛋白、微线蛋白、棒状体蛋白和细胞骨架蛋白等。其中,弓形虫的微线蛋白(MICs)参与虫体的滑行运动和入侵宿主细胞,在毒力和致病性方面发挥重要的作用[9],也是近几十年来弓形虫疫苗的热门候选抗原类型之一[10]。TgMIC1和TgMIC4可以刺激小鼠产生Th1型免疫反应,诱导针对弓形虫的保护性免疫[11];TgMIC6能够诱导慢性弓形虫感染小鼠的CD4+T细胞和CD8+T细胞产生IFN-γ[12],免疫小鼠后也能有效减轻弓形虫感染带来的危害[13];此外,TgMIC3以及TgAMA1等微线蛋白均具有较好的免疫原性,是弓形虫疫苗研究的候选抗原[7, 14]。
结合蛋白质组学和生物信息学分析结果,作者从662种交叉反应蛋白集合中筛选出弓形虫微线蛋白17A(TgMIC17A)。TgMIC17A是一种微线蛋白,具有信号肽结构,无跨膜区,具有分泌蛋白的基本特征。抗原表位预测分析显示,MIC17A有5个抗原表位,提示该蛋白可能具备较好的免疫原性。同时,MIC17A在弓形虫不同虫株中的转录水平都较高,在子孢子、速殖子、缓殖子3个阶段均可以稳定地高水平转录。以上数据提示,MIC17A是很有潜力的疫苗候选因子。本研究对TgMIC17A进行克隆、表达、鉴定,并通过小鼠免疫保护试验,评估重组抗原对弓形虫和新孢子虫感染的交叉保护效力。
1 材料与方法 1.1 材料pET-28a原核表达质粒、鼠源弓形虫阳性血清、鼠源新孢子虫阳性血清、弓形虫Pru株、Vero细胞由国家动物寄生原虫实验室保存;新孢子虫Nc1株,经Dubey授权,由日本带广畜产大学国家原虫研究所玄学南教授馈赠,本实验室传代和保存;同源重组相关试剂、实时荧光定量PCR相关试剂购自北京全式金生物技术有限公司;PCR相关试剂购自北京聚合美生物科技有限公司;免疫印迹相关试剂购自北京华兴博创基因技术有限公司;HRP标记羊抗鼠IgG二抗、ELISA相关试剂购自北京迈晨科技有限公司;4~5周龄的雌性BALB/c小鼠(SPF级),购自北京维通利华实验动物技术有限公司。
1.2 方法1.2.1 基因克隆与重组蛋白的原核表达、鉴定 按照基因号TGGT1_200250在ToxoDB数据库中找到TgMIC17A对应的核苷酸序列,使用Primer Premier 5.0软件设计引物,在引物两端引入pET-28a(+)载体的同源臂(下划线标记)。F:5′-AG-CAAATGGGTCGCGGATCCCTGCAATCTCCAGGGCTC-3′,R:5′-TCGAGTGCGGCCGCAAGCTT-GCATGTGATATCGCCTGC-3′。以弓形虫cDNA为模板,扩增TgMIC17A基因全长。将获得的目的基因片段与pET-28a(+)骨架进行同源重组,连接产物送北京睿博生物科技公司测序鉴定。
将测序正确的pET-28a-TgMIC17A转化至表达菌E. coli Rosetta(DE3)中,IPTG(0.8 mmol·L-1,37 ℃)诱导重组蛋白表达,分离上清与包涵体,进行包涵体复性,SDS-PAGE分析复性蛋白的大小与纯度。
以鼠源His单抗(1∶2 000)为一抗,HRP标记的羊抗鼠IgG为二抗进行免疫印迹分析。同时,分别以鼠源弓形虫阳性血清和鼠源新孢子虫阳性血清(1∶300)为一抗,HRP标记的羊抗鼠IgG为二抗进行免疫印迹试验,分析重组蛋白的反应原性和交叉反应性。
1.2.2 小鼠的免疫程序及抗体水平检测 将30只4~5周龄雌性BALB/c小鼠随机分成5组并进行标记,每组6只小鼠。小鼠的试验分组、免疫剂量、攻虫剂量设计如表 1所示。
|
|
表 1 小鼠的试验分组情况 Table 1 Experimental grouping of mice |
每次免疫间隔10 d,每组小鼠均免疫两次。初次免疫,每只小鼠的重组蛋白免疫量为100 μg,应用弗氏完全佐剂与重组蛋白1∶1混合乳化;二次免疫,每只小鼠的重组蛋白免疫量为50 μg,应用弗氏不完全佐剂与重组蛋白1∶1混合乳化。两次均采用背部皮下多点注射进行免疫。
于第二次免疫后10 d,每组随机取1只小鼠进行眼底静脉丛采血,每只小鼠收集200~300 μL血液于1.5 mL离心管中,37 ℃温箱放置1 h,再于4 ℃冰箱放置过夜析出血清,4 000 r·min-1离心20 min,收集血清。以TgMIC17A重组蛋白作为包被抗原(2 μg·mL-1,每孔100 μL),以小鼠血清为一抗(1∶100),以HRP标记羊抗鼠IgG为二抗(1∶5 000) 进行酶联免疫吸附试验,测定血清抗体水平。
1.2.3 小鼠攻虫试验 于第二次免疫10 d后,按照表 1对各组小鼠进行攻虫,观察小鼠的临床症状,每4 d记录一次体重,同时记录死亡时间和存活率。存活小鼠持续观察30 d后处死,采集小鼠脑组织并提取DNA。根据小鼠的28S基因和弓形虫的529基因序列、新孢子虫的Nc5基因设计特异性引物,对小鼠脑组织荷虫量进行实时荧光定量PCR检测。28S基因:上游引物(P)5′-TGCCATGGTAATCCTGCTCA-3′,下游引物(P)5′-CCTCAGCCAAGCACATACACC-3′;529基因:上游引物(P)5′-CACAGAAGGGACAGAAGT-3′,下游引物(P)5′-TCGCCTTCATCTACAGTC-3′;Nc5基因:上游引物(P)5′-ACTGGAGGCACGCTGAACAC-3′,下游引物(P)5′-AACAATGCTTCGCAAGAGGAA-3′。通过比较未免疫组和免疫组小鼠在攻虫后的体重变化、存活率、脑组织荷虫量,评价TgMIC17A对弓形虫感染小鼠的免疫保护性,对新孢子虫感染小鼠的交叉免疫保护性。
2 结果 2.1 基因克隆与重组蛋白的原核表达、鉴定经生物信息学分析,TgMIC17A的mRNA序列包含1 056个碱基,蛋白序列包含351个氨基酸,相对分子质量大小为38.7 ku,等电点为8.21,无跨膜区,N端0—29 aa处为信号肽。根据ToxoDB数据库中的信息可知,TgMIC17A在弓形虫不同虫株中的转录水平,及在虫体的不同发育时期的转录水平均较高。TgMIC17A和NcMIC17A的相同氨基酸比例为59%,氨基酸相似性为75%,提示存在一定的交叉性。
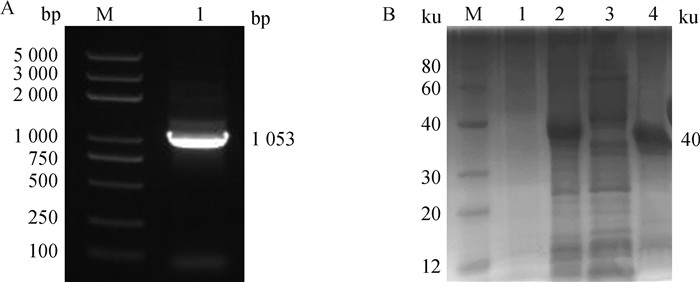
PCR扩增得到大小为1 053 bp的单一片段(图 1A),与pET-28a(+)骨架进行单片段连接,测序结果与ToxoDB数据库中基因序列完全符合,证明原核表达载体构建成功。TgMIC17A重组蛋白主要在包涵体中表达,大小约为40 ku(图 1B),与预期相符。
|
A. TgMIC17A基因克隆结果(M. DL5000 DNA相对分子质量标准;1. TgMIC17A基因克隆产物);B. 重组蛋白表达情况(M. 蛋白质相对分子质量标准;1. 未诱导菌液;2. 诱导后菌液;3. 裂解后上清液;4. 裂解后包涵体沉淀) A. Amplification of TgMIC17A gene (M. DL5000 DNA marker; 1. TgMIC17A gene); B. Recombinant protein expression (M. Protein marker; 1. Uninduced; 2. Induced; 3. Supernatant; 4. Inclusion bodies) 图 1 TgMIC17A基因克隆与重组蛋白的原核表达 Fig. 1 Cloning of TgMIC17A gene and prokaryotic expression of protein |
Western blot结果显示, 重组蛋白可与鼠源His单抗发生反应,且条带大小符合预期结果,约为40 ku,证明所收集的蛋白确定为带有6×His标签的TgMIC17A重组蛋白(图 2A);同时该蛋白可与鼠源弓形虫阳性血清和鼠源新孢子虫阳性血清发生反应,证明该蛋白具有良好的反应原性且及交叉反应性(图 2A、B)。

|
A. TgMIC17A的表达情况、反应原性验证(M. 蛋白相对分子质量标准;1. TgMIC17A重组蛋白与His-mAb反应;2. TgMIC17A重组蛋白与弓形虫阳性血清反应;3. 阳性对照-弓形虫全虫抗原与弓形虫阳性血清反应);B. TgMIC17A的交叉反应性鉴定(M. 蛋白相对分子质量标准;1. 阳性对照-新孢子虫全虫抗原与新孢子虫阳性血清反应;2、3. TgMIC17A重组蛋白与新孢子虫阳性血清反应) A. Protein expression and antigenicity verification (M. Protein marker; 1. rTgMIC17A reacts with His-mAb; 2. rTgMIC17A reacts with T. gondii positive serum antibody; 3. Positive control-T. gondii lysate antigen reacts with T. gondii positive serum antibody); B. Recombinant protein expression (M. Protein marker; 1. Positive control-N. caninum lysate antigen reacts with mouse N. caninum positive serum antibody; 2, 3. rTgMIC17A reacts with N. caninum positive serum antibody) 图 2 TgMIC17A重组蛋白的免疫印迹结果 Fig. 2 Western blot results of rTgMIC17A |
2.2.1 重组蛋白免疫小鼠后产生的抗体水平 采用间接ELISA测定各组小鼠产生的IgG抗体水平。结果显示(图 3),TgMIC17A重组蛋白免疫小鼠,可以诱导小鼠产生特异性IgG抗体,免疫组与对照组的IgG水平之间存在显著性差异(P<0.01)。

|
**. P < 0.01 图 3 TgMIC17A重组蛋白免疫小鼠后产生的IgG水平 Fig. 3 Antibody levels produced after immunized mice with rTgMIC17A |
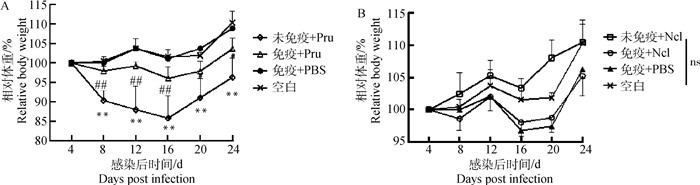
2.2.2 小鼠的相对体重变化 攻虫后每4 d称量一次小鼠的体重,以首次称量的小鼠体重为基准,绘制相对体重变化曲线(图 4)。小鼠感染弓形虫后,出现增重抑制情况,平均体重从第4天开始下降,至第16天降到最低,然后开始回升。比较各组小鼠的体重变化幅度,未免疫组小鼠的体重下降幅度最大,与空白组、免疫组存在显著性差异;而免疫组小鼠体重下降幅度小,与空白组之间没有显著性差异;小鼠感染新孢子虫后,各组小鼠体重均整体呈上升趋势,没有显著性差异。
|
A. 小鼠感染弓形虫后的相对体重变化[“*”表示未免疫+Pru组小鼠的体重与空白对照组小鼠的体重有显著差异(P<0.05),“**”表示有极显著差异(P<0.01);“#”表示攻虫后免疫组小鼠的体重与未免疫组小鼠的体重有显著差异(P<0.05)];B. 小鼠感染新孢子虫后的相对体重变化(“ns”表示空白组、未免疫组、免疫组小鼠的体重均无显著差异) A. Relative body weight of mice after challenge with T. gondii ("*" means that the relative body weight of the mice in the unimmunized group is significantly different from that of the blank control group (P < 0.05), and "**" means that there is a very significant difference (P < 0.01); B. Relative body weight of mice after challenge with N. caninum ("ns" means that there is no significant difference in the relative body weight of mice in the blank group, unimmunized group and immunized group) 图 4 小鼠攻虫后的相对体重变化 Fig. 4 Relative body weight of mice after challenge |
2.2.3 小鼠的存活率 小鼠在感染弓形虫后,未免疫组在第8天有1只小鼠死亡,其余小鼠存活,存活率为83.3%;免疫组小鼠全部存活,存活率为100.0%;小鼠在感染新孢子虫后,未免疫组和免疫组小鼠均全部存活,存活率为100.0%;空白组小鼠全部存活。免疫组小鼠均表现出相对更轻的临床症状,且先于未免疫组小鼠开始好转。
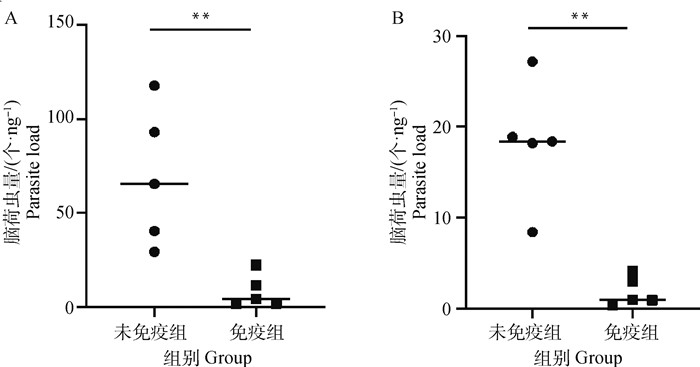
2.2.4 小鼠脑荷虫量检测 取小鼠脑组织提取DNA,采用实时荧光定量PCR检测小鼠脑组织中弓形虫或新孢子虫的荷虫量,评价TgMIC17A重组蛋白免疫小鼠对两种寄生虫感染的保护作用。结果显示(图 5),无论是感染弓形虫还是新孢子虫,免疫组小鼠的脑荷虫量均显著低于未免疫组小鼠。
|
A.感染弓形虫;B.感染新孢子虫。**. P<0.01 A. T. gondii infection; B. N. caninum infection. **. P < 0.01 图 5 小鼠感染弓形虫、新孢子虫后脑荷虫量 Fig. 5 Parasites load in brain of mice infected with T. gondii and N. caninum |
弓形虫病和新孢子虫病给全球的畜牧养殖业造成严重的损失,迄今为止,尚未筛选到治疗这两种疾病的有效药物,开发安全有效的疫苗是研究热点之一。寻找这两种寄生虫的交叉保护抗原,为动物提供更强的交叉保护作用是筛选候选疫苗的途径之一。
目前,被证实的弓形虫和新孢子虫的交叉反应抗原包括顶膜抗原AMA1、蛋白质二硫键异构酶PDI、热休克蛋白HSP70、核糖体磷酸蛋白P0、核糖体蛋白RP1、缓殖子表面蛋白BAG5、免疫相关蛋白IMP1、微线蛋白MIC3等。但并非所有的交叉反应抗原都能保护动物抵抗弓形虫和新孢子虫的感染,例如弓形虫缓殖子阶段特异性蛋白BAG5,其抗体只与新孢子虫缓殖子发生反应,不与新孢子虫速殖子发生反应[15],即对新孢子虫速殖子的感染没有保护力。目前,有交叉免疫保护效果的抗原,多是与寄生虫入侵、增殖密切相关的蛋白。例如TgAMA1是弓形虫入侵过程中的必要蛋白,条件性敲除后,弓形虫不能入侵宿主细胞[16],NcAMA1的抗体能有效抑制新孢子虫和弓形虫的入侵[7];PDI在虫体入侵宿主及增殖过程中发挥重要的作用[17],TgPDI和NcPDI的单抗可以抑制弓形虫和新孢子虫的生长[18];MIC3是虫体入侵时重要的黏附分子之一,TgMIC3重组蛋白免疫小鼠感染弓形虫后可延长存活时间,感染新孢子虫后脑荷虫量明显降低[14],这提示人们在寻找具有疫苗潜力的交叉反应抗原时,可以将对虫体入侵宿主细胞至关重要的蛋白作为候选。
前期研究显示,MIC17A是一种可被分泌到胞外的微线蛋白,在弓形虫和新孢子虫中的同源性较高,且具有交叉反应性。TgMIC17A重组蛋白免疫小鼠后,原计划比较未免疫组小鼠与免疫组小鼠感染弓形虫或新孢子虫的存活率,但由于虫株毒力经多次传代变弱、小鼠之间存在个体差异等原因,未免疫组与免疫组之间没有显著差异。因此,通过检测存活小鼠脑荷虫量评价TgMIC17A的免疫保护效果。感染Pru后,免疫组小鼠的临床症状、增重抑制情况相较于对照组明显减轻,且脑荷虫量显著降低,说明免疫组小鼠对弓形虫感染产生了良好的免疫保护力;感染Nc1后,免疫组小鼠的增重抑制情况没有明显改善,但脑荷虫量显著降低,说明免疫组小鼠对新孢子虫的感染产生了一定的免疫保护力。
4 结论MIC17A是弓形虫和新孢子虫的交叉反应抗原。本研究成功表达了TgMIC17A重组蛋白,TgMIC17A重组蛋白对弓形虫和新孢子虫感染具有交叉免疫保护效果,为筛选具有交叉免疫保护力的重组蛋白疫苗提供了可借鉴的资料。
| [1] |
LINDSAY D S, DUBEY J P. Neosporosis, toxoplasmosis, and sarcocystosis in ruminants: an update[J]. Vet Clin North Am Food Anim Pract, 2020, 36(1): 205-222. DOI:10.1016/j.cvfa.2019.11.004 |
| [2] |
LORENZI H, KHAN A, BEHNKE M S, et al. Local admixture of amplified and diversified secreted pathogenesis determinants shapes mosaic Toxoplasma gondii genomes[J]. Nat Commun, 2016, 7: 10147. DOI:10.1038/ncomms10147 |
| [3] |
LINDSAY D S, LENZ S D, DYKSTRA C C, et al. Vaccination of mice with Neospora caninum: response to oral challenge with Toxoplasma gondii oocysts[J]. J Parasitol, 1998, 84(2): 311-315. DOI:10.2307/3284488 |
| [4] |
凌慧芳, 潘德桐, 许建海, 等. 弓形虫免疫小鼠对新孢子虫感染的交叉免疫保护作用[J]. 中国兽医杂志, 2020, 56(6): 19-23. LING H F, PAN D T, XU J H, et al. Cross immunity protection effect of mice immunized with Toxoplasma gondii against Neospora caninum infection[J]. Chinese Journal of Veterinary Medicine, 2020, 56(6): 19-23. (in Chinese) |
| [5] |
REID A J, VERMONT S J, COTTON J A, et al. Comparative genomics of the apicomplexan parasites Toxoplasma gondii and Neospora caninum: coccidia differing in host range and transmission strategy[J]. PLoS Pathog, 2012, 8(3): e1002567. DOI:10.1371/journal.ppat.1002567 |
| [6] |
NISHIKAWA Y, CLAVERIA F G, FUJISAKI K, et al. Studies on serological cross-reaction of Neospora caninum with Toxoplasma gondii and Hammondia heydorni[J]. J Vet Med Sci, 2002, 64(2): 161-164. DOI:10.1292/jvms.64.161 |
| [7] |
ZHANG H S, COMPAORE M K A, LEE E G, et al. Apical membrane antigen 1 is a cross-reactive antigen between Neospora caninum and Toxoplasma gondii, and the anti-NcAMA1 antibody inhibits host cell invasion by both parasites[J]. Mol Biochem Parasitol, 2007, 151(2): 205-212. DOI:10.1016/j.molbiopara.2006.11.005 |
| [8] |
凌慧芳. 弓形虫诊断抗原的筛选及间接ELISA方法的建立[D]. 北京: 中国农业大学, 2020. LING H F. Screening of diagnostic antigens of Toxoplasma gondii and establishment of indirect ELISA method[D]. Beijing: China Agricultural University, 2020. (in Chinese) |
| [9] |
柳方远, 李双星, 印春生, 等. 弓形虫主要分泌蛋白及其功能的研究进展[J]. 中国动物传染病学报, 2020, 28(5): 94-102. LIU F Y, LI S X, YIN C S, et al. Research advances on functions of secretory proteins of Toxoplasma gondii[J]. Chinese Journal of Animal Infectious Diseases, 2020, 28(5): 94-102. (in Chinese) |
| [10] |
FOROUTAN M, ZAKI L, GHAFFARIFAR F. Recent progress in microneme-based vaccines development against Toxoplasma gondii[J]. Clin Exp Vaccine Res, 2018, 7(2): 93-103. DOI:10.7774/cevr.2018.7.2.93 |
| [11] |
LOURENÇO E V, BERNARDES E S, SILVA N M, et al. Immunization with MIC1 and MIC4 induces protective immunity against Toxoplasma gondii[J]. Microbes Infect, 2006, 8(5): 1244-1251. DOI:10.1016/j.micinf.2005.11.013 |
| [12] |
SARAAV I, WANG Q L, BROWN K M, et al. Secretory microneme proteins induce T-Cell recall responses in mice chronically infected with Toxoplasma gondii[J]. mSphere, 2019, 4(1): e00711-18. DOI:10.1128/mSphere.00711-18 |
| [13] |
PINZAN C F, SARDINHA-SILVA A, ALMEIDA F, et al. Vaccination with recombinant microneme proteins confers protection against experimental toxoplasmosis in mice[J]. PLoS One, 2015, 10(11): e0143087. DOI:10.1371/journal.pone.0143087 |
| [14] |
YANG D Y, LIU J, HAO P, et al. MIC3, a novel cross-protective antigen expressed in Toxoplasma gondii and Neospora caninum[J]. Parasitol Res, 2015, 114(10): 3791-3799. DOI:10.1007/s00436-015-4609-6 |
| [15] |
MCALLISTER M M, PARMLEY S F, WEISS L M, et al. An immunohistochemical method for detecting bradyzoite antigen (BAG5) in Toxoplasma gondii-infected tissues cross-reacts with a Neospora caninum bradyzoite antigen[J]. J Parasitol, 1996, 82(2): 354-355. DOI:10.2307/3284181 |
| [16] |
MITAL J, MEISSNER M, SOLDATI D, et al. Conditional expression of Toxoplasma gondii apical membrane antigen-1 (TgAMA1) demonstrates that TgAMA1 plays a critical role in host cell invasion[J]. Mol Biol Cell, 2005, 16(9): 4341-4349. DOI:10.1091/mbc.e05-04-0281 |
| [17] |
LIAO M, MA L Q, BANNAI H, et al. Identification of a protein disulfide isomerase of Neospora caninum in excretory-secretory products and its IgA binding and enzymatic activities[J]. Vet Parasitol, 2006, 139(1-3): 47-56. DOI:10.1016/j.vetpar.2006.02.029 |
| [18] |
LIAO M, XUAN X, HUANG X, et al. Identification and characterization of cross-reactive antigens from Neospora caninum and Toxoplasma gondii[J]. Parasitology, 2005, 130(5): 481-488. DOI:10.1017/S0031182004006948 |
(编辑 白永平)



