RNA结合基序蛋白3(RNA-binding motif protein 3, RBM3)作为一种已知的冷休克蛋白[1],在正常条件下存在于多种组织和细胞中,当动物机体与细胞在受到低温、低氧和局部缺血应激时可以刺激它的表达[2-3],并通过促进其他相关蛋白的合成维护应激条件下机体与细胞的正常生理功能[4]。从人类组织分离得到的RBM3分子量为17 ku,最长的开放阅读框编码157个氨基酸。从结构上来看,RBM3包含两个结构域:一个是氨基酸末端的RNA识别基序(RRM),它包含两个高度保守序列:核糖核蛋白1(ribonucleoprotein1, RNP1)和核糖核蛋白2(ribonucleoprotein2, RNP2);另一个是富含甘氨酸、精氨酸和酪氨酸的羧基末端序列[5]。RBM3作为一种富含甘氨酸的蛋白质,通过加速核糖体组装、稳定mRNA和减少microRNA的表达来促进蛋白质的翻译[6]。Wellmann等[7]在人类成纤维细胞内的研究发现,RBM3的mRNA和蛋白质在缺氧条件下的表达量有所增加。李云龙等[5]也提出,在哺乳动物体内RBM3蛋白的表达量会随着温度的降低而不断增加。
研究证实,RBM3可以在包括人体细胞k562、HepG2、T24在内的多种细胞系中表达[5]。而有关小鼠(Mus musculus)的研究表明,RBM3可通过减少microRNA表达来诱导小鼠神经母细胞瘤细胞(N2a)中的整体翻译水平[6]。Yan等[8]研究发现,RBM3促进了在缺氧条件下神经干细胞(neural stem cell, NSC)的增殖。另外,RBM3在黑熊(Ursus thibetanus)这类冬眠动物的肌肉、肝和心中都有表达,并且在松鼠(Sciuridae)冬眠晚期的心、肝、脑组织中高表达[9-10]。2020年,潘阳阳等[4]通过试验验证了RBM3参与牦牛(Bos grunniens) 这一高原特有哺乳动物卵丘细胞低温应激调控。因此,研究在高寒低氧环境中哺乳动物经受低温时RBM3的表达变化,有利于RBM3参与调控动物机体缺氧、低温的机制研究。而牦牛作为在我国青藏高原地区的特有动物,由于长期生活在高寒低氧的高原地区,生态学特征独特[11]。受到温度、含氧量等因素以及生存环境的综合影响,牦牛的繁殖能力低下[12],在自然条件下一年一胎或两年一胎[13]限制了高原畜牧业的发展[14]。所以,研究低温相关蛋白RBM3对牦牛生理调控机制具有重要作用[14]。
本研究采集不同繁殖时期(卵泡期、黄体期和妊娠期)雌性牦牛的卵巢、输卵管、子宫,进行牦牛RBM3基因克隆和相关生物信息学分析,并利用实时荧光定量PCR(quantitative real-time PCR, qRT-PCR)检测RBM3 mRNA的表达量,利用蛋白质免疫印迹(Western blot, WB) 检测RBM3蛋白的表达量,利用免疫组织化学法(immunohistochemistry, IHC)检测RBM3蛋白的表达定位,为探讨RBM3在高原环境下对牦牛生殖的调控提供理论依据。
1 材料与方法 1.1 样品采集于2019年10月在青海省马佳肴屠宰场采集样品。卵泡期、黄体期和妊娠期的4~6岁健康雌性牦牛各3头。采集卵巢上见成熟卵泡(卵泡期)和新鲜黄体(黄体期)同侧以及妊娠3个月(妊娠期)妊娠侧的卵巢、子宫和输卵管。将所采样品修剪后,用生理盐水冲洗干净,一部分储存于-80 ℃,另一部分室温下保存于4%多聚甲醛溶液中。
1.2 主要仪器与试剂普通PCR仪购于德国Eppendorf公司,qRT-PCR仪购于瑞士Roche公司,显微拍照仪购于日本Olympus公司,多功能成像仪购于美国GE公司;BeyoEcL PLus液购于上海碧云天公司,Trizol试剂盒购于北京全式金生物技术有限公司,TB Green® Premix Ex TaqTM Ⅱ、JM109感受态细胞购于大连TaKaRa公司;荧光定量PCR所用试剂、反转录试剂盒均购于美国Promega公司;DNA纯化回收试剂盒购于北京天根生化科技有限公司;基因克隆试验配制培养基所用试剂购于北京Solarbio公司;IHC试剂盒、WB所用抗体Rabbit Anti-beta-Actin antibody、Rabbit Anti-RBM3 antibody、Goat Anti-Rabbit IgG HH&L/RP以及DAB显色液购于北京Bioss公司。其他试剂均为国产分析纯。
1.3 牦牛RBM3基因克隆1.3.1 引物设计 参照GenBank公布的牛(Bos taurus)RBM3基因序列(XM_024987852.1)进行引物设计,肌动蛋白(β-actin)基因为内参,由上海生工进行引物合成,引物信息见表 1。
|
|
表 1 目的基因和内参基因引物序列 Table 1 Primer sequences amplifying target and house-keeping genes |
1.3.2 总RNA提取 试剂盒法提取样品总RNA,测定所提取的RNA浓度和OD260 nm/OD280 nm值后,将达到浓度和OD260 nm/OD280 nm值参照标准的RNA进行反转录,合成的cDNA保存在-20 ℃备用。
1.3.3 牦牛RBM3基因克隆 以样品cDNA为模板扩增RBM3基因。总反应体系为20 μL:TaqPCR Master Mix 10 μL, ddH2O 8 μL, cDNA模板1 μL, 10 μmol·L-1的上、下游引物各0.5 μL;反应条件:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸10 s,72 ℃保存5 min,循环35次进行PCR反应。将PCR产物进行凝胶电泳,回收产物于-20 ℃保存。用TaKaRa试剂盒构建重组质粒,将回收产物与pMDTM19-T Vector连接,然后把连接产物(10 μL)转化至JM109感受态细胞(100 μL)。把连接转化后的产物加入890 μL SOC液体培养基中,摇床培养(37 ℃, 200 r·min-1)15 h,涂布于LB琼脂平板培养基(含有Amp, X-gal, IPTG)上进行培养(37 ℃, 14 h),挑取平板培养基上的单个白色菌落并将其置于含有Amp的LB液体培养基,37 ℃振荡培养16 h。最后,将得到的菌液进行测序,根据测序结果对RBM3基因进行后续分析。
1.3.4 生物信息学分析 对牦牛RBM3基因的测序结果进行分析,具体分析网站信息见表 2。
|
|
表 2 生物信息学分析网站 Table 2 Bioinformatics analysis websites |
qRT-PCR检测牦牛不同繁殖阶段卵巢、输卵管、子宫中RBM3基因的表达水平。在20 μL (TB Green® Premix Ex TaqTMⅡ 10 μL,Free Water 6.4 μL, cDNA模板2 μL,10 μmol·L-1的上、下游引物各0.8 μL)的体系下以95 ℃预变性30 s,95 ℃变性5 s、60 ℃退火30 s、72 ℃延伸10 s,循环40次的条件进行PCR反应,重复4次。按照2-ΔΔCq计算RBM3基因在每组样品中的相对表达量。
1.5 蛋白免疫印迹法检测RBM3蛋白的表达1.5.1 蛋白样品的制备 将试验样品低温研磨后取110 mg,按照蛋白裂解液(Radio Immunoprecipitation assa, RIPA)与蛋白酶抑制剂(phenylmethanesulfonyl fluoride, PMSF)100∶1的比例配制蛋白裂解液并取110 μL加入研磨好的试验样品。然后4 ℃振荡裂解2 h后,4 ℃离心(12 000×g)5 min,吸取上清在-80 ℃保存备用。
1.5.2 蛋白质免疫印迹 经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE),电泳后电转膜(湿转)至聚偏二氟乙烯膜(polyvinylidene fluoride, PVDF)上,5%脱脂牛奶室温振荡封闭2 h。将目的条带和内参条带分别加一抗兔抗RBM3抗体(1∶1 000 PBST稀释)和兔抗beta-Actin抗体(1∶2 000 PBST稀释)4 ℃孵育11 h后用PBST(PBS∶Tween20=2 000∶1)溶液洗10次(6 min·次-1);山羊抗兔IgG H&L/HRP(1∶3 000 PBST稀释)二抗室温摇床孵育1 h后PBST溶液洗6次,每次15 min;在膜上滴加电化学发光液避光孵育2 min后WB扫描成像仪扫描蛋白条带,重复3次,最后分析RBM3蛋白相对表达量。
1.6 IHC定位RBM3蛋白表达固定组织,依次脱水、包埋、切片(厚度4 μm)、脱蜡、热修复。再进行如下步骤:滴加3% H2O2并在湿盒孵育10 min(37 ℃);滴加封闭液在湿盒孵育15 min(37 ℃);滴加一抗兔抗RBM3抗体(1∶400 PBS稀释)在湿盒孵育过夜(4 ℃),同时设置只加PBS(0.02 mol·L-1)的对照;滴加二抗(B液)在湿盒孵育15 min(37 ℃);滴加C液在湿盒孵育15 min(37 ℃);显色。最后苏木精复染、脱水、透明、树脂封片并拍照。
1.7 数据分析依据qRT-PCR结果计算RBM3的相对表达量,利用Image J软件灰度值分析RBM3蛋白的表达量(目的灰度数值/内参灰度数值),运用SPSS软件对基因和蛋白相对表达量的差异显著性进行单因素方差分析,用软件GraphPad Prism 8绘制数据图。
2 结果 2.1 牦牛RBM3基因的扩增与克隆PCR结果显示(图 1),9组样品在618 bp处出现预期的整齐条带。与NCBI数据库与参考序列将RBM3基因克隆测序结果进行比对后,相似性100%。已将牦牛RBM3序列提交至GenBank(登录号:MF142258.1)。本部分试验检测出了牦牛RBM3序列,此结果将继续用于后续生物信息学分析等试验内容。
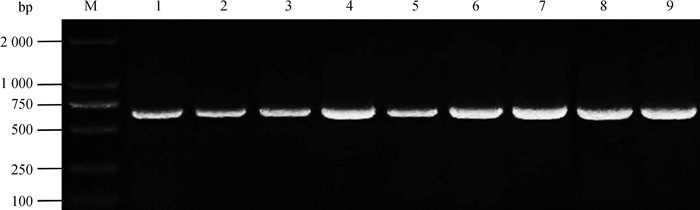
|
M.DNA相对分子质量标准;1~3.卵泡期、黄体期、妊娠期卵巢;4~6.卵泡期、黄体期、妊娠期输卵管;7~9.卵泡期、黄体期、妊娠期子宫 M.DL2000 DNA Marker; 1-3. The ovary at follicular, luteal, gestation phases; 4-6. The fallopian tube at follicular, luteal, gestation phases; 7-9. The uterus at follicular, luteal, gestation phases 图 1 RBM3 PCR扩增电泳结果 Fig. 1 The electrophoresis results of RBM3 PCR amplification |
2.2.1 牦牛RBM3基因开放阅读框分析 开放阅读框分析发现,牦牛RBM3的开放阅读框(ORF)全长为483 bp,编码了160个氨基酸。选取具有代表性的动物进行相似性比对,结果显示牦牛RBM3基因与野牦牛(Bos mutus)相似性最高(99.79%),相似性较高的还有数值为99.59%的瘤牛(Bos indicus)与99.17%的普通牛(Bos taurus);与其他动物的相似性从高到低依次为:山羊(Capra hircus)98.96%、弯角剑羚(Oryx dammah)98.76%、水牛(Bubalus bubalis)97.17%、绵羊(Ovis aries)96.16%、单峰驼(Camelus dromedarius)91.36%、羊驼(Vicugna pacos)91.36%、野骆驼(Camelus ferus)91.36%、西伯利亚虎(Panthera tigris altaica)91.30%。经MEGA 7.0软件比对(图 2)后,构建系统进化树结果显示(图 3),牦牛RBM3基因与野牦牛亲缘关系最近。将牦牛与包括基因相似性最高的野牦牛在内的所有在列动物相比,RBM3基因编码区序列在第98位核苷酸(图 2黑色箭头处)有差异,且对应编码的第33位氨基酸在牦牛上是苯丙氨酸(Phe),而在其他动物上编码的结果是丝氨酸(Ser)。另外,第51位核苷酸的比对中,牦牛、野牦牛和除西伯利亚虎之外的所有在列动物都有差异,但其编码的氨基酸均为苏氨酸(Thr),没有改变。
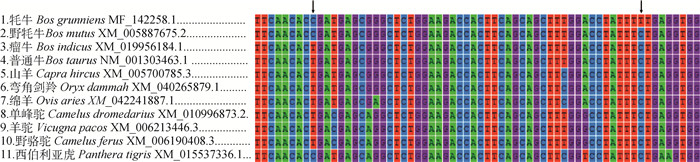
|
黑色箭头标记是第51、98位核苷酸 Black arrows point to nucleotide No.51 and No.98 图 2 不同物种间RBM3基因序列比对 Fig. 2 Sequence alignment of RBM3 orthologues among different species |

|
图 3 RBM3基因的系统进化树 Fig. 3 Phylogenetic tree of RBM3 gene |
2.2.2 牦牛RBM3基因编码蛋白的理化性质分析和结构预测 RBM3蛋白预测分子量大小17.5 ku。分析后得知,RBM3基因编码了含有18种氨基酸在内的160个氨基酸,甘氨酸(Gly)的含量最高,为21.2%;含量最低的是组氨酸(His)、异亮氨酸(Ile)、赖氨酸(Lys)、和甲硫氨酸(Met),含量为1.9%;半胱氨酸(Cys)、色氨酸(Trp)的含量为0。RBM3基因编码的氨基酸中含有带负电的氨基酸(Asp+Glu)20个(12.5%),带正电氨基酸(Arg+Lys)22个(13.8%)。该编码区共2 361个蛋白原子,理论等电点(PI)8.83,不稳定指数为24.58,是稳定蛋白。二级结构预测结果显示(图 4A),构成RBM3蛋白α- 螺旋的氨基酸个数为21个,占氨基酸总数的13.1%;构成RBM3蛋白延伸链的氨基酸有30个,占18.8%;109个氨基酸无规则卷曲,占68.1%。RBM3蛋白的三级结构预测结果如图 4B所示。
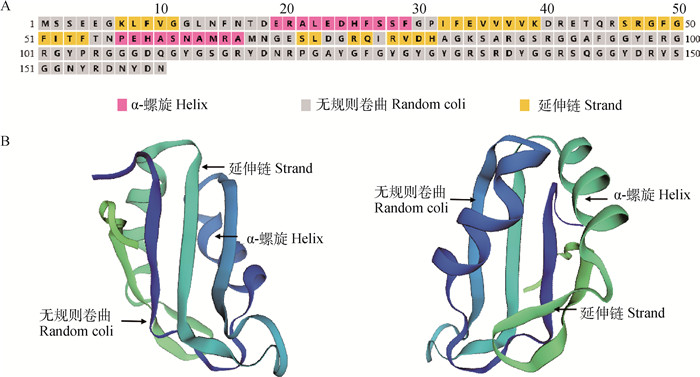
|
A. 牦牛RBM3蛋白的二级结构预测;B.牦牛RBM3蛋白三级结构预测的两个不同角度 A. The secondary structure prediction of RBM3 protein in yak; B. Prediction of tertiary structure of yak RBM3 protein from two different angles 图 4 牦牛RBM3蛋白结构预测 Fig. 4 The structure prediction of RBM3 protein in yak |
2.2.3 牦牛RBM3蛋白跨膜结构域和磷酸化位点分析 蛋白跨膜结构域预测结果(图 5A)表明RBM3蛋白不是跨膜蛋白。蛋白磷酸化位点分析结果(图 5B)表明,在组成RBM3蛋白的氨基酸中有10个丝氨酸(Ser)、2个苏氨酸(Thr)、5个酪氨酸(Tyr)的磷酸化位点具备成为蛋白质激酶磷酸化位点的条件。
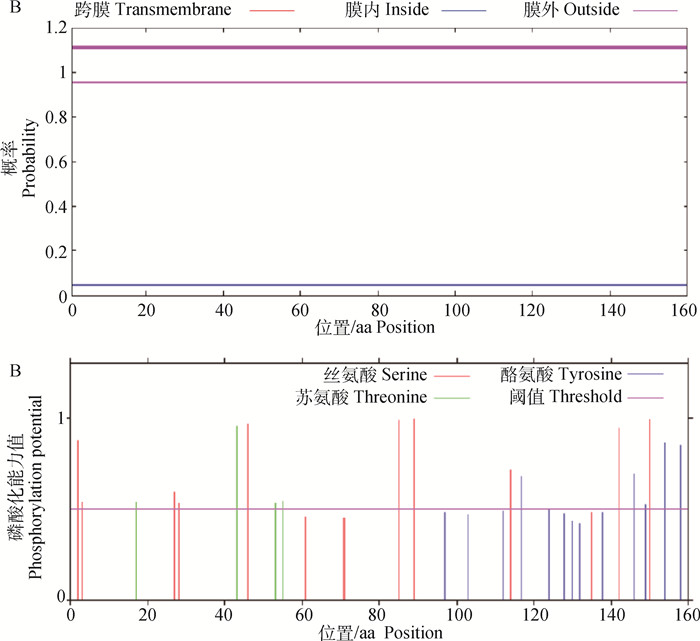
|
A.牦牛RBM3蛋白跨膜区域分析;B.牦牛RBM3蛋白磷酸化位点分析 A.The protein transmembrane regional analysis of RBM3 protein in yak; B. The protein phosphorylation site analysis of RBM3 protein in yak 图 5 牦牛RBM3蛋白跨膜区域和磷酸化位点分析 Fig. 5 The protein transmembrane region and phosphorylation sites analysis of RBM3 protein in yak |
qRT-PCR结果(图 6)显示,RBM3基因在不同繁殖阶段的牦牛卵巢、输卵管、子宫中都有表达。在卵巢中,RBM3基因在卵泡期的表达量显著低于黄体期和妊娠期(P<0.05);在输卵管中,RBM3基因在卵泡期的表达量显著高于黄体期和妊娠期(P<0.05);在子宫中,RBM3基因在各时期表达量存在明显差异,卵泡期最低,黄体期和妊娠期较高(P<0.05)。RBM3基因在牦牛发情周期不同阶段的主要生殖器官上呈差异性表达。

|
β-actin为内参基因;n=4。不同字母代表差异显著(P<0.05) β-actin is the reference gene; n=4. Different letters indicate significanct difference (P<0.05) 图 6 RBM3 mRNA在牦牛不同组织中的相对表达量 Fig. 6 Relative expression of RBM3 mRNA in different tissues in yak |
WB结果(图 7A)表明,RBM3蛋白在卵泡期、黄体期、妊娠期的牦牛卵巢、输卵管、子宫中都有表达且存在差异。通过定量分析(图 7B)在卵巢上,RBM3蛋白在黄体期的表达量最高,妊娠期次之,卵泡期最低,3个样本之间差异显著(P<0.05);在输卵管上,RBM3蛋白在黄体期和妊娠期表达较高且两者之间差异不显著(P>0.05),卵泡期的表达量最低,和同组的其他两个样本之间的差异均显著(P<0.05);在子宫中,RBM3蛋白在妊娠期的表达量最低,卵泡期的表达量最高,黄体期的表达量介于卵泡期和妊娠期之间,3个样本间差异显著(P<0.05)。
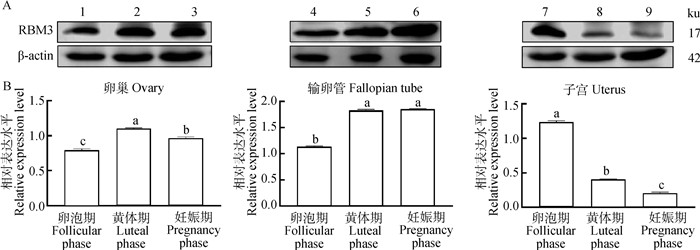
|
A.RBM3和β-actin蛋白在牦牛不同组织中的检测结果;B.RBM3蛋白在牦牛不同组织中的相对表达量。1~3. 卵泡期、黄体期、妊娠期卵巢;4~6. 卵泡期、黄体期、妊娠期输卵管;7~9. 卵泡期、黄体期、妊娠期子宫 A. Detection results of RBM3 and β-actin in different tissues of yak; B. Relative expression of RBM3 in different tissues of yak. 1-3. The ovary at follicular, luteal, gestation phases; 4-6. The fallopian tube at follicular, luteal, gestation phases; 7-9. The uterus at follicular, luteal, gestation phases 图 7 RBM3蛋白在牦牛不同组织中的表达情况 Fig. 7 Expression of RBM3 protein in different tissues of yak |
通过免疫组织化学方法检测(图 8)发现,RBM3蛋白在牦牛发情不同阶段的卵巢、输卵管、子宫切片中都有阳性表达,且均为细胞质表达。在卵巢上(图 8A、8B、8C)RBM3的主要表达分布在卵泡颗粒层(follicle granular layer, SG)、卵泡膜(theca follicle, TF)、黄体细胞(luteal cells, LC);RBM3在输卵管上(图 8D、8E、8F)的主要表达位置为黏膜上皮(epithelium mucosae, EM);RBM3在子宫上(图 8G、8H、8I)的主要表达位置为子宫内膜(endometrium, EN)和子宫腺(uterine glands, UG)。
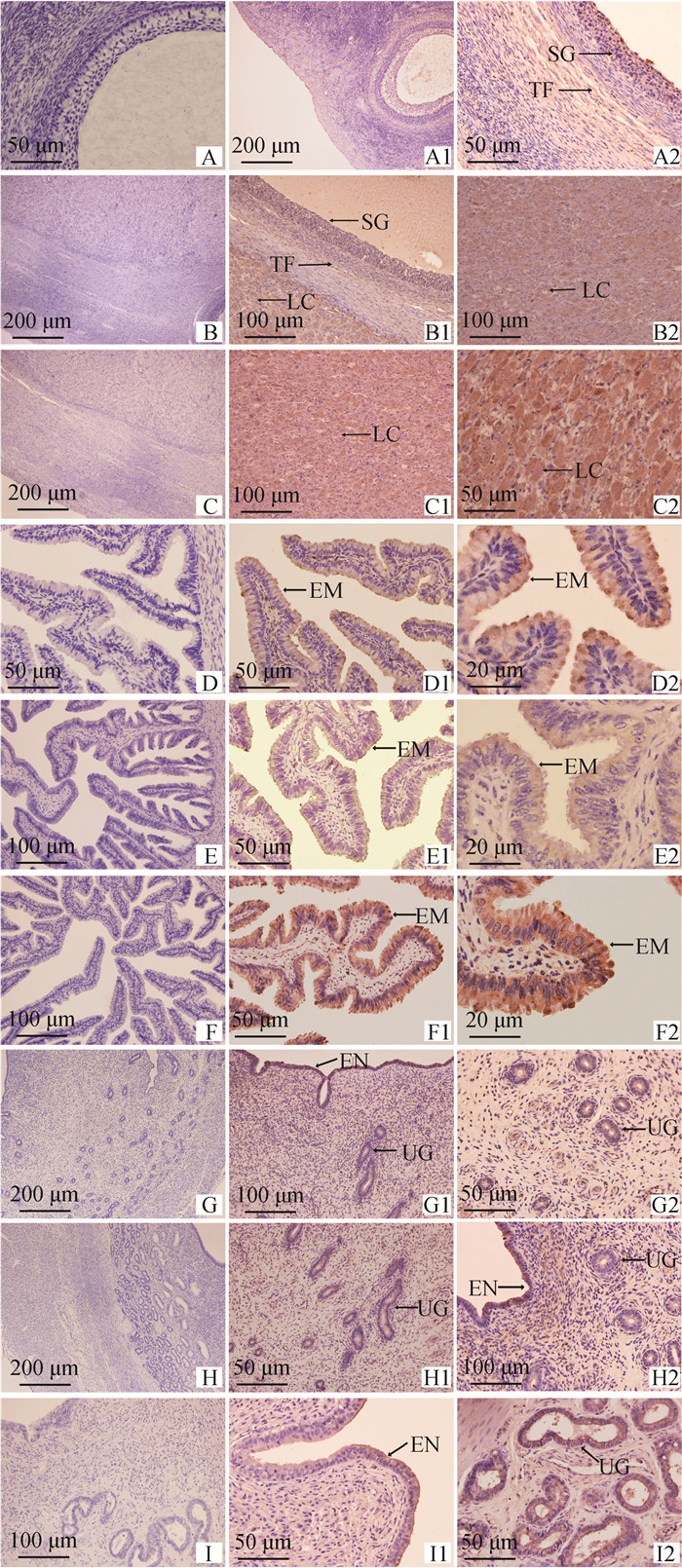
|
A-I. 阴性表达;A1、A2、B1、B2、C1、C2. 卵巢;D1、D2、E1、E2、F1、F2. 输卵管;G1、G2、H1、H2、I1、I2. 子宫。SG. 卵泡颗粒层;TF. 卵泡膜;LC. 黄体细胞;EM. 黏膜上皮;EN. 子宫内膜;UG. 子宫腺。卵泡期. A组、D组、G组;黄体期. B组、E组、H组;妊娠期. C组、F组、I组 A-I. Negative expression; A1, A2, B1, B2, C1, C2. Ovary; D1, D2, E1, E2, F1, F2. Fallopian tube; G1, G2, H1, H2, I1, I2. Uterus. SG. Follicle granular layer; TF. Theca follicle; LC. Luteal cells; EM. Epithelium mucosae; EN. Endometrium; UG. Uterine glands. Follicular phase. Group A, D and G; Luteal phase. Group B, E and H; Gestation phase. Group C, F and I 图 8 RBM3蛋白在在牦牛不同组织中的分布 Fig. 8 Distribution of RBM3 proteins in different tissues of yak |
RBM3作为动物体内的一种应激调节基因,其与冷应激的关系在1997被发现[15],但越来越多的研究表明它在细胞中有着较为复杂的功能和作用。在正常生理条件下,它可以保护细胞免受内在刺激造成的损伤[16],而在机体遭受低温、低氧等应激刺激时,则会诱导其表达并通过多种途径调节应激反应[17]。有研究表明,当动物机体内的RBM3表达量增加时,机体对抗外界有害刺激的能力就会有所增加,从而在恶劣环境下为细胞提供一个较为良好的内部环境[18]。近些年来,RBM3被认为是潜在的原癌基因进行了大量与之相关的研究[19],但对其参与生殖调控的研究却不多。本研究成功克隆了牦牛RBM3基因,分析后发现其N端含有特殊蛋白结构域RNP1和RNP2,与前人研究结果一致,存在RGG结构域。有学者发现,RBM3与部分冷休克蛋白(cold shock proteins, CSPs)具有中度核苷酸序列和功能相似性,在进化过程中保守[20],本研究结果显示牦牛RBM3与野牦牛、瘤牛、普通牛亲缘性较近,其在物种间高度保守,与前人研究RBM3是高度保守的RNA结合蛋白的结论一致[21]。RBM3的核苷酸序列与其他物种相比存在差异:第51位核苷酸和与除西伯利亚虎之外的所有比对动物都有差异,但编码的氨基酸没有发生改变(苏氨酸,Thr);第98位核苷酸也存在差异,所编码氨基酸由参与机体糖代谢、脂肪代谢的苯丙氨酸(Phe)变为在脂肪、脂肪酸新陈代谢和肌肉的生长中发挥重要作用的丝氨酸(Ser),可能为牦牛RBM3基因特点,需进一步研究。
本试验分别对RBM3的mRNA和蛋白在牦牛子宫、卵巢和输卵管中相对表达量进行了检测,发现卵泡期、黄体期、妊娠期3个不同繁殖时期的RBM3在mRNA和蛋白层面的表达趋势存在差异。这可能是由于RBM3基因在本试验涉及到的雌性牦牛不同时期、不同部位存在翻译和转录层面的调控,如磷酸化和甲基化,都对RBM3生物学功能有重要的调节作用[22-24],由此出现时空表达差异。这一差异的存在为后续进一步深入开展RBM3生理功能和翻译后修饰的相关研究提供了思路,有待进一步研究。
在雌性哺乳动物生殖过程中,卵巢作为维持雌性特征最重要的腺体器官,在生殖过程以及相关调控中发挥着重要作用[25]。本研究发现,RBM3在牦牛卵巢中的主要表达位置为卵泡颗粒层、卵泡膜以及黄体细胞,并在黄体期和妊娠期呈现高表达。黄体作为在卵巢内形成的内分泌腺体样结构,通过产生孕酮、雌激素以及其他激素来调控个体发情周期和妊娠。卵泡颗粒细胞作为参与调控原始卵泡的启动、发育、卵泡选择、成熟以及排卵过程的重要角色,与卵泡膜细胞之间也存在着一定相互作用[26],而且这种相互作用在卵泡发育和卵母细胞的成熟过程中有重要意义[27-28]。在卵巢中,卵泡破裂排卵后退化形成黄体,前人研究表明黄体细胞可以通过自分泌与旁分泌方式在黄体功能调节中起到局部调节作用[29-31],其中黄体期黄体通过分泌孕酮来抑制卵巢排卵、妊娠期黄体持续分泌孕酮维持妊娠。因此,RBM3在牦牛黄体期、妊娠期卵巢的高表达可能与黄体功能调节和妊娠维持有关系。
输卵管作为动物体内精子获能、受精及胚胎早期发育的场所。在本试验中,RBM3在牦牛输卵管中的主要表达位置为黏膜上皮,黏膜上皮可以通过分泌物影响精卵结合和合子的形成,对早期胚胎的发育和转运具有重要作用[32]。从已知的研究结果来看,输卵管在卵泡期受卵巢分泌雌激素的影响,黏膜上皮细胞快速生长、发育和增殖[33],分泌输卵管液为受精和早期胚胎发育提供稳定的环境[34]。卵巢排卵后,卵泡液和卵子一起进入输卵管,在黄体期输卵管中卵泡液和输卵管液的融合为精子到达受精部位提供了保障[35],妊娠期输卵管变粗、伸长、弯曲变多并促进早期胚胎的发育。本试验发现,RBM3在黄体期和妊娠期输卵管的表达量显著高于卵泡期,结合免疫组化结果推测RBM3在牦牛输卵管中参与了生殖配子在输卵管内的运行以及早期胚胎发育过程,这可能和RBM3调控细胞生长、分化的生理学功能有关。
子宫作为胎生动物胚胎附植以及生长发育的场所,其生长发育和活动由复杂的内分泌系统所控制,并且具有重要的生理功能[35-37]。在本研究中,RBM3在子宫的主要表达位置为子宫内膜和子宫腺,而且在子宫卵泡期的表达显著高于黄体期和妊娠期。子宫内膜作为子宫的壁层具有促进发情周期循环、孕育胎儿、内分泌等作用;而子宫腺则可以分泌多种妊娠识别、胚胎着床、促进胎儿发育的多种物质[38]。在卵泡期阶段,子宫内膜以增殖、生长以及细胞内代谢为主,子宫腺的分泌水平也在这一时期较高[39-40]。子宫内膜可以通过腺体产生的大量因子,而子宫腺通过感受激素刺激可以分泌相关因子,还可以通过分泌相关生长因子控制自身的正常生理周期。这一结果可能与子宫肌的运动对生殖机能的影响、提供胎儿生长发育的环境、构成胎儿发育的环境等[37]生理功能存在联系。因此推测,RBM3参与了雌性牦牛的子宫生理周期的调控以及妊娠识别等过程。
4 结论本研究成功克隆了牦牛RBM3基因,登录号为:MF142258.1,RBM3基因ORF全长为483 bp,编码18种、160个氨基酸。预测RBM3蛋白存在17个磷酸化位点,是稳定的非跨膜蛋白。RBM3蛋白及基因在雌性牦牛发情周期不同阶段的卵巢、子宫、输卵管中均有表达,但存在差异。本研究结果提示,RBM3参与了牦牛发情周期以及妊娠过程的调控。
| [1] |
CUTHBERT R L, SHUTE R J, SLIVKA D R. Skeletal muscle cold shock and heat shock protein mRNA response to aerobic exercise in different environmental temperatures[J]. Temperature (Austin), 2019, 6(1): 77-84. |
| [2] |
JACKSON T C, MANOLE M D, KOTERMANSKI S E, et al. Cold stress protein RBM3 responds to temperature change in an ultra-sensitive manner in young neurons[J]. Neuroscience, 2015, 305: 268-278. |
| [3] |
KIM D Y, KIM K M, KIM E J, et al. Hypothermia-induced RNA-binding motif protein 3(RBM3) stimulates osteoblast differentiation via the ERK signaling pathway[J]. Biochem Biophys Res Commun, 2018, 498(3): 459-465. |
| [4] |
潘阳阳, 王萌, 芮弦, 等. IGF-1调控RBM3表达抑制低温应激诱导牦牛卵丘细胞凋亡[J]. 中国农业科学, 2020, 53(11): 2285-2296. PAN Y Y, WANG M, RUI X, et al. RNA-binding motif protein 3(RBM3) expression is regulated by insulin-like growth factor (IGF-1) for protecting yak (Bos grunniens) cumulus cells from apoptosis during hypothermia stress[J]. Scientia Agricultura Sinica, 2020, 53(11): 2285-2296. DOI:10.3864/j.issn.0578-1752.2020.11.014 (in Chinese) |
| [5] |
李云龙, 李昌盛, 李静辉, 等. RNA结合基序蛋白3的生物学功能[J]. 生理科学进展, 2014, 45(6): 429-433. LI Y L, LI C S, LI J H, et al. Biological function of RNA binding motif protein 3[J]. Progress in Physiological Sciences, 2014, 45(6): 429-433. (in Chinese) |
| [6] |
DRESIOS J, ASCHRAFI A, OWENS G C, et al. Cold stress-induced protein Rbm3 binds 60S ribosomal subunits, alters MicroRNA levels, and enhances global protein synthesis[J]. Proc Natl Acad Sci U S A, 2005, 102(6): 1865-1870. |
| [7] |
WELLMANN S, TRUSS M, BRUDER E, et al. The RNA-binding protein RBM3 is required for cell proliferation and protects against serum deprivation-induced cell death[J]. Pediatr Res, 2010, 67(1): 35-41. |
| [8] |
YAN J Y, GOERNE T, ZELMER A, et al. The RNA-binding protein RBM3 promotes neural stem cell (NSC) proliferation under hypoxia[J]. Front Cell Dev Biol, 2019, 7: 288. |
| [9] |
FEDOROV V B, GOROPASHNAYA A V, TØIEN Ø, et al. Modulation of gene expression in heart and liver of hibernating black bears (Ursus americanus)[J]. BMC Genomics, 2011, 12(1): 171. |
| [10] |
FEDOROV V B, GOROPASHNAYA A V, TØIEN Ø, et al. Elevated expression of protein biosynthesis genes in liver and muscle of hibernating black bears (Ursus americanus)[J]. Physiol Genomics, 2009, 37(2): 108-118. |
| [11] |
付东海. 牦牛部分生长性状与血常规指标的全基因组关联分析和基因组选择研究[D]. 北京: 中国农业科学院, 2020. FU D H. Genome-wide association study and genomic selection of partial index of growth performance and hematology in yak[D]. Beijing: Chinese Academy of Agricultural Sciences, 2020. (in Chinese) |
| [12] |
阎萍, 潘和平. 环境因素对牦牛繁殖性能的影响[J]. 畜牧与兽医, 2004, 36(5): 15-16. YAN P, PAN H P. Influence of environmental factors on reproductive performance of yak[J]. Animal Husbandry & Veterinary Medicine, 2004, 36(5): 15-16. (in Chinese) |
| [13] |
张君, 余四九. 高原型牦牛繁育状况及繁殖母牛体况调查[J]. 畜牧与兽医, 2005, 37(8): 21-22. ZHANG J, YU S J. Investigation on the breeding status of plateau yaks and the body status of breeding cows[J]. Animal Husbandry & Veterinary Medicine, 2005, 37(8): 21-22. (in Chinese) |
| [14] |
程华琴, 袁钰洁, 罗文, 等. 褪黑素对牦牛黄体细胞生长及功能影响的研究[J]. 畜牧兽医学报, 2022, 53(2): 459-469. CHENG H Q, YUAN Y J, LUO W, et al. Research on the effect of melatonin on the growth and function of yak luteal cells[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(2): 459-469. (in Chinese) |
| [15] |
袁昕. 亚低温环境中冷休克蛋白RBM3基因转录的分子调控机制[D]. 新乡: 新乡医学院, 2021. YUAN X. Molecular mechanism of cold shock protein RBM3 gene transcription under mild hypothermia[D]. Xinxiang: Xinxiang Medical University, 2021. (in Chinese) |
| [16] |
YANG K, ZHANG Q, WEN Z, et al. Cloning and expression of cold-inducible RNA binding protein in domestic yak (Bos grunniens)[J]. Folia Morphol, 2016, 75(4): 460-466. |
| [17] |
DANNO S, NISHIYAMA H, HIGASHITSUJI H, et al. Increased transcript level of RBM3, a member of the glycine-rich RNA-binding protein family, in human cells in response to cold stress[J]. Biochem Biophys Res Commun, 1997, 236(3): 804-807. |
| [18] |
LLEONART M E. A new generation of proto-oncogenes: cold-inducible RNA binding proteins[J]. Biochim et Biophys Acta-Rev Cancer, 2010, 1805(1): 43-52. |
| [19] |
陈秦俊杰. 环状RNAACTN4促进肝内胆管癌进展的机制研究[D]. 上海: 中国人民解放军海军军医大学, 2021. CHEN Q J J. CircRNA ACTN4 facilitates the progression of intrahepatic cholangiocarcinoma and its molecular mechanisms[D]. Shanghai: Naval Medical University, 2021. (in Chinese) |
| [20] |
WANG X H, CHE H L, ZHANG W B, et al. Effects of mild chronic intermittent cold exposure on rat organs[J]. Int J Biol Sci, 2015, 11(10): 1171-1180. |
| [21] |
汪南. RBM3结合Raptor调控自噬保护缺血复灌诱导的心肌细胞损伤[D]. 昆明: 昆明医科大学, 2021. WANG N. RBM3 interacts with Raptor to regulate autophagy and protect cardiomyocytes from ischemia-reperfusion-induced injury[D]. Kunming: Kunming Medical University, 2021. (in Chinese) |
| [22] |
雷冰冰. RBM3分子突变对其核定位和神经保护功能的影响[D]. 新乡: 新乡医学院, 2020. LEI B B. Effect of molecular mutations of cold shock protein RBM3 on its nuclear localization and neuroprotective roles[D]. Xinxiang: Xinxiang Medical University, 2020. (in Chinese) |
| [23] |
宋克芹, 肖琦, 肖建生, 等. 亚低温上调冷休克蛋白RBM3表达减轻肾脏缺血-再灌注损伤[J]. 器官移植, 2021, 12(5): 571-578. SONG K Q, XIAO Q, XIAO J S, et al. Mild hypothermia alleviates renal ischemia-reperfusion injury by up-regulating the expression of cold-shock protein RBM3[J]. Organ Transplantation, 2021, 12(5): 571-578. (in Chinese) |
| [24] |
曹勤, 叶啟发, 王伟. 冷休克蛋白的研究进展[J]. 中华实验外科杂志, 2019, 36(10): 1921-1926. CAO Q, YE Q F, WANG W. Progress knowledge of cold shock protein[J]. Chinese Journal of Experimental Surgery, 2019, 36(10): 1921-1926. (in Chinese) |
| [25] |
王强龙, 潘阳阳, 闫翠霞, 等. 雌性牦牛主要生殖器官中DBI的表达与定位分析[J]. 畜牧兽医学报, 2022, 53(1): 169-178. WANG Q L, PAN Y Y, YAN C X, et al. Expression and localization of DBI in main reproductive organs of female yaks[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(1): 169-178. (in Chinese) |
| [26] |
王瑶瑶. RNA结合基序蛋白3对急性脑损伤的保护作用研究[D]. 合肥: 安徽医科大学, 2019. WANG Y Y. The research of protective effect of RNA binding motif Protein3 on acute brain injury[D]. Hefei: Anhui Medical University, 2019. (in Chinese) |
| [27] |
HORN G, HOFWEBER R, KREMER W, et al. Structure and function of bacterial cold shock proteins[J]. Cell Mol Life Sci, 2007, 64(12): 1457-1470. |
| [28] |
陈静波. 牛妊娠期黄体形态结构及卵母细胞体外胚胎生产的研究[D]. 杨凌: 西北农林科技大学, 2003. CHEN J B. The study on the morphology and structure of corpus luteum & the oocyte in vitro embryo production during the pregnancy period in the cow[D]. Yangling: Northwest A & F University, 2003. (in Chinese) |
| [29] |
XU M, KREEGER P K, SHEA L D, et al. Tissue-engineered follicles produce live fertile, offspring[J]. Tissue Eng, 2006, 12(10): 2739-2746. |
| [30] |
黄正洋. 表皮生长因子参与鹅卵泡颗粒细胞增殖调控机理的研究[D]. 扬州: 扬州大学, 2016. HUANG Z Y. Study of epidermal growth factor on follicular granulosa cell development in laying geese[D]. Yangzhou: Yangzhou University, 2016. (in Chinese). |
| [31] |
陈华丽. Wnt/PLC/Ca2+通路对猪卵泡颗粒细胞和卵母细胞凋亡及颗粒细胞激素分泌的影响机制[D]. 杨凌: 西北农林科技大学, 2020. CHEN H L. Effect of Wnt/PLC/Ca2+ pathway on apoptosis of porcine follicular granulosa cells and oocytes and hormone secretion of granulosa cells[D]. Yangling: Northwest A & F University, 2020. (in Chinese) |
| [32] |
EYESTONE W H, FIRST N L. Co-culture of early cattle embryos to the blastocyst stage with oviducal tissue or in conditioned medium[J]. J Reprod Fertil, 1989, 85(2): 715-720. |
| [33] |
谭娟. 牦牛生殖周期中输卵管的组织结构观察[D]. 兰州: 甘肃农业大学, 2008. TAN J. Observation on the histological structure of the yak (Bos grunniens) oviduct during reproductive cycle[D]. Lanzhou: Gansu Agricultural University, 2008. (in Chinese) |
| [34] |
杨珊珊, 何翃闳, 潘阳阳, 等. 整合素αv在牦牛繁殖周期输卵管不同部位中的表达与定位[J]. 畜牧兽医学报, 2020, 51(11): 2710-2719. YANG S S, HE H H, PAN Y Y, et al. Expression and localization of integrin αv in different parts of the fallopian tube in reproduction cycle of yak[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(11): 2710-2719. (in Chinese) |
| [35] |
李芝丰. FecBBB型和FecB++型小尾寒羊卵泡期和黄体期输卵管转录组表达分析[D]. 扬州: 扬州大学, 2021. LI Z F. Transcriptome analysis of follicular and luteal oviducts of small tail han sheep with FecBBB and FecB++ genotypes[D]. Yangzhou: Yangzhou University, 2021. (in Chinese). |
| [36] |
张蓉, 赵乐, 杨海丽, 等. 细胞外囊泡调控哺乳动物胚胎附植研究进展[J]. 畜牧兽医学报, 2021, 52(5): 1154-1162. ZHANG R, ZHAO L, YANG H L, et al. Research progress of extracellular vesicles regulating mammalian embryo implantation[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(5): 1154-1162. (in Chinese) |
| [37] |
张芮琪, 张莹利, 蒋明, 等. 成纤维生长因子4在妊娠早期牛胎盘组织的分布及表达特点[J]. 畜牧兽医学报, 2019, 50(8): 1685-1693. ZHANG R Q, ZHANG Y L, JIANG M, et al. Expression of fibroblast growth factor 4 in bovine placenta at early pregnancy[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(8): 1685-1693. (in Chinese) |
| [38] |
郭文文. 奶牛子宫内膜永生化细胞系的建立[D]. 杨凌: 西北农林科技大学, 2019. GUO W W. Establishment of cow endometrial immortalized cell lines[D]. Yangling: Northwest A & F University, 2019. (in Chinese) |
| [39] |
张晖, 潘阳阳, 王萌, 等. 牦牛PTGES基因克隆及其在发情周期主要生殖器官的表达定位[J]. 农业生物技术学报, 2021, 29(10): 1949-1957. ZHANG H, PAN Y Y, WANG M, et al. Cloning of yak's (Bos grunniens) PTGES gene and its expression and location in main reproductive organs of estrus cycle[J]. Journal of Agricultural Biotechnology, 2021, 29(10): 1949-1957. (in Chinese) |
| [40] |
喇永富. 利用转录组和蛋白质组测序筛选绵羊多羔基因的研究[D]. 兰州: 甘肃农业大学, 2020. LA Y F. Study on screening polytocous genes in sheep based on transcriptome and proteomics sequencing[D]. Lanzhou: Gansu Agricultural University, 2020. (in Chinese) |
(编辑 郭云雁)



