2. 扬州大学动物科学与技术学院, 扬州 225009;
3. 教育部农业与农产品安全国际合作联合实验室, 扬州 225009
2. College of Animal Science and Technology, Yangzhou University, Yangzhou 225009, China;
3. Joint International Research Laboratory of Agriculture & Agri-Product Safety of Ministry of Education, Yangzhou 225009, China
家鸡(Gallus Gallus domesticus)是一种广泛应用于发育生物学和基因组学研究的重要模式生物,是人类高质量膳食蛋白质的主要来源。几十年来经过遗传选育,使商品化肉鸡的生长速度和饲料效率显著提高[1-2]。然而,由于对肉鸡高生长速度的过度追求,导致现代肉鸡品种出现了腹部脂肪过度沉积的现象。腹部脂肪沉积过多既浪费日粮能量,还引起生产性能下降、蛋鸡繁殖性能减弱等问题,影响家禽产业经济效益。因此,控制腹部脂肪过度沉积已成为目前肉鸡育种工作的主要目标之一。
Kruppel样因子15(Kruppel-like factor 15,KLF15)基因是Uchida等[3]首次从人的肾cDNA文库中获得的,是一类含有锌指结构的转录因子,位于鸡的12号染色体上[4],在其羧基端具有3个C2H2锌指结构,能够识别并结合富含GC的DNA序列[5]。研究发现,腹部脂肪沉积受多种遗传因素调控[6],而KLF家族在脂肪生成过程中起着重要作用,脂肪形成受内部等级调节的影响[7]。研究发现,KLF15能够调节棕色脂肪细胞葡萄糖和脂肪酸之间的燃料转换[8],参与调控哺乳动物脂肪细胞分化和脂质沉积[9-11],还与脓毒症[12]、胶质瘤[13]、肺腺癌[14]、心房颤动[15-17]等疾病治疗和预后密切相关。
在本实验室前期测序分析中发现,KLF15基因可能参与调控鸡脂肪沉积[18]。研究表明,游离脂肪酸通过FFAR4抑制3T3-L1前脂肪细胞KLF15的表达和葡萄糖消耗[19]。另外,通过siRNA干扰KLF15基因,能够抑制猪前体脂肪细胞脂滴的形成,从而调控脂肪沉积[20-21]。目前,关于KLF15功能研究多集中在鼠[22-23]、猪[24]、牛[25-26]等哺乳动物,在家禽上鲜有报道。本研究利用RT-qPCR技术检测和盈黑鸡KLF15基因的组织表达谱及其在不同发育时期腹脂组织中的时序表达模式;利用siRNA技术干扰KLF15,检测前体脂肪细胞的增殖和成脂分化,分别从形态学和分子生物学等角度研究KLF15对前体脂肪细胞增殖和成脂分化的影响,为进一步揭示KLF15在鸡脂肪沉积过程中发挥的功能及调控机理提供理论支撑。
1 材料与方法 1.1 试验动物试验动物为和盈黑鸡,饲养于江苏和盈家禽育种科技有限公司,分别随机选取相同环境下饲养的和盈黑鸡0(出壳第1天)、4、8、12和16周龄的健康公、母鸡各4只,分别采集心、肝、脾、肺、胸肌、腿肌和腹脂组织。样本放入装有RNA wait样品保存液(天根,中国)的无酶EP管中,置于-20 ℃冰箱保存备用,待提取总RNA。
选取5只10日龄左右的和盈黑鸡母鸡,无菌状态下采集腹部脂肪组织用于原代前体脂肪细胞的分离培养。
1.2 试验试剂TRIzol购自Invitrogen(中国香港);反转录试剂盒、荧光定量试剂盒均购自诺唯赞生物科技有限公司;I型胶原蛋白酶和胎牛血清购自赛默飞世尔科技(中国)有限公司;Cell Counting Kit-8(Dojindo,日本)、EDU试剂盒(锐博生物,中国)、磷酸盐缓冲液、青霉素/链霉素溶液、DMEM/F12培养基、Triton X-100、4%多聚甲醛、油酸和油红O染色试剂盒均购自索莱宝生物科技有限公司;无水乙醇、氯仿、异丙醇均为国产分析纯。
1.3 试验方法1.3.1 组织RNA的提取 本试验采用TRIzol法提取组织总RNA,通过NanoDrop-2000c测定总RNA的质量(OD值在1.8~2.0之间为合格)和浓度。
1.3.2 引物设计 根据GenBank上的原鸡KLF15序列(XM_025154676.1)、C/EBPa序列(NM_001031459. 1)和PPARγ序列(XGAM_015292933. 2),使用Primer Premier 5软件跨内含子各设计1对RT-qPCR引物,以β-actin(NC_052545.1)作为内参基因,内参基因引物序列参照张涛等[27]的研究,引物均由上海生工生物工程股份有限公司合成,引物序列信息见表 1。
|
|
表 1 荧光定量引物 Table 1 The primers sequences of real-time PCR |
1.3.3 cDNA合成及RT-qPCR检测 反转录反应采用诺唯赞生物科技有限公司的两步法试剂盒进行,总体系为20 μL:第一步添加RNA模板1 μg,gDNA wiper Mix 4 μL, RNA-Free ddH2O补足至16 μL,吹打混匀,42 ℃孵育2 min;第二步,在第一步反应液中加入qRT Super Mix 4 μL,反应条件为37 ℃ 15 min,85 ℃ 5 min,得到cDNA,-20 ℃冰箱保存备用。
RT-qPCR反应采用诺唯赞生物科技有限公司的SYBR Green染料法荧光定量试剂进行检测,反应体系为:cDNA模板2 μL,上、下游引物各0.4 μL,Master Mix 10 μL,ROX 0.4 μL,RNA-Free ddH2O补足至20 μL。反应程序:95 ℃预变性30 s;95 ℃变性10 s,60 ℃退火30 s,40个循环数进行信息采集。
1.3.4 和盈黑鸡原代前体脂肪细胞的分离培养 鸡前体脂肪细胞的分离培养方法主要采用酶消化法,具体操作步骤:随机选择7~10日龄(7-10 d)的和盈黑鸡母鸡5只,颈静脉放血,在75%乙醇中润洗消毒,然后收集腹部脂肪组织,置于60 mm无菌培养皿中,磷酸盐缓冲液(PBS缓冲液)浸洗3~5遍。将脂肪组织剪碎,按1∶3移入装有Ⅰ型胶原蛋白酶消化液离心管中,37 ℃水浴,消化95 min,使其充分接触消化。待消化完全(一般呈黏胶状),加入等体积完全培养基终止消化,然后分别用200和400目的细胞过滤筛依次过滤,收集滤液于无菌离心管中,500×g离心10 min,弃上清液,用完全培养基重悬细胞沉淀,接种60 mm细胞培养皿中,置于37 ℃,5%的CO2培养箱中培养,待细胞贴壁,每隔48 h换液1次[28]。
1.3.5 和盈黑鸡原代前体脂肪细胞诱导分化 鸡原代前体脂肪细胞在60 mm细胞培养皿培养,当细胞增殖密度达80%~90%时,进行传代试验,将细胞悬液接种12孔培养板,置于含5% CO2培养箱中培养,待细胞增殖至完全融合时,更换诱导培养基(含有160 μmol·L-1油酸浓度的培养基),每48 h更换诱导培养基1次,直至144 h分化完全。分别在诱导12、48、96、144 h时油红O染色后观察细胞形态并拍照,然后加入异丙醇萃取分析甘油三酯含量,每组各3个重复,收集的细胞样品置于-80 ℃冰箱保存,待RNA提取。
1.3.6 EdU检测 将原代前体脂肪细胞接种于12孔板培养,使用jetPRIME polyplus转染试剂分别转染siR-KLF15和siR-NC后,利用EdU Cell Proliferation Detection Kit (Ribobio, 广州, 中国)对细胞进行固定染色,倒置荧光显微镜观察拍照,并用ImagePro Plus 6.0(Media Cybernetics, Maryland, 美国)进行统计学分析。
1.3.7 CCK-8检测 将原代前体脂肪细胞接种96孔板培养,分别转染siR-KLF15和siR-NC,每组8个重复,使用cell Counting Kit-8 cell Counting Kit (Dojindo, Kumamoto, 日本) 细胞增殖检测试剂盒,通过酶标仪(Thermo Fisher, Platinum Elmer, 德国)测定不同时期(12、24、36和48 h)的450 nm吸光值,分析细胞增殖情况。
1.3.8 油红O染色及甘油三酯含量测定 油红O既是脂溶剂也是染脂剂,待细胞诱导分化12、48、96、144 h,分别固定、染色,具体操作参照油红O染色试剂盒(Solarbio,北京,中国)说明书进行。染色完毕,在显微镜下观察并拍照记录。随后在培养板中加入200 μL异丙醇萃取10~15 min,酶标仪测定510 nm的吸光值分析甘油三酯含量[28]。
1.3.9 数据分析 数据采用2-ΔΔCt法进行处理分析,组织表达分布计算公式为:ΔCt=Ct目的基因-Ct内参基因,ΔΔCt=ΔCt组织-ΔCt参照组织(脾);表达规律计算公式为:ΔCt=Ct目的基因-Ct内参基因,ΔΔCt=ΔCt发育阶段-ΔCt参照周龄(12周龄)。其中,Ct(初始循环数)为荧光信号开始由本底进入指数增长阶段的阈值所对应的循环次数[29]。使用SPSS20.0软件对试验数据进行分析,所有数据用“均值±标准差”表示,P < 0.05(*)或P < 0.01(**)表示差异有统计学意义。
2 结果 2.1 目的基因与内参基因扩增利用已设计好的KLF15、C/EBPa、PPARγ、FAS和β-actin的引物,以cDNA为模板进行PCR扩增,将扩增产物进行1.5%琼脂糖凝胶电泳检测,结果如图 1所示,得到的条带与目的条带一致,分别为189、138、155、196和169 bp,条带长度与预期相符,清晰无拖尾,表明引物特异性良好,cDNA模板完整性好。
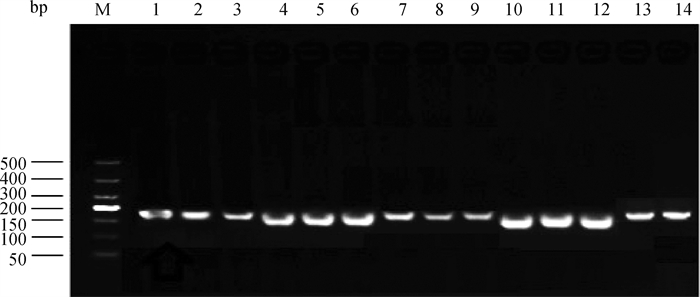
|
M.DNA相对分子质量标准; 1~3. KLF15扩增的产物;4~6. PPARγ扩增产物;7~9. β-actin扩增产物;10~12. C/EBPa扩增产物; 13~14. FAS扩增产物 M. DL500 DNA Marker; 1-3. Amplification products of KLF15; 4-6. Amplification products of PPARγ; 7-9. Amplification products of β-actin; 10-12. Amplification products of C/EBPa; 13-14. Amplification products of FAS 图 1 PCR产物凝胶电泳 Fig. 1 Gel electrophoresis of PCR products |
为了获得KLF15的组织表达分布和在脂肪组织中的发育性表达规律,利用RT-qPCR技术检测KLF15在和盈黑鸡不同组织中的表达情况。结果显示,KLF15在和盈黑鸡中呈现多组织广泛表达的特性,在公鸡肺、胸肌、肝、腹脂和腿肌均有较高的表达量,且极显著高于其它组织(P < 0.01),在母鸡胸肌组织中表达量最高,其次是腹脂组织,显著高于肝、心、腿肌和肾组织(P < 0.05),极显著高于肺和脾组织(P < 0.01)(图 2);分别选取1日龄及4、8、12和16周龄公、母鸡各3只,采集腹脂组织绘制不同发育时期的表达规律。结果显示,KLF15在公、母鸡腹脂中分别呈“L”和“U”表达趋势,表达高峰均出现在1日龄,随着生长发育的不断进行公鸡在4周龄时表达量最低,然后缓慢上升;母鸡到达12周龄时最低,然后上升(图 3)。
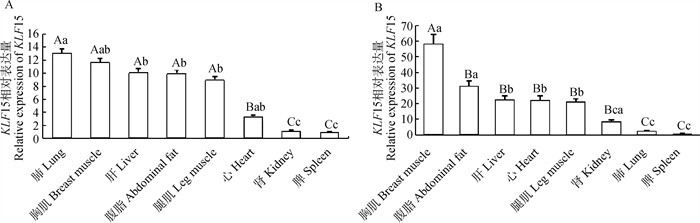
|
图中不同大写字母表示差异极显著(P < 0.01), 不同小写字母代表差异显著(P < 0.05);内参基因为β-actin,n=3 Different capital letters indicated highly significant differences (P < 0.01), different lowercase letters showed significant differences (P < 0.05).Internal reference gene is β-actin, n=3 图 2 KLF15在公鸡(A)和母鸡(B)不同组织中的表达 Fig. 2 Expression of KLF15 in different tissues of male (A) and female (B) chickens |
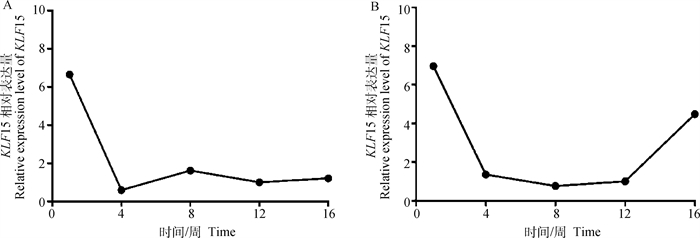
|
图 3 KLF15在和盈黑鸡公鸡(A)和母鸡(B)脂肪组织不同阶段的表达规律 Fig. 3 The expression patterns of KLF15 in abdominal fat of male (A) and female (B) Heying Black chickens at different growth stages |
利用油酸诱导脂肪细胞分化,诱导分化12、48、96、144 h时使用油红O对细胞进行染色,并拍照观察。每孔加入异丙醇萃取,酶标仪测定510 nm吸光值,分析TG含量,同时检测分化不同时期KLF15 mRNA水平。观察发现,随着诱导的进行,细胞形态随之变化,在分化12 h时,细胞轮廓清晰,48 h胞内出现少量黄色小脂滴,96 h可见橙色大小不一的脂滴,144 h细胞轮廓模糊,呈现红色片状脂滴;TG含量分析发现,随着分化的进行TG含量呈现持续上升趋势,分化144 h时TG含量最高,显著高于96 h(P < 0.05),极显著高于48和12 h(P < 0.01),KLF15 mRNA表达变化趋势与之一致,在诱导成脂的前期KLF15 mRNA呈现缓慢上升趋势,分化144 h表达量达高峰(图 4)。
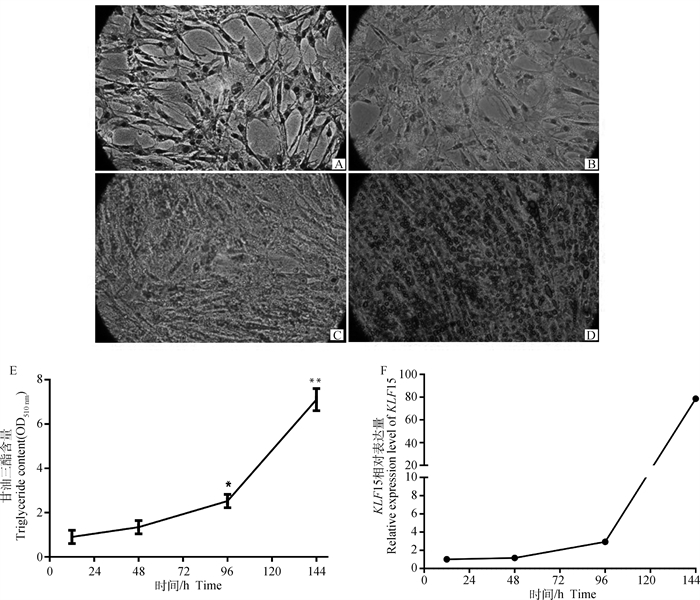
|
A、B、C、D.诱导分化12、48、96和144 h的细胞(100×);E. 脂肪细胞分化不同时期TG含量;F. KLF15在分化不同时期的表达谱。*.差异显著(P < 0.05),**.差异极显著(P < 0.01),下同 A, B, C, D. The preadipocytes induced for 12, 48, 96 and 144 h, respectively (100×); E. TG content in adipocytes at different stages of differentiation; F. Expression profile of KLF15 at different stages of differentiation. *.The significant difference (P < 0.05), * *. The extremely significant difference (P < 0.01), the same as below 图 4 KLF15对和盈黑鸡原代前体脂肪细胞分化的影响 Fig. 4 Effects of KLF15 on preadipocyte differentiation of primary precursor of Heying Black chickens |
采用CCK-8检测干扰KLF15基因后对前体脂肪细胞增殖的影响。如图 5所示,干扰KLF15基因显著抑制了细胞增殖,24 h干扰组OD值显著低于对照组(P < 0.05),36~48 h极显著低于对照组(P < 0.01)。

|
图 5 CCK-8检测干扰KLF15对前体脂肪细胞增殖的影响 Fig. 5 Effect of interfering with KLF15 on cell proliferation using CCK-8 detection |
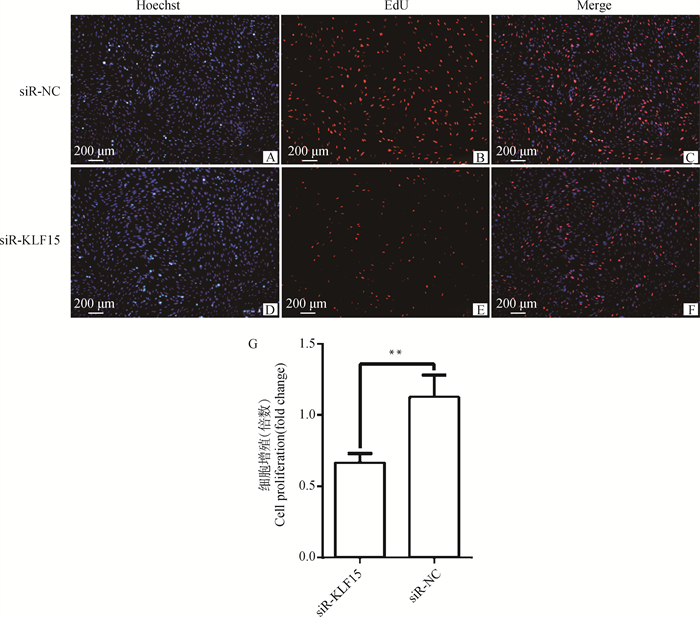
采用EdU细胞增殖试剂盒检测干扰KLF15基因对前体脂肪细胞增殖的影响,EdU检测结果如图 6所示,增殖细胞标记为红色荧光,干扰KLF15基因后,极显著抑制了细胞增殖,红色荧光细胞占蓝色荧光细胞的比例明显降低,ImagePro Plus 6.0分析发现干扰组细胞比例极显著低于对照组(P < 0.01),表明干扰KLF15基因后前体脂肪细胞增殖受到抑制。
|
图 6 在鸡前体脂肪细胞中干扰KLF15后EdU检测结果 Fig. 6 EdU detection results of interfering with KLF15 in chicken preadipocytes |
2.5.1 干扰KLF15基因对分化标记基因表达的影响 为研究KLF15基因对前体脂肪细胞分化的调控作用,本研究利用RT-qPCR技术检测干扰KLF15基因后前体脂肪细胞分化标志基因PPARγ、FAS和C/EBPa的表达变化。结果如图 7所示,与对照组相比,干扰组PPARγ、FAS和C/EBPa的表达均被抑制,其中干扰组PPARγ、C/EBPa表达极显著低于对照组(P < 0.01),FAS表达显著低于对照组(P < 0.05)。

|
图 7 在前体脂肪细胞中干扰KLF15对分化相关基因表达的影响 Fig. 7 Effects of interfering with KLF15 on the expression of differentiation-related genes in chicken preadipocytes |
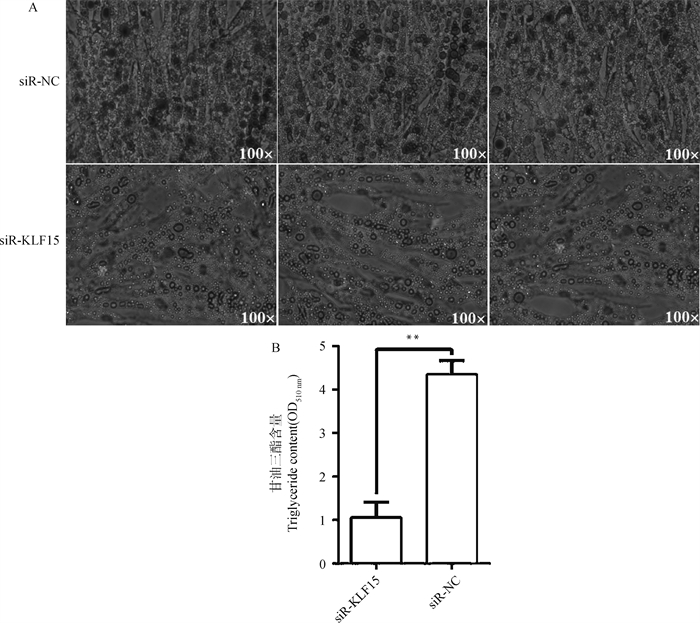
2.5.2 干扰KLF15基因对前体脂肪细胞成脂分化的影响 在前体脂肪细胞诱导分化第6天时,利用油红O试剂盒染色后进行形态学观察。结果如图 8所示,干扰组红色脂滴数量显著少于对照组,甘油三酯含量测定分析结果表明,干扰组TG含量极显著低于对照组(P < 0.01),结果与油红O染色的形态学观察结果相符。综上所述,干扰KLF15基因后,明显抑制了和盈黑鸡原代前体脂肪细胞的成脂分化。
|
图 8 干扰KLF15基因对前体脂肪细胞分化的影响 Fig. 8 The effect of interfering with KLF15 on preadipocyte differentiation |
KLF15基因是KLFs家族成员之一,具有广泛的生物学功能[30]。KLF15通过调控葡萄糖转运因子GLUT4的表达在脂肪组织和肌肉组织的代谢通路中发挥关键作用[31]。脂肪形成是一个复杂的过程,涉及许多不同的信号通路和转录因子的整合。研究表明,该家族已有多个成员可能参与脂肪细胞分化[32-33]。本实验室前期通过高通量测序技术结合生物信息学分析发现,KLF15基因在鸡前体脂肪细胞成脂分化过程中差异表达,推测其可能参与调控鸡脂肪沉积[18]。因此,本研究首先通过RT-qPCR技术对KLF15在和盈黑鸡各组织中的表达分布及在脂肪组织不同发育时期的表达规律进行定量分析,结果表明,KLF15在8个被测组织中呈现广泛表达的特性。在公鸡的肺、胸肌、肝、腹脂和腿肌的表达量极显著的高于其它组织(P < 0.01),母鸡中胸肌组织表达量最高,其次是腹脂组织显著高于其它组织(P < 0.05),而在脾组织中表达量最低。本结果与王英明等[34]的研究结果存在相似之处,该研究显示KLF15同样在肺中表达最高,肾组织中表达最低。而郭红芳[9]在牛上的研究与本研究结果相反,KLF15基因在牛肾、肝和脂肪组织中均高表达,肺中表达量最低。表明KLF15的表达存在物种特异性。发育性表达分析发现,KLF15在公、母鸡的表达分别呈现“L”型和“U”型趋势,表达量最高峰均出现在1日龄时,随后下降。表明KLF15在生长发育初期高表达。本研究通过检测KLF15在体外培养和盈黑鸡前体脂肪细胞分化过程中的表达差异来进一步明确KLF15在机体细胞生长过程中的表达模式。在分化的12 h时检测发现细胞开始融合,表达量相对较低,48 h胞内开始分化小脂滴,表达开始缓慢上升,96 h细胞形态模糊,脂滴明显增多,表达量显著上升,144 h已分化完全形成红色大脂滴,表达量达高峰,此时TG含量最高,显著或极显著高于96、48和12 h。表明KLF15在和盈黑鸡前体脂肪细胞分化过程中发挥着重要作用。
研究明确了干扰KLF15能够抑制前体脂肪细胞的增殖,本研究检测了在前体脂肪细胞中干扰KLF15对细胞增殖能力的影响,结果发现,干扰KLF15后,细胞增殖能力开始下降,在培养24、36和48 h细胞增殖水平显著或极显著低于对照组。同时,EdU检测细胞增殖试验结果与之一致。
研究阐明干扰KLF15在和盈黑鸡原代前体脂肪细胞成脂分化过程中的调控作用,本研究利用siRNA干扰KLF15表达。发现干扰KLF15后,和盈黑鸡前体脂肪细胞内脂滴的数量明显减少并变小,TG含量极显著降低(P < 0.01),表明KLF15可能是前体脂肪细胞的正调控因子。Chai等[35]研究报道,KLF15参与前脂肪细胞的分化,与甘油三酯含量呈正相关,与本试验结果一致。在猪脂质沉积过程中敲低KLF15的表达,会导致甘油三酯水平显着降低(P < 0.05);Mori等[20]在3T3-L1细胞中研究发现,过表达KLF15基因能够显著促进3T3-L1细胞脂滴的形成,表明KLF15在脂肪细胞分化过程中发挥着积极的作用。本研究中,干扰KLF15基因后PPARγ、C/EBPα等分化标志基因的表达水平显着降低(P < 0.01)。PPARγ是成脂分化的关键转录因子之一,能够调控脂肪细胞表型基因的表达,促进脂肪细胞的分化[36-37]。C/EBPa是C/EBPs家族中的一员,与PPARγ相互协同,正向调节细胞分化[38-39]。研究发现,在牛前体脂肪细胞中,过表达KLF15后成脂标志基因PPARγ和C/EBPα显著上调,而干扰KLF15后成脂标志基因显著下调,表明KLF15在脂肪细胞分化和脂质代谢中发挥正向调控作用[9]。高欣[24]研究发现,猪肾细胞瞬时转染KLF15转录因子能够显著上调成脂关键因子PPARγ的表达,促进细胞脂质沉积。脂肪酸合成酶(FAS)是催化脂肪酸从头合成的关键酶,在细胞分化过程中发挥着重要作用[40]。前期的研究表明,FAS在脂肪细胞分化过程中呈现上升趋势[28]。本研究检测发现,干扰KLF15后前体脂肪细胞分化标志基因PPARγ、FAS和C/EBPa的表达水平明显下降。因此推测,干扰KLF15可能是通过下调分化标志基因的表达来调节前体脂肪细胞的分化成脂,但KLF15具体的调控机理待更深层的研究证明。
4 结论本研究成功绘制了和盈黑鸡KLF15在多组织分布表达谱、脂肪组织时空表达谱及成脂分化过程中的表达规律,发现KLF15多组织广泛表达的特性,其在腹脂组织中表达量相对较高。在细胞分化过程中KLF15呈现上升趋势,在分化后期达到高峰。干扰KLF15能够显著抑制细胞增殖分化。推测其在前体脂肪细胞分化过程中为正调控因子,可能通过调控分化标志基因PPARγ、C/EBPa和FAS的表达抑制细胞成脂分化。然而,关于进一步阐明KLF15影响前体脂肪细胞增殖分化的机制还需深入研究,有望为肥胖治疗开辟新的思路和途径。
| [1] |
EMMERSON D A. Commercial approaches to genetic selection for growth and feed conversion in domestic poultry[J]. Poult Sci, 1997, 76(8): 1121-1125. DOI:10.1093/ps/76.8.1121 |
| [2] |
CHAMBERS J. Genetics of growth and meat production in chickens[J]. Poultry Breeding and Genetics. Amsterdam: Elsevier, 1990: 599-643.
|
| [3] |
UCHIDA S, SASAKI S, MARUMO F. Isolation of a novel zinc finger repressor that regulates the kidney-specific CLC-K1 promoter[J]. Kidney Int, 2001, 60(2): 416-421. DOI:10.1046/j.1523-1755.2001.060002416.x |
| [4] |
吕世杰. 鸡KLF15基因的组织表达特性及多态性分析研究[D]. 郑州: 河南农业大学, 2014. LV S J. Study of polymorphisms and gene expression pattern of the chicken KLF15 gene[D]. Zhengzhou: Henan Agricultural University, 2014. (in Chinese) |
| [5] |
BLACK A R, BLACK J D, AZIZKHAN-CLIFFORD J. Sp1 and krüppel-like factor family of transcription factors in cell growth regulation and cancer[J]. J Cell Physiol, 2001, 188(2): 143-160. DOI:10.1002/jcp.1111 |
| [6] |
BOONE C, MOUROT J, GRÉGOIRE F, et al. The adipose conversion process: regulation by extracellular and intracellular factors[J]. Reprod Nutr Dev, 2000, 40(4): 325-358. DOI:10.1051/rnd:2000103 |
| [7] |
GUO H F, KHAN R, RAZA S H A, et al. KLF15 promotes transcription of KLF3 gene in bovine adipocytes[J]. Gene, 2018, 659: 77-83. DOI:10.1016/j.gene.2018.03.049 |
| [8] |
NABATAME Y, HOSOOKA T, AOKI C, et al. Kruppel-like factor 15 regulates fuel switching between glucose and fatty acids in brown adipocytes[J]. J Diabetes Investig, 2021, 12(7): 1144-1151. DOI:10.1111/jdi.13511 |
| [9] |
郭红芳. KLF3和KLF15基因对牛前体脂肪细胞分化和脂质代谢调控研究[D]. 杨凌: 西北农林科技大学, 2018. GUO H F. The function of KLF3 and KLF15 in bovine preadipocyte differentiation and lipid metabolism[D]. Yangling: Northwest A&F University, 2018. (in Chinese) |
| [10] |
李青莹. KLF15对猪前体脂肪细胞分化及通过其含量预测脂肪沉积能力的研究[D]. 长春: 吉林大学, 2015. LI Q Y. Research on effects of KLF15 in porcine preadipocytes differentiation and predication of fat deposition capability[D]. Changchun: Jilin University, 2015. (in Chinese) |
| [11] |
江书忠. 猪脂肪沉积关键基因的筛选及锌指蛋白KLF13的功能研究[D]. 武汉: 华中农业大学, 2014. JIANG S Z. Screening of key genes related to porcine fat deposition and functional study of zinc finger protein KLF13[D]. Wuhan: Huazhong Agricultural University, 2014. (in Chinese) |
| [12] |
TIAN L L, ZHANG J, WANG Z Z, et al. KLF15 reduces the level of apoptosis in mouse liver induced by sepsis by inhibiting p38MAPK/ERK1/2 signaling pathway[J]. Eur Rev Med Pharmacol Sci, 2020, 24(20): 10819-10828. |
| [13] |
CHEN L, JING S Y, LIU N, et al. MiR-376a-3p alleviates the development of glioma through negatively regulating KLF15[J]. Eur Rev Med Pharmacol Sci, 2020, 24(22): 11666-11674. |
| [14] |
王晓燕. Krüppel样因子15调控肺腺癌增殖的机制研究[D]. 苏州: 苏州大学, 2019. WANG X Y. Mechanism of Krüppel-like factor 15 regulating proliferation of lung adenocarcinoma[D]. Suzhou: Soochow University, 2019. (in Chinese) |
| [15] |
TIAN X T, XU Y J, YANG Y Q. Gender differences in arrhythmias: Focused on atrial fibrillation[J]. J Cardiovasc Transl Res, 2020, 13(1): 85-96. DOI:10.1007/s12265-019-09918-w |
| [16] |
QIN D X, MANSOUR M C, RUSKIN J N, et al. Atrial fibrillation-mediated cardiomyopathy[J]. Circ Arrhythm Electrophysiol, 2019, 12(12): 007809. |
| [17] |
WIJESURENDRA R S, CASADEI B. Mechanisms of atrial fibrillation[J]. Heart, 2019, 105(24): 1860-1867. DOI:10.1136/heartjnl-2018-314267 |
| [18] |
ZHANG T, ZHANG X Q, HAN K P, et al. Genome-wide analysis of lncRNA and mRNA expression during differentiation of abdominal preadipocytes in the chicken[J]. G3 (Bethesda), 2017, 7(3): 953-966. DOI:10.1534/g3.116.037069 |
| [19] |
仇同同, 邓玉春, 王翠喆, 等. 游离脂肪酸通过FFAR4抑制脂肪细胞KLF15的表达和葡萄糖消耗[J]. 石河子大学学报: 自然科学版, 2020, 38(6): 734-740. QIU T T, DENG Y C, WANG C Z, et al. FFA inhibits the expression of KLF15 and glucose consumption in adipocytes by FFAR4[J]. Journal of Shihezi University: Natural Science, 2020, 38(6): 734-740. (in Chinese) |
| [20] |
MORI T, SAKAUE H, IGUCHI H, et al. Role of Krüppel-like Factor 15 (KLF15) in transcriptional regulation of adipogenesis[J]. J Biol Chem, 2005, 280(13): 12867-12875. DOI:10.1074/jbc.M410515200 |
| [21] |
柴孟龙, 李青莹, 姜昊, 等. 锌指蛋白15在猪前体脂肪细胞分化中的作用[J]. 吉林农业大学学报, 2016, 38(3): 325-329, 335. CHAI M L, LI Q Y, JIANG H, et al. Role of Zinc Finger Protein15 in differentiation of porcine preadipocyte[J]. Journal of Jilin Agricultural University, 2016, 38(3): 325-329, 335. (in Chinese) |
| [22] |
王杰, 陈婷, 沈清武. KLF15基因表达特征及其腺病毒超表达载体的构建[J]. 西北农林科技大学学报: 自然科学版, 2015, 43(7): 35-40. WANG J, CHEN T, SHEN Q W. Expression characteristics of KLF15 gene and construction of its adenovirus vector[J]. Journal of Northwest A&F University: Natural Science Edition, 2015, 43(7): 35-40. (in Chinese) |
| [23] |
SVENSON K L, LONG L L, CICIOTTE S L, et al. A mutation in mouse Krüppel-like factor 15 alters the gut microbiome and response to obesogenic diet[J]. PLoS ONE, 2019, 14(9): e0222536. DOI:10.1371/journal.pone.0222536 |
| [24] |
高欣. 猪PNPLA3、4基因的克隆及功能研究[D]. 武汉: 华中农业大学, 2009. GAO X. Cloning and functional analysis of porcine PNPLA3 and PNPLA4[D]. Wuhan: Huazhong Agricultural University, 2009. (in Chinese) |
| [25] |
CHEN X Y, RAZA S H A, CHENG G, et al. Bta-miR-376a targeting KLF15 interferes with adipogenesis signaling pathway to promote differentiation of Qinchuan beef cattle preadipocytes[J]. Animals (Basel), 2020, 10(12): 2362. |
| [26] |
EL-MAYET F S, HARRISON K S, JONES C. Regulation of Krüppel-like Factor 15 expression by herpes simplex virus type 1 or bovine herpesvirus 1 productive infection[J]. Viruses, 2021, 13(6): 1148. DOI:10.3390/v13061148 |
| [27] |
张涛, 张跟喜, 张向前, 等. 京海黄鸡肌细胞生成素基因(MyoG)组织表达谱及表达规律[J]. 农业生物技术学报, 2015, 23(5): 617-622. ZHANG T, ZHANG G X, ZHANG X Q, et al. Tissue expression profile and expression pattern of Myogenin gene (MyoG) in Jinghai yellow chicken (Gallus gallus)[J]. Journal of Agricultural Biotechnology, 2015, 23(5): 617-622. DOI:10.3969/j.issn.1674-7968.2015.05.007 (in Chinese) |
| [28] |
陈兰. GAS6基因调控鸡脂肪前体细胞分化的功能及遗传效应研究[D]. 扬州: 扬州大学, 2020. CHEN L. Study on the function of GAS6 gene in regulating adipocyte differentiation and its genetic effect on chicken[D]. Yangzhou: Yangzhou University, 2020. (in Chinese) |
| [29] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [30] |
SANTOS S, VOERMAN E, DAMIANO P, et al. Impact of maternal body mass index and gestational weight gain on pregnancy complications: an individual participant data meta-analysis of European, North American and Australian cohorts[J]. BJOG, 2019, 126(8): 984-995. |
| [31] |
OTTESON D C, LIU Y H, LAI H, et al. Krüppel-like factor15, a zinc-finger transcriptional regulator, represses the rhodopsin and interphotoreceptor retinoid-binding protein promoters[J]. Invest Ophthalmol Vis Sci, 2004, 45(8): 2522-2530. DOI:10.1167/iovs.04-0072 |
| [32] |
PEI H, YAO Y, YANG Y, et al. Krüppel-like factor KLF9 regulates PPARγ transactivation at the middle stage of adipogenesis[J]. Cell Death Differ, 2011, 18(2): 315-327. DOI:10.1038/cdd.2010.100 |
| [33] |
WEI S J, ZHANG L F, ZHOU X, et al. Emerging roles of zinc finger proteins in regulating adipogenesis[J]. Cell Mol Life Sci, 2013, 70(23): 4569-4584. DOI:10.1007/s00018-013-1395-0 |
| [34] |
王英明, 徐亚欧, 王志敏, 等. 藏鸡KLF15基因克隆、组织表达谱及其表达与肌内脂肪含量相关性的研究[J]. 畜牧兽医学报, 2019, 50(2): 261-270. WANG Y M, XU Y O, WANG Z M, et al. Studies on the cloning of KLF15 gene, tissue expression profile and the association between its expression and intramuscular fat content in Tibetan Chicken[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(2): 261-270. (in Chinese) |
| [35] |
CHAI M L, LI Q Y, GAO Y, et al. Effect of KLF15 on porcine preadipocyte differentiation and prediction of fat deposition ability based on KLF15 concentrations[J]. Int J Clin Exp Med, 2016, 9(7): 12430-12440. |
| [36] |
高霞, 李方正, 郇延军, 等. 猪DFAT细胞成脂再分化过程中KLF2和PPARγ的表达[J]. 畜牧兽医学报, 2017, 48(1): 68-74. GAO X, LI F Z, HUAN Y J, et al. The expression patterns of KLF2 and PPARγ during the adipogenic redifferentiation of porcine DFAT cells[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(1): 68-74. (in Chinese) |
| [37] |
张志威, 李辉, 王宁. KLF转录因子家族与脂肪细胞分化[J]. 中国生物化学与分子生物学报, 2009, 25(11): 983-990. ZHANG Z W, LI H, WANG N. Kruppel-like Factors (KLFs) and adipocyte differentiation[J]. Chinese Journal of Biochemistry and Molecular Biology, 2009, 25(11): 983-990. (in Chinese) |
| [38] |
WANG N D, FINEGOLD M J, BRADLEY A, et al. Impaired energy homeostasis in C/EBPα knockout mice[J]. Science, 1995, 269(5227): 1108-1112. DOI:10.1126/science.7652557 |
| [39] |
ROSEN E D, MACDOUGALD O A. Adipocyte differentiation from the inside out[J]. Nat Rev Mol Cell Biol, 2006, 7(12): 885-896. DOI:10.1038/nrm2066 |
| [40] |
栾兆进, 刘开东, 贺建宁, 等. 绵羊FAM134B、PPARγ、HSL和FAS基因表达量及与肌内脂肪含量的关系[J]. 畜牧兽医学报, 2016, 47(12): 2379-2389. LUAN Z J, LIU K D, HE J N, et al. The FAM134B, PPARγ, HSL and FAS gene expression patterns and their association with intramuscular fat content in sheep[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(12): 2379-2389. DOI:10.11843/j.issn.0366-6964.2016.12.007 (in Chinese) |
(编辑 郭云雁)



