商品鸡在200 d左右产蛋率可达95%以上,在480 d后产蛋量快速下降[1]。老年母鸡产蛋量的下降主要是由于卵巢老化,伴随着内分泌变化,卵黄合成和积累减少,以及进入排卵前阶段的卵泡数量减少[2]。
卵巢衰退的主要因素之一是细胞内活性氧(ROS)积聚引起的氧化应激。在正常细胞中,抗氧化防御系统来清除ROS,从而减轻氧化应激损伤[3]。然而,由于在老化过程中抗氧化剂水平逐渐降低,活性氧生成和抗氧化系统之间的平衡可能会被破坏。ROS过度累积引起的氧化应激是家禽卵巢组织衰退主要因素[3]。一定水平范围的ROS有助于维持细胞的正常信号传导,但是过量的ROS会导致氧化应激,进而损伤细胞和机体。在啮齿动物类的研究表明,大鼠和小鼠卵泡闭锁和卵泡颗粒细胞的凋亡由卵巢组织中ROS水平升高导致[1]。肝抗氧化防御功能的降低是导致老龄母鸡产蛋性能下降的原因[3]。近几年,研究人员常筛选天然植物提取物用于缓解氧化应激引起的组织损伤。天然植物提取物主要通过两种途径发挥抗氧化作用,一种是对自由基的直接清除,另一种是通过激活与抗氧化作用相关的信号通路调节抗氧化基因和蛋白表达的水平。Nrf2是一种重要的抗氧化基因细胞核转录调控因子,参与细胞内多种氧化应激防御系统的调控。Nrf2可以抑制炎症发生,促进HO-1表达从而抑制细胞凋亡[3]。在蛋鸡衰老过程中,蛋鸡卵巢抗氧化能力下降,同时Nrf2/HO-1信号通路活性降低。但激活Nrf2/HO-1信号通路是否能够增强衰老蛋鸡卵巢抗氧化能力仍鲜有报道。
目前,对衰老的研究多采用建立实验性衰老模型,在国内应用最多的是D-半乳糖(D-galactose,D-gal)诱导的衰老模型。D-gal诱导衰老模型特征与自然衰老特征相似,表现为氧化还原失衡、细胞凋亡增加、细胞增殖减少和细胞退行性变化等。实验室先前的研究也验证了D-gal诱导的卵巢衰老模型与动物机体正常衰老相似[3]。
芦荟大黄素(aloe-emodin, AE),一种天然的蒽醌衍生物,广泛应用于掌跖、虎杖、何首乌等中草药中[4]。芦荟大黄素作为中药已被用作中药已有2000多年的历史,目前仍存在于各种中药制剂中[5]。芦荟大黄素具有广泛的药理作用,包括抗癌、保肝、抗炎、抗氧化和抗菌等。本研究通过给580日龄(D580)蛋鸡注射AE比较母鸡肝中卵黄前体的形成和卵泡氧化应激水平,以阐明AE对衰老蛋鸡产蛋性能的缓解作用,再通过建立体外卵泡衰老模型,揭示AE通过Nrf2/HO-1信号途径缓解衰老蛋鸡卵泡的氧化应激。
1 材料与方法 1.1 试验动物衰老海兰白蛋鸡(D580)购买自嘉兴鑫源旺绿色生态蛋鸡养殖场。将D580蛋鸡随机分为4组,分别经腹腔注射5、10和20 mg·kg-1 AE或等量的生理盐水(对照组)。
1.2 样品采集对D580蛋鸡进行称重,并在下次排卵前12 h翅下静脉采血进行血清的分离。对所有蛋鸡颈部脱臼致死,一部分取出的肝组织于4%多聚甲醛(PFA)中固定用于石蜡组织切片,另一部分保存于液氮中用于RNA提取及逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR);取卵巢组织称重,采集等级前卵泡,按直径分为大黄卵泡(large yellow follicle,LYF,8~10 mm)、小黄卵泡(small yellow follicle,SYF,6~8 mm)、大白卵泡(large white follicle,LWF,4~6 mm)和小白卵泡(small white follicle,SWF,2~4 mm),同时采集等级卵泡(F1~F6), 分别称取等级卵泡质量和各级卵泡数量,取一部分SWFs于4%PFA中固定,用于石蜡组织切片,另一部分保存于液氮中,用于RNA提取及RT-PCR试验。
1.3 SWF培养将采集的SWFs用磷酸盐缓冲盐溶液(phosphate-buffered saline,PBS)清洗,洗净表面的红细胞并转移至含有1%双抗的DMEM中。将SWFs用无菌PBS清洗3~5次。在24孔培养板的孔内放入0.45 μm的滤纸片和卵泡,然后加入含有5%FCS、100 IU·mL-1青霉素、100 μg·mL-1链霉素、2 mmol·L-1谷氨酰胺和1×ITS(ITS: 30 nmol·L-1亚硒酸钠,5 μg·mL-1转铁蛋白和10 μg·mL-1胰岛素)的完全培养基,同时添加不同剂量D-gal(0.1、1.0、10.0 mL·mg-1)。将24孔板置于38.5 ℃的CO2培养箱培养72 h后,观察SWFs形态变化、细胞凋亡率和增殖率,筛选最佳D-gal浓度用于建立体外衰老卵泡模型。随后,在建立的体外衰老卵泡模型中添加不同浓度(5、10、20 μg·mL-1)的AE,通过卵泡组织形态观察、细胞增殖率和凋亡率测定,选择适宜的AE处理浓度。在组织培养过程中,用D-gal、AE、Nrf2激活剂DMF(3 μmol·L-1)或抑制剂ML385(6 μmol·L-1) 单独或联合处理培养的卵泡,72 h后进行形态观察、生化指标测定、实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)、蛋白质印迹法(Western blot)和免疫荧光检测。
1.4 组织切片制作和组织染色固定24 h后的组织,用酒精逐级脱水、石蜡包埋和切片,经苏木精-伊红染色法(hematoxylin-eosin staining,HE)或原位末端凋亡法(TdT-mediated dUTP Nick-End Labeling,TUNEL)染色后观察。培养的卵泡组织在体外培养48 h后,在添加10 μg·mL-15-溴脱氧尿嘧啶核苷(5-bromodeoxyuridine,BrdU)的培养基中继续培养24 h,然后收集组织制作石蜡切片。用酒精逐级脱水、石蜡包埋和切片,经小鼠抗BrdU抗体(RT1081,HUABIO,杭州)染色后观察。
1.5 RT-PCR检测组织mRNA采集衰老蛋鸡的肝组织和培养后的卵泡,研磨后置于冰盒上,Trizol法提取总RNA。提取的RNA通过反转录合成cDNA,以cDNA为模板进行RT-PCR试验,反应体系为15 μL。参照GenBank中蛋鸡及内参β-actin的基因序列,通过Primer Premier 5.0进行引物设计(表 1)。基因引物均由上海生工合成。每个RT-PCR均进行至少9个重复,使用2-ΔΔCt法以β-actin为内参基因测定相对mRNA表达水平。
|
|
表 1 引物信息 Table 1 Primer information |
将样品研磨后至于离心管中,管内加入500 μL RIPA和5 μL PMSF,60 Hz匀浆15 s,12 000 r·min-1离心15 min。离心后的样品吸取上清液至新的离心管中,根据说明书用BCA试剂盒(南京建成生物工程研究所)测定上清液中蛋白浓度。按4∶1的比例混合22 μg蛋白与5×SDS-PAGE loading buffer,99 ℃变性10 min。经10% SDS-PAGE电泳45 min后,将蛋白转移到PVDF膜上,4%脱脂奶粉室温摇床封闭1 h,加一抗孵育。所用的一抗包括:兔抗PCNA(R1306-5, 1∶500稀释)、兔抗Caspase 3(ER1802-42, 1∶500稀释)、兔抗Nrf2(ER1706-41,1∶1 000稀释)、兔抗phospho-Nrf2(ET1608-28,1∶500稀释)、兔抗phospho-NQO1(ET1702-50,1∶500稀释)、兔抗phospho-HO-1(ER1802-73,1∶500稀释)、小鼠抗phospho-β-肌动蛋白(EM21002,1∶10 000稀释,HUABIO, 杭州),在4 ℃孵育过夜。次日室温摇床复温1 h,用TBST(每升含2.45 g Tris、8.77 g NaCl和20% Tween-20)洗膜后,二抗室温摇床孵育(HRP标记鼠二抗,1∶10 000稀释;HRP标记兔二抗,1∶10 000稀释)1 h,用TBST洗膜后,用ECL化学发光液(弗德生物)进行显色。蛋白条带用Image J软件进行灰度分析。
1.7 肝和血清指标采集的全血分离出血清,保存于-20 ℃,依据试剂盒说明书测定血清激素指标(Abbott,Lisnamuck, Ireland),包括谷胱甘肽(glutathione,GSH)、总超氧化物歧化酶(total superoxide dismutase,T-SOD)、总抗氧化能力(total antioxidant capacity,T-AOC)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(CAT)和谷胱甘肽S-转移酶(GSH-ST)、丙二醛(malondialdehyde,MDA)和过氧化氢(hydrogen peroxide,H2O2)。
肝组织与生理盐水按1∶100混合后充分研磨,3 000 r·min-1离心15 min,取上清,-20 ℃保存,用于总胆固醇(total cholesterol,TC)的测定。按照试剂盒说明书进行TC的酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)测定。所用试剂盒购自南京建成生物工程有限公司。
1.8 数据分析数据全部采用“平均值(x)±标准误(sx)”形式表示,所得数据采用SPSS 16.0软件进行单因素方差分析(one-way ANOVA)和Duncan多重比较进行分析,P < 0.05表达差异显著。
2 结果 2.1 不同剂量药物处理后卵巢质量、卵泡数量和体重的变化注射10 mg·kg-1 AE后,母鸡体重降低了11.54%。同时,LYF、SYF、LWF和SWF数量分别上升了32.00%、34.62%、50.00%和54.21%(图 1)。本文选择10 mg·kg-1 AE进行后续试验。
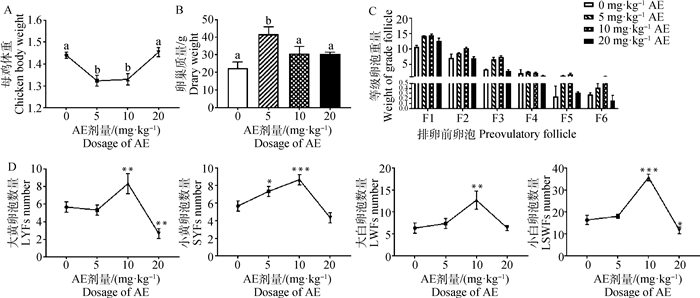
|
A. 体重;B. 卵巢质量;C. 排卵前卵泡质量;D. 大黄卵泡、小黄卵泡、大白卵泡和小白卵泡数量。字母不同表示有显著差异,*.P < 0.05,**.P < 0.01,***.P < 0.001 A. Body weight; B. Ovarian weight; C. Preovulatory follicle weight; D. Number of large yellow, small yellow, large white and small white follicles. Different letters represent significant differences, *. P < 0.05, **.P < 0.01, ***.P < 0.001 图 1 不同剂量AE对衰老蛋鸡体重、卵巢质量和卵泡数量的影响 Fig. 1 Effects of different doses of AE on body weight, ovarian weight and follicle number of aging layers |
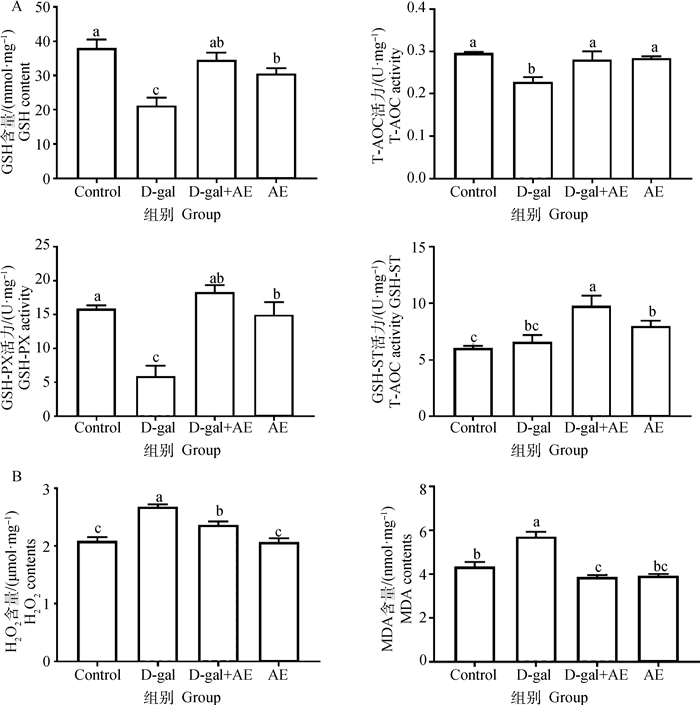
与对照组相比,注射10 mg·kg-1 AE组显著升高了蛋鸡卵泡GSH、T-SOD、T-AOC、GSH-Px、CAT和GSH-ST水平(分别提高了46.73%、25.08%、9.61%、37.44%、18.90%和31.18%)。并且注射10 mg·kg-1 AE可以使蛋鸡卵泡中MDA和H2O2水平分别降低49.41%和72.58%。另外,注射10 mg·kg-1 AE蛋鸡卵泡中E2水平升高了34.14%,同时P4水平提高6.8倍。注射10 mg·kg-1 AE处理还可以显著升高肝组织中TG水平(71.52%)。此外,注射10 mg·kg-1 AE处理后D580蛋鸡卵泡ERα和ERβ表达量显著升高(图 2)。

|
A. 抗氧化能力;B. 氧化指标;C. 血清激素水平和肝TG水平;D. ERs表达水平。*.P < 0.05,**.P < 0.01,***.P < 0.001 A. Antioxidant capacity; B. Oxidation index; C. Serum hormone level and liver TG level; D. The expression level of ERs. *.P < 0.05, **.P < 0.01, ***.P < 0.001 图 2 AE对衰老蛋鸡SWF抗氧化能力和肝三酰甘油合成能力的影响 Fig. 2 Effects of AE on antioxidant capacity of ovary and triglyceride synthesis of liver in aging laying hens |
采用RT-PCR方法检测肝卵黄合成和脂肪酸合成相关基因,如图 3所示,注射10 mg·kg-1 AE可以明显提高蛋鸡肝卵黄合成相关基因(FAS、ACC、ATP、ACYL、SCD)表达水平,但是SREBP基因表达水平明显下降(P < 0.05或P < 0.01)。同时,注射10 mg·kg-1 AE还可以提高卵黄沉积相关基因VTGⅡ、ApoVLDLⅡ、ApoB、PPARα和PPARγ表达水平(P < 0.05或P < 0.01)。
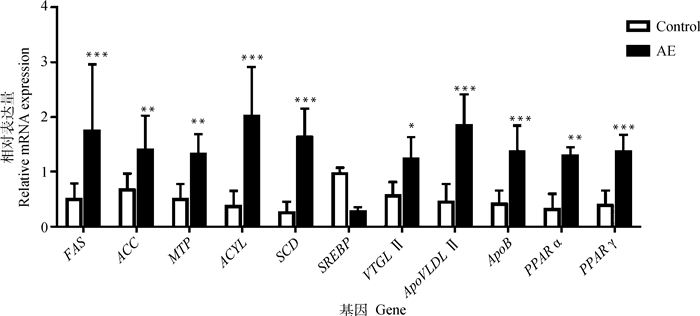
|
β-actin 为内参基因,各组数据均为x±sx(n=9)。*.P < 0.05,**.P < 0.01,***.P < 0.001 β-actin is an internal reference gene, and the data of each group are the mean±standard error (n=9). *.P < 0.05, **.P < 0.01, ***.P < 0.001 图 3 AE对衰老蛋鸡肝卵黄合成和沉积相关基因的影响 Fig. 3 Effects of AE on genes related to yolk synthesis and deposition in liver of aging laying hens |
D-gal(0.1、1.0和10.0 mg·mL-1)体外处理D280蛋鸡SWF。培养72 h后,H&E染色结果显示,对照组SWF形态正常,颗粒细胞排列规则;0.1 mg·mL-1 D-gal处理后,部分颗粒细胞出现排列松散、不规则,卵泡基本维持在原来的形态;1 mg·mL-1 D-gal处理后,大部分颗粒细胞排列松散且不规则,出现核固缩。10 mg·mL-1 D-gal处理后,SWF和颗粒细胞受损严重,几乎所有的颗粒细胞呈现不规则排布,SWF发生凋亡并出现空洞(图 4A)。TUNEL染色显示,对照组只有极少量的细胞出现凋亡现象,D-gal诱导卵泡组织细胞凋亡呈剂量依赖性增多(图 4A)。Western blot结果显示,在D-gal诱导衰老卵泡中,细胞增殖相关蛋白PCNA的表达量显著下调,同时细胞凋亡相关蛋白Caspase3的表达量显著上调,这些变化呈D-gal剂量依赖性(图 4B)。

|
A. 荧光染色,标尺:20 μm;HE染色,标尺:50 μm;B. 体外培养72 h后280日龄蛋鸡小白卵泡组织通过Western blot检测PCNA和Caspase3表达的变化。不同字母表示差异显著(P < 0.05) A. Immunofluorescence staining, scale bar: 20 μm; HE staining, scale bar: 50 μm; B. The expression of PCNA and Caspase3 in 280-day-old laying hens were detected by Western blot after 72 h culture. Different letters indicate significant difference (P < 0.05) 图 4 D-gal诱导卵泡衰老模型的建立 Fig. 4 Establishment of follicular aging model induced by D-gal |
经不同剂量AE对10 mg·mL-1 D-gal体外诱导衰老保护的D280蛋鸡小白卵泡HE染色结果显示,AE对小白卵泡衰老的保护作用呈剂量依赖性增加后下降。与对照组相比,低剂量AE(5 μg·mL-1)组,出现轻微好转,部分颗粒细胞出现排列松散、不规则,卵泡基本维持在原来的形态。在中剂量AE (10 μg·mL-1)组,生长卵泡形态相对正常,颗粒细胞规则排布。高剂量AE(20 μg·mL-1)组,保护效果不如中剂量组,颗粒细胞排列较松散。通过BrdU检测不同剂量AE对10 mg·mL-1 D-gal体外诱导衰老D280蛋鸡SWF细胞凋亡保护的影响,结果显示,与对照组相比,随着AE剂量的加大直至10 μg·mL-1时,小白卵泡中增殖细胞逐渐增多。而20 μg·mL-1的AE处理后,细胞增殖率反而下降(图 5A)。Western blot结果显示,在AE保护D-gal诱导衰老卵泡中,细胞增殖相关蛋白PCNA的表达量随着AE剂量增加至中剂量AE(10 μg·mL-1) 时显著上调,同时细胞凋亡关蛋白Caspase3的表达量显著下调,这些变化在高剂量AE(20 μg·mL-1)时反而不如中剂量组显著(图 5B)。
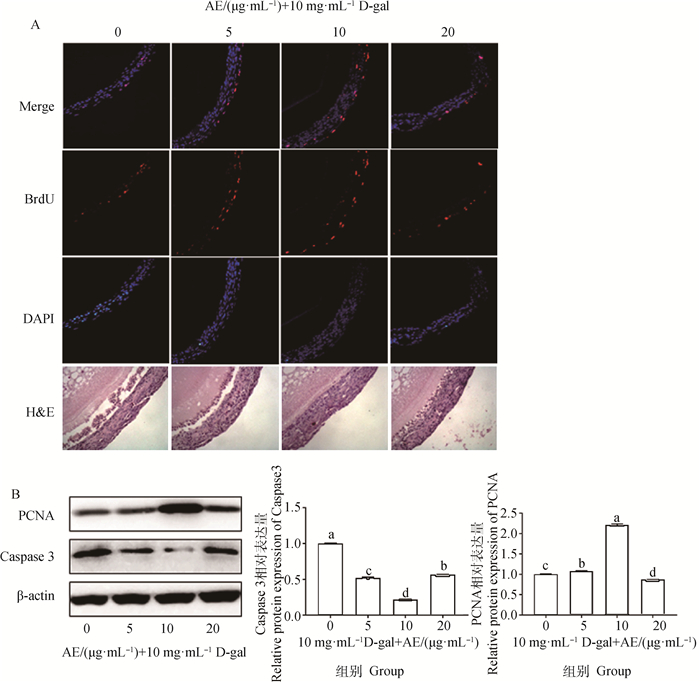
|
A. 荧光染色,标尺:20 μm;HE染色,标尺:50 μm;B. 体外培养72 h后280日龄蛋鸡小白卵泡组织通过Western blot检测PCNA和Caspase3的表达变化。不同字母表示差异显著(P < 0.05) A. Immunofluorescence staining, scale bar: 20 μm; HE staining, scale bar: 50 μm; B. Expression of PCNA and Caspase3 in 280-day-old laying hens were detected by Western blot after 72 h culture. Different letters indicate significant difference (P < 0.05) 图 5 不同剂量AE对D-gal诱导小白卵泡衰老的保护作用 Fig. 5 Protective effects of different doses of AE on aging of small white follicles induced by D-gal |
选取10 mg·mL-1 D-gal和10 μg·mL-1AE进行AE缓解卵泡氧化应激损伤对比试验。HE染色结果显示,对照组卵泡组织内生长卵泡形态正常,颗粒细胞规则排布。D-gal组SWF和颗粒细胞受损严重,几乎所有的颗粒细胞呈现不规则排布,SWF发生凋亡并出现空洞。而在D-gal+AE组,这一现象得到了缓解,仅有部分颗粒细胞出现排列松散、不规则。AE组生长卵泡形态正常,颗粒细胞规则排布,与对照组相比有促进作用。通过BrdU检测细胞凋亡或增殖的影响,结果显示,D-gal组只有极少量细胞增殖现象。在D-gal+AE组,小白卵泡中增殖细胞显著增多,甚至超过对照组。AE组细胞增殖明显,超过对照组。说明AE能缓解卵泡氧化应激损伤(图 6A)。Western blot结果显示,D-gal组PCNA的表达量显著下调,同时细胞凋亡相关蛋白Caspase3的表达量显著上调,而在D-gal+AE组这一现象缓解,且AE组与对照组相比有促进作用,细胞增殖相关蛋白PCNA的表达量显著上调(图 6B)。

|
A. 荧光染色,标尺:20 μm;HE染色,标尺:50 μm;B. 体外培养72 h后280日龄蛋鸡小白卵泡组织通过Western blot检测PCNA和Caspase3的表达的变化。各组数据均为x±sx,不同字母表示差异显著(P < 0.05) A. Immunofluorescence staining, scale bar: 20 μm; HE staining, scale bar: 50 μm; B. Expression of PCNA and Caspase3 in 280-day-old laying hens were detected by Western blot after 72 h culture. Different letters indicate significant difference (P < 0.05) 图 6 AE对卵泡氧化应激损伤的缓解作用 Fig. 6 Alleviating effect of AE on ovarian oxidative stress damage |
AE处理可以明显提高蛋鸡卵泡体外培养中GSH-Px、T-AOC、GSH、GSH-ST水平,并且AE处理可降低卵泡中MDA和H2O2水平(图 7)。
|
A. 抗氧化能力;B. 氧化指标。各组数据均为x±sx,不同字母表示差异显著(P < 0.05) A. Antioxidant capacity; B. Oxidation index. Different letters indicate significant difference (P < 0.05) 图 7 AE对衰老蛋鸡体外卵泡抗氧化能力的影响 Fig. 7 Effect of AE on antioxidant capacity of ovary in aging layers in vitro |
结果显示,与对照组相比,D-gal诱导衰老卵泡pNrf2/Nrf2、HO-1和NQO1的表达量显著下调,AE单独处理组和D-gal与AE联合处理组Nrf2、pNrf2和HO-1的表达水平与对照组无显著差异(图 8A)。RT-PCR结果显示,D-gal处理显著下调Nrf2和HO-1基因的表达水平,同时添加AE处理可有效缓解Nrf2和HO-1基因的表达水平的降低。与对照组相比,单独使用AE处理能显著上调HO-1基因的表达水平,D-gal与AE联合处理显著上调Nrf2基因的表达水平(图 8B)。对Nrf2/HO-1下游几种抗氧化基因表达水平的检测结果显示,与对照组相比,Gclm、Gclx、Txn和Gpxr基因的转录水平显著下调,同时添加AE处理不同程度的缓解这些基因转录水平的下调;Gclm、Gclx、Txn和Gpxr基因在AE单独处理组以及D-gal和AE联合处理组SWF中的表达水平显著高于对照组(图 8B)。D-gal下调SWF中Nrf2/HO-1通路活性,添加AE处理,Nrf2/HO-1通路活性得到有效缓解。

|
A.Western blot; B.RT-PCR。不同字母代表有显著性差异(P < 0.05) A.Western blot; B.RT-PCR. Different letters indicate significant difference (P < 0.05) 图 8 AE对Nrf2/HO-1通路活性及相关基因表达的影响 Fig. 8 Effects of AE on Nrf2/HO-1 pathway |
为进一步探究AE对D-gal诱导衰老卵泡氧化应激的缓解作用是否通过Nrf2/HO-1信号通路的激活实现,本试验选取ML385和DMF分别作为Nrf2/HO-1信号通路的阻断剂和激活剂,检测激活和抑制Nrf2/HO-1信号通路后,AE是否仍发挥抗氧化应激的作用。Western blot结果显示,3 μmol·L-1 DMF单独处理72 h后,SWF中pNrf2/Nrf2和HO-1的表达量显著高于对照组;与对照组相比,D-gal单独处理显著降低HO-1和pNrf2/Nrf2的表达水平;D-gal与DMF联合处理可使SWF中pNrf2/Nrf2的表达量恢复至对照组水平;D-gal与AE联合处理组SWF中HO-1的表达量与对照组均无显著差异(图 9)。单独使用ML385(6 μmol·L-1)处理72 h后,SWF中pNrf2/Nrf2和HO-1的表达量显著高于对照组;与对照组相比,D-gal单独处理显著降低pNrf2/Nrf2和HO-1的表达水平;D-gal与DMF联合处理,使SWF中pNrf2/Nrf2的表达量恢复至对照组水平;D-gal与AE联合处理组SWF中HO-1的表达量与对照组均无显著差异(图 9)。

|
不同字母代表有显著性差异(P < 0.05) Different letters indicate significant difference (P < 0.05) 图 9 Nrf2激活剂和阻断剂对芦荟大黄素对D-gal诱导衰老卵泡氧化应激缓解作用的变化 Fig. 9 Effects of Nrf2 activators and inhibitors on the alleviating effect of AE on oxidative stress on aging follicles induced by D-gal |
母鸡在达到性成熟后,卵巢中存在大量生长缓慢的直径在2~6 mm的卵泡以维持产蛋进程,机体每天会筛选出1个直径6~8 mm卵泡进入快速发育阶段。在等级前卵泡中,肝合成大量的卵黄蛋白原(vitellogenin, VTG)和载脂蛋白(apolipoprotein,APO),经血液循环运送至卵巢,在卵泡中沉积。越来越多的证据表明,随着年龄的增长,雌性小鼠和人类在卵泡储备和卵母细胞质量方面都有一定程度的下降[6]。卵巢衰老的主要原因是ROS在卵巢中逐渐积累引起的氧化应激[7]。在衰老过程中,ROS发生积聚,同时,机体内抗氧化物质水平降低,氧化还原水平失衡,最终导致器官功能失常[8-9]。6和12月龄大鼠小脑组织中SOD、CAT和GSH水平显著高于18月龄大鼠[1]。卵巢衰老影响了母禽的商业价值。然而,关于蛋鸡卵巢衰老引起的卵泡质量下降机制的研究很少。阐明卵巢内卵泡衰老和缓解氧化应激的机制可延长母禽产蛋周期,从而提高产蛋性能。
蛋鸡产蛋量在500日龄后急剧下降。因此,了解老化过程中蛋鸡产蛋性能下降的机理,能够采取有效措施缓解卵巢衰老,从而提升母鸡的经济价值。越来越多的证据表明,补充食用抗氧化剂是减轻卵泡氧化应激的有效措施[10]。芦荟大黄素是一种蒽醌类多酚化合物,存在于一些传统药用植物中,如决明子、大黄和何首乌。芦荟大黄素具有多种药理作用[6]。芦荟大黄素可能是大黄和决明子的肝毒性成分之一[11-13]。作为植物中有效的抗氧化剂之一,芦荟大黄素被广泛用于防止氧化应激介导的组织损伤。先前的研究已经证实芦荟大黄素通过上调p53的表达、刺激p21/WAF1、下调calpain-2(CAPN2)和泛素蛋白连接酶E3A(UBE3A)来促进人肝癌细胞系的抗增殖和凋亡[14-15]。然而,芦荟大黄素在蛋鸡卵巢衰老,特别是卵泡衰老中的抗氧化作用尚未明确阐明。在本研究中,腹腔注射AE显著提高了D580蛋鸡卵泡中GSH水平、T-SOD活性、GSH-Px活性和T-AOC活性,且MDA和H2O2含量显著降低,这说明AE可以提高衰老蛋鸡卵泡抗氧化水平、血清E2水平、肝TC水平以及参与蛋黄前体合成的关键基因转录。
D-gal诱导的卵巢衰老模型显示,卵巢形态结构异常,显著下调细胞增殖相关蛋白PCNA的表达量,同时显著上调细胞凋亡关蛋白Caspase3的表达量[16]。在D-gal诱导衰老模型中,通常伴随着因抗氧化酶活性降低和氧化产物增多引起的氧化应激[17]。这说明D-gal诱导的衰老模型与氧化应激模型相关,因为抗氧化酶活性降低与氧化剂水平升高之间存在明确的关系[17]。在本研究中,观察到在D-gal诱导的衰老卵泡中,与对照组相比,GSH、T-AOC的含量以及T-SOD、CAT和GSH-Px的活性显著降低,而MDA和H2O2的水平显著提高。同时,D-gal诱导衰老组织中,卵泡颗粒细胞出现形态损伤,这些现象在添加AE处理后得到缓解。本研究发现,D-gal诱导卵泡组织细胞凋亡率升高、细胞增殖率降低,同时添加AE处理,显著缓解这些现象。通过体外试验研究AE缓解卵泡氧化应激损伤发现,AE能缓解D-gal造成的卵泡结构异常,同时可以使细胞增殖相关蛋白PCNA的表达量显著上调,细胞凋亡关蛋白Caspase3的表达量显著下调。
Nrf2是一种氧化还原敏感的转录因子,对氧化应激具有细胞保护作用。CAT、SOD和HO-1的表达以及GSH的合成均受Nrf2调节[18-19]。Nrf2/HO-1途径的激活诱导小鼠肾中GSH、CAT和SOD水平升高[20-21]。先前的研究表明,Nrf2表达及其靶基因表现出年龄依赖性下降[22]。在本研究中,作者检测自然衰老母鸡卵泡中相关蛋白和基因的表达,研究了衰老与Nrf2/HO-1通路活性的影响。然后研究了芦荟大黄素对D-gal诱导的衰老卵泡氧化应激的保护作用。此外,还证实了芦荟大黄素对自然衰老卵泡氧化应激的潜在抑制作用。本研究表明,衰老过程中卵泡中Nrf2/HO-1通路的活性显著降低。
Nrf2/HO-1途径的激活可上调许多抗氧化基因的表达,并减轻组织中的氧化应激[23]。Su等[24]证明,Nrf2诱导HO-1需要转录阻遏物BACH1失活。AE对氧化应激的保护作用是通过激活Nrf2/HO-1或AKT/mTOR/MAPK信号途径实现的[25-27]。Abdellatef等[28]报道,AE通过上调Nrf2介导的HO-1抑制TNFα诱导的信号通路的激活内皮细胞中的表达。在本研究中,D-gal处理显著降低了Nrf2、pNrf2、HO-1的表达,同时补充AE缓解了这种下降的趋势,与对照组相比,单独使用AE显著上调了Nrf2、HO-1和pNrf2的表达。为了阐明AE与氧化应激相关的保护作用机制,分别添加Nrf2的激活剂DMF和Nrf2的抑制剂,这些结果表明,AE对衰老卵泡氧化应激的保护作用与DMF相似,而ML385处理消除了AE对衰老卵泡氧化应激的保护作用。
AE提高D580母鸡卵黄沉积能力,并通过激活Nrf2/HO-1途径提高了D580母鸡卵泡的体外抗氧化能力,并维持了细胞增殖和凋亡之间的动态平衡。
综上所述,AE能够缓解衰老母鸡产蛋性能下降,提高蛋鸡的经济效益,为提高家禽的产蛋性能提供理论依据,为禽蛋的高质量生产具有实际意义。同时,采用中药解决产蛋量下降问题的新思路为日后研究蛋鸡的生产性能、禽蛋的产出等开拓了新方法。
4 结论AE可以提升血清E2水平和卵黄递质合成中的关键基因(VTGⅡ、ApoB、ApoVLDLⅡ、FAS、ACC、MTP、ACLY、SCD、MALⅠ和PPARγ),从而提高蛋黄前体的合成能力。AE通过激活衰老卵泡Nrf2/HO-1信号通路,提高衰老蛋鸡卵泡的抗氧化能力,发挥其促进细胞增殖和抑制细胞凋亡的作用,从而延缓蛋鸡卵巢衰退。
| [1] |
YAO J W, MA Y F, ZHOU S, et al. Metformin prevents follicular atresia in aging laying chickens through activation of PI3K/AKT and calcium signaling pathways[J]. Oxid Med Cell Longev, 2020, 2020: 3648040. |
| [2] |
MA Y F, YAO J W, ZHOU S, et al. Enhancing effect of FSH on follicular development through yolk formation and deposition in the low-yield laying chickens[J]. Theriogenology, 2020, 157: 418-430. DOI:10.1016/j.theriogenology.2020.07.012 |
| [3] |
LIU X T, LIN X, MI Y L, et al. Age-related changes of yolk precursor formation in the liver of laying hens[J]. J Zhejiang Univ Sci B, 2018, 19(5): 390-399. DOI:10.1631/jzus.B1700054 |
| [4] |
刘豪杰, 陈雪蕾. 芦荟大黄素对胃癌SGC-7901细胞Cav-1/PTEN/PI3K/PKB信号通路及侵袭、转移的影响[J]. 湖南中医药大学学报, 2021, 41(6): 827-831. LIU H J, CHEN X L. Effects of aloe emodin on Cav-1/PTEN/PI3K/PKB signaling pathway, invasion and metastasis of gastric cancer sgc-7901 cells[J]. Journal of Human University of Chinese Medicine, 2021, 41(6): 827-831. DOI:10.3969/j.issn.1674-070X.2021.06.002 (in Chinese) |
| [5] |
王瑞婕, 杨勇, 白婷. 大黄素甲醚对酒精性肝损伤中SIRT1-AMPK通路的影响[J]. 中国药理学通报, 2020, 36(11): 1557-1562. WANG R J, YANG Y, BAI T. Effect of physcion on SIRT1-AMPK pathway in alcoholic liver injury[J]. Chinese Pharmacological Bulletin, 2020, 36(11): 1557-1562. DOI:10.3969/j.issn.1001-1978.2020.11.015 (in Chinese) |
| [6] |
DEVINE P J, PERREAULT S D, LUDERER U. Roles of reactive oxygen species and antioxidants in ovarian toxicity[J]. Biol Reprod, 2012, 86(2): 27. |
| [7] |
SHEN M, JIANG Y, GUAN Z Q, et al. Protective mechanism of FSH against oxidative damage in mouse ovarian granulosa cells by repressing autophagy[J]. Autophagy, 2017, 13(8): 1364-1385. DOI:10.1080/15548627.2017.1327941 |
| [8] |
BEN-MEIR A, BURSTEIN E, BORREGO-ALVAREZ A, et al. Coenzyme Q10 restores oocyte mitochondrial function and fertility during reproductive aging[J]. Aging Cell, 2015, 14(5): 887-895. DOI:10.1111/acel.12368 |
| [9] |
徐磊, 彭玥晗, 许金蔓, 等. 去乙酰化酶3对线粒体功能和猪生长发育影响的研究进展[J]. 中国畜牧兽医, 2019, 46(9): 2560-2566. XU L, PENG Y H, XU J M, et al. Advances in studies on the effects of Sirt3 on mitochondrial function and porcine growth[J]. China Animal Husbandry and Veterinary Medicine, 2019, 46(9): 2560-2566. (in Chinese) |
| [10] |
BANU S K, STANLEY J A, SIVAKUMAR K K, et al. Resveratrol protects the ovary against chromium-toxicity by enhancing endogenous antioxidant enzymes and inhibiting metabolic clearance of estradiol[J]. Toxicol Appl Pharmacol, 2016, 303: 65-78. DOI:10.1016/j.taap.2016.04.016 |
| [11] |
李彦桥. 基于MRP-氧化应激的芦荟大黄素对老年小鼠肝肾毒性机制研究[D]. 成都: 成都中医药大学, 2019. LI Y Q. Hepatotoxicity and nephrotoxicity mechanism of aloe-emodin basedon MRP-oxidative stress in aging mice[D]. Chengdu: Chengdu University of Ttaditional Chinese Medicine, 2019. (in Chinese) |
| [12] |
GADAKA M A, IBRAHIM M, MUAZU A B. Effect of aqueous-methanol leave extract of Cassia occidentalis on CCl4 induced hepatotoxic rabbits[J]. J Nat Sci Res, 2021, 12(10): 49-53. |
| [13] |
王伽伯, 马永刚, 张萍, 等. 炮制对大黄化学成分和肝肾毒性的影响及其典型相关分析[J]. 药学学报, 2009, 44(8): 885-890. WANG J B, MA Y G, ZHANG P, et al. Effect of processing on the chemical contents and hepatic and renal toxicity of rhubarb studied by canonical correlation analysis[J]. Acta Pharmaceutica Sinica, 2009, 44(8): 885-890. DOI:10.3321/j.issn:0513-4870.2009.08.011 (in Chinese) |
| [14] |
KUO P L, LIN T C, LIN C C. The antiproliferative activity of aloe-emodin is through p53-dependent and p21-dependent apoptotic pathway in human hepatoma cell lines[J]. Life Sci, 2002, 71(16): 1879-1892. DOI:10.1016/S0024-3205(02)01900-8 |
| [15] |
JEON W, JEON Y K, NAM M J. Apoptosis by aloe-emodin is mediated through down-regulation of calpain-2 and ubiquitin-protein ligase E3A in human hepatoma Huh-7 cells[J]. Cell Biol Int, 2012, 36(2): 163-167. DOI:10.1042/CBI20100723 |
| [16] |
LIU X T, LIN X, ZHANG S Y, et al. Lycopene ameliorates oxidative stress in the aging chicken ovary via activation of Nrf2/HO-1 pathway[J]. Aging, 2018, 10(8): 2016-2036. DOI:10.18632/aging.101526 |
| [17] |
LU J, ZHENG Y L, WU D M, et al. Ursolic acid ameliorates cognition deficits and attenuates oxidative damage in the brain of senescent mice induced by D-galactose[J]. Biochem Pharmacol, 2007, 74(7): 1078-1090. DOI:10.1016/j.bcp.2007.07.007 |
| [18] |
DAS M, DEVI K P. Dihydroactinidiolide regulates Nrf2/HO-1 expression and inhibits caspase-3/Bax pathway to protect SH-SY5Y human neuroblastoma cells from oxidative stress induced neuronal apoptosis[J]. NeuroToxicology, 2021, 84: 53-63. DOI:10.1016/j.neuro.2021.02.006 |
| [19] |
GUO H, WANG Y, JIA W X, et al. MiR-133a-3p relieves the oxidative stress induced trophoblast cell apoptosis through the BACH1/Nrf2/HO-1 signaling pathway[J]. Physiol Res, 2021, 70: 67-78. |
| [20] |
KIM E N, LIM J H, KIM M Y, et al. Resveratrol, an Nrf2 activator, ameliorates aging-related progressive renal injury[J]. Aging, 2018, 10(1): 83-99. DOI:10.18632/aging.101361 |
| [21] |
PARK S Y, JIN M L, KO M J, et al. Anti-neuroinflammatory effect of emodin in LPS-stimulated microglia: involvement of AMPK/Nrf2 activation[J]. Neurochem Res, 2016, 41(11): 2981-2992. DOI:10.1007/s11064-016-2018-6 |
| [22] |
ZHANG H Q, DAVIES K J A, FORMAN H J. Oxidative stress response and Nrf2 signaling in aging[J]. Free Radic Biol Med, 2015, 88: 314-336. DOI:10.1016/j.freeradbiomed.2015.05.036 |
| [23] |
LEE W J, LI W Y, LEE S W, et al. Anti-inflammatory and antioxidant effects of Soroseris hirsuta extract by regulating iNOS/NF-κB and NRF2/HO-1 pathways in murine macrophage RAW 264. 7 cells[J]. Appl Sci, 2021, 11(10): 4711. DOI:10.3390/app11104711 |
| [24] |
SU D, WANG X W, MA Y, et al. Nrf2-induced miR-23a-27a-24-2 cluster modulates damage repair of intestinal mucosa by targeting the Bach1/HO-1 axis in inflammatory bowel diseases[J]. Free Radic Biol Med, 2021, 163: 1-9. DOI:10.1016/j.freeradbiomed.2020.11.006 |
| [25] |
GAO Z M, SUI J D, FAN R, et al. Emodin protects against acute pancreatitis-associated lung injury by inhibiting NLPR3 inflammasome activation via Nrf2/HO-1 signaling[J]. Drug Des Devel Ther, 2020, 14: 1971-1982. DOI:10.2147/DDDT.S247103 |
| [26] |
XIAN M H, CAI J L, ZHENG K N, et al. Aloe-emodin prevents nerve injury and neuroinflammation caused by ischemic stroke via the PI3K/AKT/mTOR and NF-κB pathway[J]. Food Funct, 2021, 12(17): 8056-8067. DOI:10.1039/D1FO01144H |
| [27] |
申凤鸽, 葛春坡, 袁鹏. 芦荟大黄素通过调节Akt/mTOR和MAPK信号诱导非小细胞肺癌细胞自噬和凋亡[J]. 解剖学杂志, 2021, 44(S1): 197-197. SHEN F G, GE C P, YUAN P. Aloe emodin induces autophagy and apoptosis of non-small cell lung cancer cells by regulating Akt/mTOR and MAPK signals[J]. Chinese Journal of Anatomy, 2021, 44(S1): 197-197. (in Chinese) |
| [28] |
ABDELLATEF A A, FATHY M, MOHAMMED A E S I, et al. Inhibition of cell-intrinsic NF-κB activity and metastatic abilities of breast cancer by aloe-emodin and emodic-acid isolated from Asphodelus microcarpus[J]. J Nat Med, 2021, 75(4): 840-853. DOI:10.1007/s11418-021-01526-w |
(编辑 白永平)



