2. 黑龙江省普通高等学校 动物普通疾病防治重点实验室,哈尔滨 150030
2. Key Laboratory of Animal Disease Control, College of General Higher Education, Heilongjiang Province, Harbin 150030, China
奶牛蹄叶炎是一种较为严重且多发的肢蹄病,患病奶牛常常出现蹄部疼痛,蹄壳变形,以及多种并发症[1],造成奶牛的繁殖能力和泌乳能力的大幅度下降。由于患有蹄叶炎奶牛的淘汰率高,因此造成了巨大的损失[2-3]。本文通过对机体主要的能量代谢器官(肝和肌肉)在患急性蹄叶炎的奶牛中能量代谢和葡萄糖转运的变化,来反应急性蹄叶炎奶牛体内的能量代谢和葡萄糖转运的变化,为之后的奶牛蹄叶炎的研究提供一定的试验基础。
三磷酸腺苷激酶(5′-adenosine monophosphate-activated protein kinase,AMPK)是一种高度保守的调节细胞代谢状态的激酶[4],通过调节AMP/ATP的比值来调节机体能量代谢,当在细胞处于低能量电荷的状态下AMPK被高AMP/ATP比值激活时[5-6],此时该激酶的作用是降低消耗ATP的合成代谢途径的活性,并增加产生ATP的分解代谢途径的活性。根据组织的不同,在不同的生理情况都有可能激活AMPK,例如低血糖、组织局部缺血、热休克和剧烈运动[7]。虽然AMPK的常见激活途径是在剧烈运动的诱导下在骨骼肌中进行的,但该激酶仍然在许多其他组织(如心、脂肪组织、肝)的代谢调节中起着十分关键作用[8-9]。
葡萄糖转运蛋白-1(glucose transporter-1,GLUT-1)是一种非胰岛素介导的葡萄糖转运蛋白,主要负责大脑、红细胞、内皮细胞和皮肤角质形成细胞等组织中的基础葡萄糖摄取[10-11]。葡萄糖转运蛋白-4(glucose transporter-4,GLUT-4)仅在胰岛素敏感的组织中表达[12]。GLUT-4蛋白在基础状态下主要定位于细胞器内,在大鼠和人的心、骨骼肌和脂肪组织等组织中表达,受胰岛素刺激后被转运至细胞膜,发挥跨膜转运葡萄糖的功能[13]。胰岛素通过刺激周围组织特别是骨骼肌和脂肪组织中的葡萄糖摄取和糖原积累,来防止进食后血糖浓度过高,当GLUT-4蛋白易位或功能受损时,就容易发生胰岛素抵抗[14]。
本研究选用机体的高代谢组织肝和骨骼肌,通过检测AMPK、p-AMPK、GLUT蛋白和基因以及其他相关基因的表达来探究奶牛急性蹄叶炎对机体能量代谢的影响。
1 材料与方法 1.1 试验动物从同一奶牛场购进12头体格大小相近非妊娠期的中国荷斯坦母牛,年龄18~20月龄(20.67±3.01),体重355~403 kg(379.7±19.77 kg),参照Sprecher等[15]的制定体况评分标准,评分2.7~3.3(3.0±0.23),无过往病史。每头母牛在试验开始前进行蹄部检查和跛行评分[15]确保奶牛蹄部健康无跛行,在正式试验前饲喂30 d饲草,保证奶牛自由采食,每天对奶牛进行牵溜使奶牛适应生存环境和试验流程,减少应激[16]。
将12头奶牛随机分为两组(n=6),分别为试验组(OF组)和对照组(CON组),OF组灌服大量低聚果糖,剂量为17 g·kg-1体重,溶于2 L·100 kg-1体重的温水中,经瘤胃导管一次性灌服。在之前3 d每天通过瘤胃导管灌服5%剂量的低聚果糖作为过渡期。CON组以同样的方式给予等体积的温水[17-18]。在低聚果糖灌服后的72 h,将奶牛安乐死,取肝和肌肉组织。
为保证奶牛的动物福利在低聚果糖灌服后的18和24 h给与补液[17]。
1.2 组织样本的采集和处理在低聚果糖灌服后的72 h,将奶牛麻醉后,用活检钳夹取适量的肝组织;直接切取足量的臀后部肌肉,用无菌的PBS清洗去血迹,切碎后分装到冻存管中,放入液氮中暂时保存,待采样结束后放入-80 ℃冰箱中长期保存,备用。
1.3 检测指标及方法用Western blot的方法分别检测肝和肌肉的AMPK、P-AMPK、GLUT-1、GLUT-4蛋白表达情况。用实时荧光定量PCR检测肝和肌肉组织中AMPK、GLUT-1、GLUT-4、PPAR-γ、PEPCK、PGC1-α基因表达情况。引物序列见表 1。
|
|
表 1 引物序列 Table 1 The primer sequences |
JTFSTPRP-48组织研磨机(上海净信实业发展有限公司)、Tanon5200全自动化学发光成像分析系统(上海天能科技有限公司)、C1000 TouchTM PCR仪(美国伯乐公司)、NO-ONE AZY1708063超微量核酸蛋白测定仪(美国Gene公司)、Light Cycler 480Ⅱ实时荧光定量PCR仪(德国罗氏诊断仪器有限公司)。
AMPK、P-AMPK抗体购自美国CST公司。GLUT-1、CLUT-4抗体购自美国Novers公司。引物的设计与合成由上海生物工程股份有限公司完成。
1.5 数据统计与分析用Spss22.0进行数据处理,采用单因素的方差分析进行数据统计,用GraphPad Prism 5.0软件绘制统计图。
2 结果 2.1 动物表现在试验过程中,所有CON组的奶牛均表现正常。低聚果糖灌服之后,OF组的奶牛最早在6 h开始出现腹泻,同时出现跛行,随后其他试验牛陆续开始出现不同程度的跛行,通过跛行评分(表 2)[15]断定试验组的奶牛有明显的跛行,并伴有腹泻,体温、蹄温升高,指(趾)动脉亢进,瘤胃蠕动减缓。依据奶牛的跛行情况和临床症状判断为奶牛急性蹄叶炎疾病模型建立成功。在试验过程中所有奶牛均以人道主义的方式对待。
|
|
表 2 跛行评分表[15] Table 2 Lameness score |
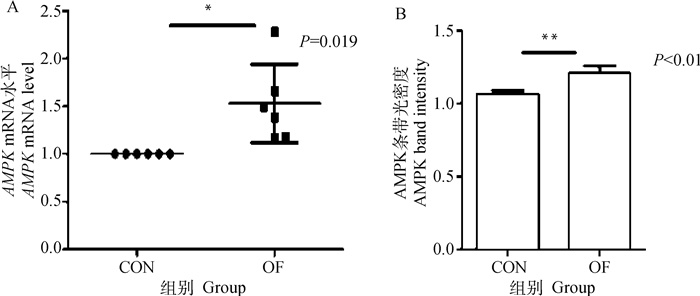
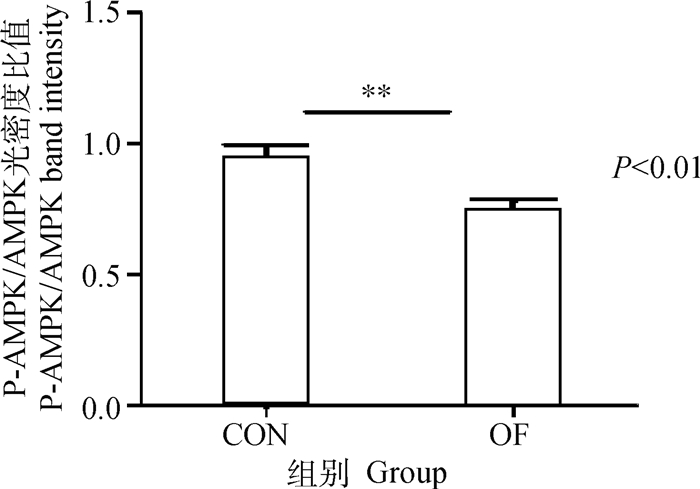
与CON组相比OF组奶牛肝组织中AMPK基因和蛋白的表达量显著增加(图 1A、B)(P < 0.05, P < 0.01)。但OF组奶牛肝组织中的P-AMPK/AMPK的比值极显著下降(P < 0.01)(图 2)。
|
A. mRNA表达水平;B.蛋白表达水平。与CON组相比,*.P < 0.05;* *.P < 0.01, 下图同 A. mRNA expression; B. Protein expression. Compared with CON group, *. P < 0.05; * *. P < 0.01, the same as below 图 1 肝AMPK mRNA和蛋白表达水平变化 Fig. 1 Changes in AMPK mRNA and protein expression in liver |
|
图 2 肝P-AMPK/AMPK比值 Fig. 2 Ratio of P-AMPK/AMPK in liver |
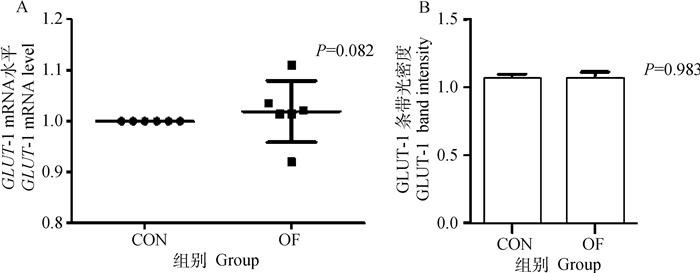
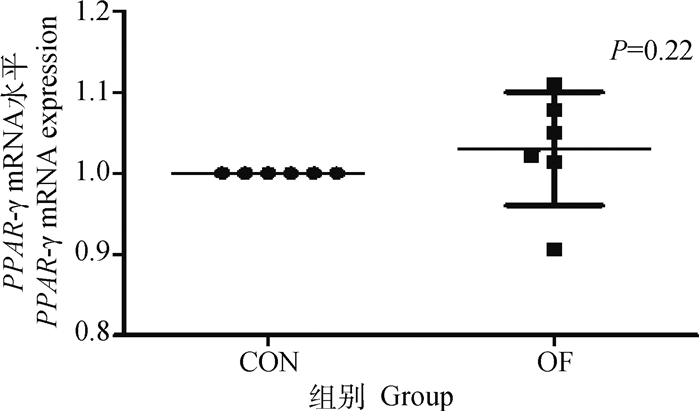
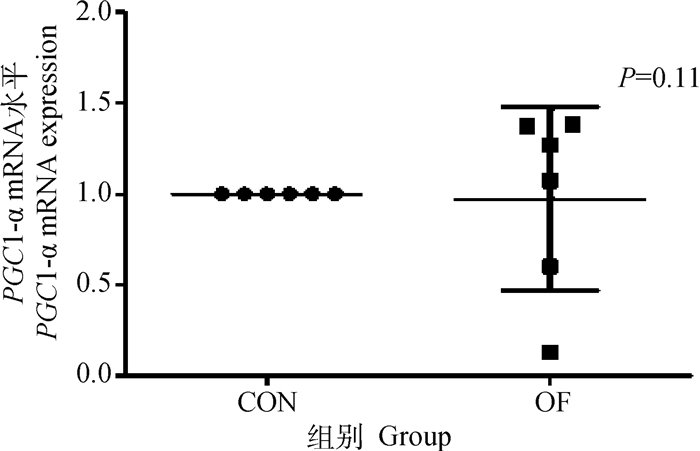
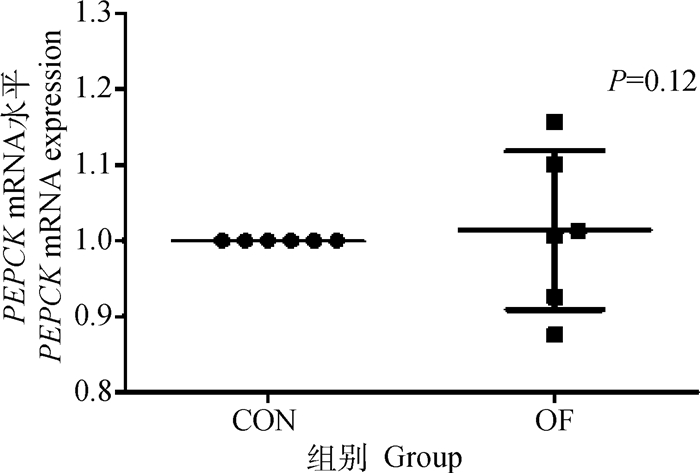
OF组奶牛肝组织中GLUT-1基因和蛋白的表达量与CON组相比无显著变化(P>0.05)(图 3A、B)。同时OF组奶牛肝组织中PPAR-γ基因,PGC1-α基因和PEPCK基因的表达量无显著变化(P>0.05)(图 4~6)。
|
A. mRNA表达水平;B.蛋白表达水平 A. mRNA expression; B. Protein expression 图 3 肝GLUT-1 mRNA和蛋白表达水平变化 Fig. 3 Changes in GLUT-1 mRNA and protein expression in liver |
|
图 4 肝PPAR-γ mRNA表达水平变化 Fig. 4 Changes in PPAR-γ mRNA expression in liver |
|
图 5 肝PGC1-α mRNA表达水平变化 Fig. 5 Changes in PGC1-α mRNA expression in liver |
|
图 6 肝PEPCK mRNA表达水平变化 Fig. 6 Changes in PEPCK mRNA expression in liver |
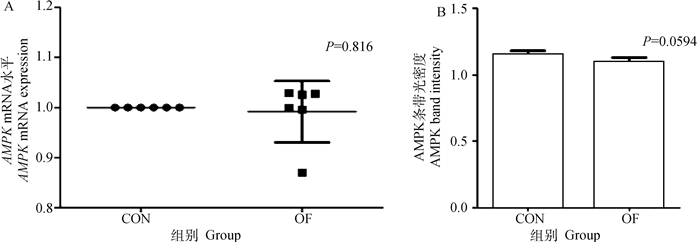
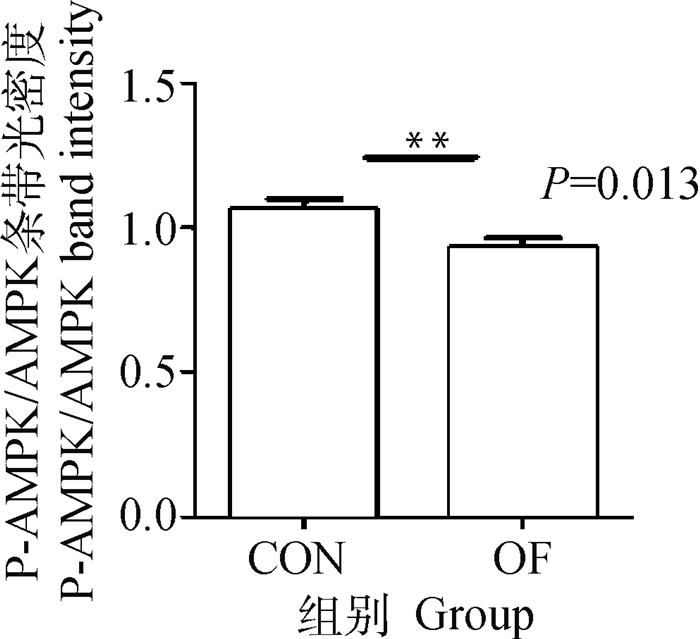
与CON组相比,OF组奶牛肌肉的AMPK基因和蛋白的表达量无显著变化(P>0.05)(图 7A、B)。但OF组奶牛的肌肉组织P-AMPK/AMPK比值显著下降(P < 0.05)(图 8)。这表明奶牛急性蹄叶炎模型中肌肉组织的AMPK的磷酸化被抑制。
|
A. mRNA表达水平;B.蛋白表达水平 A. mRNA expression; B. Protein expression 图 7 肌肉AMPK mRNA和蛋白表达水平变化 Fig. 7 Changes in AMPK mRNA and protein expression in muscle |
|
图 8 肌肉P-AMPK/AMPK比值 Fig. 8 Ratio of P-AMPK/AMPK in muscle |
与CON组相比,OF组奶牛的肌肉组织中GLUT-4的蛋白表达量显著下降,且差异极显著,这与GLUT-4基因的变化相符合(P < 0.01)(图 9A、B)。这表明奶牛急性蹄叶炎过程中肌肉组织葡萄糖的转运和利用被抑制。

|
A. mRNA表达水平;B.蛋白表达水平 A. mRNA expression; B. Protein expression 图 9 肌肉GLUT-4 mRNA和蛋白表达水平变化 Fig. 9 Changes in GLUT-4 mRNA expression and protein expression in muscle |
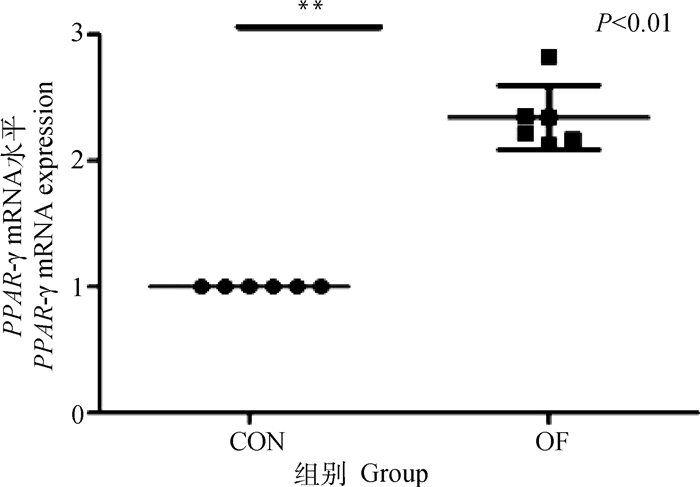
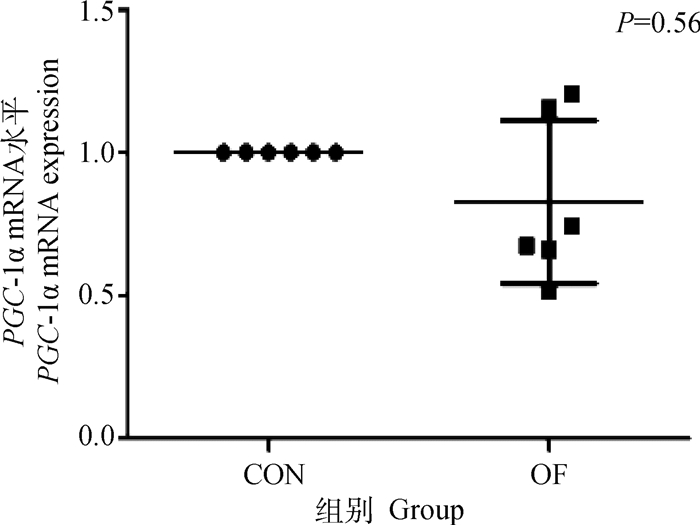
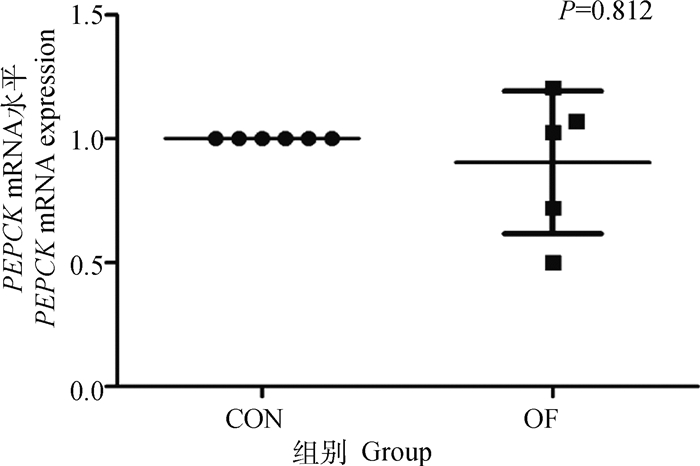
结果表明,OF组奶牛肌肉组织的PPAR-γ基因的表达量极显著升高(P < 0.01)(图 10)。这可能表明奶牛急性蹄叶炎模型肌肉组织ATP消耗迅速增加。OF组奶牛肌肉的PGC1-α mRNA表达量无显著的变化(P>0.05),但PEPCK mRNA表达量极显著升高(P < 0.01)(图 11、12)。
|
图 10 肌肉PPAR-γ mRNA表达水平变化 Fig. 10 Changes in PPAR-γ mRNA expression in muscle |
|
图 11 肌肉PGC1-α mRNA表达水平变化 Fig. 11 Changes in PGC1-α mRNA expression in muscle |
|
图 12 肌肉PEPCK mRNA表达水平变化 Fig. 12 Changes in PEPCK mRNA expression in muscle |
奶牛蹄叶炎是指奶牛蹄真皮的弥散性、无败性炎症,本病最常侵害前肢的内侧指和后肢的外侧趾,其他指(趾)也有发病,高产奶牛的发病率更高[19]。目前,关于蹄叶炎的病因和致病机理还没有得到很好的解释。较多的研究认为蹄叶炎是动物机体代谢紊乱的局部表现,在马和奶牛上展开的研究结果均认为,蹄叶炎的发生与组织的能量代谢衰竭有关[20]。本试验在奶牛急性蹄叶炎的疾病模型下对高能代谢组织(肝和肌肉)的相关代谢指标和葡萄糖转运的情况进行研究,探究患急性蹄叶炎奶牛的能量代谢和葡萄糖转运情况。
AMPK(AMP-activated protein kinases)作为能量传感器能实时监测AMP和ATP的浓度,调节机体的能量代谢[21]。AMPK作为重要的能量调节枢纽已被广泛研究。有研究发现,AMPK参与维持细胞极性,AMPK还可以调节内源性抗氧化应激基因的表达,具有一定的抗氧化应激的功能[22-23]。此外,AMPK与自噬以及组织中的高炎症反应有关。AMPK有许多生产和激活的途径,例如PPAR-γ能介导AMPK的转录活性和抑制AMPK的激活;而PGC1-α能增强AMPK表达和激活AMPK乙酰化[24]。
在OF组奶牛肝组织中AMPK的基因表达量显著增加,同时AMPK的蛋白表达量极显著升高,而P-AMPK的蛋白表达量没有明显改变,导致P-AMPK/AMPK的比值极显著下降,虽然相对于CON组奶牛磷酸化的AMPK无明显改变,但是存在相对的磷酸化AMPK功能下降的趋势。但在肝中GLUT-1的表达没有显著的下降,且其他基因指标没有显著变化,这表明肝葡萄糖转运功能并未受到影响,而磷酸化AMPK功能下降可能仅仅是灌服低聚果糖引起的奶牛肝能量代谢功能暂时性的紊乱,并未导致肝能量代谢功能受损。综合AMPK、P-AMPK和CLUT-1的检测结果表明,在奶牛急性蹄叶炎发生时可能并没有显著的影响肝的能量代谢,这与Burns等[12, 25]的试验结果相一致。在OF组的肌肉组织中AMPK的蛋白和基因的表达量均无明显的改变,但OF组肌肉组织中PPAR-γ的基因表达量极显著升高,而P-AMPK的蛋白表达量极显著下降,P-AMPK/AMPK的比值显著下降,过多的PPAR-γ表达能够抑制AMPK的激活,这可能说明在奶牛急性蹄叶炎的肌肉组织中AMPK的磷酸化被明显的抑制,没有磷酸化的AMPK不能起到能量调节的作用,这说明急性蹄叶炎奶牛的肌肉组织存在能量代谢异常。
组织内的葡萄糖摄取主要是通过葡萄糖转运系统实现,GLUT-4转运蛋白在胰岛素敏感组织中表达,主要在大鼠和人的心、骨骼肌和脂肪组织中表达,主要分布在细胞核内,受到胰岛素刺激后被转运至细胞膜[26]。当GLUT-4转运蛋白发生易位或功能受损时,机体会产生胰岛素抵抗[27-28]。GLUT-1是一种非胰岛素依赖的葡萄糖转运蛋白,在大脑、红细胞、内皮细胞和皮肤角质形成细胞,肝组织中表达,主要分布于细胞膜上[29]。该蛋白是一种非胰岛素依赖的葡萄糖转运受体蛋白,主要位于基础状态的细胞膜中,不需要胰岛素刺激即可上调和激活。
在OF组奶牛肝中GLUT-1的基因表达无显著变化,同时蛋白表达量也无显著变化;但OF组奶牛的肌肉组织中GLUT-4的蛋白和基因水平表达量均显著下降,肌肉组织是胰岛素敏感的组织,其葡萄糖的转运需依靠GLUT-4转运蛋白。文献[16]证实,OF组奶牛的血清胰岛素浓度在6、12、36和48 h与CON组相比显著下降,这与肌肉中GLUT-4的转运受体蛋白表达量极显著下降相互印证,这也证明在奶牛急性蹄叶炎中肌肉的损伤也可能存在。
依据肝和肌肉组织中AMPK、p-AMPK/AMPK和GLUT的变化来看,肝作为能量代谢和葡萄糖转运的主要器官之一,并未受到奶牛急性蹄叶炎的显著影响,但在这一疾病的发病过程中肌肉组织的能量代谢和葡萄糖转运受到了显著的抑制,由此表明奶牛急性蹄叶炎能够抑制肌肉的能量代谢和葡萄糖的转运功能,但对肝未发现明显的影响。
4 结论通过检测建立奶牛急性蹄叶炎疾病模型,检测该模型中肝和骨骼肌的能量代谢和葡萄糖转运的功能变化,发现奶牛急性蹄叶炎对机体的能量代谢和葡萄糖转运的功能产生影响,主要的影响肌肉组织。本试验主要着手与对能量代谢和葡萄糖转运的研究,并未对肌肉的损伤进行相关的探究,所以在此未能探讨该影响是否会对肌肉造成损伤,但依据试验结果分析,可能会对肌肉造成明显的损伤,这有待于进一步的探究。
| [1] |
ALVERGNAS M, STRABEL T, RZEWUSKA K, et al. Claw disorders in dairy cattle: effects on production, welfare and farm economics with possible prevention methods[J]. Livestock Sci, 2019, 222: 54-64. DOI:10.1016/j.livsci.2019.02.011 |
| [2] |
SMILIE R H, HOBLET K H, WEISS W P, et al. Prevalence of lesions associated with subclinical laminitis in first-lactation cows from herds with high milk production[J]. J Am Vet Med Assoc, 1996, 208(9): 1445-1451. |
| [3] |
DOLECHECK K, BEWLEY J. Animal board invited review: dairy cow lameness expenditures, losses and total cost[J]. Animal, 2018, 12(7): 1462-1474. DOI:10.1017/S1751731118000575 |
| [4] |
MCBRIDE A, HARDIE D G. AMP-activated protein kinase-a sensor of glycogen as well as AMP and ATP?[J]. Acta Physiol (Oxf), 2009, 196(1): 99-113. DOI:10.1111/j.1748-1716.2009.01975.x |
| [5] |
MCGEE S L, HARGREAVES M. AMPK-mediated regulation of transcription in skeletal muscle[J]. Clin Sci (Lond), 2010, 118(8): 507-518. DOI:10.1042/CS20090533 |
| [6] |
POTUNURU U R, PRIYA K V, VARSHA M K N S, et al. Amarogentin, a secoiridoid glycoside, activates AMP- activated protein kinase (AMPK) to exert beneficial vasculo-metabolic effects[J]. Biochim Biophys Acta General Subj, 2019, 1863(8): 1270-1282. DOI:10.1016/j.bbagen.2019.05.008 |
| [7] |
ZHAO X, ZENG Z W, GAUR U, et al. Metformin protects PC12 cells and hippocampal neurons from H2O2-induced oxidative damage through activation of AMPK pathway[J]. J Cell Physiol, 2019, 234(9): 16619-16629. DOI:10.1002/jcp.28337 |
| [8] |
SHIRWANY N A, ZOU M H. AMPK in cardiovascular health and disease[J]. Acta Pharmacol Sin, 2010, 31(9): 1075-1084. DOI:10.1038/aps.2010.139 |
| [9] |
MELOUANE A, YOSHIOKA M, KANZAKI M, et al. Sparc, an EPS-induced gene, modulates the extracellular matrix and mitochondrial function via ILK/AMPK pathways in C2C12 cells[J]. Life Sci, 2019, 229: 277-287. DOI:10.1016/j.lfs.2019.05.070 |
| [10] |
MOBASHERI A, CRITCHLOW K, CLEGG R D, et al. Chronic equine laminitis is characterised by loss of GLUT1, GLUT4 and ENaC positive laminar keratinocytes[J]. Equine Vet J, 2004, 36(3): 248-254. |
| [11] |
EZEH U, CHEN I Y D, CHEN Y H, et al. Adipocyte expression of glucose transporter 1 and 4 in PCOS: relationship to insulin-mediated and non-insulin-mediated whole-body glucose uptake[J]. Clin Endocrinol, 2019, 90(4): 542-552. DOI:10.1111/cen.13931 |
| [12] |
BURNS T A, WATTS M R, WEBER P S, et al. Distribution of insulin receptor and insulin-like growth factor-1 receptor in the digital laminae of mixed-breed ponies: an immunohistochemical study[J]. Equine Vet J, 2013, 45(3): 326-332. DOI:10.1111/j.2042-3306.2012.00631.x |
| [13] |
VERMA R, HALDAR C. Expression of receptors for melatonin (MT1), thyroid hormone (TR-α), deiodinase (Dio-2), glucose transporters (GLUT-1 & 4) and its relation with splenic cell survival (Bcl-2) of golden hamster, Mesocricetus auratus[J]. Biol Rhyth Res, 2018, 50(3): 454-465. |
| [14] |
JHA D, MITRA MAZUMDER P. High fat diet administration leads to the mitochondrial dysfunction and selectively alters the expression of class 1 GLUT protein in mice[J]. Mol Biol Rep, 2019, 46(2): 1727-1736. DOI:10.1007/s11033-019-04623-y |
| [15] |
SPRECHER D J, HOSTETLER D E, KANEENE J B. A lameness scoring system that uses posture and gait to predict dairy cattle reproductive performance[J]. Theriogenology, 1997, 47(6): 1179-1187. DOI:10.1016/S0093-691X(97)00098-8 |
| [16] |
李岳鹏, 丁嘉峰, 张献颢, 等. 低聚果糖诱导的奶牛急性蹄叶炎血液糖脂代谢的研究[J]. 畜牧兽医学报, 2019, 50(11): 2333-2338. LI Y P, DING J F, ZHANG X H, et al. Metabolism of glucose and lipid in the blood of acute laminitis in dairy cows induced by oligofructose[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(11): 2333-2338. (in Chinese) |
| [17] |
DANSCHER A M, ENEMARK J M D, TELEZHENKO E, et al. Oligofructose overload induces lameness in cattle[J]. J Dairy Sci, 2009, 92(2): 607-616. DOI:10.3168/jds.2008-1271 |
| [18] |
THOEFNER M B, POLLITT C C, VAN EPS A W, et al. Acute bovine laminitis: a new induction model using alimentary oligofructose overload[J]. J Dairy Sci, 2004, 87(9): 2932-2940. DOI:10.3168/jds.S0022-0302(04)73424-4 |
| [19] |
李楠, 安锡忠, 秦建华, 等. 保定地区奶牛蹄叶炎与体内矿物元素的关系研究[J]. 黑龙江畜牧兽医, 2015(24): 113-115. LI N, AN X Z, QIN J H, et al. Study on the relationship between hoof inflammation and mineral elements in dairy cows in Baoding area[J]. Heilongjiang Animal Science and Veterinary Medicine, 2015(24): 113-115. (in Chinese) |
| [20] |
MARR C M. Laminitis: recent advances and future directions[J]. Equine Vet J, 2012, 44(6): 733-734. DOI:10.1111/j.2042-3306.2012.00671.x |
| [21] |
HARDIE D G. AMP-activated/SNF1 protein kinases: conserved guardians of cellular energy[J]. Nat Rev Mol Cell Biol, 2007, 8(10): 774-785. DOI:10.1038/nrm2249 |
| [22] |
TOWLER M C, HARDIE D G. AMP-activated protein kinase in metabolic control and insulin signaling[J]. Circulat Res, 2007, 100(3): 328-341. DOI:10.1161/01.RES.0000256090.42690.05 |
| [23] |
YANG Y M, HAN C Y, KIM Y J, et al. AMPK-associated signaling to bridge the gap between fuel metabolism and hepatocyte viability[J]. World J Gastroenterol, 2010, 16(30): 3731-3742. DOI:10.3748/wjg.v16.i30.3731 |
| [24] |
SCHULTZE S M, HEMMINGS B A, NIESSEN M, et al. PI3K/AKT, MAPK and AMPK signalling: protein kinases in glucose homeostasis[J]. Exp Rev Mol Med, 2012, 14: e1. DOI:10.1017/S1462399411002109 |
| [25] |
BURNS T A, WATTS M R, WEBER P S, et al. Effect of dietary nonstructural carbohydrate content on activation of 5'-adenosine monophosphate-activated protein kinase in liver, skeletal muscle, and digital laminae of lean and obese ponies[J]. J Vet Intern Med, 2014, 28(4): 1280-1288. DOI:10.1111/jvim.12356 |
| [26] |
MONTEL-HAGEN A, BLANC L, BOYER-CLAVEL M, et al. The Glut1 and Glut4 glucose transporters are differentially expressed during perinatal and postnatal erythropoiesis[J]. Blood, 2008, 112(12): 4729-4738. DOI:10.1182/blood-2008-05-159269 |
| [27] |
HA E, YIM S V, CHUNG J H, et al. Melatonin stimulates glucose transport via insulin receptor substrate-1/phosphatidylinositol 3-kinase pathway in C2C12 murine skeletal muscle cells[J]. J Pineal Res, 2006, 41(1): 67-72. DOI:10.1111/j.1600-079X.2006.00334.x |
| [28] |
HALEY M J, KRISHNAN S, BURROWS D, et al. Acute high-fat feeding leads to disruptions in glucose homeostasis and worsens stroke outcome[J]. J Cerebr Blood Flow Metabol, 2019, 39(6): 1026-1037. DOI:10.1177/0271678X17744718 |
| [29] |
LI Z Q, LIU H, JU W, et al. LncRNA GASL1 inhibits growth and promotes expression of apoptosis-associated proteins in prostate carcinoma cells through GLUT-1[J]. Oncol Lett, 2019, 17(6): 5327-5334. |
(编辑 白永平)



