2. 哈尔滨商业大学药学院,哈尔滨 150028
2. School of Pharmacy, Harbin University of Commerce, Harbin 150028, China
当机体内活性氧(reactive oxygen species,ROS)的产生与机体清除ROS或修复其造成的损伤之间不能达到平衡时便会出现氧化应激[1]。集约化养殖、饲粮更换与污染、鸡舍温度与通风条件、强制换羽、运输转群等多种因素均会引发鸡的氧化应激,使鸡群受到不同程度的氧化损伤[2]。氧化应激会危害鸡的健康,导致采食量下降、新陈代谢失常、免疫力下降,还会引发鸡的多种炎症反应,产生病理损伤,降低鸡的生产性能,给养鸡生产造成严重的经济损失,及时地给鸡补充一些抗氧化生物活性物质可有效预防或修复氧化损伤[3]。
桑叶是一种药食同源的多功能植物,具有抗炎、抗氧化、降血脂、治疗糖尿病和心血管疾病等多种功能[4-5]。2013年,桑叶被农业农村部列为可饲用天然植物,近年来作为新型饲料资源用于畜禽养殖,不仅能有效缓解我国饲料资源的短缺,其所含的丰富营养物质和生物活性物质还能缓解畜禽的氧化损伤,提高生产性能[6-7]。多项研究表明,日粮中添加桑叶或桑叶提取物,能显著提高鸡的抗氧化能力[8-10]。桑叶中含有黄酮类、生物碱类、多糖类和植物甾醇类等多种活性成分。然而,桑叶对鸡的抗氧化作用功效的物质基础及其机制仍不明确。
网络药理学以系统生物学理论为指导,整合了生物信息学、多向药理学、计算机科学等多学科技术,整体性和系统性地研究药物和疾病间相互作用[11]。将网络药理学用于中药药效物质和作用机理的研究,与中药多成分、多靶点、多途径、系统调控的特点相符,成为中药研究的新方法[12]。中兽医学和中医学同宗同源,有相同的整体观念。近年来已有少许报道将网络药理学用于研究饲用天然植物在畜禽上的作用机理[13-15]。本研究通过网络药理学方法,分析桑叶在鸡氧化应激中理论上起作用的功效物质及潜在的关键作用靶点,并通过功能和通路富集分析得到桑叶增强鸡抗氧化作用的相关信号通路和代谢途径,为桑叶在鸡生产中的应用提供相关启示。
1 材料与方法 1.1 桑叶活性成分及其靶点的筛选通过中药系统药理学分析平台(TCMSP,https://tcmspw.com/tcmsp.php)检索桑叶的化学成分,筛选条件设置为化合物口服利用度(oral bioavailability, OB)≥30%,类药性(drug-likeness,DL)≥0.18。并查阅文献,补充不符合筛选条件却是桑叶主要功效成分或已报道的具有抗氧化作用的化合物,作为有效活性成分。进一步通过TCMSP平台,收集有效活性成分的靶点,其中,绿原酸在TCMSP中无靶点,但有报道称其是桑叶的主要抗氧化成分之一[16],因此,通过herb平台(http://herb.ac.cn/)收集其靶点。通过Uniprot平台(https://www.uniprot.org/)对收集到的靶点名称进行标准化校正。利用Cytoscape3.7.2软件构建桑叶化合物-靶点网络图。
1.2 桑叶与鸡(抗)氧化蛋白质-蛋白质相互作用(PPI)网络的构建在NCBI数据库的gene平台(https://www.ncbi.nlm.nih.gov/)内输入检索词“Gallus gallus”和“antioxidant”/“antioxidative”/“antioxidation”/“oxidative stress”/“oxidative”/“oxidation”/“oxidant”,尽量多地收集鸡(抗)氧化相关基因,其中,输入“Gallus gallus”和“antioxidative”/“antioxidation”时没有检索结果,将其余词条检索到的基因整理去除重复,然后与桑叶的化合物相关靶点一起上传至STRING数据库(version 11.0, https://string-db.org/),研究物种选择为“Gallus gallus”,最低互作分值(minimum required interaction score)设置为高可信(high confidence 0.7),得到桑叶作用于鸡(抗)氧化的PPI网络图,并将数据导入Cytoscape 3.7.2软件作进一步分析。
1.3 靶点的GO富集和KEGG通路富集分析将桑叶作用于鸡(抗)氧化的靶点蛋白基因上传至DAVID数据库(version6.8,https://david.ncifcrf.gov/home.jsp),物种选择为“Gallus gallus”,进行GO(gene ontology)功能富集和KEGG(Kyoto encyclopedia of genes and genomes)通路富集分析,设置所有伪发现率(false discovery rate,FDR < 0.01),对结果进行筛选分析。
2 结果 2.1 桑叶活性成分及其靶点筛选通过TCMSP数据库检索桑叶所有化学成分,共269个。通过口服利用度和类药性的筛选;另外,加上1-脱氧野尻霉素(1-deoxynojirimycin,DNJ)、紫云英苷(astragalin)、异槲皮素(isoquercitrin)、芦丁(rutin)、绿原酸(chlorogenic acid)这5个化合物,它们虽然不符合筛选条件,但却是桑叶主要功效成分;最后剔除没有对应靶点的化学成分,共得到符合条件的化合物30个(表 1),共收集到靶点蛋白221个。利用Cytoscape3.7.2构建桑叶活性化合物-靶点网络图,如图 1所示,网络图共包含251个节点,550条边。从化合物方面看,网络中每个化合物平均与16.8个靶点相连,连接靶点≥10的化合物有13个(表 2)。槲皮素(quercetin)的度值最高,能与145个靶点蛋白相互作用,其次为山柰酚(kaempferol)、花生四烯酸(arachidonic acid)、β-谷甾醇(beta-sitosterol)等(表 2)。从靶点角度看,网络中每个靶点平均与2.3个化合物相连,连接化合物≥10的靶点蛋白有8个(表 3)。前列腺素合酶G/H 2(PTGS2)的度值最高,其次为前列腺素合酶G/H 1(PTGS1)、热休克蛋白90(HSP90AA1)、凝血因子Xa(F7)、过氧化物酶体增殖激活受体γ(PPARG)等。
|
|
表 1 桑叶有效活性成分 Table 1 Active compounds of Mori Folium |

|
圆圈代表化合物,正方形代表靶点,形状大小与度值成正比 The circles represent compounds and squares represent targets, the shape size is proportional to the degree value 图 1 桑叶活性化合物-靶点网络 Fig. 1 Compound-target network of Mori Folium |
|
|
表 2 桑叶中度≥10的活性成分 Table 2 Active compounds of Mori Folium with degree≥10 |
|
|
表 3 桑叶中度≥10的靶点 Table 3 Targets of Mori Folium with degree≥10 |
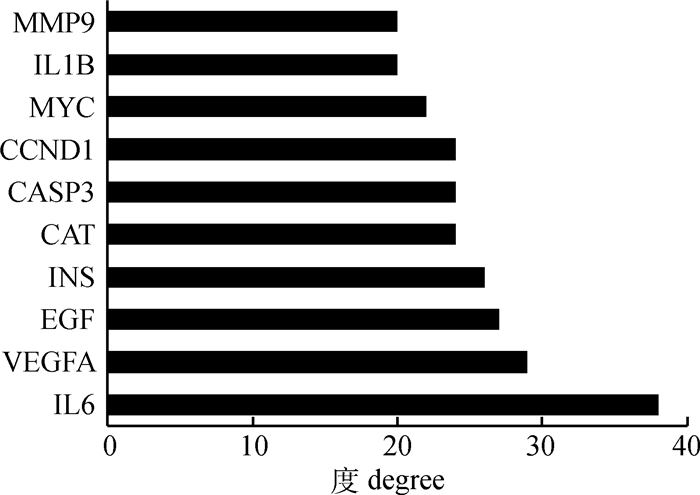
在NCBI的gene数据库中得到与鸡(抗)氧化相关的基因共120个,利用STRING数据库构建桑叶作用于鸡(抗)氧化的PPI网络,去除无相互作用的节点,得到的网络共有220个节点(氧化相关靶点60个,化合物靶点151个,共同靶点9个),661条边(图 2)。根据节点的度值绘制前10个靶点蛋白的条形图(图 3),其中白细胞介素6(IL-6)、血管内皮生长因子A(VEGFA)、表皮生长因子(EGF)、胰岛素(INS)、过氧化氢酶(CAT)、胱天蛋白酶3(CASP3)、细胞周期蛋白D1(CCND1)等度值较大。为了更加直观地显示桑叶与鸡(抗)氧化蛋白的关系,将PPI网络图数据导入Cytoscape 3.7.2软件,分析筛选与鸡(抗)氧化直接作用的桑叶化合物靶点蛋白,并构建PPI图(图 4)。进一步分析可知,桑叶化合物靶点中IL-6、CASP3、CAT、PTGS2、白细胞介素1 beta(IL-1B)、基质金属蛋白酶9(MMP9)等可直接作用于鸡(抗)氧化蛋白且度值较高,其中PTGS2是桑叶化合物和(抗)氧化的共同靶点。

|
图 2 桑叶作用于鸡(抗)氧化靶点的PPI网络图 Fig. 2 The PPI network of Mori Folium interacting with (anti)oxidant targets in Gallus gallus |
|
图 3 PPI网络中关键靶点的度 Fig. 3 The degree of key targets in PPI network |

|
正方形代表化合物靶点,圆圈代表鸡(抗)氧化相关靶点,三角形代表桑叶化合物和鸡(抗)氧化的共同靶点,形状大小与度值成正比 The squares represent the compound targets, the circles represent the chicken (anti)oxidation related targets, and the triangles represent the common targets of Mori Folium compound and chicken (anti)oxidation, the shape size is proportional to the degree value 图 4 桑叶中直接作用于鸡(抗)氧化的靶点网络图 Fig. 4 The network of Mori Folium directly interacting with (anti)oxidant targets in Gallus gallus |
用DAVID数据库对桑叶作用于鸡(抗)氧化PPI网络中的靶点蛋白进行GO功能富集和KEGG通路分析,对GO富集结果中FDR < 0.01的条目进行可视化。如图 5所示,其中分子功能(molecular function)有3条,涉及亚铁红素结合活性(heme binding)、核染色质结合活性(chromatin binding)、过氧化物酶活性(peroxidase activity);生物过程(biological process)有7条, 主要涉及炎症反应(inflammatory response)、氧化应激反应(response to oxidative stress)、细胞氧化还原平衡(cell redox homeostasis)、RNA聚合酶Ⅱ启动子转录的正调控(positive regulation of transcription from RNA polymerase Ⅱ promoter)等;细胞组成(cellular component)有6条,主要涉及细胞外间隙(extracellular space)、过氧化物酶体(peroxisome)、细胞质基质(cytosol)、线粒体(mitochondrion)等。KEGG通路分析共得到37条相关通路,表 4列出了结果中FDR < 0.01的24通路,其中具有代表性的通路有NOD样受体信号通路(NOD-like receptor signaling pathway)、过氧化物酶体增殖物激活受体信号通路(PPAR signaling pathway)、Toll样受体信号通路(Toll-like receptor signaling pathway)、细胞凋亡(Apoptosis)等。

|
红色条形表示分子功能,蓝色条形表示生物过程,绿色条形表示细胞组成 The red bars represent the molecular function, the blue bars represent the biological process, and the green bars represent the cell composition 图 5 桑叶对鸡(抗)氧化靶点蛋白的GO富集结果 Fig. 5 GO enrichment results of Mori Folium on chicken (anti)oxidant targets |
|
|
表 4 桑叶对鸡(抗)氧化靶点蛋白的KEGG富集结果 Table 4 KEGG enrichment results of Mori Folium on chicken (anti)oxidant target protein |
桑叶是农业部规定的可饲用天然植物,蛋白含量高,且含有多种生物活性物质,在我国古时就已作为饲料用于桑蚕养殖,近年来作为非常规蛋白饲料越来越多地用于动物生产。在限抗禁抗的政策下,桑叶因含有种类丰富、生物功能多样的天然活性物质被逐渐开发为功能性饲料添加剂。桑叶在饲用中显示出良好的抗氧化效果,但其作用机理尚不明确。本研究采用网络药理学方法,分析了桑叶的化学成分、靶点与鸡氧化应激之间的关系。
通过桑叶作用靶点与鸡(抗)氧化的PPI网络的构建及分析可知,桑叶作用于鸡(抗)氧化的关键靶点有IL-6、VEGFA、EGF、INS、CAT、CASP3、CCND1、PTGS2、IL-1B和MMP9等。IL-6是一个多效性的细胞因子,既可作为重要的促炎因子参与炎症反应,又有抗炎作用。研究表明,ROS可以活化核因子κB(NF-κB)进而诱导IL-6的表达[17]。VEGFA属于血管内皮生长因子家族,可以通过激活核因子E2相关因子2(Nrf2)信号通路保护细胞抵抗氧化应激,并形成正反馈通路增加自身表达量[18]。EGF能减轻炎症或氧化应激等对肠黏膜上皮细胞的损伤,并能促进黏膜上皮的修复[19]。研究显示,EGF可以促进断奶仔猪小肠绒毛的发育以及上皮细胞的分化,保护断奶仔猪的肠道屏障,提高平均日增重[20]。INS不仅在维持机体的葡萄糖稳态中发挥重要功能,越来越多的研究表明,其在保护细胞和器官免受氧化损伤方面也有重要功能,它可以通过胰岛素信号通路调节多种抗氧化酶,还能与抗氧化酶转录有关的因子如Nrf2和NF-κB互作,从而抑制ROS的产生并促进清除已有的ROS[21]。CAT是机体内主要的抗氧化酶之一,其经典功能是清除体内的ROS,CAT可将超氧化物歧化酶(SOD)催化生成的过氧化氢转变成水,维持机体的氧化还原稳态。CAT作为一种新型酶制剂用于动物养殖,具有抗氧化损伤、增强免疫力、抑菌抗炎等多种功能。在饲粮中添加CAT能提高肉鸡的抗氧化能力,改善生长性能和肠道形态[22-23]。氧化应激会损伤细胞,促进细胞凋亡,CASP3是细胞凋亡反应的最终效应蛋白之一,研究显示,低氧会增强人髓核来源间充质干细胞中CASP3的活性,促进细胞凋亡[24]。CCND1调控细胞周期从G0到G1期的转变,氧化损伤会影响CCND1蛋白的表达,使细胞周期阻滞,促进细胞凋亡[25]。PTGS2又称环加氧酶2(COX-2),是一种促炎因子,在介导炎症反应中有重要作用。ROS会促进炎症反应,诱导COX-2的产生[26],有研究表明,肾小球系膜细胞线粒体来源的ROS会激活NF-κB的活性、诱导COX-2 mRNA和其蛋白的表达[27]。IL-1B和IL-6一样,也是典型的炎症介质。另一方面,研究显示IL-1B可以抑制星形胶质细胞氧化损伤中ROS的增加,其机制可能是通过NF-κB信号途径,增加了星形胶质细胞中谷胱甘肽(GSH)的产生[28]。MMP9属于基质金属蛋白酶(MMPs)家族,可降解细胞外基质成分。MMPs的细胞外基质降解活性可被氧化应激和炎症状态激活,作为炎症介质促进炎症反应[29]。
由桑叶直接作用于鸡(抗)氧化的靶点网络图可知,IL-6、CASP3、CAT、PTGS2、IL-1B、INS、MMP9是可以直接作用于鸡(抗)氧化的桑叶化合物靶点且度值较高,通过桑叶活性化合物-靶点网络图将这些靶点对应到相应的桑叶化合物。IL-6和IL-1B对应的桑叶化合物均为芦丁和槲皮素;CASP3对应槲皮素、芦丁、山柰酚、β-谷甾醇、β-胡萝卜素和花生四烯酸;CAT对应芦丁;MMP9对应槲皮素;INS对应芦丁;PTGS2对应槲皮素、山柰酚、β-谷甾醇、β-胡萝卜素和花生四烯酸等21个化合物,体现了中草药发挥作用时多成分、多靶点的特点。有研究表明,桑叶黄酮能提高动物氧化应激能力,槲皮素是桑叶中主要黄酮类之一,可以抑制DNA氧化损伤而发挥抗氧化作用,还可以增加一些蛋白的表达以消除自由基的损伤[30]。槲皮素在鸡生产中已有较多应用,在日粮中添加槲皮素可以提高蛋鸡的抗氧化能力,血清总抗氧化能力(T-AOC)、SOD和谷胱甘肽过氧化物酶(GSH-Px)活性均显著提高,产蛋率显著提高、料蛋比显著下降[31]。芦丁是槲皮素的配糖体,能与自由基结合从而抑制自由基链式反应并能提高CAT、SOD等抗氧化酶活性[32]。芦丁作为一种绿色饲料添加剂用于动物生产,不仅能提高鸡的生长性能[33],对鱼类、反刍动物生长性能和产品品质的提升也有促进作用[34-35]。山柰酚能够诱导Nrf2-抗氧化反应元件(ARE)通路中ARE的表达,使受Nrf2调控的基因表达量提高,从而促进自由基的清除,并可以和槲皮素、紫檀芪协同作用,增强抗氧化功能[36]。花生四烯酸在水产饲料添加剂中研究较多,是鱼类的必需脂肪酸之一,在一定浓度范围内具有正向生理功能,促进鱼的生长、存活和繁殖,提高抗氧化能力[37]。在蛋鸡中研发富含花生四烯酸的鸡蛋,为人类提供必需的不饱和脂肪酸以预防心脑血管疾病,具有广阔的市场需求。β-谷甾醇是一种植物甾醇,植物甾醇被用于畜禽、水产养殖,具有抗氧化、调节免疫力、促进动物生长、提升畜产品品质等功能。在肉鸡饲粮中添加植物甾醇,其总超氧化物歧化酶活性显著提高、血清总胆固醇显著降低。日粮中添加β-谷甾醇可以提高肉鸡肠道抗氧化水平,改善肠道形态,提高免疫力[38]。β-胡萝卜素是维生素A的前体物质,可以抑制脂质氧化并保护细胞的抗氧化系统以减少机体的氧化损伤。β-胡萝卜素可作为饲料添加剂用于畜禽和水产养殖[39-40],用于肉鸡可提高其生产性能及抗氧化能力;用于蛋鸡不仅能提高蛋鸡和鸡蛋的抗氧化活性,还能沉积色素,改善蛋黄色泽[41]。
本研究中,GO富集分析表明桑叶的活性成分可在细胞外间隙、过氧化物酶体、细胞质基质、线粒体等细胞的不同部位,通过发挥亚铁红素结合活性、核染色质结合活性、过氧化物酶活性等多种生物活性,在炎症反应、氧化应激反应、细胞氧化还原平衡等不同的生物过程中发挥作用,从而在鸡的抗氧化损伤中起作用。同时,KEGG通路富集分析显示,与桑叶作用于鸡氧化应激相关性较大的代谢通路有NOD样受体信号通路、过氧化物酶体增殖物激活受体信号通路、Toll样受体信号通路、细胞凋亡等。氧化应激会激活多种转录因子,进而引起炎症信号通路相关基因表达量的变化,导致慢性炎症[42]。Toll样受体和NOD样受体为介导炎症反应的代表性受体,被激活后均能通过介导经典的NF-κB通路、丝裂原活化蛋白激酶(MAPK)通路诱导炎症因子的释放[43-44]。PPARs属于类固醇激素受体家族,有PPARα、PPARβ/δ和PPARγ 3种亚型。PPAR可行使多种生物学功能,涉及脂类代谢、脂肪形成、血糖控制、炎症反应及氧化应激等[45]。研究表明,PPARα对视网膜细胞凋亡和氧化应激有保护作用,部分原因可能是其通过下调低氧诱导因子-1alpha(HIF-1α)/烟酰胺腺嘌呤二核苷酸磷酸氧化酶4(NOX4)信号通路以减轻视网膜细胞的氧化损伤[46]。ROS作为第二信使在正常生理条件下参与多种信号通路的调节,然而在氧化应激中,过量的ROS会造成细胞内生物分子的损伤,引发细胞凋亡[47]。ROS可以促进脂筏参与的信号转导,激活死亡受体介导的细胞凋亡;还能激活B细胞淋巴瘤/白血病-2(BCL-2)超家族的促凋亡蛋白使线粒体外膜的通透性增加,进而导致线粒体释放凋亡激活剂,触发细胞凋亡[48]。
4 结论综上所述,桑叶通过多种成分、多个靶点、多条通路协同作用增强鸡的抗氧化功能,理论上,其关键靶点有IL-6、VEGFA、EGF、INS、CAT、CASP3、CCND1、PTGS2、IL-1B和MMP9等,通过槲皮素、芦丁、山柰酚、β-谷甾醇、β-胡萝卜素和花生四烯酸等关键活性成分,NOD样受体信号通路、过氧化物酶体增殖物激活受体信号通路、Toll样受体信号通路、细胞凋亡等主要信号通路调控鸡的氧化应激。下一步需要对分析得到的成分、靶点、通路进行试验验证,为桑叶在鸡生产中的开发应用提供理论参考。
| [1] |
REUTER S, GUPTA S C, CHATURVEDI M M, et al. Oxidative stress, inflammation, and cancer: how are they linked?[J]. Free Radic Biol Med, 2010, 49(11): 1603-1616. DOI:10.1016/j.freeradbiomed.2010.09.006 |
| [2] |
SURAI P F, KOCHISH I I, FISININ V I, et al. Antioxidant defence systems and oxidative stress in poultry biology: an update[J]. Antioxidants (Basel), 2019, 8(7): 235. DOI:10.3390/antiox8070235 |
| [3] |
LEE M T, LIN W C, YU B, et al. Antioxidant capacity of phytochemicals and their potential effects on oxidative status in animals-A review[J]. Asian-Australas J Anim Sci, 2017, 30(3): 299-308. |
| [4] |
SINGH R, BAGACHI A, SEMWAL A, et al. Traditional uses, phytochemistry and pharmacology of Morus alba Linn.: A review[J]. J Med Plants Res, 2013, 7(9): 461-469. |
| [5] |
GRYN-RYNKO A, BAZYLAK G, OLSZEWSKA-SLONINA D. New potential phytotherapeutics obtained from white mulberry (Morus alba L.) leaves[J]. Biomed Pharmacother, 2016, 84: 628-636. DOI:10.1016/j.biopha.2016.09.081 |
| [6] |
LIU Y Y, LI Y H, XIAO Y, et al. Mulberry leaf powder regulates antioxidative capacity and lipid metabolism in finishing pigs[J]. Anim Nutr, 2021, 7(2): 421-429. DOI:10.1016/j.aninu.2020.08.005 |
| [7] |
WANG B, YANG C T, DIAO Q Y, et al. The influence of mulberry leaf flavonoids and Candida tropicalis on antioxidant function and gastrointestinal development of preweaning calves challenged with Escherichia coli O141:K99[J]. J Dairy Sci, 2018, 101(7): 6098-6108. DOI:10.3168/jds.2017-13957 |
| [8] |
许祯莹, 雷春龙, 李娟, 等. 日粮中添加桑叶粉对蛋鸡血液抗氧化和免疫指标的影响[J]. 畜牧与兽医, 2017, 49(12): 34-38. XU Z Y, LEI C L, LI J, et al. Effects of mulberry leaf meal on serum antioxidant indexes and immune indexes of laying hens[J]. Animal Husbandry & Veterinary Medicine, 2017, 49(12): 34-38. (in Chinese) |
| [9] |
LIN W C, LEE M T, CHANG S C, et al. Effects of mulberry leaves on production performance and the potential modulation of antioxidative status in laying hens[J]. Poult Sci, 2017, 96(5): 1191-1203. DOI:10.3382/ps/pew350 |
| [10] |
TILAHUN M, URGE M, YIRGA M. Effect of substituting commercial feed with mulberry leaf meal on performance of broiler chickens[J]. J Biol Agric Healthc, 2018, 8(14): 58-63. |
| [11] |
HOPKINS A L. Network pharmacology[J]. Nat Biotechnol, 2007, 25(10): 1110-1111. DOI:10.1038/nbt1007-1110 |
| [12] |
LI S, ZHANG B. Traditional Chinese medicine network pharmacology: theory, methodology and application[J]. Chin J Nat Med, 2013, 11(2): 110-120. |
| [13] |
王春花, 孙雪芳. 基于网络药理学探讨葛根芩连汤治疗猪腹泻的靶点与通路[J]. 畜牧兽医学报, 2020, 51(11): 2875-2885. WANG C H, SUN X F. The target and pathway of Gegen Qinlian decoction in treating swine diarrhea based on network pharmacology[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(11): 2875-2885. DOI:10.11843/j.issn.0366-6964.2020.11.026 (in Chinese) |
| [14] |
刘晓曦, 刘明江, 尹朋, 等. 中兽药网络药理学研究进展[J]. 畜牧兽医学报, 2014, 45(6): 859-862. LIU X X, LIU M J, YIN P, et al. A review on the traditional Chinese veterinary medicine network pharmacology[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(6): 859-862. (in Chinese) |
| [15] |
董朕, 白东东, 刘利利, 等. 基于网络药理学分析归芪益母汤治疗牛气血两虚证的作用机制[J]. 畜牧兽医学报, 2018, 49(12): 2733-2744. DONG Z, BAI D D, LIU L L, et al. The mechanism of Gui Qi Yimu decoction powder in treating cow qi and blood two deficiency syndrome based on network pharmacology[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(12): 2733-2744. DOI:10.11843/j.issn.0366-6964.2018.12.023 (in Chinese) |
| [16] |
MEMON A A, MEMON N, LUTHRIA D L, et al. Phenolic acids profiling and antioxidant potential of mulberry (Morus laevigata W., Morus nigra L., Morus alba L.) leaves and fruits grown in Pakistan[J]. Pol J Food Nutr Sci, 2010, 60(1): 25-32. |
| [17] |
YAO L, HU D N, CHEN M, et al. Subtoxic levels hydrogen peroxide-induced expression of interleukin-6 by epidermal melanocytes[J]. Arch Dermatol Res, 2012, 304(10): 831-838. DOI:10.1007/s00403-012-1277-6 |
| [18] |
KWEIDER N, FRAGOULIS A, ROSEN C, et al. Interplay between vascular endothelial growth factor (VEGF) and nuclear factor erythroid 2-related factor-2 (Nrf2): implications for preeclampsia[J]. J Biol Chem, 2011, 286(50): 42863-42872. DOI:10.1074/jbc.M111.286880 |
| [19] |
TANG X P, LIU B, WANG X R, et al. Epidermal growth factor, through alleviating oxidative stress, protect IPEC-J2 cells from lipopolysaccharides-induced apoptosis[J]. Int J Mol Sci, 2018, 19(3): 848. DOI:10.3390/ijms19030848 |
| [20] |
汤小朋. 表皮生长因子对脂多糖诱导的仔猪肠道屏障功能及磷吸收影响研究[D]. 长沙: 湖南农业大学, 2018. TANG X P. The study of influences of epidermal growth factor on intestinal barrier function and phosphorus absorption of weaned piglets[D]. Changsha: Hunan Agricultural University, 2018. (in Chinese) |
| [21] |
WANG X, WU H, CHEN H L, et al. Does insulin bolster antioxidant defenses via the extracellular signal-regulated kinases-protein kinase B-nuclear factor erythroid 2 p45-related factor 2 pathway?[J]. Antioxid Redox Signal, 2012, 16(10): 1061-1070. DOI:10.1089/ars.2011.4460 |
| [22] |
唐明红. 过氧化氢酶对黄羽肉鸡生长性能、肠道形态以及抗氧化能力的影响[J]. 动物营养学报, 2021, 33(7): 4153-4161. TANG M H. Effects of catalase on growth performance, intestinal morphology and antioxidant capacity in yellow broilers[J]. Chinese Journal of Animal Nutrition, 2021, 33(7): 4153-4161. DOI:10.3969/j.issn.1006-267x.2021.07.056 (in Chinese) |
| [23] |
王芳, 符晨星, 陈家顺, 等. 过氧化氢酶的生物学功能及在动物中的应用[J]. 饲料研究, 2021, 44(5): 126-129. WANG F, FU C X, CHEN J S, et al. Biological function of catalase and its application in animals[J]. Feed Research, 2021, 44(5): 126-129. (in Chinese) |
| [24] |
TIAN D S, LIU J J, CHEN L, et al. The protective effects of PI3K/Akt pathway on human nucleus pulposus mesenchymal stem cells against hypoxia and nutrition deficiency[J]. J Orthop Surg Res, 2020, 15(1): 29. DOI:10.1186/s13018-020-1551-9 |
| [25] |
BURCH P M, HEINTZ N H. Redox regulation of cell-cycle re-entry: cyclin D1 as a primary target for the mitogenic effects of reactive oxygen and nitrogen species[J]. Antioxid Redox Signal, 2005, 7(5-6): 741-751. DOI:10.1089/ars.2005.7.741 |
| [26] |
WONG W T, TIAN X Y, CHEN Y C, et al. Bone morphogenic protein-4 impairs endothelial function through oxidative stress-dependent cyclooxygenase-2 upregulation: implications on hypertension[J]. Circ Res, 2010, 107(8): 984-991. DOI:10.1161/CIRCRESAHA.110.222794 |
| [27] |
KIRITOSHI S, NISHIKAWA T, SONODA K, et al. Reactive oxygen species from mitochondria induce cyclooxygenase-2 gene expression in human mesangial cells: potential role in diabetic nephropathy[J]. Diabetes, 2003, 52(10): 2570-2577. DOI:10.2337/diabetes.52.10.2570 |
| [28] |
CHOWDHURY T, ALLEN M F, THORN T L, et al. Interleukin-1β protects neurons against oxidant-induced injury via the promotion of astrocyte glutathione production[J]. Antioxidants (Basel), 2018, 7(8): 100. DOI:10.3390/antiox7080100 |
| [29] |
HE Y, JACKMAN N A, THORN T L, et al. Interleukin-1β protects astrocytes against oxidant-induced injury via an NF-κB-dependent upregulation of glutathione synthesis[J]. Glia, 2015, 63(9): 1568-1580. DOI:10.1002/glia.22828 |
| [30] |
MENDOZA E E, BURD R. Quercetin as a systemic chemopreventative agent: structural and functional mechanisms[J]. Mini Rev Med Chem, 2011, 11(14): 1216-1221. |
| [31] |
孙丹彤, 滕楠, 由莹, 等. 日粮添加槲皮素对蛋鸡生产性能及抗氧化能力的影响[J]. 中国饲料, 2014(21): 8-10. SUN D T, TENG N, YOU Y, et al. Effects of dietary quercetin on production performance and antioxidation in laying hens[J]. China Feed, 2014(21): 8-10, 13. DOI:10.3969/j.issn.1004-3314.2014.21.003 (in Chinese) |
| [32] |
YANG J X, GUO J, YUAN J F. In vitro antioxidant properties of rutin[J]. LWT-Food Sci Technol, 2008, 41(6): 1060-1066. DOI:10.1016/j.lwt.2007.06.010 |
| [33] |
李颖平, 庞全海, 秦红, 等. 芦丁对AA肉鸡生长性能肉鸡生长性能、血清生化指标和肉鸡腹水综合征的影响[J]. 中国家禽, 2019, 41(17): 30-33. LI Y P, PANG Q H, QIN H, et al. Effects of Rutin on growth performance, serum biochemical indexes and ascites syndrome of AA broilers[J]. China Poultry, 2019, 41(17): 30-33. (in Chinese) |
| [34] |
占今舜, 钟小军, 杨群, 等. 芦丁的生物活性功能及其在反刍动物生产中的应用[J]. 动物营养学报, 2019, 31(7): 2952-2957. ZHAN J S, ZHONG X J, YANG Q, et al. Bio-active functions of rutin and its application in ruminant production[J]. Chinese Journal of Animal Nutrition, 2019, 31(7): 2952-2957. DOI:10.3969/j.issn.1006-267x.2019.07.002 (in Chinese) |
| [35] |
陈密, 付国香, 董娟娥, 等. 芦丁对草鱼生长性能、体成分、非特异性免疫力和肠道消化酶活性的影响[J]. 动物营养学报, 2019, 31(10): 4868-4876. CHEN M, FU G X, DONG J E, et al. Effects of rutin on growth performance, body composition, non-specific immunity and intestinal digestive enzyme activities of grass carp (Ctenopharyngodon idella)[J]. Chinese Journal of Animal Nutrition, 2019, 31(10): 4868-4876. (in Chinese) |
| [36] |
SAW C L L, GUO Y, YANG A Y, et al. The berry constituents quercetin, kaempferol, and pterostilbene synergistically attenuate reactive oxygen species: involvement of the Nrf2-ARE signaling pathway[J]. Food Chem Toxicol, 2014, 72: 303-311. DOI:10.1016/j.fct.2014.07.038 |
| [37] |
王成强, 王际英, 黄炳山, 等. 饲料花生四烯酸水平对珍珠龙胆石斑鱼幼鱼生长性能、抗氧化能力、血清生化指标以及肝脏和肌肉脂肪酸组成的影响[J]. 动物营养学报, 2018, 30(9): 3567-3580. WANG C Q, WANG J Y, HUANG B S, et al. Effects of dietary arachidonic acid level on growth performance, antioxidant ability, serum biochemical parameters and fatty acid composition in liver and muscle of juvenile hybrid grouper (Epinephelus fuscoguttatus♀× Epinephelus lanceolatus♂)[J]. Chinese Journal of Animal Nutrition, 2018, 30(9): 3567-3580. DOI:10.3969/j.issn.1006-267x.2018.09.027 (in Chinese) |
| [38] |
CHENG Y F, CHEN Y P, LI J, et al. Dietary β-sitosterol regulates serum lipid level and improves immune function, antioxidant status, and intestinal morphology in broilers[J]. Poult Sci, 2020, 99(3): 1400-1408. DOI:10.1016/j.psj.2019.10.025 |
| [39] |
姚玉妮. β-胡萝卜素在畜禽生产中的应用[J]. 中国饲料添加剂, 2016(3): 20-22. YAO Y N. The application of β-carotene in livestock and poultry production[J]. China Feed Additive, 2016(3): 20-22. (in Chinese) |
| [40] |
王玉, 柳森, 段健诚, 等. 饲料中β-胡萝卜素添加量对脊尾白虾生长及抗氧化酶活性的影响[J]. 海洋渔业, 2020, 42(4): 427-434. WANG Y, LIU S, DUAN J C, et al. Effect of β-carotene addition in feed on growth and antioxidant enzyme activities of Exopalaemon carinicauda[J]. Marine Fisheries, 2020, 42(4): 427-434. DOI:10.3969/j.issn.1004-2490.2020.04.006 (in Chinese) |
| [41] |
封海生, 姚红涛, 王志宽, 等. 发酵来源β-胡萝卜素和虾青素对蛋鸡产蛋品质与抗氧化功能的影响[J]. 当代畜牧, 2020(1): 14-18. FENG H S, YAO H T, WANG Z K, et al. Effects of beta-carotene and astaxanthin from fermentation on egg quality and antioxidant capacity in laying hens[J]. Contemporary Animal Husbandry, 2020(1): 14-18. (in Chinese) |
| [42] |
HUSSAIN T, TAN B, YIN Y L, et al. Oxidative stress and inflammation: what polyphenols can do for us?[J]. Oxid Med Cell Longev, 2016, 2016: 7432797. |
| [43] |
PLATNICH J M, MURUVE D A. NOD-like receptors and inflammasomes: A review of their canonical and non-canonical signaling pathways[J]. Arch Biochem Biophys, 2019, 670: 4-14. DOI:10.1016/j.abb.2019.02.008 |
| [44] |
SATOH T, AKIRA S. Toll-like receptor signaling and its inducible proteins[J]. Microbiol Spectr, 2016, 4(6). DOI:10.1128/microbiolspec.MCHD-0040-2016 |
| [45] |
DEVCHAND P R, ZIOUZENKOVA O, PLUTZKY J. Oxidative stress and peroxisome proliferator-activated receptors: reversing the curse?[J]. Circ Res, 2004, 95(12): 1137-1139. DOI:10.1161/01.RES.0000151331.69399.b2 |
| [46] |
MORAN E, DING L X, WANG Z X, et al. Protective and antioxidant effects of PPARα in the ischemic retina[J]. Invest Ophthalmol Vis Sci, 2014, 55(7): 4568-4576. DOI:10.1167/iovs.13-13127 |
| [47] |
RADI E, FORMICHI P, BATTISTI C, et al. Apoptosis and oxidative stress in neurodegenerative diseases[J]. J Alzheimers Dis, 2014, 42(S3): S125-S152. DOI:10.3233/JAD-132738 |
| [48] |
XU T, DING W, JI X Y, et al. Oxidative stress in cell death and cardiovascular diseases[J]. Oxid Med Cell Longev, 2019, 2019: 9030563. |
(编辑 范子娟)



