牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)属于黄病毒科(Flaviviridae)瘟病毒属(Pestivirus),是一种线性、单股、正链、RNA病毒[1]。该病毒不仅感染牛羊等家畜,在鹿、骆驼等野生动物中也有感染的报道,常造成高热、腹泻、白细胞减少、黏膜病、繁殖机能障碍和免疫抑制等,也会造成孕畜流产、产死胎、产木乃伊胎和畸形胎[2-3]。早期妊娠母畜感染NCP型BVDV后会生产持续性感染的犊牛,即PI牛,终生带毒并不定期排毒,成为BVDV的重要传染源[4]。
哺乳动物的信号肽酶复合体由信号肽酶复合体亚基1(signal peptidase complex subunit 1,SPCS1)、SPCS2、SPCS3、SEC11A和SEC11C 5个亚基组成,其中SPCS1是微粒体信号肽酶复合物的重要组成部分,负责裂解许多分泌型和膜相关蛋白的细胞信号肽[5]。SPCS1是影响西尼罗病毒(WNV)[6]、日本脑炎病毒(JEV)[7]、丙型肝炎病毒(HCV)[6-7]、登革热病毒(DENV)[8]、寨卡病毒(ZIKV)[9-10]、黄热病病毒(YFV)[5]等复制的重要宿主因子。Zhang等[6]通过CRISPR/Cas9全基因组文库筛选发现SPCS1对黄病毒科病毒的结构蛋白切割和具有感染性病毒的产生等具有重要的作用。通过RNA干扰或CRISPR/Cas9敲低SPCS1表达将显著性降低JEV、WNV、DENV、ZIKV、YFV和HCV等子代病毒的产生。BVDV与上述病毒同属于黄病毒科,但BVDV复制是否受到SPCS1的影响,目前尚未有报道。本文利用CRISPR/Cas9敲低SPCS1蛋白,BVDV感染SPCS1敲低细胞后,使用荧光定量PCR定量BVDV 5′非翻译区(untranslated region,UTR)mRNA水平、免疫荧光染色检测BVDV双链RNA(double-stranded RNA,dsRNA)量、观察BVDV感染致细胞病变效应(cytopathic effect,CPE)和测定子代病毒滴度等研究SPCS1对BVDV复制的影响,为BVDV的防控研发和感染机制的探究等提供重要依据。
1 材料与方法 1.1 细胞、病毒和质粒牛肾细胞(Madin-Darby bovine kidney cell,MDBK)、人胚肾细胞(human embryonic kidneys-293T,HEK-293T)购自上海细胞库,BVDV TC毒株由本学院传染病实验室冉多良教授惠赠[11],该毒株为CP型、1b亚型,大肠杆菌感受态细胞Stbl3购自北京博迈德基因技术有限公司,lentiCRISPR v2(52961)、pSPAX2(12260)和pMD2.G(12259)购自Addgene公司。
1.2 主要试剂和仪器胎牛血清、马血清、TRIzol、嘌呤霉素、聚凝胺、明胶、T4 DNA ligase购自Thermo Fisher Scientific,ECL显色试剂盒、Western细胞裂解液、牛血清白蛋白BSA、Triton X-100、抗荧光淬灭剂和山羊血清购自上海碧云天生物技术有限公司,BsmB I购自NEB公司,线性聚醚酰亚胺PEI(MW 40 000)购自美国Polysciences公司,核酸染料SYBR Green I和cDNA第一条链合成试剂盒购自北京天根生化科技有限公司,鼠抗dsRNA J2单克隆抗体(货号10010200)购自SCICONS公司,CoraLite488偶联山羊抗鼠IgG(H+L)(货号SA00013-1)、兔抗SPCS1多克隆抗体(货号11847-1-AP)和HRP偶联山羊抗兔IgG(H+L)(货号SA00001-2)购自Proteintech公司,超微量分光光度计(Onedrop)购自南京五义科技有限公司,实时荧光定量PCR仪(7500 Fast)购自Applied Biosystems公司,激光共聚焦显微镜(LSM 510)购自ZEISS公司。
1.3 sgRNA设计根据GenBank数据库中SPCS1基因(Gene ID:511453)序列,结合CHOPCHOP和Benchling等平台,设计靶向SPCS1基因的sgRNA和阴性对照Scramble sgRNA,具体序列信息见表 1,sgRNA由北京擎科生物科技有限公司合成。
|
|
表 1 sgRNA的序列信息 Table 1 Sequences information of sgRNA |
sgRNA融合、sgRNA插入慢病毒载体lentiCRISPR v2、转化、测序鉴定等参照Sanjana等[12]报道,构建成lentiCRISPR v2-SPCS1/Scramble sgRNA质粒。
1.5 慢病毒包装、感染和阳性细胞筛选在6孔细胞培养板用0.1%明胶溶液包被30 min,接种5×105个·孔-1HEK-293T细胞,待细胞密度约90%时,每孔加入2 μg lentiCRISPR v2-SPCS1/Scramble sgRNA、2 μg pSPAX2、1 μg pMD2.G和15 μL PEI,具体转染步骤参照胡新艳等[13]报道,转染48 h收集慢病毒悬液,8 000 r·min-1离心5 min,收集上清并用0.45 μm滤器过滤,获得SPCS1 sgRNA和Scramble sgRNA慢病毒。取2 mL慢病毒悬液加入2 mL MDBK细胞(约5×105个),混匀后加入4 μL聚凝胺(8 mg·mL-1),置于细胞培养箱中继续培养24 h,更换新鲜的细胞培养液后继续培养48 h,用终浓度为2 mg·mL-1的嘌呤霉素筛选阳性细胞,连续筛选5代次后,获得SPCS1 KD和Scramble阳性细胞。
1.6 检测SPCS1蛋白表达水平分别收集5×105个SPCS1 KD和Scramble阳性细胞,1 000 r·min-1离心5 min,弃掉培养液后加入500 μL含终浓度为1 mmol·L-1 PMSF的RIPA裂解液,混匀后置于冰上静置10 min,12 000 r·min-1 4 ℃离心10 min,收集上清,使用BCA蛋白浓度测定试剂盒测定总蛋白浓度。分别取60 μg总蛋白进行Western blot检测,一抗使用兔抗SPCS1多克隆抗体(1∶500稀释),二抗使用HRP偶联山羊抗兔IgG(H+L)抗体(1∶5 000稀释),具体步骤参照胡新艳等[13]文献。
1.7 检测SPCS1 KD细胞活性将Scramble和SPCS1 KD细胞消化后计数,接种105个·孔-1的细胞于6孔细胞培养板中,各孔加入2 mL细胞培养液后,置于相同条件下继续培养,分别在接种后12、24、36、48和72 h时,使用胰酶消化后加入台盼蓝溶液对细胞进行染色,活细胞计数,每个时间点平行重复计数4个孔。
1.8 荧光定量PCR检测BVDV mRNA水平变化分别接种相同数量的Scramble和SPCS1 KD细胞至6孔细胞培养板,培养8 h后感染10 000 TCID50的BVDV,孵育2 h后更换成细胞维持液(5%马血清+DMEM);按照BVDV感染12、24、36和48 h后收集细胞及培养液,TRIzol裂解液处理细胞并提取总RNA,反转录1 μg RNA成cDNA,利用荧光定量PCR检测BVDV 5′UTR mRNA水平。荧光定量PCR引物、反应体系及条件、标准曲线参照田瑞鑫等[14]报道。
1.9 免疫荧光染色检测BVDV dsRNA量将单个细胞爬片放入24孔板中,用0.1%明胶溶液包被处理30 min后,分别接种相同数量的Scramble和SPCS1 KD细胞,BVDV感染步骤和感染时间同“1.8”;感染不同时间后收集细胞并依次使用4%多聚甲醛和0.5% Triton X-100处理细胞20 min;加入新鲜配制的封闭液(0.5% Triton X-100、1% BSA、1%山羊血清)封闭1 h;加入1∶1 200稀释的兔抗dsRNA mAb J2溶液,置于4 ℃孵育过夜;次日加入1∶200稀释的CoraLite488偶联山羊抗兔IgG(H+L)溶液,置于常温静置2 h;使用抗荧光淬灭剂封片,在激光共聚焦显微镜下观察和分析绿色荧光标记的dsRNA分布和荧光量。
1.10 观察BVDV感染细胞CPE变化用胰酶消化Scramble和SPCS1 KD细胞并进行细胞计数后,接种相同数量的细胞至6孔细胞培养板中,BVDV感染步骤和感染时间同“1.8”;感染不同时间后使用倒置显微镜观察CPE变化。
1.11 测定子代病毒TCID50细胞接种方法、病毒感染和感染时间等步骤同“1.8”,感染不同时间后反复冻融3次,收集病毒悬液后6 000 r·min-1 4 ℃离心3 min,弃细胞沉淀后将病毒进行倍比稀释,最终稀释度为100、10-1、10-2…… 10-8,分别接种至细胞密度约70%的MDBK细胞中,每个稀释度做8个重复试验,孵育2 h后更换成5%马血清的细胞维持液,继续培养4~5 d观察CPE情况,统计半数及以上细胞发生CPE的孔数,使用Reed-Muench法计算子代病毒TCID50[15]。
1.12 数据统计数据结果以“平均值±标准误(x±sx)”表示。利用SPSS 19.0(IBM)对重复数据进行独立样本t检验分析,*.P < 0.05和**.P < 0.01分别表示数据差异显著和极显著。
2 结果 2.1 Western blot鉴定SPCS1蛋白敲低情况用Western blot检测SPCS1 KD细胞中SPCS1蛋白表达情况,同时使用细胞计数法检测活细胞数量。结果如图 1所示,与对照Scramble的SPCS1蛋白表达量相比,SPCS1 KD细胞中的SPCS1蛋白表达量显著性降低,表明成功获得SPCS1敲低的细胞SPCS1 KD。与Scramble对照细胞相比,SPCS1 KD细胞的活性并未发生显著性差异(图 2),表明SPCS1敲低未影响MDBK细胞活性,为后续研究提供材料。
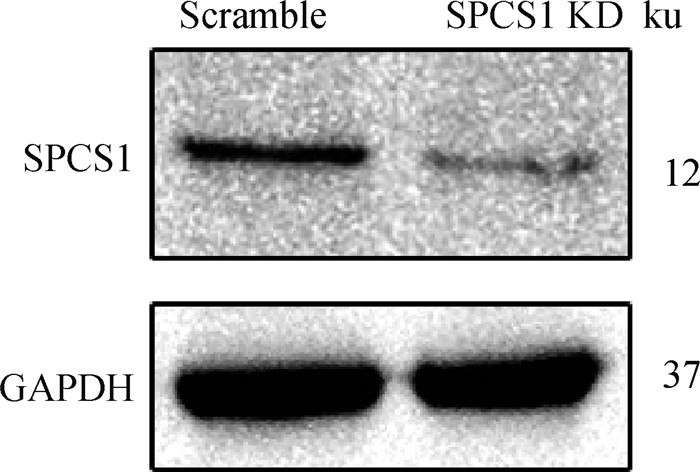
|
图 1 Western blot检测SPCS1蛋白表达 Fig. 1 Western blot detection of SPCS1 protein expression |

|
图 2 细胞活性检测 Fig. 2 Detection of cell activity |
荧光定量PCR检测BVDV感染Scramble和SPCS1 KD细胞不同时间后BVDV 5′UTR mRNA表达情况。结果如图 3所示,BVDV感染SPCS1 KD细胞后,与对照Scramble相比,BVDV 5′ UTR mRNA的水平在不同时间段内都极显著下降(P < 0.01),最高降低93.1%(BVDV感染48 h时),表明敲低SPCS1显著性影响BVDV mRNA复制。
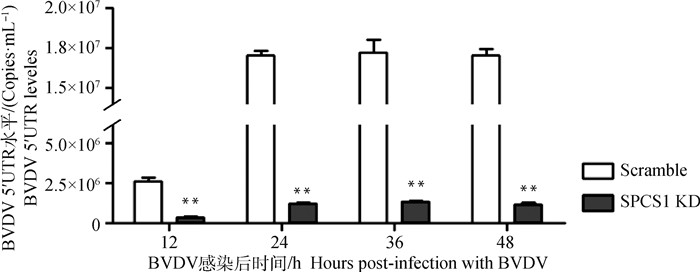
|
**.P < 0.01 图 3 荧光定量PCR检测BVDV 5′UTR mRNA水平 Fig. 3 Detection of BVDV 5′UTR mRNA levels by real-time quantitative PCR |
SPCS1 KD和Scramble细胞感染BVDV不同时间后,免疫荧光染色检测BVDV dsRNA量变化。结果如图 4所示,BVDV感染SPCS1 KD细胞不同时间后,与对照细胞Scramble相比,SPCS1 KD细胞中的绿色荧光明显减少,表明BVDV dsRNA积累显著性减少,证明敲低SPCS1会抑制BVDV的复制。
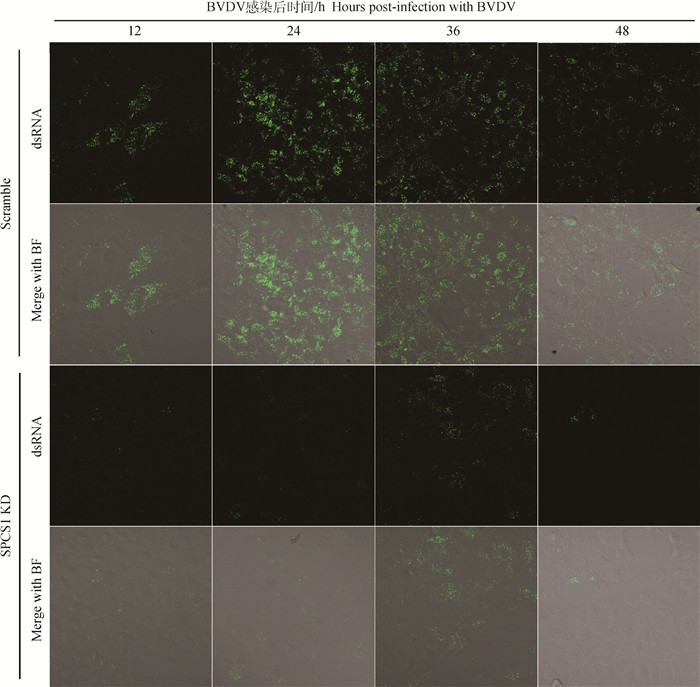
|
图 4 免疫荧光染色检测BVDV dsRNA量(630×) Fig. 4 Immunofluorescence staining to detect the amount of BVDV dsRNA (630×) |
在Scramble和SPCS1 KD细胞中感染BVDV不同时间后,倒置显微镜下观察BVDV感染不同细胞后致细胞CPE变化情况。结果如图 5所示,Scramble细胞感染BVDV 24 h后,细胞形态发生变化,呈现典型的CPE现象,如细胞聚集、变圆、皱缩、脱落死亡等,Scramble细胞被感染48 h时大部分发生细胞脱落;与Scramble细胞相比,BVDV感染SPCS1 KD细胞12、24、36 h时细胞的CPE不明显,BVDV感染48 h时细胞才出现较弱的CPE。结果表明SPCS1敲低阻止BVDV复制,减少细胞内BVDV数量,从而导致被感染的细胞CPE现象减弱。
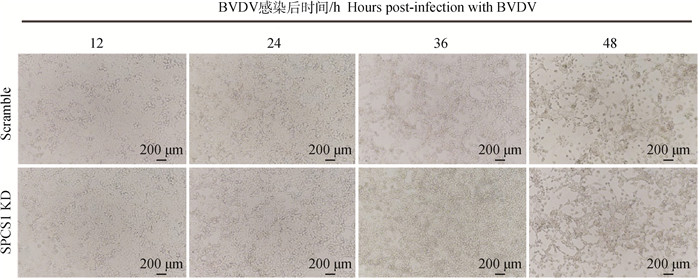
|
图 5 BVDV感染不同时间段CPE情况 Fig. 5 CPE in different time periods of BVDV infection |
Reed-Muench法测定BVDV感染Scramble和SPCS1 KD细胞后不同时间段子代病毒滴度变化情况。结果显示,BVDV感染SPCS1 KD细胞后24、36和48 h时与Scramble细胞相比,SPCS1 KD细胞的子代病毒滴度显著性降低(P < 0.01),BVDV感染48 h时子代病毒滴度降低最多,下降95.8%,表明SPCS1基因敲低影响BVDV胞内复制,降低子代病毒颗粒的数量。
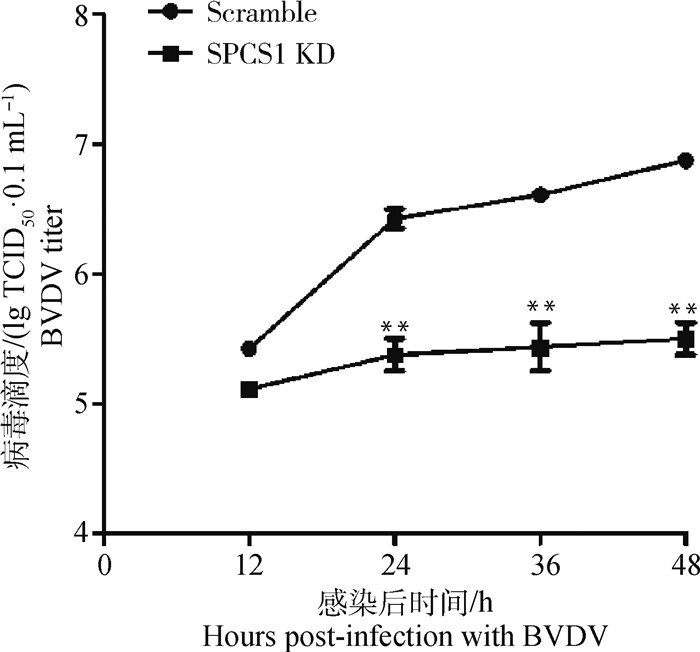
|
图 6 BVDV感染不同时间段子代病毒滴度测定 Fig. 6 Determination of viral titers of progeny in different time periods of BVDV infection |
SPCS1与SPCS2、SPCS3、SEC11A和SEC11C等5个亚基,共成组成信号肽酶复合体[16]。SPCS1在WNV、HCV、ZIKV、YFV、DENV和JEV等黄病毒科病毒复制过程中发挥重要的作用。Suzuki等[8]报道发现SPCS1能与HCV结构蛋白E2和非结构蛋白NS2相互作用,进而影响膜相关的E2-NS2复合物产生,参与HCV包装释放等复制环节。Ma等[7]研究发现SPCS1与JEV非结构蛋白NS2B的两个跨膜结构域NS2B(1—49)和NS2B(84—131)相互作用,从而介导SPCS1与NS2B相互作用,影响JEV蛋白的翻译后加工和病毒体的装配。而同属于黄病毒科的BVDV的复制是否也受SPCS1调控?本研究通过CRISPR/Cas9敲低SPCS1蛋白,结合荧光定量PCR、免疫荧光染色、CPE观察和子代病毒滴度测定等发现,敲低SPCS1通过降低BVDV 5′UTR mRNA水平,减少dsRNA量,BVDV感染造成的CPE现象也有所减弱,降低子代病毒水平来抑制BVDV的复制,表明SPCS1敲低影响BVDV复制,进而证明SPCS1在BVDV复制过程中起到重要的作用。本研究进一步证明SPCS1在黄病毒科病毒复制的重要作用,SPCS1有望成为黄病毒科病毒防控的重要药物靶点。
本课题组使用蛋白邻近标记技术筛选与BVDV离子通道蛋白p7互作的蛋白,这些蛋白可能参与到BVDV p7蛋白翻译、折叠、加工、修饰、转运、聚合等形成过程,经基因编辑后发现SPCS1敲低显著性影响BVDV复制,降低BVDV子代病毒颗粒的形成,表明SPCS1蛋白参与BVDV复制过程。黄病毒科p7蛋白与NS2蛋白共定位于宿主细胞膜,辅助病毒入侵和释放[17]。SPCS1蛋白是否影响p7和NS2蛋白共定位、互作和聚合成复合物等,尚不清楚,亟待研究探索。
4 结论使用CRISPR/Cas9技术敲低SPCS1后显著性影响BVDV复制。
| [1] |
李玲. 猪瘟病毒新型反向遗传操作技术平台的建立和病毒复制调控研究[D]. 武汉: 武汉大学, 2015. LI L. A novel reverse genetics system for classical swine fever virus and the viral replication regulation[D]. Wuhan: Wuhan University, 2015. (in Chinese) |
| [2] |
高闪电, 王锦明, 田占成, 等. 1株牛病毒性腹泻病毒分离毒株的基因组特征[J]. 畜牧兽医学报, 2020, 51(8): 1913-1922. GAO S D, WANG J M, TIAN Z C, et al. Genomic characteristics of a bovine viral diarrhea virus isolate[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(8): 1913-1922. (in Chinese) |
| [3] |
马振国. 新疆地区牛病毒性腹泻-粘膜病流行病学调查[D]. 石河子: 石河子大学, 2019. MA Z G. Epidemiological survey of bovine viral diarrhea-mucosal disease in Xinjiang[D]. Shihezi: Shihezi University, 2019. (in Chinese) |
| [4] |
KHODAKARAM-TAFTI A, FARJANIKISH G H. Persistent bovine viral diarrhea virus (BVDV) infection in cattle herds[J]. Iran J Vet Res, 2017, 18(3): 154-163. |
| [5] |
ROTHER M, NAUMANN M. Signal peptidase complex subunit 1 is an essential Zika virus host factor in placental trophoblasts[J]. Virus Res, 2021, 296: 198338. DOI:10.1016/j.virusres.2021.198338 |
| [6] |
ZHANG R, MINER J J, GORMAN M J, et al. A CRISPR screen defines a signal peptide processing pathway required by flaviviruses[J]. Nature, 2016, 535(7610): 164-168. DOI:10.1038/nature18625 |
| [7] |
MA L, LI F, ZHANG J W, et al. Host factor SPCS1 regulates the replication of Japanese encephalitis virus through interactions with transmembrane domains of NS2B[J]. J Virol, 2018, 92(12): e00197-18. DOI:10.1128/JVI.00197-18 |
| [8] |
SUZUKI R, MATSUDA M, WATASHI K, et al. Signal peptidase complex subunit 1 participates in the assembly of hepatitis C virus through an interaction with E2 and NS2[J]. PLoS Pathog, 2013, 9(8): e1003589. DOI:10.1371/journal.ppat.1003589 |
| [9] |
ESTOPPEY D, LEE C M, JANOSCHKE M, et al. The natural product cavinafungin selectively interferes with Zika and dengue virus replication by inhibition of the host signal peptidase[J]. Cell Rep, 2017, 19(3): 451-460. DOI:10.1016/j.celrep.2017.03.071 |
| [10] |
YI W, PING Z. Recent advances in the identification of the host factors involved in dengue virus replication[J]. Virol Sin, 2017, 32(1): 23-31. DOI:10.1007/s12250-016-3902-6 |
| [11] |
梁霄勇, 季新成, 冉多良. 牛病毒性腹泻病毒TC株的分离鉴定及E0基因的序列分析[J]. 畜牧与兽医, 2016, 48(7): 36-40. LIANG X Y, JI X C, RAN D L. Isolation and identification of bovine viral diarrhea virus TC strain and sequence analysis of E0 gene[J]. Animal Husbandry & Veterinary Medicine, 2016, 48(7): 36-40. (in Chinese) |
| [12] |
SANJANA N E, SHALEM O, ZHANG F. Improved vectors and genome-wide libraries for CRISPR screening[J]. Nat Methods, 2014, 11(8): 783-784. DOI:10.1038/nmeth.3047 |
| [13] |
胡新艳, 郭妍婷, 赵新艳, 等. 紧密连接蛋白Occludin影响牛病毒性腹泻病毒感染[J]. 中国兽医学报, 2020, 40(11): 2119-2126. HU X Y, GUO Y T, ZHAO X Y, et al. Tight junction protein Occludin affects bovine viral diarrhea virus infection[J]. Chinese Journal of Veterinary Science, 2020, 40(11): 2119-2126. (in Chinese) |
| [14] |
田瑞鑫, 李胜男, 胡新艳, 等. 牛miR-29b影响牛病毒性腹泻病毒感染BALB/c小鼠的作用[J]. 中国兽医学报, 2020, 40(2): 264-271. TIAN R X, LI S N, HU X Y, et al. Effect of bovine miRNA-29b on bovine viral diarrhea virus infection in BALB/c mice[J]. Chinese Journal of Veterinary Science, 2020, 40(2): 264-271. (in Chinese) |
| [15] |
LEI C F, YANG J, HU J, et al. On the calculation of TCID50 for quantitation of virus infectivity[J]. Virol Sin, 2021, 36(1): 141-144. DOI:10.1007/s12250-020-00230-5 |
| [16] |
CUI J Q, CHEN W, SUN J H, et al. Competitive inhibition of the endoplasmic reticulum signal peptidase by non-cleavable mutant preprotein cargos[J]. J Biol Chem, 2015, 290(47): 28131-28140. DOI:10.1074/jbc.M115.692350 |
| [17] |
JONES C T, MURRAY C L, EASTMAN D K, et al. Hepatitis C virus p7 and NS2 proteins are essential for production of infectious virus[J]. J Virol, 2007, 81(16): 8374-8383. DOI:10.1128/JVI.00690-07 |
(编辑 白永平)



