2. 湖南农业大学,湖南兽药工程技术研究中心,长沙 410128
2. Hunan Engineering Technology Research Center of Veterinary Drug, Hunan Agricultural University, Changsha 410128, China
多杀性巴氏杆菌(Pasteurella multocida)是一种分布广泛,能引起猪、羊、牛、鸡、兔、马、鹅、人等多个宿主致病的革兰阴性菌。常在宿主营养不良和抵抗力下降时引起巴氏杆菌病,如禽霍乱、猪的萎缩性鼻炎和牛的呼吸道疾病等,对动物和人类健康造成极大的危害[1-2]。根据荚膜抗原免疫原性的差异,多杀性巴氏杆菌可分为A、B、D、E和F 5个荚膜血清型,16个脂多糖血清型(Heddleston血清型,分成L1 ~ L16)[3-4]。随着分子生物学技术的发展,现已建立了多种分子分型方法,如多位点序列分型法(MLST)[5]、基于脂多糖外核编码基因簇的PCR分型法[6]。
P. multocida的致病性与荚膜等多种毒力因子有关。它们通过损伤宿主的有关组织和侵害宿主的防御系统并激发炎症反应来促进该菌的侵袭和定殖,从而引起疾病[1-2]。P. multocida的毒力因子多种多样,包括荚膜、脂多糖(lipopolysaccharide,LPS)、菌毛、黏附素、毒素、铁调节和铁摄取蛋白、透明质酸酶、参与唾液酸代谢的酶、多种外面蛋白等[1, 7-8]。不同血清型的P. multocida有一定的宿主偏好性,P. multocida毒力因子的分布在不同血清型以及同一血清型的不同菌株之间存在多态性[9-11]。研究不同菌株的毒力因子特点,对于了解P. multocida的致病机制以及巴氏杆菌病的防治具有重要的参考价值。
P. multocida CS株是从发病猪的肺部病变组织分离到的一个强毒株,为探讨该病原菌的致病机制,作者对其致病基因组进行了分析,研究结果将为更进一步了解P. multocida CS株致病作用的分子机制积累资料。
1 材料与方法 1.1 病原菌的分离和分型鉴定P. multocida CS株由湖南农业大学动物医学院李润成博士从猪肺疫病患猪肺部病料中分离得到。分离株经含有5%小牛血清的TSB 37 ℃培养过夜,收集菌液,按TIANamp Bacteria DNA Kit细菌基因组DNA提取试剂盒说明[天根生化科技(北京)有限公司]提取P. multocida CS株基因组DNA,利用16S rRNA基因引物(F:5′-AGAGT-TTGATCCTGGCTCAG-3′;R: 5′-GGTTACCTTGTTACGACTT-3′)进行PCR鉴定,测序后,经分析确定是否为P. multocida。根据全基因组序列中有关DNA片段,确定P. multocida CS株的荚膜血清型、MLST和Heddleston血清型分型[6, 12]。
1.2 P. multocida CS株的毒力鉴定和小鼠致病试验取4周龄重18~22 g SPF昆明小鼠(购自湖南斯莱克景达实验动物有限公司)50只。随机分为A、B、C、D和E 5组,每组10只。将细菌培养至对数生长期,收集菌液,调整成1.0×102、1.0×103、1.0×104、1.0×105 CFU·mL-1多个浓度,分别按200 μL· 只-1对A、B、C、D组小鼠进行滴鼻攻毒。对照组E接种等量的生理盐水。攻毒12 h后,记录小鼠发病和死亡情况,连续观察7 d。利用寇氏法计算半致死剂量(median lethal dose,LD50)[13]。
调整培养至对数生长期的细菌至浓度为5×102 CFU·mL-1,按200 μL·只-1滴鼻感染小鼠,观察小鼠感染后的临床表现和死亡情况。解剖小鼠,观察肺部的眼观病理学变化;取小鼠肺部病变组织,10%福尔马林固定,常规石蜡切片,HE染色,显微镜下观察小鼠肺部组织病理学变化。
1.3 全基因组测序及组装收集于含5%小牛血清的TSB中37 ℃过夜培养的细菌,按TIANamp Bacteria DNA Kit细菌基因组DNA提取试剂盒[天根生化科技(北京)有限公司]说明提取P. multocida CS株基因组DNA。用NanoDrop 2000 (Thermo Scientific)核酸浓度检测仪检测样品DNA的纯度和浓度。
细菌基因组测序和组装由上海美吉生物医药科技有限公司完成。即:取检测合格的基因组DNA构建基因组小片段文库(350 bp),利用Illumina2的HiSeq2500测序平台进行双末端测序,测序深度200×。获得的原始数据去除引物、接头和筛除低质量的数据之后,利用短序列组装软件SOAPdenovo2 (http://soap.genomics.org.cn/) 对二代测序后的优化序列拼接,得到最优的contigs组装结果。contigs之间的拼接组装由PCR扩增及测序的方式完成。
1.4 基因预测及功能注释分析使用Glimmer (http://ccb.jhu.edu/software/glimmer/index.shtml)预测细菌染色体基因组中的CDs,利用tRNAscan-SE v2.0软件(http://trna.ucsc.edu/software/)预测基因组中转运RNA (tRNA)基因,利用Barrnap软件(https://github.com/tseemann/barrnap)预测基因组中核糖体RNA(rRNA)基因。编码序列的功能注释通过与GO(gene ontology)、COG(clusters of orthologous groups)和KEGG(kyoto Encyclopedia of genes and genomes)数据库Blast比对完成。
1.5 致病基因组分析毒力基因预测和病原菌宿主互作采用Diamond(https://github.com/bbuchfink/diamond)和PHI(http://www.phi-base.org/)数据库注释比较分析软件进行比对分析,毒力基因注释使用致病菌毒力因子数据库(The virulence factor database,VFDB)(http://www.mgc.ac.cn/VFs/)进行,分泌系统采用KEGG数据库(http://www.genome.jp/kegg/)进行注释。分泌蛋白分析采用信号肽预测工具SignalP(http://www.cbs.dtu.dk/services/SignalP)进行。双组分调控系统由hmmer3(http://www.hmmer.org/)预测,并筛选与分泌系统相关蛋白。
1.6 进化分析查找GenBank数据库,下载不同地域、不同宿主来源和不同血清型具有全基因组序列的P.multocida 67株,利用mafft进行单拷贝同源基因对齐,经Gblocks进行非同源片段剪切后,使用RaAXML的最大释然法(maximum likelihood,ML)构建进化树。
2 结果 2.1 P. multocida CS株对小鼠的致病性分析将16S rRNA基因PCR扩增产物的测序结果,经Blast分析,鉴定该菌为血清A型。毒力测定结果表明,小鼠感染P. multocida后48 h,A和E组全部存活,且未见显著临床症状;B、C、D组小鼠逐渐显现精神不振,食欲下降,被毛粗乱,闭目,嗜睡等症状;C组和D组小鼠全部死亡;B组感染后48 h 6只死亡,72 h后,又有3只死亡,余下的1只逐渐恢复进食,7 d后恢复正常。根据寇式法计算P. multocida CS株对小鼠的LD50为5×102CFU·mL-1。可见,该分离株毒力较强。
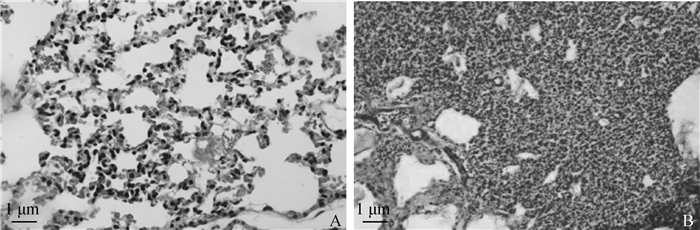
发病小鼠肺眼观病变可见出血点、淤血和水肿现象。组织病理学可观察到肺泡壁增生塌陷明显,肺泡腔减小,有大量的炎性渗出和炎症细胞(图 1)。
|
A.正常小鼠肺组织;B.感染小鼠肺组织。扫文章首页OSID码可查看彩图 A.Histological section of health mice; B. Histopathical section of infected mice. The color pictures can be found by scanning the OSID code on the front page 图 1 P. multocida CS株感染小鼠肺部的组织病理学观察 Fig. 1 Histopathogical observation of lungs in mice infected with P. multocida CS strain |
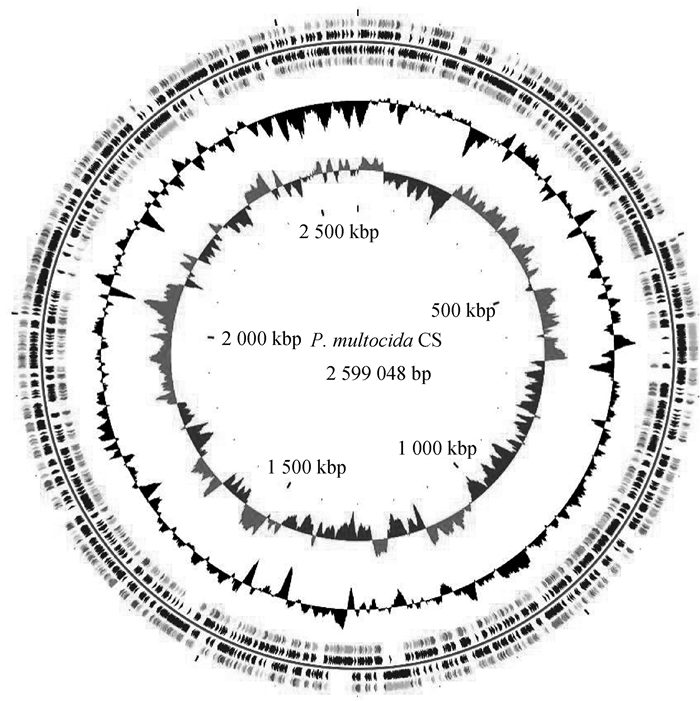
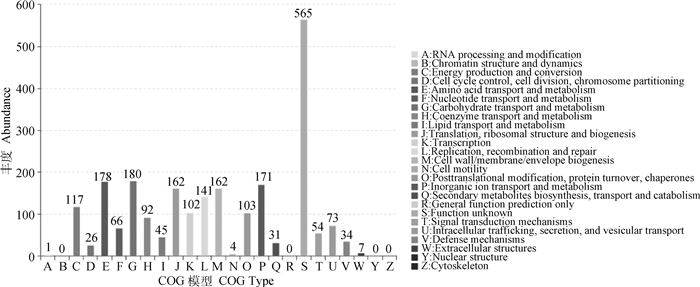
将测序后的P. multocida CS株全基因组信息提交至NCBI,获得登录号SUB11119617。通过对CS株的全基因组序列分析发现,该菌株全基因组大小为2 599 048 bp,G+C含量为39.932%,编码2 580个基因,其中tRNA53个,rRNA3个。其全基因组的遗传结构如图 2。序列分析发现,该菌株为L6型。结合血清型鉴定结果,将其命名为P. multocida CS株(type A: L6)。编码基因的COG分类如图 3。
|
扫文章首页OSID码可查看彩图。圈图从外到内第1圈和第4圈为正链、负链上的CDS,不同的颜色表示不同的COG功能分类;第2圈和第3圈分别为正链、负链上的CDS、tRNA、rRNA;第五圈为GC含量,向外的部分表示该区域GC含量高于全基因组平均GC含量,向内的部分表示该区域GC含量低于全基因组平均GC含量;第六圈为GC-Skew值,一般前导链GC skew>0,后滞链GC skew < 0,也可以辅助判断复制起点(累计偏移最小值)和终点(累计偏移最大值),尤其对环状基因组最为重要;最内一圈为基因组大小标识 The color picture can be found by scanning the OSID code on the front page. Circle 1-4 indicate CDs distrubition of positive and negative chain (colour indicates gene function classication) in scaffold sequence; Circle 2 and 3 indicate CDS, tRNA, rRNA gene distrubition of positive and negative chain in scaffold sequence; Circle 5 indicates GC content. Outside part indicates that GC content is higher than the average content and inside part indicates less than the average content; Circle 6, GC skew. G+C skew > 0 (yellow green) means this region is leadin g chain and G+C skew < 0 (purple) means this region is logging chain 图 2 P. multocida CS株基因组圈图 Fig. 2 Circular genome maps of P. multocida CS strain from outside to inside indicate the following |
|
扫文章首页OSID码可查看彩图 The color picture can be found by scanning the OSID code on the front page 图 3 P. multocida CS株核心基因的COG注释结果 Fig. 3 COG annotation results of core gene set of P. multocida CS strain |
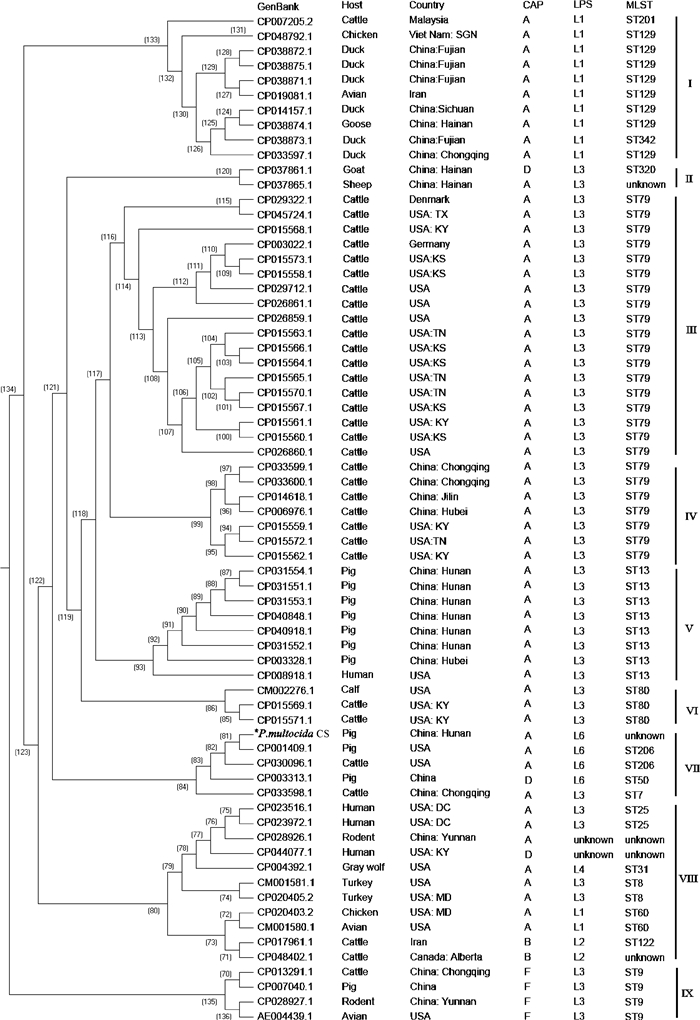
通过分析筛选到31个看家基因(dnaG、frr、infC、nusA、pgk、pyrG、rplA、rplB、rplC、rplD、rplE、rplF、rplK、rplL、rplM、rplN、rplP、rplS、rplT、rpmA、rpoB、rpsB、rpsC、rpsE、rpsI、rpsJ、rpsK、rpsM、rpsS、smpB、tsf),以此构建基于67株P.multocida的系统进化树(图 4)。从图可见,67株P. multocida可分为7个分支,其中,F血清型为独立的1个分支,A、B和D血清型构成另外6个分支。P. multocida CS株属第Ⅶ分支,该分支包含1个猪源性、2个牛源性的血清A型毒株(CP001409.1、CP030096.1、CP033598.1),和1个猪源性的D型毒株(CP003313.1)。同时作者也发现P. multocida血清A、B和D型未形成独立的分支。同时,从图还可分析发现,寄生于禽类的主要为L1型,寄生于牛的主要为L3型,寄生于猪的主要为L3型和L6型。可见,相对L血清型分类系统,P.multocida存在一定的宿主偏好性(图 4)。
|
图 4 P. multocida CS株的系统进化分析 Fig. 4 Phylogenetic relationship of P. multocida CS strain |
本研究从P. multocida CS株全基因组共筛选到254个毒力基因,其中141个可利用VFDB的毒素分类体系进行归类。这些基因共分为4大类(表 1),即:43个非特异性毒力因子(nonspecific virulence factor)编码基因,其中,铁摄取相关基因40个和胞外酶基因3个;37个防御性毒力因子(defensive virulence factors)编码基因,其中抗吞噬基因23个,细胞代谢基因2个,相突变(phase variation)基因3个和压力蛋白基因9个;58个攻击性毒力因子(offensive virulence factors)基因,其中黏附基因35个,分泌系统基因15个,侵入基因7个和肌动蛋白运动基因1个;毒力调节相关基因(regulation of virulence-associated genes)4个,这一类全部为调节基因。
|
|
表 1 P. multocida CS株毒力基因分类 Table 1 Classification of virulence factor genes of P. multocida CS strain |
通过对P. multocida CS株与本研究引用的67个不同菌株的毒力基因比较发现,铁摄取系统相关的多个基因在不同菌株间的出现频率存在差异(表 2)。tbpA基因在血清A型的总分布频率为66.67%,但不同宿主检出率差异较大,其中,羊和人P. multocida检出率为0%,禽P. multocida检出率为87.5%,猪P. multocida检出率为12.5%,牛P. multocida检出率为10%。就血清型而言,tbpA基因在牛P. multocida血清B型分布频率为50.00%,牛P. multocida血清D和F型的基因组均未检测到,irp基因在血清A型分布频率为86.67%,猪、牛和人P. multocida检测率为100%,禽P. multocida为87.5%,猪P. multocida血清D型为100%,山羊和人P. multocida未检测到,山羊和人P. multocida血清B型与F型分布频率都为0%。tbpA和irp基因在P. multocida不同基因组的分布存在多态性。
|
|
表 2 P. multocida毒力基因在不同血清型分布的比较 Table 2 Distribution comparasion of P. multocida virulence factor genes among different serotye of P. multocida |
黏附相关的一些基因在不同宿主和不同血清来源的菌株出现的频率存在差异(表 2)。ppdD基因P. multocida血清A型的分布频率为66.67%,其中猪、狗和人P. multocida的检出率为100%,羊和啮齿动物P.multocida的检出率为0%,禽P. multocida的检出率为12.5%,牛P. multocida的检出率为90%;在P. multocida血清型B的分布频率为50.00%;在P. multocida血清型D和F型中分布频率为0%。ompA基因在P. multocida血清A型的分布频率为56.67%,其中猪和人P. multocida的检出率为100%,狗、啮齿动物和羊P. multocida的检出率为0%,牛的检出率为10%,禽的检出率为87.5%;猪P. multocida血清D型的检出率为100%,羊和人P. multocida的检出率为0%;在P. multocida血清B型和F型检出率为0%。可见,ppdD基因和ompA基因在P. multocida不同基因组的分布存在多态性,是否与细菌的毒力相关有待进一步研究。
2.5 P. multocida CS株的分泌系统和其转运蛋白分析分泌系统与细菌的毒力密切相关。分析发现,P. multocida血清型A的分泌系统包括Ⅰ型、Tat型、Sec-SRP型3种类型(表 3)。其中Ⅰ型分泌系统由hlyD基因组成,Tat型包括tatC、tatB、tatA 3个基因,Sec-SRP型分泌系统由11个基因组成,分别为secB、secY、yajC、secD、secF、secG、yidC、ffh、ftsY、secA、secE。Sec分泌系统的转运蛋白包括SPⅠ和Ⅱ 2种。本研发现,P. multocida CS株的Sec分泌系统的转运蛋白共153个,其中SPⅠ型149个(149/153),4个未定型。经TMHMM预测发现,这些SPⅠ型分泌蛋白有26个为跨膜蛋白,19个蛋白含1个跨膜区,有2个含2个跨膜区,2个含3个跨膜区,1个有5个跨膜区,1个含8个跨膜区,10个跨膜区的有1个。
|
|
表 3 P. multocida CS株的分泌系统 Table 3 Secretion system of P. multocida CS strain |
通过对不同血清型菌株分泌系统的基因分布频率分析发现,hlyD基因在不同血清型的分布差异明显,血清A型菌株分布频率为60%,B型菌株分布频率为50%,D型菌株分布频率为66.67%,F型菌株分布频率为0%。A型中不同宿主差异较大,其中禽、啮齿动物和羊P. multocida的检出率为0%,狗和人P. multocida的检出率为100%,猪P. multocida的检出率为87.5%,牛P. multocida的检出率为90%。猪和人P. multocida血清型D的检出率都为100%,羊P. multocida的检出率为0%。
2.6 P. multocida CS株的双组分调控系统分析双组分调控系统分析发现,P. multocida中存在30个双组分调控相关基因,分为3种类型(表 4)。其中调节子(regulator)相关基因有16个,包括pgtA、spot、fis、arcA、qseB、uhpA、cpxR、ttrR、yfbR、narP、cca、dgt、phoB、glnD、dctD和ompR,感应子(sensor)相关基因有12个,分别为gyrB、pgtB、parE、htpG、qseC、uhpB、cpxA、ttrS、msrC、narQ、mutL和phoR,包括hybrid相关基因有2个,即arcB和hamP。
|
|
表 4 不同血清型P. multocida菌株双组分调控系统比较 Table 4 Distribution comparasion of two-component signal transduction pathway genes among different serotye of P. multocida |
多杀性巴氏杆菌是一种宿主非常广泛的病原菌,可引起多种疾病[2]。P. multocida CS株分离于猪肺疫患猪病料中,经鉴定为多杀性巴氏杆菌血清A型。通过对基因组相关序列分析,发现该菌属于Heddleston血清型分类中的L6。小鼠毒性试验显示,该菌对小鼠的LD50为5×102 CFU·mL-1,显示较强毒性[14-15]。小鼠感染后,显现精神不振、食欲下降、被毛粗乱、嗜睡等症状。眼观病变可见,肺有出血点、淤血和水肿现象。组织病理学观察发现,致病小鼠肺泡壁增生塌陷明显,肺泡腔减小,伴有大量炎性渗出和炎性细胞。
本研究报道了P. multocida CS株全基因组信息(登录号SUB11119617)。通过对P. multocida CS株的全基因组序列分析,结果表明CS株全基因组大小为2 599 048 bp,G+C含量为39.932%,编码CDs为2 580个,占整个基因组长度的69.6%,编码基因的平均长度为952 bp。编码基因中有87.95%可进行COGs功能分类,29个为未知功能基因。此外,还有53个tRNA基因和3个rRNA基因。P. multocida CS株基因组的这些特征和以往报道的有关P. multocida基因组的基本相同[7, 16]。
通过对利用ML法对来源于不同宿主和地域具全基因组序列的67个P. multocida分离株构建基于31个全基因组单拷贝核心基因的系统进化分析发现,这些菌株可分为9个分支,其中所有血清型F为独立的一个分支,P. multocida血清A、B和D型形成另外8个分支,且这些分支没有明显地域偏好性。同时笔者也发现P. multocida血清A、B和D型未形成独立的分支。P. multocida CS属于第Ⅶ分支。该支中包含3个猪源性和2个牛源性血清A型毒株,以及1个来源于猪的D型毒株。对于Heddleston血清型而言,寄生于禽类的主要为L1型,寄生于牛的主要为L3型,寄生于猪的主要为L3型和L6型。显示一定的宿主偏好性。不同菌株在不同宿主存在优势分布。这一结果与Peng等[10]基于全基因组单拷贝核心基因的单核苷酸多态性聚类分析研究结果基本一致。
通过对进化树的分析发现,第Ⅱ、Ⅷ支包括血清A型、血清B型和D型,相对于血清型F,它们有较近的近缘关系。这个结果是否说明P. multocida血清A型、B型和D型为多元起源,有待进一步证明。进一步分析LPS血清型、Heddleston血清型和MLST的进化关系发现,血清F型皆为L3: ST9,其他LPS血清型未见ST9。ST9与血清F型是否有对应关系,有待进一步研究。同时还发现,第Ⅰ支主要为ST129,第Ⅲ和第Ⅳ支为ST79,第Ⅴ支为ST13,第Ⅵ、Ⅶ、Ⅷ支则存在多态性,这几支主要为血清A型,血清A型的进化与MLST分型的关系值得进一步分析。
毒力因子是衡量微生物毒性的重要指标,是引起宿主致病的重要因素[17-18]。分析发现P. multocida CS株含254个毒力相关基因,根据VFDB数据库的分类方法包括4大类11小类。通过对这些基因在不同血清型和同一血清型的不同分离株的分析发现,铁摄取系统、黏附系统和双组分调控系统相关的多个基因在不同的毒株(包括血清型)的出现频率存在多态性。铁是细菌生长发育的必需营养物质,铁结合受体是细菌铁摄入受体系统的重要组成部分,负责将铁运送到细菌的细胞内[19]。细菌的铁结合受体包括TbpA和TbpB。耶尔松菌的研究发现,TbpA是高度保守的蛋白,几乎存在于所有的致病菌株中,是细菌致病的重要分子基础[19]。本研究在P. multocida CS株的基因组只检测到tbpA基因,未发现tbpB基因。这和以往有关牛P. multocida的报道一致[20]。本研究发现,tbpA可存在牛、禽、猪P. multocida的基因组中,且出现频率在不同的血清型有差异。Ewers等[21]利用PCR和DNA杂交技术对289株不同宿主来源的P. multocida进行检测,发现tbpA只存在于反刍动物P. multocida的基因组中。Farahani等[22]利用PCR技术研究发现,在所检测的63株禽P. multocida和牛P. multocida中,禽P. multocida基因组tbpA的检出率为23.3%,牛P. multocida为100%。我国猪群P. multocida的tbpA检出率低于10%[23]。本试验采用的是GenBank记录的具有全基因组序列的P. multocida,二者的差异是否是因为PCR和DNA杂交技术的灵敏性所致,有待进一步证明。由于本研究采用的样本主要来自血清A型,其他血清型的样本数少,因此,tbpA在基因组中出现频率的多态性是否能反映P. multocida不同毒株毒力的差异,有待进一步研究。此外,还发现irp基因以及黏附的相关的ppdD基因和ompA基因在强毒血清型(血清A型)的分布较高。这种群体遗传学特征与前人的研究结果基本一致[21, 24-25]。这个结果是否推断这可能是同一血清型的不同菌株毒力强弱差异的原因之一,有待进一步研究[24-25]。
分泌系统与细菌的毒力息息相关[26]。本研究发现,P. multocida CS株的分泌系统由Ⅰ型(hly基因)、Tat型、Sec-SRP型3种类型组成。通过对不同血清型的P. multocida的分泌系统基因组成的比较分析发现hlyD基因在A型菌株的分布频率为60%,在B型菌株中的分布频率为50%,在D型菌株中的分布频率为66.67%,而F型菌株中分布频率为0%。hlyD基因的分布是否不同菌株毒力不同的原因有待进一步研究。
双组分信号转导系统(TCSs)是原核生物中最主要的信号转导系统,由感受蛋白和调节蛋白等组成[27-28]。有些双组分信号转导系统本身就为毒素蛋白[29]。双组分调控系统使细菌能够感知、响应和适应广泛的环境、压力源和生长条件,这些环境刺激在细菌致病菌侵染过程中可发挥调控作用[30]。病原菌在侵染不同阶段对微环境的适应不仅需要表达特定的毒力因子,还需要对代谢过程进行紧密的调控,在这些过程中,双组分调节系统都起到了重要作用[30]。本研究中笔者共发现16个调节相关基因,12个感应相关基因和2个hybrid相关基因。这些基因在不同血清型的分布存在多态性,这个现象与P. multocida的毒力关系,有待进一步研究。
4 结论通过对从猪体内分离的多杀性巴氏杆菌CS株的毒力分析发现,该分离株为血清型,具较强毒性,与1个猪源性、2个牛源P. multocida血清A型毒株和1个猪源性P. multocida 血清D型毒株有较近的亲缘关系。全基因组分析发现,其基因组的基本特征与GenBank收录的多杀性巴氏杆菌的基因组基本相同;基因组含254个毒力相关基因,其中铁摄取系统、黏附系统、分泌系统和双组分调控系统的基因在不同的血清以及同一血清型内出现频率存在多态性。该结果为进一步研究多杀性巴氏杆菌不同血清型的进化和致病机制等的研究积累了基础资料。
| [1] |
赵霞, 顾有方, 郭伟娜. 多杀性巴氏杆菌毒力因子研究进展[J]. 动物医学进展, 2020, 41(11): 100-103. ZHAO X, GU Y F, GUO W N. Advance in virulence factors of Pasteurella multocida[J]. Progress in Veterinary Medicine, 2020, 41(11): 100-103. DOI:10.3969/j.issn.1007-5038.2020.11.019 (in Chinese) |
| [2] |
HARPER M, BOYCE J D, ADLER B. Pasteurella multocida pathogenesis: 125 years after Pasteur[J]. FEMS Microbiol Lett, 2006, 265(1): 1-10. DOI:10.1111/j.1574-6968.2006.00442.x |
| [3] |
CARTER G R. Further observations on typing Pasteurella multocida by the indirect hemagglutination test[J]. Can J Comp Med Vet Sci, 1962, 26(10): 238-240. |
| [4] |
HEDDLESTON K L, GALLAGHER J E, REBERS P A. Fowl cholera: gel diffusion precipitin test for serotyping pasteurella multocida from avian species[J]. Avian Dis, 1972, 16(4): 925-936. DOI:10.2307/1588773 |
| [5] |
JOLLEY K A, MAIDEN M C J. BIGSdb: scalable analysis of bacterial genome variation at the population level[J]. BMC Bioinformatics, 2010, 11: 595. DOI:10.1186/1471-2105-11-595 |
| [6] |
HARPER M, JOHN M, TURNI C, et al. Development of a rapid multiplex PCR assay to genotype Pasteurella multocida strains by use of the lipopolysaccharide outer core biosynthesis locus[J]. J Clin Microbiol, 2015, 53(2): 477-485. DOI:10.1128/JCM.02824-14 |
| [7] |
PENG Z, WANG X R, ZHOU R, et al. Pasteurella multocida: genotypes and genomics[J]. Microbiol Mol Biol Rev, 2019, 83(4): e00014-19. |
| [8] |
李卉. 多杀性巴氏杆菌毒力因子及基因表达的研究进展[J]. 中兽医学杂志, 2015, 4(9): 12-13. LI H. Research progress on virulence factors and gene expression of Pasteurella multocida[J]. Chinese Journal of Traditional Veterinary Science, 2015, 4(9): 12-13. (in Chinese) |
| [9] |
PORS S E, CHADFIELD M S, SØRENSEN D B, et al. The origin of Pasteurella multocida impacts pathology and inflammation when assessed in a mouse model[J]. Res Vet Sci, 2016, 105: 139-142. DOI:10.1016/j.rvsc.2016.02.007 |
| [10] |
PENG Z, LIANG W, WANG F, et al. Genetic and phylogenetic characteristics of Pasteurella multocida isolates from different host species[J]. Front Microbiol, 2018, 9: 1408. DOI:10.3389/fmicb.2018.01408 |
| [11] |
DE OLIVEIRA FILHO J X, MORÉS M A Z, REBELLATO R, et al. Pathogenic variability among Pasteurella multocida type A isolates from Brazilian pig farms[J]. BMC Vet Res, 2018, 14(1): 244. DOI:10.1186/s12917-018-1565-2 |
| [12] |
TOWNSEND K M, BOYCE J D, CHUNG J Y, et al. Genetic organization of Pasteurella multocida cap Loci and development of a multiplex capsular PCR typing system[J]. J Clin Microbiol, 2001, 39(3): 924-929. DOI:10.1128/JCM.39.3.924-929.2001 |
| [13] |
张文举, 刘少杰, 张艳英, 等. 河北部分地区狐狸源肺炎克雷伯菌血清型鉴定、毒力基因及致病性检测[J]. 中国兽医学报, 2020, 40(4): 735-739. ZHANG W J, LIU S J, ZHANG Y Y, et al. Serotype identification, virulence genes and pathogenicity detection of Klebsiella pneumoniae from foxes in some areas of Hebei Province[J]. Chinese Journal of Veterinary Science, 2020, 40(4): 735-739. (in Chinese) |
| [14] |
刘海燕, 杨有文, 王远微, 等. 6株山羊源多杀性巴氏杆菌血清型、耐药性及致病性分析[J]. 黑龙江畜牧兽医, 2020(16): 65-68. LIU H Y, YANG Y W, WANG Y W, et al. Serotype, drug resistance and pathogenicity analysis of 6 strains of Pasteurella multocida from goats[J]. Heilongjiang Animal Science and Veterinary Medicine, 2020(16): 65-68. (in Chinese) |
| [15] |
韩猛立, 张星星, 吴桐忠, 等. 兔源巴氏杆菌分离与鉴定[J]. 新疆农业科学, 2018, 55(7): 1333-1342. HAN M L, ZHANG X X, WU T Z, et al. Isolation and Identification of Pasteurella multocida rabbits[J]. Xinjiang Agricultural Sciences, 2018, 55(7): 1333-1342. (in Chinese) |
| [16] |
LIU W J, YANG M J, XU Z F, et al. Complete genome sequence of Pasteurella multocida HN06, a toxigenic strain of serogroup D[J]. J Bacteriol, 2012, 194(12): 3292-3293. DOI:10.1128/JB.00215-12 |
| [17] |
KONG C, NEOH H M, NATHAN S. Targeting Staphylococcus aureus toxins: a potential form of anti-virulence therapy[J]. Toxins, 2016, 8(3): 72. DOI:10.3390/toxins8030072 |
| [18] |
张亚楠, 李亚菲, 陈汝佳, 等. A: L1 ST128型鸭源多杀性巴氏杆菌的耐药性及毒力分析[J]. 畜牧兽医学报, 2021, 52(10): 2852-2863. ZHANG Y N, LI Y F, CHEN R J, et al. Resistance and virulence analysis of type A: L1 ST128 Pasteurella multocida from ducks[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(10): 2852-2863. DOI:10.11843/j.issn.0366-6964.2021.010.016 (in Chinese) |
| [19] |
NOINAJ N, BUCHANAN S K, CORNELISSEN C N. The transferrin-iron import system from pathogenic Neisseria species[J]. Mol Microbiol, 2012, 86(2): 246-257. DOI:10.1111/mmi.12002 |
| [20] |
OGUNNARIWO J A, SCHRYVERS A B. Characterization of a novel transferrin receptor in bovine strains of Pasteurella multocida[J]. J Bacteriol, 2001, 183(3): 890-896. DOI:10.1128/JB.183.3.890-896.2001 |
| [21] |
EWERS C, LUBKE-BECKER A, BETHE A, et al. Virulence genotype of Pasteurella multocida strains isolated from different hosts with various disease status[J]. Vet Microbiol, 2006, 114(3-4): 304-317. DOI:10.1016/j.vetmic.2005.12.012 |
| [22] |
FARAHANI M F, ESMAELIZAD M, JABBARI A R. Investigation of iron uptake and virulence gene factors (fur, tonB, exbD, exbB, hgbA, hgbB1, hgbB2 and tbpA) among isolates of Pasteurella multocida from Iran[J]. Iran J Microbiol, 2019, 11(3): 191-197. |
| [23] |
彭忠, 梁婉, 艾伟诚, 等. 我国猪群中多杀性巴氏杆菌的基因型分析[J]. 畜牧兽医学报, 2019, 50(5): 1064-1072. PENG Z, LIANG W, AI W C, et al. Genotypical characteristics of swine Pasteurella multocida in China[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(5): 1064-1072. (in Chinese) |
| [24] |
HARPER M, BOYCE J D, ADLER B. The key surface components of Pasteurella multocida: capsule and lipopolysaccharide[J]. Curr Top Microbiol Immunol, 2012, 361: 39-51. |
| [25] |
MICHAEL F S, VINOGRADOV E, LI J J, et al. Structural analysis of the lipopolysaccharide from Pasteurella multocida genome strain Pm70 and identification of the putative lipopolysaccharide glycosyltransferases[J]. Glycobiology, 2005, 15(4): 323-333. DOI:10.1093/glycob/cwi015 |
| [26] |
尹磊, 祁克宗, 宋祥军, 等. 大肠杆菌Ⅲ型分泌系统2毒力岛研究进展[J]. 微生物学通报, 2017, 44(12): 3031-3037. YIN L, QI K Z, SONG X J, et al. Type Ⅲ secretion system 2 pathogenicity islands of Escherichia coli[J]. Microbiology China, 2017, 44(12): 3031-3037. (in Chinese) |
| [27] |
WILLIAMS R H, WHITWORTH D E. The genetic organisation of prokaryotic two-component system signalling pathways[J]. BMC Genomics, 2010, 11: 720. DOI:10.1186/1471-2164-11-720 |
| [28] |
WILLETT J W, CROSSON S. Atypical modes of bacterial histidine kinase signaling[J]. Mol Microbiol, 2017, 103(2): 197-202. DOI:10.1111/mmi.13525 |
| [29] |
LAUB M T, GOULIAN M. Specificity in Two-component signal transduction pathways[J]. Annu Rev Genet, 2007, 41: 121-145. DOI:10.1146/annurev.genet.41.042007.170548 |
| [30] |
BEIER D, GROSS R. Regulation of bacterial virulence by two-component systems[J]. Curr Opin Microbiol, 2006, 9(2): 143-152. DOI:10.1016/j.mib.2006.01.005 |
(编辑 白永平)



