海南黑山羊又称东山羊,是海南省目前唯一的地方优良山羊品种,在全省均有分布,主要集中于万宁、琼中、儋州、澄迈等市县[1]。在长期热带环境的自然选择下,海南黑山羊形成耐高温高湿、性成熟早、耐粗饲、抗病力强、无膻味等特点[2]。研究表明,海南黑山羊的抗病力除了受饲养管理和营养水平等因素影响外,还受到基因表达调控的影响[3]。因此,通过基因层面研究海南黑山羊的抗病机制,对于山羊疾病的预防和控制具有重要意义。甘露聚糖结合凝集素(mannose binding lectin,MBL)作为一种重要的抗感染免疫分子,是目前发现的少数能活化补体系统的胶凝素。补体通过凝集素途径在病原体或细胞表面活化,发挥消灭病原体和调理吞噬等免疫防御功能[4]。研究表明,动物体内的MBL1和MBL2基因分别编码MBL-A和MBL-C蛋白[5]。其中,MBL2基因编码的甘露聚糖结合凝集素C(mannose binding lectin C,MBL-C)是存在于动物体内、由肝组织合成并分泌到血液中的一种血清型胶凝集素,属于C型(Ca2+依赖型)凝集素超家族的成员[6]。MBL-C作为一种急性期蛋白,以激活补体效应的方式参与动物体内的体液免疫途径,在宿主抵抗病原体感染过程中发挥重要的天然抗感染免疫功能[7-10]。MBL2基因能够通过补体依赖和非依赖的机制中和登革热病毒,进而抑制登革热病毒的感染[11]。此外,多数研究表明,MBL2基因的多态性与感染性疾病的易感性有关。Fraser等[12]的研究发现,牛的两种胶原凝集素基因(MBL1和MBL2)的突变与乳腺炎有关。牦牛MBL2基因3′-UTR区的A997C/T1295C位点多态性与牦牛血清巴氏杆菌抗体水平相关,提示可能参与牦牛巴氏杆菌体液免疫反应[13]。水牛MBL基因的多态性与水牛抵御布氏杆菌感染的能力显著相关,其原因可能是MBL基因的变异导致水牛体内MBL表达的不足,影响了水牛正常的免疫功能[14]。
目前,MBL2基因的研究主要集中在其多态性与疾病的关联分析[15],对于该基因在山羊上的表达调控研究相对较少。因此,本研究选取海南黑山羊MBL2基因启动子序列1 009 bp,构建了一系列启动子截短的pGL3-Basic重组质粒。在线网站预测转录因子结合位点,并利用点突变技术构建转录因子结合位点缺失的pGL3-Basic重组质粒。采用双荧光素酶报告基因检测系统检测所构建的重组质粒的启动子转录活性变化情况,进一步确定山羊MBL2基因的最小核心启动子区域以及对MBL2基因起关键调控作用的转录因子。期望有助于揭示海南黑山羊MBL2基因表达分子调控机制,为探寻其免疫基因的功能提供理论基础。
1 材料与方法 1.1 试验样品本研究采集2头海南黑山羊(海南初心牧业有限公司)的肝组织,置于-80 ℃保存备用。
1.2 试验材料pGL3-Basic质粒、pcDNA3.1-EGFP质粒于本实验室保存,双荧光素酶基因内参pRL-TK载体、Dual-LuciferaseⓇ Reporter Assay System双荧光素酶报告基因检测试剂盒购自美国Promega公司;脂质体LipofectamineⓇ2000 Reagent、限制性内切酶Dpn1、Sac1和Kpn1、T4 DNA连接酶购自美国Invitrogen公司;胰蛋白酶、胎牛血清购自美国Gibco公司;PBS缓冲液、DMEM培养基购自Boster美国公司;2XPfu PCR MasterMix、D2000 DNA maker、1 kb DNA ladder、DEPC水、DH5α感受态细胞、无内毒素质粒小提中量试剂盒、组织基因组DNA提取试剂盒购自天根生化科技(北京)有限公司;氨苄青霉素(AMP)购自索莱宝科技有限公司;293T细胞由本实验室保存;NanoPhotometerⓇ购自德国Implen公司;DNA胶回收试剂盒、PCR产物纯化试剂盒、质粒DNA小提试剂盒、引物合成购自生工生物工程(上海)股份有限公司;测序由北京六合华大基因公司完成。
1.3 试验方法1.3.1 进化树分析 从NCBI数据库(https://www.ncbi.nlm.nih.gov)中检索并下载20个物种的MBL2基因序列。用ClustalW(codon)方法对20条基因CDS区序列进行系统发育分析。利用MEGA X软件采用极大似然法构建系统发育树。模拟1 000次重复抽样中获得Bootstrap值。
1.3.2 山羊MBL2基因启动子区的生物信息学分析 利用NCBI数据库搜索山羊MBL2(NCBI登录号:NC_030833.1)基因组DNA信息,并结合NCBI公布的MBL2基因的转录起始位点(TSS)的位置,选取山羊MBL2基因5′UTR上游启动子区1 009 bp (Chr26:45045136-45046144) 作为研究的序列。使用Promoter 2.0在线软件对启动子的序列特征进行分析。采用在线软件JASPAR、AnimalTFDB3.0和Alibaba2对启动子区进行转录因子结合位点的预测。采用RepeatMasker程序来预测序列的重复元件。同时使用MethPrimer软件对启动子区进行CpG岛预测,具体的生物信息学软件信息见表 1。
|
|
表 1 生物信息学分析MBL2启动子区所用的软件 Table 1 Softwares for bioinformatics analysis of the MBL2 promoter region |
1.3.3 山羊MBL2基因启动子截短片段的PCR扩增 提取山羊肝组织的基因组DNA,浓度测定及琼脂糖凝胶电泳合格后置于-20 ℃备用。采用DNAMAN软件设计扩增山羊MBL2基因启动子的7条引物(上游:F1、F2、F3、F4、F5、F6,下游:R)上游引物5′端加Kpn1酶切位点,下游引物5′端加Sac1酶切位点,引物具体信息见表 2。以山羊肝组织基因组DNA为模板,PCR反应体系为50 μL:基因组DNA模板为200 ng,上下游引物各2 μL,25 μL的2XPfu PCR MasterMix,ddH2O水补齐体系。PCR的扩增程序:95 ℃预变性3 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 kb/2 min,32个循环,72 ℃终延伸5 min。将反应完成的PCR产物在1.5%的琼脂糖凝胶电泳中检测后利用胶回收试剂盒回收目的条带。
|
|
表 2 扩增山羊MBL2基因启动子区的引物信息 Table 2 The primer information of goat MBL2 gene promoter region |
1.3.4 山羊MBL2基因启动子报告重组质粒的构建及鉴定 使用Kpn1酶和Sac1酶在37 ℃分别酶切目的片段和pGL3-Basic空载体2 h,之后用DNA产物纯化试剂盒纯化酶切反应物。将得到的纯化产物用T4连接酶16 ℃连接过夜,将反应产物转化至DH5α感受态细胞,在含有氨苄青霉素的玻璃平板中培养8~10 h,经菌落PCR鉴定出阳性单克隆菌落,进一步取阳性单克隆菌落在LB液体培养基中扩大培养12 h,提取重组质粒后经限制性内切酶Kpn1和Sac1酶切和测序鉴定。将测序正确的6个MBL2基因启动子截短重组质粒分别命名为pGL3-F1(-945/+64)、pGL3-F2(-741/+64)、pGL3-F3(-629/+64)、pGL3-F4(-483/+64)、pGL3-F5(-304/+64)、pGL3-F6(-45/+64)。将测序正确的阳性单克隆过夜扩大培养,之后用去内毒素的质粒提取试剂盒提取重组质粒,并经NanoPhotometerⓇ检测浓度和纯度。
1.3.5 细胞的培养、转染及双荧光素酶报告基因活性检测 将10%胎牛血清(FBS)的DMEM培养基中处于指数生长期的293T细胞,按每孔2.4×104个细胞的密度接种至96孔板,置于37 ℃,5%CO2的细胞培养箱中培养,待细胞的融合度达到80%~90%时,根据LipofectamineⓇ 2000 Reagent转染试剂盒进行质粒转染。为研究山羊MBL2基因启动子不同区域的转录活性,按照LipofectamineⓇ 2000:截短重组质粒: 内参质粒pRL-TK为0.5 μL: 200 ng: 4 ng的比例共转染293T细胞,pGL3-Basic质粒为阴性对照,pcDNA3.1-EGFP质粒为阳性对照,按照试剂盒的说明书进行试验操作,每组试验重复3次。转染6~8 h将无血清的培养基换成含10%FBS的DMEM培养基,继续培养细胞至48 h后裂解细胞,利用Promega公司的Dual-LuciferaseⓇ Reporter Assay System双荧光素酶报告基因检测试剂盒和奥地利Tecan公司的SparkⓇ多功能微孔板检测仪检测萤火虫荧光素酶(F值)和海肾荧光素酶(R值)。通过计算萤火虫荧光素酶和海肾荧光素酶的比值(Luc)来确定山羊MBL2基因的核心启动子区域。
1.3.6 山羊MBL2基因核心启动子区载体的构建 利用DNAMAN软件设计扩增山羊MBL2基因核心启动子区(-304/-45 bp)的上、下游引物(F7、R1,表 1),并在上、下游引物的5′端分别引入Kpn1酶和Sac1酶的酶切位点。以重组质粒pGL3-F5为模板,核心启动子区载体的构建过程参照“1.3.3”和“1.3.4”的操作步骤。将测序正确的阳性单克隆命名为pGL3-F7,进一步扩大培养阳性单克隆并使用去内毒素质粒提取试剂盒提取质粒。
1.3.7 关键转录因子结合位点的预测及定点突变载体的构建 通过在线软件再次对山羊MBL2基因的核心启动区潜在的转录因子结合位点进行预测,取它们的交集结果并筛选出评分较高的3个转录因子结合位点。参照天根生化科技有限公司的点突变试剂盒说明书对预测的潜在转录因子结合位点设计缺失引物,引物的具体信息见表 3。以构建成功的pGL3-F7重组质粒为模板,PCR反应体系同“1.3.3”,PCR反应条件:95 ℃ 3 min,94 ℃ 30 s,60 ℃ 1 min,68 ℃ 1 min,18个循环,68 ℃ 10 min。将1 μL的Dpn1酶及2 μL的10×Green Buffer加到PCR产物中,37 ℃孵育2~3 h。取出10 μL的酶切产物用1%的琼脂糖凝胶电泳检测是否出现目的产物,采用DNA产物纯化试剂盒纯化产物,转化,菌液PCR及酶切鉴定阳性单克隆,经测序正确的阳性单克隆过夜扩大培养,用去内毒素质粒提取试剂盒提取质粒。构建成功的缺失载体命名为pGL3-转录因子。
|
|
表 3 转录因子结合位点的突变引物 Table 3 Mutated primers for transcription factor binding sites |
所有试验均重复3次,采用GraphPad Prism8软件分析数据,one-way ANOVA方法检验数据,数据结果以“平均值±标准误”表示,P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果 2.1 MBL2基因在不同物种中的进化树分析为了解MBL2基因在不同物种中潜在的进化关系,采用MEGA X软件对20个物种的MBL2基因编码序列构建系统进化树(图 1)。进化分析结果显示,山羊MBL2基因编码序列与反刍动物(绵羊、牛)具有较近的遗传距离,与蓝鲸的遗传距离较远。
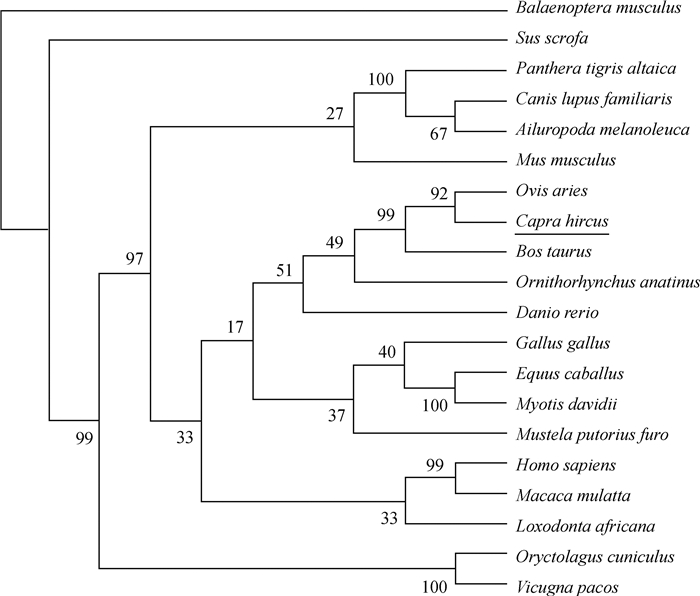
|
图 1 MBL2基因的进化分析 Fig. 1 Evolutional analysis of MBL2 gene |
通过NCBI数据库下载山羊MBL2基因启动子序列(-945/+64 bp),利用Promoter 2.0软件预测山羊MBL2基因-446 bp为启动子位置,分值为1.076。用RepeatMasker程序来预测序列的重复元件,发现存在两个重复元件LINE1(-945/-618 bp)、LINE2 (-477/-369 bp)。采用Methprimer软件对预测的启动子序列进行CpG岛分析,未发现CpG岛存在(图 2)。并利用在线软件对启动子区进行转录因子结合位点预测,预测的结果见图 3。

|
图 2 山羊MBL2基因启动子甲基化位点分析 Fig. 2 Methylation site analysis of goat MBL2 gene promoter |

|
潜在转录因子结合位点在序列中用方框标明 Putative transcription factor binding sites are boxed in the sequence 图 3 山羊MBL2基因启动子区转录因子结合位点的预测结果图 Fig. 3 Predicted results of transcription factor binding sites in goat MBL2 gene promoter region |
利用DNAMAN软件设计的引物(F1/R、F2/R、F3/R、F4/R、F5/R、F6/R)对启动子序列进行逐段PCR截短,PCR产物经1.5%的琼脂糖凝胶检测得到6个不同的逐段截短的单一条带启动子片段(图 4A),与预期的结果一致。构建的重组载体经Kpn1和Sac1双酶切鉴定,结果(图 4B)发现各个重组质粒酶切后均出现了两条带,一条为目的片段1 009、803、693、547、368、109 bp,另一条为4 818 bp的pGL3-Basic片段。将经酶切验证正确的重组质粒送北京六合华大基因公司测序,测序结果经DNAMAN软件比对发现与预期结果一致,证明重组质粒构建成功。
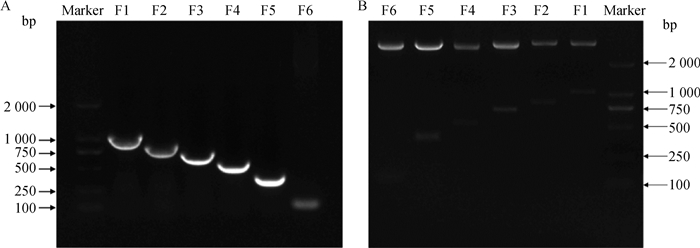
|
Marker.D2000 DNA marker;A. F1~F6为系列截短的片段;B. F1~F6为重组质粒pGL3-F1至pGL3-F6经Kpn1和Sac1双酶切的结果 Marker. D2000 DNA marker; A. F1-F6 is a series of truncated segments; B. F1-F6 was the result of recombined plasmid pGL3-F1 to pGL3-F6 digested with Kpn1 and Sac1 double enzymes 图 4 系列截短的MBL2基因启动子序列PCR扩增产物和重组质粒双酶切的电泳图 Fig. 4 The electrophoresis image of PCR amplification products of series truncated promoter sequence of MBL2 gene and double digestion of recombined plasmid |
使用LipofectamineⓇ 2000将构建的6个双荧光素报告载体pGL3-F1~pGL3-F6瞬时转染293T细胞,48 h后利用双荧光素酶报告基因检测系统检测启动子系列截短的双荧光素酶载体的活性(图 5)。结果所示,随着启动子片段的逐段截短,启动子的荧光活性呈现先上升后下降的趋势,表明在启动子区(-945/-629 bp)中存在着抑制启动子荧光活性的转录因子结合位点。当截短到山羊MBL2基因启动子区-304/-45 bp之间时,荧光活性的比值变化最大,启动子的活性降到较低。这一结果说明山羊MBL2基因5′UTR上游启动子区1 009 bp(-945/+64 bp)具有调控基因转录的功能,且在启动子区(-304/-45 bp)为山羊MBL2基因近端的核心启动子区。
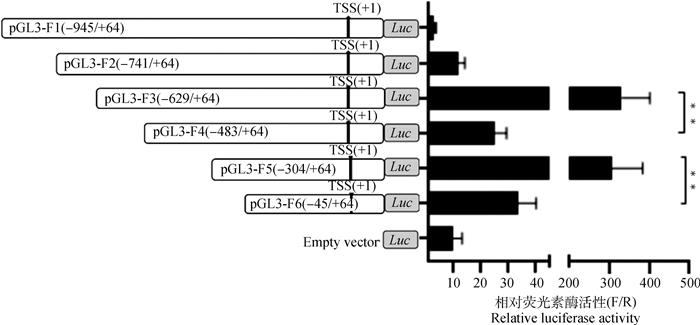
|
*. P < 0.05, **. P < 0.01,下同 *. P < 0.05, **. P < 0.01, the same as follow 图 5 MBL2启动子截短体pGL3-F1到pGL3-F6的荧光活性检测 Fig. 5 The MBL2 promoter activities of pGL3-F1 to pGL3-F6 |
以构建成功的pGL3-F5(-304/+64 bp)重组载体为模板,PCR扩增出MBL2基因核心启动区的片段(图 6A),构建重组载体。重组质粒经双酶切后, 采用1.5%琼脂糖凝胶电泳(图 6B)鉴定出两条带,分别为4 818 bp的pGL3-Basic质粒以及259 bp的目的片段。测序结果经DNAMAN比对与预期片段一致,说明重组载体pGL3-F7构建成功。
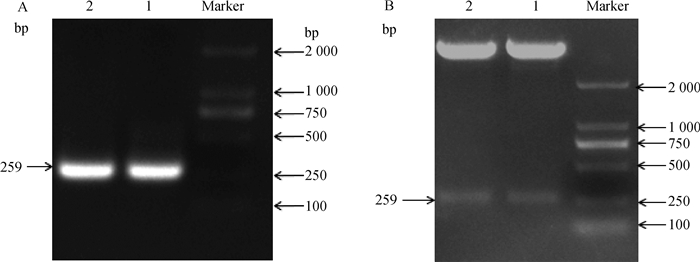
|
Marker.D2000 DNA marker;A. 1~2:MBL2基因核心启动子区域的PCR扩增产物电泳图;B. MBL2基因核心启动子区域的重组质粒经Sac1和Kpn1双酶切图 Marker. D2000 DNA marker; A. Electrophoresis image of PCR amplification products in the core promoter region of MBL2 gene; B. The recombinant plasmid in the core promoter region of MBL2 gene was digested by Sac1 and Kpn1 enzymes 图 6 MBL2基因核心启动子区域的PCR扩增和重组质粒双酶切电泳图 Fig. 6 Electrophoresis image of PCR amplification and double digestion of recombinant plasmid in the MBL2 gene core promoter region |
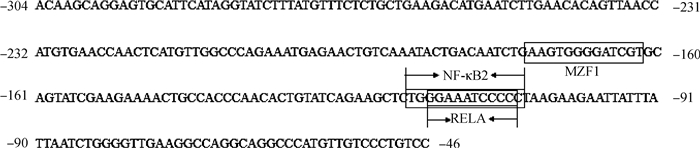
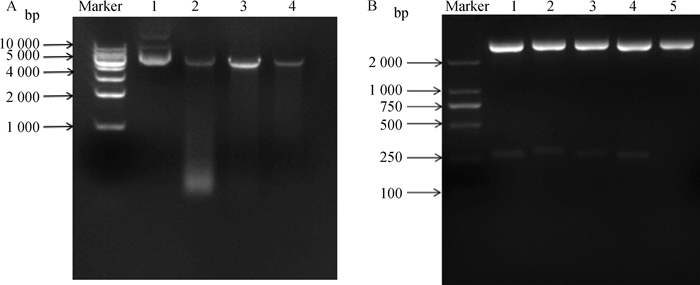
使用在线软件JASPAR和AnimalTFDB3.0对山羊MBL2基因核心启动子区进行关键转录因子结合位点预测,结果发现在MBL2核心启动子区存在RELA、MZF1、NF-κB2等3个关键的转录因子结合位点,与前期预测的潜在转录因子结合位点结果一致(图 7)。以构建成功的pGL3-F7为模板,PCR扩增出3个不同的启动子缺失载体pGL3-RELA、pGL3-NF-κB2、pGL3-MZF1(图 8A),构建的缺失载体经Kpn1和Sac1双酶切(图 8B)和测序鉴定,测序结果与预期片段一致。将3个构建成功的缺失载体转染到293T细胞,48 h后检测萤火虫荧光值(F)和海肾荧光值(R),计算F/R相对比值。结果显示(图 9),缺失MZF1的结合位点后,其荧光活性相对于对照组(pGL3-F7载体)上升,说明了转录因子MZF1可能对山羊MBL2基因的转录起到负调控的作用或者是不起作用。缺失RELA和NF-κB2结合位点后,pGL3-RELA和pGL3-NF-κB2的荧光活性相对于对照组有极显著下降(P < 0.01),说明了转录因子RELA和NF-κB2可能对山羊MBL2基因的转录活性有正调控作用。进一步比较pGL3-RELA和pGL3-NF-κB2之间的荧光活性,发现pGL3-RELA较pGL3-NF-κB2的荧光活性有着显著的下降(P < 0.05)。
|
潜在转录因子结合位点在序列中用方框标明 Putative transcription factor binding sites are boxed in the sequence 图 7 山羊MBL2基因核心启动子区的转录因子结合位点的预测 Fig. 7 Prediction of transcription factor binding sites in the core promoter region of goat MBL2 gene |
|
A. Marker: 1 kb DNA Ladder;1~4: MBL2核心启动子区域、转录因子(RELA、NF-κB2、MZF1)结合位点缺失的PCR扩增图;B. Marker: D2000 DNA marker;1~5:MBL2核心启动子区域重组质粒pGL3-F7、结合位点缺失载体pGL3-MZF1、pGL3-NF-κB2、pGL3-RELA和pGL3-Basic空载体的双酶切图 A. Marker: 1 kb DNA Ladder; 1-4: PCR amplification diagram of MBL2 core promoter region, transcription factor(RELA, NF-κB2, MZF1) binding site deletion. B. Marker: D2000 DNA marker; MBL2 core promoter region recombinant plasmid pGL3-F7, binding site deletion vector pGL3-MZF1, pGL3-NF-κB2, pGL3-RELA and pGL3-Basic empty vector dual enzyme digestion diagram 图 8 MBL2核心启动子区域转录因子结合位点缺失载体的PCR扩增和双酶切电泳图 Fig. 8 PCR amplification and double digestion electrophoresis images of vectors with deletion of transcription factor binding sites in the MBL2 core promoter region |

|
潜在转录因子结合位点的缺失在序列中用黑色横线标明 The deletion of potential transcription factor binding sites are indicated by black horizontal line in the sequence 图 9 定点缺失关键转录因子的荧光活性测定 Fig. 9 Fluorescence activity determination of site-deletions of key transcription factors |
C型(Ca2+依赖型)凝集素基因超家族成员在脊椎动物的天然免疫中发挥着调理吞噬和抵御外界病原体入侵的作用[16]。MBL2基因作为C型钙依赖凝集素基因超家族成员之一,在宿主抵御病原体感染的第一道防线中扮演着重要角色[17-18]。MBL2基因编码的MBL-C蛋白作为人和动物先天性免疫凝集素途径中的重要组分,能够在个体发育的早期发挥直接抵御病原体感染的作用。MBL-C普遍存在于人和动物的血液中,MBL2基因中的短核苷酸变异(SNVs)与多种感染性疾病的易感性相关。研究表明,人类MBL2基因1号外显子的突变与麻风杆菌的易感性有关[19]。赵中利[20]对奶牛MBL2基因研究发现,MBL2基因的多态性与金黄色葡萄球菌引起的奶牛乳腺炎存在着显著相关,其可能的机理是奶牛MBL2基因突变导致血清中MBL-C水平下降,影响奶牛的免疫功能。MBL2基因作为先天性免疫应答机制的重要组分,是调控畜禽对病原体抗性或易感的关键基因。因此,MBL2基因的表达调控研究对探索山羊在抵抗细菌性感染的机理中有着重要的理论和实践意义。
本研究利用启动子定位软件对MBL2基因进行分析,结果表明MBL2基因转录起始位点上游1 009 bp(-945/+64)的序列上存在MZF1、FOXC2、RELA等多个转录因子结合位点,提示该序列可能属于启动子区域。CpG岛作为位于真核生物转录起始位点附近富含GC的序列,具有调控转录效率的作用。在本研究中,利用生物信息学软件对山羊MBL2基因启动子序列1 009 bp进行分析,预测结果显示,该序列GC含量不高(42.7%),无真核生物启动子经典CpG岛。对重复元件预测,分析表明该序列存在两个重复元件LINE1(-945/-618 bp)和LINE2 (-477/-369 bp)。通常认为重复元件是由于反转录元件的插入形成的序列,是生物进化过程中的一种保护机制[21]。重复元件能保护基因的外显子、启动子部位免受突变而引起的功能丧失,但其具体的作用机制还需深入研究。
通过对启动子序列5′端侧翼区进行逐段缺失,联合双荧光素酶报告基因检测系统检测山羊MBL2基因的核心启动子区域,结果发现其启动子最小活性区域介于-304至-45 bp,与奶牛MBL2基因启动子的最小活性区域介于-85至+52 bp略有差别。进一步运用点突变技术和双荧光素酶报告基因检测系统对该区域的转录因子结合位点进行鉴定,发现缺失RELA或NF-κB2的结合位点,山羊MBL2基因的转录活性较对照组极显著下降,且pGL3-RELA较pGL3-NF-κB2的荧光活性显著下降。该结果表明,虽然RELA和NF-κB2的结合位点仅有3个碱基的差异,但它们在调控山羊MBL2基因的转录能力上却存在显著差异。究其原因可能是RELA与山羊MBL2基因启动子序列结合比NF-κB2更稳定。研究表明,NF-κB2能与人类免疫缺陷病毒(HIV)的启动子序列稳定结合可能是由RELA对该序列有比较低的亲和力决定[22]。研究报道,NF-κB2对结合位点的亲和力比NF-κB1弱得多,但当RELA协同作用时,NF-κB2较NF-κB1能更有效地与基因的启动子序列结合,进而激活基因的定向转录[23]。综上所述,尽管NF-κB各亚基在DNA结合上存在相似性,但它们在激活基因转录的能力上却存在显著差异。
NF-κB是一类多效性的转录因子,能识别并结合多种靶基因启动子部位上特定的序列,从而启动靶基因的表达[24]。RELA和NF-κB2均属于NF-κB家族重要的成员,都具有一个N端Rel同源结构域,负责其与DNA结合以及二聚体化。RELA无前体,其C端有一个或多个转录活性区域,具有直接作用于转录元件促进激活基因转录的功能。NF-κB2含有前体p100,缺乏转录活性区域,没有独立激活基因转录的功能,其同源二聚体可以抑制基因的转录。因此,NF-κB亚基之间通常是以二聚体的形式存在。研究表明,RELA与NF-κB2组成的异源二聚体存在协同作用,能共同激活基因的转录,但是没有说明这两个转录因子是结合在基因的同一位点[25-27]。本研究发现,RELA和NF-κB2有可能以结合在山羊MBL2基因启动子部位的同一个位点的方式,从而发挥了协同促进山羊MBL2基因转录的作用。
RELA作为一个真核生物转录因子,能参与信号分子和调节许多炎症基因的表达[28]。RELA是REL家族中研究最广泛的转录因子成员之一,该转录因子广泛地调节真核生物基因的表达并参与到多种生物过程,如炎症、肿瘤形成、病毒复制、细胞凋亡和增殖等过程,并与许多炎性相关疾病的发病机制有密切的联系[29]。研究表明,向肝组织缺失RELA基因的小鼠和正常小鼠的腹腔中注射肺炎克雷伯菌、肺炎链球菌、大肠杆菌,缺失RELA小鼠较正常小鼠的免疫力降低,对病原体的易感性增强,容易使其诱发肺炎、败血症或激活NKT细胞,说明RELA对小鼠肝感染致病菌期间产生的对肝具有保护作用的急性期反应至关重要[30]。在绵羊感染肺炎支原体的过程中,RELA的转录水平和磷酸化水平显著提高,使绵羊体内的肺炎支原体数量增加,说明RELA在绵羊肺炎支原体致病机制中发挥了重要作用[31]。有研究发现,呼吸道合胞病毒通过捕获RELA到细胞质包涵体中,阻断被感染细胞内先天免疫信号的激活,使病毒在细胞内大量复制,从而引起牛的呼吸道急性疾病[32]。
NF-κB2是参与NF-κB非经典途径的主要转录因子,是多种靶基因的关键调控因子,在炎症组织中表达量很高。研究表明NF-κB2通路可影响T细胞、B细胞的分化及NK细胞的功能,该基因的遗传突变与人的免疫缺陷病相关[33]。通过RNAi技术沉默NF-κB2的表达,使人类巨细胞病毒蛋白US31的表达量降低,并抑制了NF-κB2在单核巨噬细胞中的激活,这在一定程度上有助于全身性红斑狼疮病的治疗[34]。
本研究中缺失了转录因子RELA、NF-κB2的结合位点,山羊MBL2基因的启动子转录活性显著下降,说明RELA和NF-κB2可能在对调控山羊MBL2基因的转录上发挥了正调控的作用。MBL2基因作为C型钙依赖凝集素基因超家族成员之一,其编码的MBL-C蛋白通过凝集素途径激活补体,发挥调理吞噬、清除病原体的作用,其免疫防御功能的实现受到转录因子RELA、NF-κB2的调控。因此推测,转录因子RELA、NF-κB2可能通过调控海南黑山羊MBL2基因在血浆中的表达水平,增强海南黑山羊对病原体的抵抗力。
4 结论本研究通过体外试验确定了山羊MBL2基因核心启动子位于-304至-45 bp区域。结合在线软件预测、借助定点突变技术及双荧光素酶报告基因检测系统初步鉴定NF-κB家族的成员RELA和NF-κB2对山羊MBL2基因的转录活性可能有正调控作用,且RELA和NF-κB2有可能发挥了促进山羊MBL2基因转录的协同作用。以上结果为进一步研究MBL2基因在调控山羊抗病功能中提供了理论依据。
| [1] |
ZHOU H H, ZHENG X L, MA T M, et al. Genotype identification and phylogenetic analysis of Enterocytozoon bieneusi in farmed black goats (Capra hircus) from China's Hainan Province[J]. Parasite, 2019, 26(7): 62. |
| [2] |
叶玉秀, 雷湘兰, 程文科, 等. 海南黑山羊研究进展与产业发展思路[J]. 热带农业科学, 2016, 36(10): 114-118. YE Y X, LEI X L, CHENG W K, et al. Research progress and some thoughts of industrial development of Hainan Black Goats[J]. Chinese Journal of Tropical Agriculture, 2016, 36(10): 114-118. (in Chinese) |
| [3] |
ZHANG K Z, TAO P, LIU J X, et al. Distinct expression profile and histological distribution of NLRP3 inflammasome components in the tissues of Hainan black goat suggest a site-specific role in the inflammatory response[J]. Acta Vet Hung, 2017, 65(3): 402-416. DOI:10.1556/004.2017.038 |
| [4] |
IDOWU P A, IDOWU A P, ZISHIRI O T, et al. Activity of mannose-binding lectin on bacterial-infected chickens-A review[J]. Animals(Basel), 2021, 11(3): 787. |
| [5] |
KALIA N, SINGH J, KAUR M. The ambiguous role of mannose-binding lectin (MBL) in human immunity[J]. Open Med (Wars), 2021, 16(1): 299-310. DOI:10.1515/med-2021-0239 |
| [6] |
CHEN Y, HU M, DENG F, et al. Mannan-binding lectin deficiency augments hepatic endoplasmic reticulum stress through IP3R-controlled calcium release[J]. Cell Calcium, 2021, 100: 102477. DOI:10.1016/j.ceca.2021.102477 |
| [7] |
GADJEVA M, TAKAHASHI K, THIEL S. Mannan-binding lectin-a soluble pattern recognition molecule[J]. Mol Immunol, 2004, 41(2-3): 113-121. DOI:10.1016/j.molimm.2004.03.015 |
| [8] |
ZHENG M F, SHI S Y, WEI W, et al. Correlation between MBL2/CD14/TNF-α gene polymorphisms and susceptibility to spinal tuberculosis in Chinese population[J]. Biosci Rep, 2018, 38(1): BSR20171140. DOI:10.1042/BSR20171140 |
| [9] |
MEDETALIBEYOGLU A, BAHAT G, SENKAL N, et al. Mannose binding lectin gene 2 (rs1800450) missense variant may contribute to development and severity of COVID-19 infection[J]. Infect Genet Evol, 2021, 89: 104717. DOI:10.1016/j.meegid.2021.104717 |
| [10] |
MORETTI R, SOGLIA D, CHESSA S, et al. Identification of SNPs associated with somatic cell score in candidate genes in Italian Holstein Friesian Bulls[J]. Animals (Basel), 2021, 11(2): 366. |
| [11] |
GIANG N T, VAN TONG H, QUYET D, et al. Complement protein levels and MBL2 polymorphisms are associated with dengue and disease severity[J]. Sci Rep, 2020, 10(1): 14923. DOI:10.1038/s41598-020-71947-2 |
| [12] |
FRASER R S, LUMSDEN J S, LILLIE B N. Identification of polymorphisms in the bovine collagenous lectins and their association with infectious diseases in cattle[J]. Immunogenetics, 2018, 70(8): 533-546. DOI:10.1007/s00251-018-1061-7 |
| [13] |
温东旭, 陈建春, 王一飞, 等. 牦牛MBL2基因3'-UTR区抗菌相关SNPs的筛选[J]. 中国兽医科学, 2021, 51(7): 898-907. WEN D X, CHEN J C, WANG Y F, et al. Screening of SNPs related to antibacterial activity in the 3'-UTR region in MBL2 gene of yak[J]. Chinese Veterinary Science, 2021, 51(7): 898-907. (in Chinese) |
| [14] |
CAPPARELLI R, PARLATO M, AMOROSO M G, et al. Mannose-binding lectin haplotypes influence Brucella abortus infection in the water buffalo (Bubalus bubalis)[J]. Immunogenetics, 2008, 60(3-4): 157-165. DOI:10.1007/s00251-008-0284-4 |
| [15] |
YUAN Z C, XU W D, LAN Y Y, et al. Association of MBL2 gene polymorphisms and systemic lupus erythematosus susceptibility: a meta-analysis[J]. Int J Rheum Dis, 2021, 24(2): 147-158. DOI:10.1111/1756-185X.14017 |
| [16] |
BROWN G D, WILLMENT J A, WHITEHEAD L. C-type lectins in immunity and homeostasis[J]. Nat Rev Immunol, 2018, 18(6): 374-389. DOI:10.1038/s41577-018-0004-8 |
| [17] |
BOSCHMANN S E, GOELDNER I, TUON F F, et al. Mannose-binding lectin polymorphisms and rheumatoid arthritis: a short review and meta-analysis[J]. Mol Immunol, 2016, 69: 77-85. DOI:10.1016/j.molimm.2015.10.010 |
| [18] |
温东旭, 张鹏宇, 徐业芬, 等. 牦牛MBL2基因mRNA及相关miRNAs在不同组织中的表达分析[J]. 中国兽医科学, 2020, 50(7): 886-897. WEN D X, ZHANG P Y, XU Y F, et al. Expression analyses of yak MBL2 gene mRNA and related miRNAs in different tissues[J]. Chinese Veterinary Science, 2020, 50(7): 886-897. (in Chinese) |
| [19] |
TIYO B T, VENDRAMINI E C L, DE SOUZA V H, et al. Association of MBL2 Exon 1 polymorphisms with multibacillary leprosy[J]. Front Immunol, 2020, 11: 1927. DOI:10.3389/fimmu.2020.01927 |
| [20] |
赵中利. MBL2基因与奶牛乳腺炎抗性研究[D]. 长春: 吉林大学, 2012: 1-141. ZHAO Z L. The study of MBL2 gene and dairy cattle mastitis resistance[J]. Changchun: Jinlin University, 2012: 1-141. (in Chinese) |
| [21] |
VASILYEV S A, TOLMACHEVA E N, VASILYEVA O Y, et al. LINE-1 retrotransposon methylation in chorionic villi of first trimester miscarriages with aneuploidy[J]. J Assist Reprod Genet, 2021, 38(1): 139-149. DOI:10.1007/s10815-020-02003-1 |
| [22] |
URBAN M B, BAEUERLE P A. The 65-kD subunit of NF-kappa B is a receptor for I kappa B and a modulator of DNA-binding specificity[J]. Genes Dev, 1990, 4(11): 1975-1984. DOI:10.1101/gad.4.11.1975 |
| [23] |
DUCKETT C S, PERKINS N D, KOWALIK T F, et al. Dimerization of NF-KB2 with RelA(p65) regulates DNA binding, transcriptional activation, and inhibition by an I kappa B-alpha (MAD-3)[J]. Mol Cell Biol, 1993, 13(3): 1315-1322. |
| [24] |
杨洋. NF-κB靶基因谱及其调控网络的研究[D]. 南京: 东南大学, 2016: 1-149. YANG Y. NF-κB target genes spectrum and study of gene regulatory networks[D]. Nanjing: Southeast University, 2016: 1-149. (in Chinese) |
| [25] |
CHAWLA M, MUKHERJEE T, DEKA A, et al. An epithelial Nfkb2 pathway exacerbates intestinal inflammation by supplementing latent RelA dimers to the canonical NF-κB module[J]. Proc Natl Acad Sci U S A, 2021, 118(25): e2024828118. DOI:10.1073/pnas.2024828118 |
| [26] |
CAO J P, WANG H J, YU J K, et al. The involvement of NF-κB p65/p52 in the effects of GDNF on DA neurons in early PD rats[J]. Brain Res Bull, 2008, 76(5): 505-511. DOI:10.1016/j.brainresbull.2008.03.007 |
| [27] |
CAO J P, NIU H Y, WANG H J, et al. NF-κB p65/p52 plays a role in GDNF up-regulating Bcl-2 and Bcl-w expression in 6-OHDA-induced apoptosis of MN9D cell[J]. Int J Neurosci, 2013, 123(10): 705-710. DOI:10.3109/00207454.2013.795149 |
| [28] |
NGO K A, KISHIMOTO K, DAVIS-TURAK J, et al. Dissecting the regulatory strategies of NF-κB RelA target genes in the inflammatory response reveals differential transactivation logics[J]. Cell Rep, 2020, 30(8): 2758-2775. DOI:10.1016/j.celrep.2020.01.108 |
| [29] |
CHEN S, JIANG S C, ZHENG W, et al. RelA/p65 inhibition prevents tendon adhesion by modulating inflammation, cell proliferation, and apoptosis[J]. Cell Death Dis, 2017, 8(3): e2710. DOI:10.1038/cddis.2017.135 |
| [30] |
KIM Y, ALLEN E, BAIRD L A, et al. NF-κB RELA is required for hepatoprotection during pneumonia and sepsis[J]. Infect Immun, 2019, 87(8): e00132-19. |
| [31] |
张俊波, 印双红, 陆安法. NF-κB信号通路调控绵羊肺炎支原体感染宿主肺泡上皮细胞的作用机理[J]. 内蒙古大学学报: 自然科学版, 2018, 49(3): 296-303. ZHANG J B, YIN S H, LU A F. The role of NF-κb signaling pathway in the infection of mycoplasma pneumoniae in sheep alveolar epithelial cell[J]. Journal of Inner Mongolia University (Natural Science Edition), 2018, 49(3): 296-303. (in Chinese) |
| [32] |
JOBE F, SIMPSON J, HAWES P, et al. Respiratory syncytial virus sequesters NF-κB subunit p65 to cytoplasmic inclusion bodies to inhibit innate immune signaling[J]. J Virol, 2020, 94(22): e01380-20. |
| [33] |
LOUGARIS V, TABELLINI G, VITALI M, et al. Defective natural killer-cell cytotoxic activity in NFKB2-mutated CVID-like disease[J]. J Allergy Clin Immunol, 2015, 135(6): 1641-1643. DOI:10.1016/j.jaci.2014.11.038 |
| [34] |
GUO G Q, YE S S, XIE S D, et al. The cytomegalovirus protein US31 induces inflammation through mono-macrophages in systemic lupus erythematosus by promoting NF-κB2 activation[J]. Cell Death Dis, 2018, 9(2): 104. DOI:10.1038/s41419-017-0122-4 |
(编辑 范子娟)



