2. 河北唯尊养殖有限公司,衡水 053900;
3. 饶阳县农业农村局,衡水 053900
2. Hebei Weizun Breeding Company, Hengshui 053900, China;
3. Raoyang Agriculture and Rural Bureau, Hengshui 053900, China
产羔数是绵羊重要的经济性状之一,长期以来绵羊繁殖性状研究主要集在染色体核基因变异及其遗传效应,其中FecB作为绵羊的多胎主效应基因研究较为广泛[1],母羊多胎性状遗传力为0.1~0.3[2],可以通过选择表型和基因型从而提高母羊产羔率。但已有研究发现,在小尾寒羊体内不携带FecB基因突变的母羊仍可以观测到较高的胎产羔数,由此推断还存在其他的多羔效应基因[3]。随着动物遗传学和生物技术的快速发展,已有研究表明线粒体基因变异影响畜禽经济性状,如奶牛的产奶性能[4-5]、繁殖性能[6]、屠宰性能[7],肉牛的生长[8]和肉品质[9-10],猪的繁殖性能[11]和肉品质[12]。线粒体在能量代谢[13]、凋亡[14]、分化[15]、信号转导[16]等方面起着关键的作用,最近研究发现线粒体基因单倍型会影响牛的生理代谢性状[17]、鸡[18]和猪[19]的能量代谢。Reicher等[20]研究报道,绵羊线粒体基因变异与繁殖力相关。Wang等[21]发现,线粒体tRNA基因多态性与猪的产活仔数有关。2020年,Liu等[22]利用转线粒体细胞模型证实了线粒体基因变异影响猪产仔数。
线粒体基因组具有母系遗传特性,通过卵细胞将遗传信息传给子代,子代线粒体基因组均来自母本[23-24]。本团队前期研究发现,小尾寒羊线粒体tRNA-Lys(T7719G)基因变异与产羔数显著相关[25],该基因变异对以小尾寒羊为母本的杂交后代羊群产羔数的影响尚未见报道。在我国北方地区,常以小尾寒羊为母本进行生产实践的杂交,因此开展以小尾寒羊为母本的二元杂交羊群线粒体tRNA-Lys(T7719G)基因变异遗传分析,将有利于辅助提高产羔数,为提高羊群选育质量提供分子选种手段。此外,已有研究指出季节和胎次是影响绵羊产羔数的重要因素[26]。为此,本研究以小尾寒羊为母本的杂交羊群为研究对象,分析线粒体tRNA-Lys(T7719G)基因变异对产羔数的影响,并将其与季节、胎次作为变量进行了遗传学分析,旨在探索tRNA-Lys(T7719G)变异基因作为分子标记提高胎产羔数的可行性,为绵羊分子育种提供理论依据。
1 材料与方法 1.1 试验动物及样品采集1.1.1 试验动物 试验羊来自河北唯尊养殖有限公司种羊场,选择以小尾寒羊为母系的健康适龄繁殖母羊173只,共551次产羔记录。
1.1.2 主要试验试剂 血液基因组柱式小量提取试剂盒(康为世纪)、2×Taq PCR MasterMix(博迈德)。
1.1.3 引物设计 根据绵羊线粒体基因组序列(GenBank:AF010406)设计覆盖绵羊线粒体基因组序列的引物:上游引物:5′-CTACGGTCAATGCTCAGAA-3′,下游引物:5′-GTTGTGGTAGAAGTTGTGTT-3′,该引物由北京六合华大基因科技股份有限公司合成。
1.2 试验方法1.2.1 血样采集与DNA提取 通过颈静脉进行采血,新鲜血液暂存于含有柠檬酸钠抗凝剂的离心管中,做好羊号标记,迅速运回实验室进行DNA提取。血液若需长时间保存,应放于-80 ℃环境内。使用血液基因组柱式小量提取试剂盒进行DNA的提取,琼脂糖凝胶电泳检测DNA质量。
1.2.2 PCR测序检测变异 PCR扩增反应体系(25 μL):Mix 10 μL,上、下游引物各0.4 μL,ddH2O 13.2 μL,模板DNA 1 μL。PCR反应程序:94 ℃预变性5 min; 94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,30个循环; 72 ℃总延伸5 min。使用1%的琼脂糖凝胶电泳检测PCR扩增产物,其中电泳电压为100 V,电流为100 mA,时间为30 min。利用PCR产物进行测序,分析鉴定基因型。
1.2.3 数据处理 测序结果通过DNAMAN软件对其数据进行拼接,运用Oligo 7 Primer Analysis Software将试验绵羊序列与绵羊线粒体基因组标准序列(GenBank:AF010406)比对分析。使用EXCEL软件整理母羊的产羔记录,开展线粒体tRNA-Lys(T7719G) 基因型频率及其与胎产羔数的关联性分析。采用SPSS 23.0统计分析软件进行分析比较。
1.3 建立线性回归模型线性模型:Yinmk=μ+Pi+Gn+Sm+einmk,其中Yinmk为产羔数,μ为群体均值,Pi为第i个胎次的固定效应(i=1,2,3,4,5,6,7),Gn为第n种tRNA-Lys (T7719G) 基因型的固定效应(j=1, 2),Sm为第m种产羔季节的固定效应(m=1,2,3,4),einmk为随机残差效应。将产羔季节转换为虚拟变量(虚拟变量1,2,3的值分别为0、0、0时为春季; 1、0、0时为夏季; 0、1、0时为秋季; 0、0、1时为冬季)。
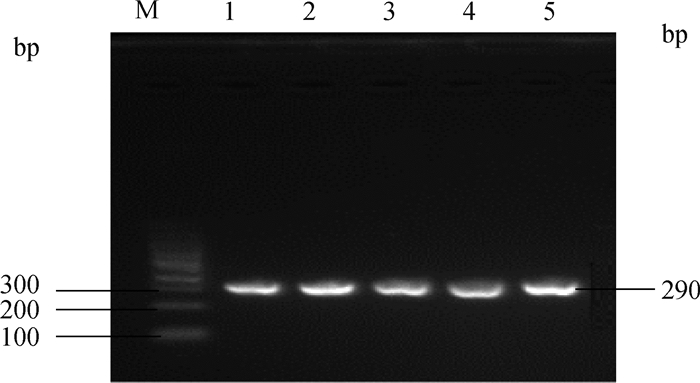
2 结果 2.1 琼脂糖凝胶电泳检测PCR产物线粒体tRNA-Lys(T7719G)基因片段大小为290 bp,电泳结果如图 1所示,PCR产物条带清晰,可用于测序。
|
M.DNA相对分子质量标准; 1~5.样品1~5的PCR扩增产物 M. DNA marker; 1-5. PCR products of sample 1-5 图 1 tRNA-Lys(T7719G)基因PCR扩增产物电泳结果 Fig. 1 Electrophoresis results of PCR amplification products of tRNA-Lys (T7719G) gene |
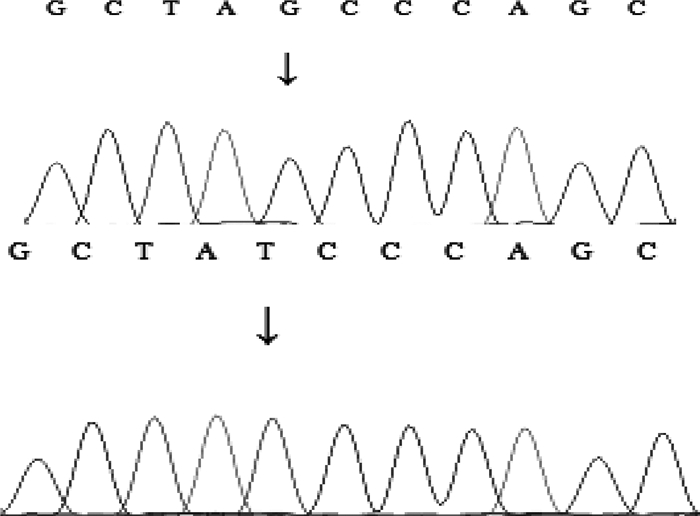
PCR扩增产物的测序结果如图 2、3所示,线粒体tRNA-Lys基因编码区7719位点存在T→G变异。

|
图 2 tRNA-Lys基因T7719G变异位点测序结果 Fig. 2 Sequencing results of T7719G variation site of tRNA-Lys gene |
|
图 3 tRNA-Lys基因T7719G变异位点测序峰图 Fig. 3 Sequencing peak of T7719G variation site of tRNA-Lys gene |
tRNA-Lys(T7719G)基因多态性结果如表 1所示,杂交羊群出现G和T两种等位基因,基因频率分别为57.80%和42.20%,携带G等位基因的母羊平均胎产羔数较携带T等位基因的母羊多0.08只。
|
|
表 1 线粒体tRNA-Lys(T7719G)基因型频率分布及平均胎产羔数 Table 1 Frequency distribution of mitochondrial tRNA-Lys (T7719G) genotypes and average litter size |
杂交母羊胎产羔数分布情况如表 2所示,胎产单羔的比例为52.27%,胎产双羔的比例为36.30%,胎产多羔的比例为11.43%。
|
|
表 2 母羊胎产羔数分布情况 Table 2 Distribution of ewe litter size |
结果(表 3)表明,胎产羔数与虚拟变量3、胎次、携带G基因数均有显著相关性且具有统计学意义(Significance < 0.05),均呈正相关(Pearson系数>0),胎产羔数与虚拟变量1和虚拟变量2虽然并没有显著相关性,但由于虚拟变量1、2、3均由季节变量转化而来,因此将其纳入多元线性回归方程进行分析。相关分析结果表明在季节不变的情况下,胎产羔数随胎次及G基因携带母羊数量的增加而增加。
|
|
表 3 线粒体tRNA-Lys(T7719G)基因、胎次及产羔季节与胎产羔数的相关分析 Table 3 Correlation analysis of mitochondrial tRNA-Lys (T7719G) gene, parity, lambing season and litter size |
方差分析结果(表 4)表明,检验统计量F为3.698,Significance值为0.003,由此可认为线粒体tRNA-Lys(T7719G)基因突变、胎次及产羔季节与胎产羔数存在显著差异,模型整体显著,具有统计学意义。由回归系数表(表 5)可知,胎产羔数与胎次、虚拟变量3、携带G基因数之间有显著线性关系(Significance < 0.05),通过容差和VIF值判断模型不存在严重的多重共线性(VIF < 20)。胎产羔数预测模型方程为:胎产羔数=1.201+(-0.009)×虚拟变量1+0.043×虚拟变量2+0.194×虚拟变量3+0.061×胎次+0.123×携带G等位基因母羊数量,回归方程表明每个tRNA-Lys基因突变为G等位基因可使群体胎产羔数增加0.123只。
|
|
表 4 线粒体tRNA-Lys(T7719G)基因、胎次及产羔季节与胎产羔数的方差分析模型 Table 4 ANOVA model of mitochondrial tRNA-Lys (T7719G) gene, parity, lambing season and litter size |
|
|
表 5 线粒体tRNA-Lys(T7719G)基因、胎次及产羔季节与胎产羔数多元线性回归系数 Table 5 Multiple linear regression coefficients of mitochondrial tRNA-Lys (T7719G) gene, parity, lambing season and litter size |
本研究结果表明,tRNA-Lys(T7719G)基因在小尾寒羊母羊杂交群体中存在两种等位基因分别为G和T,等位基因频率为57.80%和42.20%,说明在小尾寒羊母羊群体中G等位基因变异较为普遍,携带G等位基因个体平均产羔数比携带T等位基因的个体多0.08只。季节、胎次是影响绵羊胎产羔数的重要因素,因此,本研究将上述两个因素与tRNA-Lys(T7719G)基因变异进行了相关分析,结果表明,产羔季节、胎次、基因型对母羊胎产羔数都具有显著的影响。这就提示在生产实践中,尽量在短日照季节集中配种,在羊群管理中尽量提高经产母羊的比例。Wang等[21]发现了13个线粒体tRNA变异,变异个体的繁殖性能显著比野生型个体产活仔数多0.989只,这一结果与本研究结果类似,同时表明线粒体tRNA基因与繁殖性能的相关性,这一结果与Wang等[21]的报道一致。多元线性回归分析表明,G等位基因可使胎产羔数增加0.123只。因此,可以通过提高携带G等位基因的母羊个体数量来提高后代产羔数。提高产羔率是提高繁殖效率的重要方式,常见育种方式对于低遗传力的产羔性状选种效果非常有限,使用分子标记辅助选种可缩短世代间隔提高选育效率[27]。
线粒体在保证排卵[28]和胚胎发育方面[29]具有重要作用。早期胚胎中主要由线粒体通过糖酵解为受精卵提供能量,之后则转变为氧化磷酸化[30]。线粒体在卵母细胞发育成熟过程中的分布变化和线粒体基因组拷贝数的变化以及产生ATP能力的大小都会影响卵母细胞的发育情况[31]。线粒体基因组通过非孟德尔遗传形式影响线粒体功能[32],作为动物细胞器内的唯一遗传物质,只编码与氧化呼吸链相关的蛋白质和转运体,具有分子结构简单、无组织特异性、母系遗传、拷贝数高、进化速率快等特点[33-34]。因其独特的性质,线粒体基因组成为研究进化的重要分子生物学工具[27]。在生殖过程中,线粒体基因组遵循母系遗传方式,只通过卵细胞将其中的遗传信息传给下一代,使得子代中线粒体基因组序列和母亲的一致[23]。牟天伊等[35]研究发现,线粒体基因组拷贝数与卵母细胞质量、胚胎发育情况有关,结果表明线粒体基因组变异会引起线粒体结构、功能的改变,同时也与卵母细胞受精有关。研究报道,线粒体变异会与生理状态有关,会影响蛋白质合成的效率,进而影响表型性状[36-37]。线粒体tRNA-Lys(T7719G)基因变异通过生殖细胞影响产羔数的生理机制有待从细胞水平上深入研究。
4 结论tRNA-Lys(T7719G)基因在以小尾寒羊为母本的杂交羊群中存在G、T两种等位基因,等位基因频率分别为57.80%和42.20%,携带G等位基因的母羊平均胎产羔数较携带T等位基因的母羊多0.08只。在季节因素不变的情况下,产羔数随胎次以及携带G等位基因母羊个体数量的增加而增加。建立了胎产羔数预测模型方程:胎产羔数=1.201+(-0.009)×虚拟变量1+0.043×虚拟变量2+0.194×虚拟变量3+0.061×胎次+0.123×携带G基因母羊数量,羊群中增加一个携带G等位基因的个体,胎产羔数增加0.123只。本研究进一步证实tRNA-Lys(T7719G)可作为分子标记进行辅助选种,提高以小尾寒羊为母本的羊群产羔数。
| [1] |
文禹粱, 郭晓飞, 马琳, 等. 绵羊BMPR2基因组织表达及其多态性与产羔数的相关性分析[J]. 安徽农业科学, 2021, 49(20): 98-104. WEN Y L, GUO X F, MA L, et al. Tissue expression of BMPR2 gene and correlation analysis of its polymorphism with litter size in Ovis aries[J]. Journal of Anhui Agricultural Sciences, 2021, 49(20): 98-104. DOI:10.3969/j.issn.0517-6611.2021.20.026 (in Chinese) |
| [2] |
陶林, 潘林香, 王金文, 等. 鲁中肉羊育种中FecB突变应用效果分析[J]. 中国畜牧杂志, 2020, 56(3): 47-50. TAO L, PAN L X, WANG J W, et al. Analysis of the application effects of FecB mutation in breeding of Luzhong mutton sheep[J]. Chinese Journal of Animal Science, 2020, 56(3): 47-50. (in Chinese) |
| [3] |
刘秋月, 胡文萍, 贺小云, 等. 绵羊多羔主效基因FecB高通量检测方法的建立及应用[J]. 畜牧兽医学报, 2017, 48(1): 39-51. LIU Q Y, HU W P, HE X Y, et al. Establishment of high-throughput molecular detection methods for ovine high fecundity major gene FecB and their application[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(1): 39-51. (in Chinese) |
| [4] |
左冉坤, 迟良, 董记红, 等. 高表达线粒体融合蛋白2(MFN2)可抑制高BHBA活化的奶牛肝细胞NF-κB炎性通路[J]. 中国兽医学报, 2021, 41(2): 302-306, 331. ZUO R K, CHI L, DONG J H, et al. Overexpression of MFN2 inhibits the activation of NF-κB inflammatory pathway induced by BHBA in cow hepatocytes[J]. Chinese Journal of Veterinary Science, 2021, 41(2): 302-306, 331. (in Chinese) |
| [5] |
QIN Y H, CHEN S Y, LAI S J. Polymorphisms of mitochondrial ATPase 8/6 genes and association with milk production traits in holstein cows[J]. Anim Biotechnol, 2012, 23(3): 204-212. DOI:10.1080/10495398.2012.686468 |
| [6] |
SUTARNO, CUMMINS J M, GREEFF J, et al. Mitochondrial DNA polymorphisms and fertility in beef cattle[J]. Theriogenology, 2002, 57(6): 1603-1610. DOI:10.1016/S0093-691X(02)00664-7 |
| [7] |
李武峰, 杨润军, 甘乾福, 等. 肉牛PRKAG3基因多态性及其与胴体和肉质性状的关联分析[J]. 畜牧兽医学报, 2009, 40(7): 1106-1111. LI W F, YANG R J, GAN Q F, et al. Polymorphism of PRKAG3 gene and its association with carcass and meat quality traits in beef cattle[J]. Acta Veterinaria et Zootechnica Sinica, 2009, 40(7): 1106-1111. DOI:10.3321/j.issn:0366-6964.2009.07.023 (in Chinese) |
| [8] |
ZHANG B, CHEN H, HUA L S, et al. Novel SNPs of the mtDNA ND5 gene and their associations with several growth traits in the Nanyang cattle breed[J]. Biochem Genet, 2008, 46(5): 362-368. |
| [9] |
田万强. 牛AMPK家族7个基因SNP检测及其与生长和肉质性状的关联分析[D]. 杨凌: 西北农林科技大学, 2013: 1-197. TIAN W Q. Singie Nueleotide polymorphism of 7 genes of AMPK family and associations with growth and meat quality traits in cattle[D]. Yangling: Northwest A&F University, 2013: 1-197. (in Chinese) |
| [10] |
MANNEN H, MORIMOTO M L, OYAMAT K, et al. Identification of mitochondrial DNA substitutions related to meat quality in Japanese black cattle[J]. J Anim Sci, 2003, 81(1): 68-73. DOI:10.2527/2003.81168x |
| [11] |
PRADHAN M, PAL A, SAMANTA A K, et al. Mutations in cytochrome B gene effects female reproduction of Ghungroo pig[J]. Theriogenology, 2018, 119: 121-130. DOI:10.1016/j.theriogenology.2018.05.015 |
| [12] |
李正杰, 周先坤, 王浥尘, 等. 阿坝藏族羌族自治州若尔盖地区藏猪mtDNA D-Loop的遗传多样性分析[J]. 畜牧兽医学报, 2019, 50(12): 2387-2399. LI Z J, ZHOU X K, WANG Y C, et al. Genetic diversity of Tibetan Pig mitochondrial DNA D-loop in Ruoergai area of A'ba Tibetan and Qiang autonomous prefecture[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(12): 2387-2399. DOI:10.11843/j.issn.0366-6964.2019.12.003 (in Chinese) |
| [13] |
WANG Y K, ZHAO J, LIU X L, et al. Identification of SNPs and copy number variations in mitochondrial genes related to the reproductive capacity of the cultured Asian yellow pond turtle (Mauremys mutica)[J]. Anim Reprod Sci, 2019, 205: 78-87. DOI:10.1016/j.anireprosci.2019.04.006 |
| [14] |
郑凯, 杨梅桂, 闫朝君, 等. 线粒体动力学与细胞凋亡[J]. 中国细胞生物学学报, 2019, 41(8): 1465-1476. ZHENG K, YANG M G, YAN C J, et al. Mitochondrial dynamics and apoptosis[J]. Chinese Journal of Cell Biology, 2019, 41(8): 1465-1476. (in Chinese) |
| [15] |
LIU H, SHI W S, WANG D, et al. Association analysis of mitochondrial DNA polymorphisms with oocyte number in pigs[J]. Reprod Fertil Dev, 2019, 31(4): 805-809. DOI:10.1071/RD18219 |
| [16] |
宋亚曼, 卢中秋, 管敏鑫. 线粒体与细胞Ca2+信号转导[J]. 生理学报, 2012, 64(3): 333-340. SONG Y M, LU Z Q, GUAN M X. Mitochondria couple cellular Ca2+ signal transduction[J]. Acta Physiologica Sinica, 2012, 64(3): 333-340. (in Chinese) |
| [17] |
WANG J K, XIANG H, LIU L Q, et al. Mitochondrial haplotypes influence metabolic traits across bovine inter- and intra-species cybrids[J]. Sci Rep, 2017, 7(1): 4179. DOI:10.1038/s41598-017-04457-3 |
| [18] |
KONG M H, XIANG H, WANG J K, et al. Mitochondrial DNA haplotypes influence energy metabolism across chicken transmitochondrial cybrids[J]. Genes, 2020, 11(1): 100. DOI:10.3390/genes11010100 |
| [19] |
YU G H, XIANG H, TIAN J H, et al. Mitochondrial haplotypes influence metabolic traits in porcine transmitochondrial cybrids[J]. Sci Rep, 2015, 5: 13118. DOI:10.1038/srep13118 |
| [20] |
REICHER S, SEROUSSI E, WELLER J I, et al. Ovine mitochondrial DNA sequence variation and its association with production and reproduction traits within an Afec-Assaf flock[J]. J Anim Sci, 2012, 90(7): 2084-2091. DOI:10.2527/jas.2011-4673 |
| [21] |
WANG D, NING C, XIANG H, et al. Polymorphism of mitochondrial tRNA genes associated with the number of pigs born alive[J]. J Anim Sci Biotechnol, 2018, 9: 86. DOI:10.1186/s40104-018-0299-0 |
| [22] |
LIU H, WANG J K, WANG D, et al. Cybrid model supports mitochondrial genetic effect on pig litter size[J]. Front Genet, 2020, 11: 579382. DOI:10.3389/fgene.2020.579382 |
| [23] |
章诺贝, 张吉翔. 线粒体DNA母系遗传机制的研究进展[J]. 国际遗传学杂志, 2007, 30(3): 207-208, 216. ZHANG N B, ZHANG J X. Advance of the research on the mechanisms of maternal inheritance of mitochondrial DNA[J]. International Journal of Genetics, 2007, 30(3): 207-208, 216. DOI:10.3760/cma.j.issn.1673-4386.2007.03.011 (in Chinese) |
| [24] |
PAKENDORF B, STONEKING M. Mitochondrial DNA and human evolution[J]. Annu Rev Genomics Hum Genet, 2005, 6: 165-183. DOI:10.1146/annurev.genom.6.080604.162249 |
| [25] |
CHEN X Y, WANG D, XIANG H, et al. Mitochondrial DNA T7719G in tRNA-Lys gene affects litter size in Small-tailed Han sheep[J]. J Anim Sci Biotechnol, 2017, 8: 31. DOI:10.1186/s40104-017-0160-x |
| [26] |
李聪翀, 张立, 普布次仁, 等. 绵羊多羔性状影响因素的研究进展[J]. 云南畜牧兽医, 2020(1): 36-43. LI C C, ZHANG L, PU B C R, et al. Research progress on influencing factors of multi-lambing traits in sheep[J]. Yunnan Journal of Animal Science and Veterinary Medicine, 2020(1): 36-43. (in Chinese) |
| [27] |
RAMESH P, MALLIKARJUNA G, SAMEENA S, et al. Advancements in molecular marker technologies and their applications in diversity studies[J]. J Biosci, 2020, 45(1): 123. DOI:10.1007/s12038-020-00089-4 |
| [28] |
FANG E F, SCHEIBYE-KNUDSEN M, CHUA K F, et al. Nuclear DNA Damage Signalling to Mitochondria in Ageing[J]. Nat Rev Mol Cell Biol, 2016, 17(5): 308-321. DOI:10.1038/nrm.2016.14 |
| [29] |
张尊月, 李坪, 唐莉, 等. 线粒体和胚胎发育关系的研究进展[J]. 昆明医科大学学报, 2019, 40(1): 118-122. ZHANG Z Y, LI P, TANG L, et al. Research progress on the relationship between mitochondria and embryonic development[J]. Journal of Kunming Medical University, 2019, 40(1): 118-122. DOI:10.3969/j.issn.1003-4706.2019.01.026 (in Chinese) |
| [30] |
徐梓萌, 马盼盼, 栾维民, 等. 线粒体与胚胎质量相关性研究进展[J]. 动物医学进展, 2018, 39(11): 102-106. XU Z M, MA P P, LUAN W M, et al. Advance in correlation between mitochondria and embryo quality[J]. Progress in Veterinary Medicine, 2018, 39(11): 102-106. DOI:10.3969/j.issn.1007-5038.2018.11.021 (in Chinese) |
| [31] |
李贝贝, 杜馨, 张敏, 等. 颗粒细胞线粒体功能与卵母细胞发育相关性的研究进展[J]. 国际生殖健康/计划生育杂志, 2020, 39(6): 482-485. LI B B, DU X, ZHANG M, et al. Correlation between mitochondrial function of granulosa cells and oocyte development[J]. Journal of International Reproductive Health/Family Planning, 2020, 39(6): 482-485. (in Chinese) |
| [32] |
牛华锋, 陈玉林, 任战军, 等. 中国绵羊品种mtDNA遗传多态性与系统进化研究[J]. 中国农学通报, 2011, 27(17): 21-25. NIU H F, CHEN Y L, REN Z J, et al. Study on mtDNA genetic diversity and phylogeny evolution of Chinese sheep breeds[J]. Chinese Agricultural Science Bulletin, 2011, 27(17): 21-25. (in Chinese) |
| [33] |
巫小倩, 张顺华, 朱砺. 线粒体DNA异质性[J]. 中国生物化学与分子生物学报, 2017, 33(1): 11-16. WU X Q, ZHANG S H, ZHU L. Mitochondrial DNA heteroplasmy[J]. Chinese Journal of Biochemistry and Molecular Biology, 2017, 33(1): 11-16. (in Chinese) |
| [34] |
王凯悦. 云南7个地方黄牛品种全基因组遗传多样性与起源研究[D]. 杨凌: 西北农林科技大学, 2021: 1-95. WANG K Y. Whole-genome genetic diversity and origin of 7 native cattle breeds in Yunnan[D]. Yangling: Northwest A&F University, 2021: 1-95. (in Chinese) |
| [35] |
牟天伊, 王树玉, 马延敏, 等. 线粒体DNA拷贝数与卵母细胞质量及胚胎发育相关性研究进展[J]. 中华实用诊断与治疗杂志, 2020, 34(12): 1287-1289. MU T Y, WANG S Y, MA Y M, et al. Correlation of mitochondrial DNA copy number with oocyte quality and embryo development[J]. Journal of Chinese Practical Diagnosis and Therapy, 2020, 34(12): 1287-1289. (in Chinese) |
| [36] |
饶本强, 邓丽, 闫巍. 线粒体DNA突变与肿瘤[J]. 肿瘤代谢与营养电子杂志, 2018, 5(1): 1-10. RAO B Q, DENG L, YAN W. Mitochondrial DNA mutations and human cancer[J]. Electronic Journal of Metabolism and Nutrition of Cancer, 2018, 5(1): 1-10. (in Chinese) |
| [37] |
SCHNEIDER A. Mitochondrial tRNA import and its consequences for mitochondrial translation[J]. Annu Rev Biochem, 2011, 80: 1033-1053. DOI:10.1146/annurev-biochem-060109-092838 |
(编辑 郭云雁)



