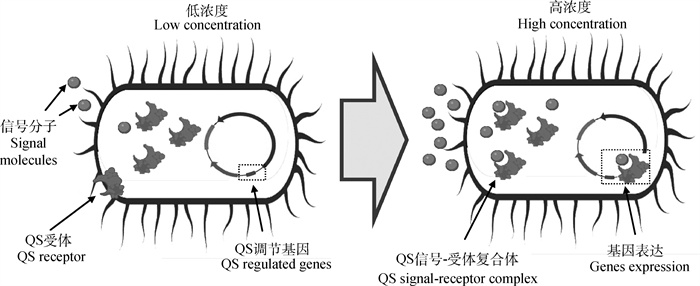
群体感应(quorum sensing,QS)是微生物中的一种通讯系统,通过交换被称为自诱导分子(autoinducer,AI)的化学信号分子来完成[1]。在QS作用下,自诱导分子随着细菌数量的增加而积聚,并将自诱导分子释放到外环境中[2]。当自诱导分子的浓度达到一定程度时,该细菌群体的一些特定基因便可以表达[3](图 1)。Fuqua等[4]于1994年在其研究中首次提出了群体感应这一概念,此后便被广泛采用。QS系统在微生物许多生命活动中发挥重要作用,如微生物发酵[5]、生物膜生长发育[6]以及耐药性的产生[7]等。但是由于各种自诱导分子的组成、功能以及不同QS系统间的关系十分复杂,目前只对少数几种模式细菌有系统性研究,对于畜禽消化道细菌QS的研究更是少见。有鉴于此,本文综述了近年来国内外关于畜禽消化道细菌QS的研究进展,并总结了细菌QS对于畜禽消化道菌群与畜禽的作用及其相关调控,以期为利用细菌QS系统提高畜禽生产水平提供理论参考。
1 细菌QS的种类及其作用层次 1.1 细菌QS的种类根据细菌分泌信号分子的不同,主要分为几类:1)酰基高丝氨酸内酯类信号分子(acyl-homoserine lactone,AHL),多数存在于革兰阴性菌QS系统[8]。AHL是由细菌细胞中LuxI型酶合成,在浓度达到适度阈值后激活LuxR蛋白,从而调控相关基因的表达。AHL的作用范围主要包括:生物荧光的产生、质粒DNA转移、毒力基因的表达、生物膜的形成等[9-10]。2)被称作自诱导肽的寡肽类分子(autoinducing peptides,AIP),由革兰阳性菌QS系统分泌,通过细胞膜上的ABC转运系统(ATP binding cassette)运输到胞外,再被双组分磷酸蛋白激酶识别,激活体内RNAⅢ的转录,进而诱导致病因子表达。其功能包括促进毒力基因表达、产生抗微生物复合物等[11]。3)呋喃糖基硼酸二酯(furanosyl-borate-diester)类化合物信号分子,也称自体诱导物2(autoinducer-2,AI-2),革兰阳性菌和革兰阴性菌均可分泌,由细菌细胞中LuxS型酶合成其前体物质4,5-二羟基-2,3-戊二酮(DPD),进一步修饰生成AI-2,可参与细菌种内和种间的信号交流[12-13]。
1.2 细菌QS的作用层次QS相应的作用层次主要分为细胞内QS全细胞调控机制、不同模式的种内细菌QS调控机制以及种间的QS调控机制3个层次[14]。1)已完成的基因组分析表明,多数细菌的QS系统是以一种全细胞水平的方式来调控基因表达的。2)细菌种内的QS调控机制又分为平行型模式的QS调控、顺序型模式的QS调控、竞争型模式的QS调控,以及开-闭型模式的QS调控等。在细胞间的交流中,不同信号结构体系中提供信息传递、检测、转译和应答过程可以作为用于区别其他类型的唯一特性[14]。3)种间的QS调控机制,也称“合作-欺骗”生态关系。欺骗指的是细菌个体从公共池中获取其他个体分泌的公共物质,享受QS利益的行为;合作指的是细菌个体通过相互交流,分泌能被群体中任意个体使用的公共物质[15]。
2 细菌QS在畜禽消化道中的研究进展由于消化道结构、生理特性以及消化道菌群组成等各方面的不同,目前,猪和家禽消化道中细菌QS的研究发现主要集中于QS在大肠杆菌、产气荚膜梭菌、空肠梭菌等致病性细菌的发病机制中所发挥的作用,而反刍动物瘤胃中细菌QS的报道则多与QS在瘤胃细菌粗纤维降解与微生物蛋白合成等生理活动中的作用有关。
2.1 在猪消化道中的研究Zhu等[16]研究发现,肠毒性大肠埃希杆菌(Enterotoxigenic Escherichia coli,ETEC)菌株JG280所诱导的猪小肠上皮IPEC-J2细胞死亡具有细菌细胞密度依赖性,其随后的研究结果表明,JG280的AI-2信号分子所介导的QS参与了ETEC的发病机制。刘云[17]研究表明,AHL类信号分子3OC12-HSL对仔猪IPEC-J2细胞形态具有明显影响。其进一步研究表明,3OC12-HSL在细菌黏附、侵袭宿主细胞过程中起着重要作用,影响了病原菌和宿主细胞间的互作,从而引起IPEC-J2形态的改变。Yang等[18]从猪肠道内容物中首次分离出AHL阳性菌,并将其命名为嗜水气假单胞菌YZ2(Aeromonas hydrophila YZ2),通过构建来自YZ2的luxl(编码产生AHL类信号分子)同源基因的大肠杆菌表达载体,进一步研究证明AHL能够在大肠杆菌中诱导QS相关致病基因(包含fliC、sdiA、gadA等)表达。最新的研究表明,3OC12-HSL还会通过抑制仔猪IPEC-J2细胞的跨膜运输功能并影响精氨酸和脯氨酸的代谢而降低IPEC-J2细胞活力,从而对低出生体重仔猪的肠道健康产生不利影响[19]。
2.2 在家禽消化道中的研究相对于猪和反刍动物,针对家禽消化道中细菌QS的相关研究及报道较少。Novak和Fratamico[20]研究发现,能够引起鸡坏死性肠炎(necrotic enteritis,NE)的产气荚膜梭菌[21]可以产生种间信号分子AI-2,且QS信号分子类似物会抑制其活性。据报道,从鸡消化道中分离出的产气荚膜梭菌含有Agr型和Lux型QS,这两种类型的QS在NE的发病机制中均起着重要作用[22]。禽致病性大肠杆菌(avian pathogenic Escherichia coli,APEC)中也存在QS,并且缺失LuxS基因的APEC突变株DDE17的毒力、运动能力等都有所下降,证实了AI-2介导的QS在APEC导致家禽患大肠杆菌病中起着重要作用[23]。研究发现[24],缺失LuxS基因的空肠弯曲菌突变体生物膜形成会受到抑制,其运动能力以及在鸡消化道中的定植能力也会降低。进一步研究表明,抑制鸡消化道中空肠梭菌QS能够减少粪便中的空肠梭菌数量,从而控制其在环境中的传播。
2.3 在反刍动物消化道中的研究反刍动物的瘤胃是一种特殊的天然发酵罐,其中栖息着诸多种类的微生物,这些微生物具有降解纤维素、合成菌体蛋白和维生素等多种作用,对反刍动物的生产性能及健康产生重要影响[25],因而细菌QS在反刍动物消化道中的研究发现多集中于瘤胃细菌。Erickson等[26]最早发现奶牛瘤胃液中的细菌可以产生AHL,但并未在所有试验奶牛的瘤胃液中检测到AHL,推测产生AHL的细菌可能并非维持瘤胃正常发酵所必需的菌群。Mitsumori等[27]在溶纤维丁酸弧菌、瘤胃真杆菌、黄色瘤胃球菌和溶淀粉琥珀酸单胞菌的培养液中均检测到了AI-2类信号分子,同时在奶牛瘤胃液中检测到了LuxS基因(编码产生AI-2类信号分子)的同源物,表明瘤胃中存在由AI-2介导的QS系统。Ran等[28]于不同采样时间均未在山羊瘤胃内容物及体外发酵的瘤胃液中检测到AHLs和AI-2活性,但在体内和体外的瘤胃液里克隆到了瘤胃普雷沃菌(Prevotella ruminicola)LuxS的同源物。研究者推测可能是由于饲养条件与检测技术的限制,导致AHLs和AI-2未被检出。然而LuxS基因同源物的发现表明山羊瘤胃微生物仍然可能存在AI-2介导的QS。至今已证实黄色瘤胃球菌、牛瘤胃链球菌等瘤胃微生物存在多种AI介导的QS,但是由于瘤胃微生物种类多、数量大,仍需进一步研究瘤胃中究竟哪些微生物存在QS、存在哪种AI介导的QS,以及QS是如何调控这些微生物的[29]。
综上所述,针对畜禽消化道中细菌QS的研究起步较晚,近年来,对于畜禽消化道中细菌QS的研究逐渐发展和深入。然而,还存在很多需要探索的问题,例如在不同种类动物中是否存在不同的作用机制,以及不同细菌种类在同种类动物中的作用及其机制等。以上问题均需要通过进一步的深入研究证实。
3 QS对畜禽消化和免疫功能的影响 3.1 QS对畜禽消化功能的影响已有的相关研究报道表明,细菌QS存在于畜禽消化道菌群中,并且其可能通过调控消化道细菌生理代谢活动进而对宿主消化功能产生影响。冉涛和谭支良[29]的报道表明,反刍动物瘤胃微生物中的溶纤维丁酸弧菌、白色瘤胃球菌和黄色瘤胃球菌等细菌存在多种AI信号分子介导的QS,具有调节瘤胃细菌运动、定植和生物膜形成等功能[30],并且这些细菌在瘤胃发酵过程中对降解纤维素、半纤维素和木质素等[31]有重要作用,推测QS在瘤胃厌氧发酵过程中也起着重要作用。有研究表明[32],在14月龄草原红牛日粮中添加参照橡树皮提取物成分制成的QS抑制剂(quorum sensing inhibitor,QSI,成分:松柏醇50%,3, 4, 5-三甲氧基苯酚20%,丙基间苯二酚15.5%,香草醛5.9%,氧杂茶邻酮5.3%,东莨菪素3.3%)可提高瘤胃中挥发性脂肪酸(volatile fatty acids,VFA)浓度以及促进菌体蛋白合成,表明QSI可能通过抑制消化道某些细菌QS功能而提高了消化率,据此可以推测被此QSI所抑制的细菌QS会对草原红牛消化功能产生不利影响。Patra等[33]研究发现,反刍动物以甲烷形式所损失的能量占饲料总能的2%~15%,而瘤胃产甲烷菌主要利用VFA和氢气生成甲烷[34]。由于QS能够对产甲烷菌细胞形态、生物膜生成及瘤胃菌群增殖产生影响[35-37],其可能在瘤胃中细菌与甲烷菌的互作中发挥作用,因此如果对这一作用机制开展深入研究,有望为提高饲料利用率及减少甲烷排放寻找到一条新途径。目前,QS对猪和家禽消化的影响的相关报道极少,但是QS对乳酸菌[3, 38]、沙门菌[39]、大肠杆菌[40]等消化道细菌生物膜形成、毒力因子表达等有重要作用,进而对消化道中菌群组成和结构、pH等产生影响,因此推测QS会对猪和家禽的消化功能同样发挥作用。
综上所述,畜禽消化道菌群中存在QS,也可以推测消化道细菌QS会对畜禽消化功能产生影响,但是QS影响消化道细菌具体作用机制以及对畜禽消化功能的作用仍需进一步探索和明确。而如何利用细菌QS对于畜禽消化道菌群的作用机制对畜禽消化功能实现有效调控,将会是今后研究的一系列热点。
3.2 QS对畜禽免疫功能的影响QS可以通过促进或抑制细菌毒力因子基因表达影响细菌的代谢、运动、毒素分泌等,进而影响畜禽免疫功能。Gart等[41]的研究报道,沙门菌Ⅱ型QS系统可以介导鞭毛基因(fliC和fliD)和毒力岛SPI-1(编码细菌毒力基因簇的染色体片段)相关毒力因子(invF、sicA、sopB和sopE)的表达,影响沙门菌对宿主细胞的黏附和侵袭,进而引发宿主体液和细胞免疫应答。Moreira等[42]研究证实沙门菌Ⅲ型QS系统中的QseC、QseE基因在沙门菌毒力基因(sipA、sopB和sifA)的表达中发挥重要作用,影响沙门菌的毒力和运动性,进而影响沙门菌侵染畜禽肠道黏膜上皮、破坏肠道屏障及诱导炎症反应的能力。研究表明,金黄色葡萄球菌QS辅助基因调节系统(accessorygene regulator,Agr)中的转录单位RNAⅢ通过反义碱基配对机制和转录抑制蛋白Rot影响基因表达,可调控α-溶血素、PSMα及PSMβ等多种毒素的释放,从而具有影响宿主白细胞、血小板等的裂解以及抑制吞噬细胞的吞噬功能等一系列作用[43]。QS具有影响细菌毒力因子中内毒素、外毒素的分泌,进而调节畜禽免疫功能的作用。细菌毒力因子中的内毒素可诱导机体巨噬细胞产生肿瘤坏死因子α(TNF-α)、白细胞介素-1(IL-1)和白细胞介素-6(IL-6),还会引起血小板减少、骨髓反应和过敏反应等一系列免疫反应[44]。此外,细菌分泌的外毒素能破坏宿主细胞、干扰免疫反应,如α-溶血素可以裂解白细胞、血小板、上皮细胞等[45]。
QS除了通过促进或抑制细菌毒力因子表达,也能通过调控短链脂肪酸生成的方式影响机体免疫功能。由于反刍动物瘤胃中的白色瘤胃球菌、黄色瘤胃球菌等能够将木质纤维素降解生成乙酸、丙酸、丁酸等[31, 46],QS能够调控这些细菌的代谢、运动以及增殖等生理活动,从而影响乙酸、丁酸等短链脂肪酸调节消化道菌群、保护肠道黏膜屏障、抗炎抗肿瘤等作用[47]。此外,研究报道产丁酸的梭菌属、梭杆菌属等菌属中均有受QS调控的菌种[48],推测QS也能通过调控产丁酸菌的生理活动影响丁酸的生成进而调节畜禽免疫功能,但仍需进一步验证。
综上,细菌QS可能通过影响细菌毒力因子表达、短链脂肪酸生成等方式影响畜禽免疫活动。然而迄今只对消化道中极个别致病性细菌QS有较为全面的研究,接下来应深入探究畜禽消化道中常见及优势细菌的QS通过调控毒力因子、短链脂肪酸等途径进而影响畜禽免疫功能的具体机制或模式。
4 畜禽消化道细菌QS相关调控 4.1 细菌QS的相应调控手段干扰和破坏QS的过程称作群体淬灭(quorum quenching,QQ),可以减少或消除细菌间的“交流”,阻碍致病菌致病因子表达,从而抵御致病菌感染。相较于使用抗生素灭菌或抑菌,QQ不会影响细菌的生存和生长,并且只针对某一类靶细菌的QS,能够特异性抑制致病菌的致病性,而不是采用全部消杀的方式,不易造成选择压力和耐药性[49]。有鉴于此,QQ作为一种新型的、有效的病害防控方法,具有良好的应用前景。
QS需要先后经由信号分子分泌、识别以及信号—受体复合体形成3个主要步骤而产生作用(图 2),因此QQ可以通过破坏或抑制以上3个步骤中的任意一个而实现。即可以通过降低QS信号分子调节基因的表达来抑制信号分子生成,或使用信号分子降解酶降解、破坏信号分子,或使用信号分子类似物、信号受体抑制剂等阻止信号分子与相应的受体蛋白结合[50-52]。
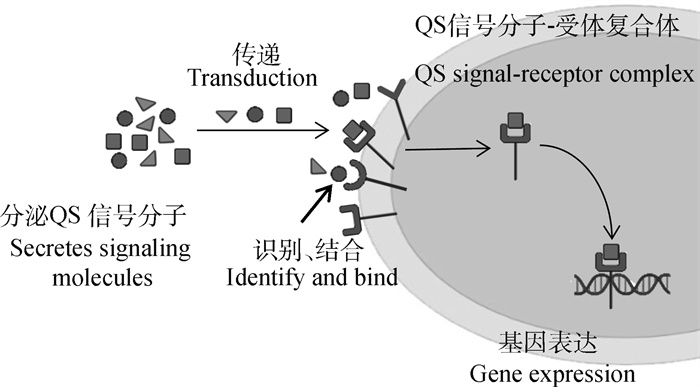
|
图 2 群体感应作用机理 Fig. 2 Mechanism of action of Quorum sensing |
如今已经发现诸多能够淬灭细菌QS的物质,但仅有少量应用于畜禽,尤其是暂未发现QS信号分子类似物应用于畜禽消化道细菌的报道。因此,使细菌QS相关调控的研究应用于畜禽生产将成为重点。以下分别是通过抑制QS信号分子生成、传递来淬灭畜禽消化道细菌QS的研究成果。
4.2.1 抑制信号分子生成 细菌生长过程当中会产生多种QS信号分子,并不断分泌到周围环境中,达到“信息交流”的目的。生成QS信号分子需要底物、各种酶以及多种调节基因共同作用,譬如革兰阴性菌QS中LuxI蛋白能够催化S-腺苷蛋氨酸(S-adenosyl methionine,SAM)上的高丝氨酸与载体蛋白酰基侧链结合,进而形成信号分子AHL;AI-2的生成则是S-腺苷同型半胱氨酸(S-adenosyl homocysteine,SAH)在核苷酶Pfs的作用下分解为腺嘌呤和S-核糖基同型半胱氨酸(LuxS),接着LuxS反应产生AI-2的前体物质4,5-二羟基-2,3-戊二酮(DPD)[53];因而可以通过破坏底物、抑制酶活性和调节基因的表达阻碍信号分子产生。通过总结相关报道发现,众多天然植物活性成分能够抑制QS信号分子生成[54-61](表 1)。除天然植物活性成分外,发现一些化合物也具有抑制QS信号分子生成的作用。Dong等[49]研究表明,三氯生(triclosan)能够阻止酰基载体蛋白被还原,起到抑制信号分子AHL生成的作用。Alfaro等[62]合成了三氢核糖基-L-同型半胱氨酸和S-高核糖基-L-半胱氨酸两种LuxS的底物类似物,均能够降低LuxS活性进而抑制信号分子AI-2生成。随着研究的不断深入,将会有更多的天然或人工合成化合物用于抑制QS信号分子生成。
|
|
表 1 植物活性成分抑制QS信号分子生成 Table 1 Natural plant active ingredients inhibit the formation of QS signaling molecules |
4.2.2 破坏信号分子,抑制其传递 通过破坏QS信号分子,抑制其传递,进而干扰细菌通讯途径能够达到群体淬灭的目的。例如,N-酰基高丝氨酸内酯酶可水解QS信号分子酰基高丝氨酸内酯的内酯环,从而破坏其作为信号分子的功能。但是水解产物N-酰基高丝氨酸在酸性介质中能够重新环化成N-酰基高丝氨酸内酯,因而N-酰基高丝氨酸内酯酶的淬灭作用是可逆的[63]。淬灭酶在动物试验中已经得到应用,张广民等[64-65]曾在肉鸡饲料及断奶仔猪日粮中添加500 g·t-1 N-乙酰基高丝氨酸内酯酶。结果显示,不同日龄的肉鸡淬灭酶组和对照组相比料肉比有明显降低,日增重和饲料转化率有一定提高;断奶仔猪生产性能显著改善,腹泻率得到降低。也有研究结果表明[66],在日粮中添加N-酰基高丝氨酸内酯酶能够改善绵羊瘤胃发酵,提高日粮营养利用效率和干物质表观消化率。Kim等[67]研究发现,日粮中添加嗜酸乳杆菌30SC能够提高仔猪消化道中乳酸杆菌相对丰度,减少大肠杆菌的数量,有效改善仔猪的生长性能和免疫状态。其相关研究表明,30SC细胞提取物可以深度抑制肠出血性大肠杆菌O157:17(ETEC)中AI-2信号分子活性,但30SC益生菌细胞提取物破坏或降解AI-2信号分子的过程仍需进一步研究。
4.3 淬灭畜禽消化道细菌QS的其他方法目前暂未发现信号分子类似物(可抑制信号分子与受体蛋白结合)以及受体抑制剂作用于畜禽消化道细菌的报道,但已有诸多关于运用信号分子类似物和受体抑制剂淬灭QS的研究[68]。Mcinnis等[69]设计合成的多种硫代内酯类信号分子类似物对LuxI/LuxR型QS系统有影响。其中,六个碳短酰基尾的OHHL硫内酯类似物对LuxR受体具有抑制作用。Brackman等[70]合成了一系列酰胺键被三唑环取代的AHL类似物,发现其均能抑制铜绿假单胞菌的LuxR型QS系统。Sully等[71]发现了一种小分子抑制剂——savirin,它能够抑制受体蛋白AgrA活性,从而干扰金黄色葡萄球菌中agr介导的QS。Paczkowski等[72]研究表明,对铜绿假单胞菌进行类黄酮处理,可改变QS调控靶标启动子的转录,抑制毒力因子的产生,这是由于黄酮类化合物通过拮抗信号分子的结合受体LasR和RhlR而特异性地抑制QS。O’Loughlin等[73]利用重组大肠杆菌菌株测定间溴硫代内酯(meta-bromo-thiolactone, mBTL)对LasR和RhlR两种受体的影响,结果表明,mBTL能够部分抑制两种受体,但只在一定浓度范围才能发挥效力。Kalaiarasan等[74]在mCTL与mBTL上引入更多氢键,设计合成了N-(4-(4-氟苯胺)丁酰)-L-高丝氨酸内酯(FABHL)和N-(4-(4-氯苯胺)丁酰)-L-高丝氨酸内酯(CABHL),FABHL和CABHL均能通过干扰QS抑制生物膜形成,且CABHL能够显著下调lasR和rhlR基因的表达。
综上,尽管已有诸多研究表明QS信号分子类似物和受体抑制剂能够淬灭细菌QS,然而暂未见应用于畜禽的相关报道。如何利用QS信号分子类似物或受体抑制剂对畜禽消化道QS进行淬灭进而有效调控消化道菌群并提升畜禽健康与生产水平,是需要进一步探究的问题。
5 小结与展望细菌QS的发现作为微生物学领域的重大进展之一,增进了人们对细菌通讯系统及细菌种内和种间互作竞争机制的深入了解,促进了环境科学、食品科学、兽医学等相关学科的发展。近年来,关于细菌QS在细菌感染、食品保鲜、厌氧发酵等领域的研究逐渐增多,但其在畜禽上的报道相对少见。随着全世界对于畜牧业减排、禁抗的要求越来越高,如何利用细菌QS克服细菌抗药性以及调控畜禽消化与免疫等功能必将成为研究热点。有鉴于此,基于已有的细菌QS信号分子、信号通路、调控机理等方面的研究成果,进一步深入研究畜禽消化道细菌QS在畜禽生产中的作用及其调控机制,对于保障畜禽健康、提高畜禽产品品质、以及促进畜禽养殖产业提质增效等均具有积极的指导意义。
| [1] |
TAGA M E, BASSLER B L. Chemical communication among bacteria[J]. Proc Natl Acad Sci U S A, 2003, 100(S2): 14549-14554. |
| [2] |
SURETTE M G, MILLER M B, BASSLER B L. Quorum sensing in Escherichia coli, Salmonella typhimurium, and Vibrio harveyi: a new family of genes responsible for autoinducer production[J]. Proc Natl Acad Sci U S A, 1999, 96(4): 1639-1644. DOI:10.1073/pnas.96.4.1639 |
| [3] |
WATERS C M, BASSLER B L. Quorum sensing: cell-to-cell communication in bacteria[J]. Annu Rev Cell Dev Biol, 2005, 21: 319-346. DOI:10.1146/annurev.cellbio.21.012704.131001 |
| [4] |
FUQUA W C, WINANS S C, GREENBERG E P. Quorum sensing in bacteria: the LuxR-LuxI family of cell density-responsive transcriptional regulators[J]. J Bacteriol, 1994, 176(2): 269-275. DOI:10.1128/jb.176.2.269-275.1994 |
| [5] |
BREXÓ R P, DE SOUZA SANT'ANA A. Microbial interactions during sugar cane must fermentation for bioethanol production: does quorum sensing play a role?[J]. Crit Rev Biotechnol, 2018, 38(2): 231-244. DOI:10.1080/07388551.2017.1332570 |
| [6] |
HE Y W, XU M, LIN K, et al. Genome scale analysis of diffusible signal factor regulon in Xanthomonas campestris pv. campestris: identification of novel cell-cell communication-dependent genes and functions[J]. Mol Microbiol, 2006, 59(2): 610-622. DOI:10.1111/j.1365-2958.2005.04961.x |
| [7] |
KALIA C V, PATEL S K S, KANG Y C, et al. Quorum sensing inhibitors as antipathogens: biotechnological applications[J]. Biotechnol Adv, 2019, 37(1): 68-90. DOI:10.1016/j.biotechadv.2018.11.006 |
| [8] |
KLEEREBEZEM M, OUADRI L E N, KUIPERS O P, et al. Quorum sensing by peptide pheromones and two-component signal-transduction systems in Gram-positive bacteria[J]. Mol Microbiol, 1997, 24(5): 895-904. DOI:10.1046/j.1365-2958.1997.4251782.x |
| [9] |
DONG Y H, WANG L H, ZHANG L H. Quorum-quenching microbial infections: mechanisms and implications[J]. Philos Trans Roy Soc B Biol Sci, 2007, 362(1483): 1201-1211. DOI:10.1098/rstb.2007.2045 |
| [10] |
STURME M H J, KLEEREBEZEM M, NAKAYAMA J, et al. Cell to cell communication by autoinducing peptides in gram-positive bacteria[J]. Antonie Van Leeuwenhoek, 2002, 81(1-4): 233-243. |
| [11] |
王飞飞, 吴豪益, 林晨, 等. 基于食源性细菌群体淬灭的生物膜控制研究进展[J]. 食品科学, 2020, 41(19): 290-295. WANG F F, WU H Y, LIN C, et al. Advances in foodborne microbial biofilm control based on bacteria quorum quenching[J]. Food Science, 2020, 41(19): 290-295. DOI:10.7506/spkx1002-6630-20200425-328 (in Chinese) |
| [12] |
姜凯. AHL类和AI-2类抑制剂对铜绿假单胞菌PAO1群体感应作用的研究[D]. 长春: 吉林大学, 2020. JIANG K. Study on the effects of AHL and AI-2 inhibitors on the quorum sensing of Pseudomonas aeruginosa PAO1[D]. Changchun: Jilin University, 2020. (in Chinese) |
| [13] |
SUN J B, DANIEL R, WAGNER-DÖBLER I, et al. Is autoinducer-2 a universal signal for interspecies communication: a comparative genomic and phylogenetic analysis of the synthesis and signal transduction pathways[J]. BMC Evol Biol, 2004, 4(1): 36. DOI:10.1186/1471-2148-4-36 |
| [14] |
姜巨全, 肖鸿禹, 胡宝忠. 细菌群体感应分子水平调控机制研究进展[J]. 黑龙江大学自然科学学报, 2013, 30(2): 232-238. JIANG J Q, XIAO H Y, HU B Z. Research progress on molecular-level regulatory mechanism of bacterial quorum sensing[J]. Journal of Natural Science of Heilongjiang University, 2013, 30(2): 232-238. (in Chinese) |
| [15] |
赖柏民, 汪美贞, 沈东升. 细菌群体感应"合作-欺骗"研究进展[J]. 应用生态学报, 2017, 28(5): 1735-1742. LAI B M, WANG M Z, SHEN D S. Bacterial quorum sensing: cooperation and cheating[J]. Chinese Journal of Applied Ecology, 2017, 28(5): 1735-1742. (in Chinese) |
| [16] |
ZHU J, YIN X H, YU H, et al. Involvement of quorum sensing and heat-stable enterotoxin a in cell damage caused by a porcine enterotoxigenic Escherichia coli strain[J]. Infect Immun, 2011, 79(4): 1688-1695. DOI:10.1128/IAI.01281-10 |
| [17] |
刘云. 细菌群体感应信号分子3OC12-HSL对仔猪小肠上皮细胞IPEC-J2的影响[D]. 扬州: 扬州大学, 2017. LIU Y. Effect of bacterial quorum sensing signal 3OC12-HSL on intestine porcine epithelial cell line IPEC-J2[D]. Yangzhou: Yangzhou University, 2017. (in Chinese) |
| [18] |
YANG Y, ZHOU M X, HARDWIDGE P R, et al. Isolation and characterization of N-acyl homoserine lactone-producing bacteria from cattle rumen and swine intestines[J]. Front Cell Infect Microbiol, 2018, 8: 155. DOI:10.3389/fcimb.2018.00155 |
| [19] |
TAO S Y, XIONG Y, WANG Z Y, et al. N-acyl-homoserine lactones may affect the gut health of low-birth-weight piglets by altering intestinal epithelial cell barrier function and amino acid metabolism[J]. J Nutr, 2021, 151(7): 1736-1746. DOI:10.1093/jn/nxab104 |
| [20] |
NOVAK J S, FRATAMICO P M. Evaluation of ascorbic acid as a quorum-sensing analogue to control growth, sporulation, and enterotoxin production in Clostridium perfringens[J]. J Food Sci, 2004, 69(3): FMS72-FMS78. |
| [21] |
MCDEVITT R M, BROOKER J D, ACAMOVIC T, et al. Necrotic enteritis; a continuing challenge for the poultry industry[J]. World Poultry Sci J, 2006, 62(2): 221-247. DOI:10.1079/WPS200593 |
| [22] |
YU Q, LEPP D, GOHARI I M, et al. The agr-like quorum sensing system is required for pathogenesis of necrotic enteritis caused by Clostridium perfringens in poultry[J]. Infect Immun, 2017, 85(6): e00975-16. |
| [23] |
HAN X G, BAI H, LIU L, et al. The luxS gene functions in the pathogenesis of avian pathogenic Escherichia coli[J]. Microb Pathog, 2013, 55: 21-27. DOI:10.1016/j.micpath.2012.09.008 |
| [24] |
ŠIMUNOVIĆ K, SAHIN O, KOVAC J, et al. (-)-ɑ-Pinene reduces quorum sensing and Campylobacter jejuni colonization in broiler chickens[J]. PLoS One, 2020, 15(4): e0230423. DOI:10.1371/journal.pone.0230423 |
| [25] |
WANG Z, YANG D S, LI X Y, et al. Modulation of rumen fermentation and microbial community through increasing dietary cation-anion difference in Chinese Holstein dairy cows under heat stress conditions[J]. J Appl Microbiol, 2021, 130(3): 722-735. DOI:10.1111/jam.14812 |
| [26] |
ERICKSON D L, NSEREKO V L, MORGAVI D P, et al. Evidence of quorum sensing in the rumen ecosystem: detection of N-acyl homoserine lactone autoinducers in ruminal contents[J]. Can J Microbiol, 2002, 48(4): 374-378. DOI:10.1139/w02-022 |
| [27] |
MITSUMORI M, XU L M, KAJIKAWA H, et al. Possible quorum sensing in the rumen microbial community: detection of quorum-sensing signal molecules from rumen bacteria[J]. FEMS Microbiol Lett, 2003, 219(1): 47-52. DOI:10.1016/S0378-1097(02)01192-8 |
| [28] |
RAN T, ZHOU C S, XU L W, et al. Initial detection of the quorum sensing autoinducer activity in the rumen of goats in vivo and in vitro[J]. J Integr Agric, 2016, 15(10): 2343-2352. DOI:10.1016/S2095-3119(16)61417-X |
| [29] |
冉涛, 谭支良. 反刍家畜瘤胃微生物群体感应[J]. 动物营养学报, 2012, 24(7): 1207-1215. RAN T, TAN Z L. Rumen microbial quorum-sensing of ruminant livestock[J]. Acta Zoonutrimenta Sinica, 2012, 24(7): 1207-1215. DOI:10.3969/j.issn.1006-267x.2012.07.004 (in Chinese) |
| [30] |
GHALI I, SHINKAI T, MITSUMORI M. Mining of luxS genes from rumen microbial consortia by metagenomic and metatranscriptomic approaches[J]. Anim Sci J, 2016, 87(5): 666-673. DOI:10.1111/asj.12476 |
| [31] |
郑娟善, 张剑搏, 梁泽毅, 等. 瘤胃微生物对木质纤维素降解的研究进展[J]. 动物营养学报, 2020, 32(5): 2010-2019. ZHENG J S, ZHANG J B, LIANG Z Y, et al. Research progress on degradation of lignocellulose by rumen microorganisms[J]. Chinese Journal of Animal Nutrition, 2020, 32(5): 2010-2019. DOI:10.3969/j.issn.1006-267x.2020.05.008 (in Chinese) |
| [32] |
ATLANDEROVA K N, MAKAEVA A M, KURILKINA M Y, et al. Technology for increasing the bioavailability of feed using quorum sensing inhibitors[J]. IOP Conf Ser: Earth Environ Sci, 2021, 624: 012159. DOI:10.1088/1755-1315/624/1/012159 |
| [33] |
PATRA A, PARK T, KIM M, et al. Rumen methanogens and mitigation of methane emission by anti-methanogenic compounds and substances[J]. J Anim Sci Biotechnol, 2017, 8: 13. DOI:10.1186/s40104-017-0145-9 |
| [34] |
BUCCIONI A, CAPPUCCI A, MELE M. Methane emission from enteric fermentation: methanogenesis and fermentation[M]//SEJIAN V, GAUGHAN J, BAUMGARD L, et al. Climate Change Impact on Livestock: Adaptation and Mitigation. New Delhi: Springer, 2015: 171-186.
|
| [35] |
WON M Y, OYAMA L B, COURTNEY S J, et al. Can rumen bacteria communicate to each other?[J]. Microbiome, 2020, 8(1): 23. DOI:10.1186/s40168-020-00796-y |
| [36] |
ZHANG G S, ZHANG F, DING G, et al. Acyl homoserine lactone-based quorum sensing in a methanogenic archaeon[J]. ISME J, 2012, 6(7): 1336-1344. DOI:10.1038/ismej.2011.203 |
| [37] |
CHARLESWORTH J C, BELOE C, WATTERS C, et al. Quorum sensing in archaea: recent advances and emerging directions[M]//WITZANY G. Biocommunication of Archaea. Cham: Springer, 2017: 119-132.
|
| [38] |
KAREB O, AÏDER M. Quorum sensing circuits in the communicating mechanisms of bacteria and its implication in the biosynthesis of bacteriocins by lactic acid bacteria: a review[J]. Probiotics Antimicro Prot, 2020, 12(1): 5-17. DOI:10.1007/s12602-019-09555-4 |
| [39] |
DE FREITAS L L, DA SILVA F P, FERNANDES K M, et al. The virulence of Salmonella Enteritidis in Galleria mellonella is improved by N-dodecanoyl-homoserine lactone[J]. Microb Pathog, 2021, 152: 104730. DOI:10.1016/j.micpath.2021.104730 |
| [40] |
CHATTERJEE B, VITTAL R R. Quorum sensing modulatory and biofilm inhibitory activity of Plectranthus barbatus essential oil: a novel intervention strategy[J]. Arch Microbiol, 2021, 203(4): 1767-1778. DOI:10.1007/s00203-020-02171-9 |
| [41] |
GART E V, SUCHODOLSKI J S, WELSH T H, et al. Salmonella typhimurium and multidirectional communication in the gut[J]. Front Microbiol, 2016, 7: 1872. |
| [42] |
MOREIRA C G, WEINSHENKER D, SPERANDIO V. QseC mediates Salmonella enterica serovar typhimurium virulence in vitro and in vivo[J]. Infect Immun, 2010, 78(3): 914-926. DOI:10.1128/IAI.01038-09 |
| [43] |
万佳宏, 常佳伟, 魏彦琴, 等. 金黄色葡萄球菌Agr群体感应系统及其抗毒力治疗研究进展[J]. 中国病原生物学杂志, 2020, 15(1): 115-118, 122. WAN J H, CHANG J W, WEI Y Q, et al. Advances in research on the Agr quorum sensing system in Staphylococcus aureus and antivirulence therapy based on that system[J]. Journal of Parasitic Biology, 2020, 15(1): 115-118, 122. (in Chinese) |
| [44] |
张吉鹍. 内毒素的生物活性及其对猪的危害[J]. 猪业科学, 2020, 37(11): 134-137. ZHANG J K. The bioactivity of Endotoxin and its harm to the pigs[J]. Swine Industry Science, 2020, 37(11): 134-137. DOI:10.3969/j.issn.1673-5358.2020.11.034 (in Chinese) |
| [45] |
OLIVEIRA D, BORGES A, SIMÕES M. Staphylococcus aureus toxins and their molecular activity in infectious diseases[J]. Toxins, 2018, 10(6): 252. DOI:10.3390/toxins10060252 |
| [46] |
梁胜男, 柯楚新, 黄鹤, 等. 肠道内产丁酸细菌及其产物丁酸生理功能的研究进展[J]. 微生物学通报, 2021, 48(3): 948-959. LIANG S N, KE C X, HUANG H, et al. Butyrate-producing bacteria in the intestinal tract and the physiological function of their metabolite butyrate: a review[J]. Microbiology China, 2021, 48(3): 948-959. (in Chinese) |
| [47] |
ZHAO J, SHAO T, CHEN S, et al. Characterization and identification of cellulase-producing Enterococcus species isolated from Tibetan yak (Bos grunniens) rumen and their application in various forage silages[J]. J Appl Microbiol, 2021, 131(3): 1102-1112. DOI:10.1111/jam.15014 |
| [48] |
BEDFORD A, GONG J. Implications of butyrate and its derivatives for gut health and animal production[J]. Anim Nutr, 2018, 4(2): 151-159. DOI:10.1016/j.aninu.2017.08.010 |
| [49] |
DONG Y H, WANG L H, XU J L, et al. Quenching quorum-sensing-dependent bacterial infection by an N-acyl homoserine lactonase[J]. Nature, 2001, 411(6839): 813-817. DOI:10.1038/35081101 |
| [50] |
SIKDAR R, ELIAS M. Quorum quenching enzymes and their effects on virulence, biofilm, and microbiomes: a review of recent advances[J]. Expert Rev Anti Infect Ther, 2020, 18(12): 1221-1233. DOI:10.1080/14787210.2020.1794815 |
| [51] |
GRANDCLÉMENT C, TANNIÈRES M, MORÉRA S, et al. Quorum quenching: role in nature and applied developments[J]. FEMS Microbiol Rev, 2016, 40(1): 86-116. DOI:10.1093/femsre/fuv038 |
| [52] |
孙锋, 严慧聪, 汪美贞. 细菌群体感应调控多样性及群体感应淬灭[J]. 微生物学报, 2019, 59(3): 454-467. SUN F, YAN H C, WANG M Z. Advance of the diversity of bacterial quorum sensing and quorum quenching[J]. Acta Microbiologica Sinica, 2019, 59(3): 454-467. (in Chinese) |
| [53] |
杜宏. 戊糖片球菌YF-8对温和气单胞菌群体感应淬灭作用研究[D]. 锦州: 渤海大学, 2021. DU H. Study on quorum quenching effect of Pediococcus pentosaceus YF-8 on Aeromonas sobria[D]. Jinzhou: Bohai University, 2021. (in Chinese) |
| [54] |
王一鸣. 丁香酚抑制猪源肺炎克雷伯菌AI-2信号分子和MrkD蛋白机制研究[D]. 长春: 吉林农业大学, 2019. WANG Y M. Study on mechanism of porcine derived Klebsiella pneumoniae AI-2 signal molecule and MrkD protein inhibitory effect by eugenol[D]. Changchun: Jilin Agricultural University, 2019. (in Chinese) |
| [55] |
PENG L Y, YUAN M, CUI Z Q, et al. Rutin inhibits quorum sensing, biofilm formation and virulence genes in avian pathogenic Escherichia coli[J]. Microb Pathog, 2018, 119: 54-59. DOI:10.1016/j.micpath.2018.04.007 |
| [56] |
PENG L Y, YUAN M, WU Z M, et al. Anti-bacterial activity of baicalin against APEC through inhibition of quorum sensing and inflammatory responses[J]. Sci Rep, 2019, 9(1): 4063. DOI:10.1038/s41598-019-40684-6 |
| [57] |
NAKAGAWA S, HILLEBRAND G G, NUNEZ G. Rosmarinus officinalis L. (rosemary)extracts containing carnosic acid and carnosol are potent quorum sensing inhibitors of Staphylococcus aureus virulence[J]. Antibiotics (Basel), 2020, 9(4): 149. DOI:10.3390/antibiotics9040149 |
| [58] |
GENG Y F, YANG C, ZHANG Y, et al. An innovative role for luteolin as a natural quorum sensing inhibitor in Pseudomonas aeruginosa[J]. Life Sci, 2021, 274: 119325. DOI:10.1016/j.lfs.2021.119325 |
| [59] |
PELARTI S M, ZAREHSHURAN L K, BABAEEKHOU L, et al. Antibacterial, anti-biofilm and anti-quorum sensing activities of Artemisia dracunculus essential oil (EO): a study against Salmonella enterica serovar Typhimurium and Staphylococcus aureus[J]. Arch Microbiol, 2021, 203(4): 1529-1537. DOI:10.1007/s00203-020-02138-w |
| [60] |
HUSAIN F M, AHMAD I, KHAN M S, et al. Sub-MICs of Mentha piperita essential oil and menthol inhibits AHL mediated quorum sensing and biofilm of Gram-negative bacteria[J]. Front Microbiol, 2015, 6: 420. |
| [61] |
GUO X, ZHANG L Y, WU S C, et al. Andrographolide interferes quorum sensing to reduce cell damage caused by avian pathogenic Escherichia coli[J]. Vet Microbiol, 2014, 174(3-4): 496-503. DOI:10.1016/j.vetmic.2014.09.021 |
| [62] |
ALFARO J F, ZHANG T, WYNN D P, et al. Synthesis of LuxS inhibitors targeting bacterial cell-cell communication[J]. Org Lett, 2004, 6(18): 3043-3046. DOI:10.1021/ol049182i |
| [63] |
常晶, 史国萃, 曾名湧, 等. 细菌群体感应淬灭酶及其应用研究进展[J]. 生物加工过程, 2019, 17(3): 244-250. CHANG J, SHI G C, ZENG M Y, et al. Quorum quenching enzymes-a review[J]. Chinese Journal of Bioprocess Engineering, 2019, 17(3): 244-250. DOI:10.3969/j.issn.1672-3678.2019.03.003 (in Chinese) |
| [64] |
张广民, 王振兴, 汤海鸥, 等. N-乙酰高丝氨酸内酯酶对肉鸡生产性能的影响[J]. 饲料工业, 2015, 36(1): 30-33. ZHANG G M, WANG Z X, TANG H O, et al. Effect of AHL-lactonase on production performance of broilers[J]. Feed Industry, 2015, 36(1): 30-33. (in Chinese) |
| [65] |
张广民, 王振兴, 汤海鸥, 等. N-酰基高丝氨酸内酯酶对断奶仔猪生产性能的影响[J]. 中国饲料, 2014(23): 19-21. ZHANG G M, WANG Z X, TANG H O, et al. Effects of AHL-lactonase on growth performance in weaned piglets[J]. China Feed, 2014(23): 19-21. (in Chinese) |
| [66] |
李胜利. 淬灭酶及沙蒿多糖对绵羊瘤胃微生态和营养代谢及免疫影响研究[D]. 呼和浩特: 内蒙古农业大学, 2016. LI S L. The effects of AHL-lactonase and Artemisia seed polysaccharide on rumen microflora and nutrient metabolism and immune effect in sheep[D]. Huhehaote: Inner Mongolia Agricultural University, 2016. (in Chinese) |
| [67] |
KIM J G, KIM J P, KIM Y H, et al. Influences of quorum-quenching probiotic bacteria on the gut microbial community and immune function in weaning pigs[J]. Anim Sci J, 2018, 89(2): 412-422. DOI:10.1111/asj.12954 |
| [68] |
郭冰怡, 董燕红. 细菌群体感应抑制剂研究进展[J]. 农药学学报, 2018, 20(4): 408-424. GUO B Y, DONG Y H. Research progress on inhibitors toward quorum sensing system[J]. Chinese Journal of Pesticide Science, 2018, 20(4): 408-424. (in Chinese) |
| [69] |
MCINNIS C E, BLACKWELL H E. Thiolactone modulators of quorum sensing revealed through library design and screening[J]. Bioorg Med Chem, 2011, 19(16): 4820-4828. DOI:10.1016/j.bmc.2011.06.071 |
| [70] |
BRACKMAN G, RISSEEUW M, CELEN S, et al. Synthesis and evaluation of the quorum sensing inhibitory effect of substituted triazolyldihydrofuranones[J]. Bioorg Med Chem, 2012, 20(15): 4737-4743. DOI:10.1016/j.bmc.2012.06.009 |
| [71] |
SULLY E K, MALACHOWA N, ELMORE B O, et al. Selective chemical inhibition of agr quorum sensing in Staphylococcus aureus promotes host defense with minimal impact on resistance[J]. PLoS Pathog, 2014, 10(6): e1004174. DOI:10.1371/journal.ppat.1004174 |
| [72] |
PACZKOWSKI J E, MUKHERJEE S, MCCREADY A R, et al. Flavonoids suppress Pseudomonas aeruginosa virulence through allosteric inhibition of quorum-sensing receptors[J]. J Biol Chem, 2017, 292(10): 4064-4076. DOI:10.1074/jbc.M116.770552 |
| [73] |
O'LOUGHLIN C T, MILLER L C, SIRYAPORN A, et al. A quorum-sensing inhibitor blocks Pseudomonas aeruginosa virulence and biofilm formation[J]. Proc Natl Acad Sci U S A, 2013, 110(44): 17981-17986. DOI:10.1073/pnas.1316981110 |
| [74] |
KALAIARASAN E, THIRUMALASWAMY K, HARISH B N, et al. Inhibition of quorum sensing-controlled biofilm formation in Pseudomonas aeruginosa by quorum-sensing inhibitors[J]. Microb Pathog, 2017, 111: 99-107. DOI:10.1016/j.micpath.2017.08.017 |
(编辑 白永平)