温度是影响物种健康和生存的重要环境因素,家畜多为恒温动物,对环境温度变化极为敏感,当环境温度低于动物的适宜温度下限(肉鸡为10 ℃,蛋鸡为13 ℃,哺乳猪为30 ℃,仔猪为20 ℃,育肥猪为16 ℃,空怀母猪为16 ℃,公猪为14 ℃,山羊为20 ℃,绵羊为21 ℃)时,会对动物造成冷应激[1]。气候变化综合指数(comprehensive climate index,CCI)是目前判断动物冷热应激最准确的指数之一,该指数计算包括温度,湿度,风速和太阳直射时间,当环境CCI在0~25时动物处于无应激状态(即冷应激<0,热应激>25),北方地区冬季平均温度低于-15 ℃,畜舍内CCI均<0[2],持续低温引起动物的冷应激是北方畜牧养殖中普遍存在的福利问题,冷应激不仅会降低动物的生长性能和饲料效率[3-4],还会影响动物的免疫和抗氧化功能。冷应激对动物免疫和抗氧化功能影响的严重程度与其持续时间呈正比,通常认为急性冷应激(12 h以内)会增加机体产生的促炎细胞因子和活性氧(reactive oxygen species, ROS)引起炎症反应和氧化应激,且长期的慢性冷应激(几天甚至几个月)则会导致动物机体发生炎症损伤及抗氧化失衡[5-9]。热休克蛋白(heat shock protein,HSP)是机体缓解应激反应的重要蛋白,它通过参与相关信号转导调节机体免疫和抗氧化功能[1, 9-11]。畜禽在冷应激状态下通过提高HSP水平缓解炎症和氧化损伤[12],但冷应激引起的炎症反应和氧化应激下HSP调控免疫反应和抗氧化功能的机制却少有系统报道。本文通过归纳前人研究结果,就冷应激引起的炎症反应及氧化应激下,机体HSP对免疫反应和抗氧化功能的调控机制进行综述,以期为缓解畜禽冷应激理论研究提供参考。
1 冷应激引起机体炎症反应及氧化应激 1.1 诱导机体炎症反应机体免疫系统包括免疫器官、免疫细胞和免疫分子,在防御病原微生物入侵方面发挥重要作用。核因子-κB(nuclear factor kappa-B,NF-κB)是一种主要在淋巴细胞中表达的介导炎症和免疫反应的关键转录因子,急性冷应激会通过激活NF-κB信号通路提高下游促炎细胞因子的基因转录与分泌,导致机体产生炎症反应,而持续的慢性冷应激则会抑制NF-κB的核移位,降低促炎细胞因子的基因转录,抑制免疫细胞活性及吞噬抗原能力,引起脾发生病变、淋巴结减少,心组织发生炎症、空泡、嗜酸性粒细胞变性和肌肉纤维化,小肠损伤和紧密连接结构被破坏等,从而抑制机体免疫功能[13-17]。但也有研究发现,急性冷应激会抑制炎症反应,而慢性冷应激会诱发炎症反应。Wang等[8]研究发现,3 h 4 ℃急性冷应激抑制了小鼠脑组织中NF-κB核移位,进而减少了肿瘤坏死因子α(TNF-α)的基因转录。Su等[9]研究发现,35 d的14 ℃持续冷应激会诱导肉鸡血清诱导型一氧化氮合酶(iNOS)、环氧合酶2(COX-2)、前列腺素E合酶(PTGEs)、肿瘤坏死因子α(TNF-α)和白细胞介素(IL)4等细胞因子的mRNA表达水平提高,引起炎症损伤。因此,冷应激对机体免疫功能的影响与应激时间的长短及强度,不同物种间的适宜温度下限和机体间不同组织等均有关系。
1.2 诱导机体氧化损伤机体细胞线粒体呼吸会产生超氧阴离子(O2-·)、过氧化氢(H2O2)和羟自由基(·OH)等ROS,过多的ROS会氧化不饱和脂肪酸产生脂质过氧化物(MDA),使蛋白变性和DNA损伤,导致细胞坏死,对机体造成严重伤害,而酶和非酶抗氧化剂是保护机体抵抗氧化应激的重要物质[5]。在细胞抗氧化防御系统下,ROS通常保持在较低水平,但冷应激引起的代谢加强会增加自由基负荷,并产生大量的ROS,降低酶促和非酶促抗氧化水平[16],还会诱导瞬间受体电位离子通道(transient receptor potential A1,TRPA1)活化,增加Ca2+流入,使ROS水平升高,加剧寒冷环境下的氧化应激[18]。臧树成[16]研究发现,冷应激会损伤大鼠肝组织,使肝组织出现细胞间隙变小,脂肪变性,通过使用H2O2模拟体内大鼠肝组织冷应激状态后,结果显示氧化应激下大鼠肝组织中MDA含量上升,超氧化物歧化酶(SOD)蛋白水平和谷胱甘肽过氧化物酶(GSH-Px)活力均下降,肝细胞凋亡率增加。核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)是抗氧化防御系统的主要调控因子,过量产生的ROS会激活Nrf2信号通路,提高下游抗氧化酶的基因转录来抵抗氧化失衡[19]。丛培芳等[20]研究发现,极端低温导致小鼠心肌组织中过氧化氢酶(CAT)和Nrf2的mRNA表达量增加,Kelch样环氧氯丙烷相关蛋白1(kelch-like ECH-associated protein 1,Keap1)的mRNA表达量降低。Frigault等[21]研究发现,冬眠松鼠心组织的Nrf2 mRNA转录水平显著提高,Keap1的mRNA表达量显著降低。因此,急、慢性冷应激均会引起氧化应激,损伤机体抗氧化系统及机体组织,且机体会通过激活Nrf2信号通路来抵抗氧化应激。
2 冷应激引起机体HSP表达提高HSP家族(HSPs)是一类高度保守的分子伴侣蛋白,通过恢复蛋白质错误折叠、保护新生蛋白质的翻译、帮助蛋白质的细胞器转运、减少有毒物的聚集等功能参与细胞的损伤、修复、增殖、分化和凋亡[22],在调节细胞周期进程、抵抗机体应激方面有重要作用[23]。HSPs依据分子量的大小可分为HSP110、HSP90、HSP70、HSP60、小分子HSPs(如HSP12-34)及泛素等几个家族[24]。不同分子量的HSP功能也不相同。HSP27的主要功能是修复心损伤。HSP32也称为血红素加氧酶1(heme oxygenase-1, HO-1),在脊椎动物系统中负责帮助机体适应氧化、炎症和细胞毒性应激,并催化血红素降解[25]。HSP40是HSP70的合作蛋白,可以调节HSP70的ATP酶活性作用参与蛋白质解离和跨膜运输[26]。HSP60在应激状态下会迅速活化并修复变性的蛋白。HSP70是机体分布与表达均最高的HSP,在应激条件下参与新合成蛋白质的折叠、修饰和转运。HSP90是细胞内最活跃的HSP,可以维持细胞内蛋白质的构型。HSP110可结合多肽,是一种免疫佐剂,可激活免疫细胞启动免疫应答[27]。因此,炎症和氧化失衡均可激活HSPs的表达,各个器官的损伤和修复过程也通常伴随着HSPs的上调,其含量的高低可用于衡量应激程度,也被称为应激蛋白[28]。
冷应激产生的信号会激活机体自我防御机制,通常机体会通过上调HSPs水平来适应寒冷环境。热休克转录因子(heat shock transcription factor,HSF)家族(包括鼠类和人HSF-1、2和4以及禽类特有的HSF-3)是HSP的关键转录因子,其中HSF-1和HSF-3可以响应低温环境直接上调HSPs的基因和蛋白表达[29];也可以引起机体内分泌状态的改变间接诱导HSPs的表达,冷应激状态下机体会降低胰岛素分泌、提高血糖,补偿机体能量消耗[30],胰岛素的降低向受体衰变加速因子2(decayacceleratingfactor-2,DAF-2)传递信号,使DAF-2的调节器(DDL-1)磷酸化,解离热休克蛋白结合因子(heat shock factor binding protein 1,HSB-1)、HSF-1、DDL-1和DDL-2结合形成的抑制复合物,释放HSF-1,三个HSF-1单体聚合成一个有活性的HSF-1三聚体进入细胞核,并与热休克元件(heat shock element,HSE)结合增加HSP基因转录和翻译的水平[31]。且HSPs的转录还受到Nrf2和NF-κB转录因子的调控,也会被促炎细胞因子IL-1β、TNF-α、脂多糖(lipopolysaccharide,LPS)和ROS激活[32]。Wang等[33]指出,冷(4 ℃)、热应激(40 ℃)均可诱导粉虱的大多数HSP基因过表达,而沉默HSPs可显著降低粉虱在45 ℃下的存活率,在-4 ℃下影响不大。在-4 ℃处理1 h提取头部和身体RNA后发现,体内多数蛋白的合成速率均下降,只有HSP显著增加,这表明HSPs提高了粉虱耐寒性,从而保护其免受极端环境温度的影响。综上所述,低温环境和内分泌变化均会参与调节HSPs的快速产生,帮助维持机体稳态。
3 炎症反应下HSP对机体免疫功能的调节作用在动物机体免疫系统中,免疫细胞与其他生理系统协调发挥最佳功能的能力取决于信号转导,而冷应激引起的HSPs表达提高可参与调节机体免疫功能。Rastogi与Haldar[34]研究发现,皮下注射褪黑素会提高冷应激下松鼠脾HSF-1和HSP70的表达,进而增加血液淋巴细胞比率来增强免疫力。Ren等[12]发现,冷应激会引起鹌鹑脾组织的炎症损伤,而HSP70的表达增加可能会通过抑制前炎症细胞因子(NF-κB、COX-2、PTGES和TNF-α)的表达来保护脾免受炎症损伤。目前,已有研究表明,冷应激对机体的影响涉及复杂的代谢反应、生理变化和大量的信号转导,而HSP作为体内重要分子伴侣蛋白,在细胞内和细胞外对免疫系统具有多重调节作用。HSPs的细胞内蛋白(intracellular heat shock protein,IHSP)可通过信号转导和胞内运输缓解炎症反应,但长期应激和细胞凋亡会触发HSP从胞内主动或被动释放,胞外蛋白(extracellular heat shock protein,EHSP)可以加强免疫细胞功能,提高促炎细胞因子分泌,维持机体免疫功能动态平衡[35]。
3.1 胞外调节免疫细胞,加强免疫反应EHSP的胞外免疫调控作用主要分为两方面,一方面是加强抗原呈递与免疫细胞功能,保护免疫细胞免受炎症损伤,提高机体适应性免疫。抗原呈递细胞(antigen-presenting cells, APC)可以加工呈递抗原给抗原特异性细胞,EHSP可增加细胞外环境中抗原和APC之间交叉呈递的有效性。HSPs与肽复合形成HSP肽复合物,该复合物可以通过APC进行加工呈递给主要组织相容性复合体(major histocompatibility complex, MHC)Ⅰ类分子供CD8+细胞毒性T淋巴细胞(CTL)识别[36],且HSPs也可直接作为抗原呈递分子[1]。巨噬细胞(macrophages,Mø)和树突状细胞(dendritic cell, DC)是一类专职的APC。其中,Mø是获得性免疫的重要效应细胞,可定向转移并集中到炎症部位,杀伤清除炎症部位的病原体、异物及衰老细胞。而EHSP可诱导激活Mø促进炎症反应参与免疫应答[37]。DC吞噬能力很弱,但有活跃的运动能力,是最强的APC,胞外的HSP70可与DC结合,诱导它们成熟,参与免疫调节[38],且EHSP可促进DC和Mø合成释放促炎细胞因子,激发T细胞的适应性免疫反应[35]。自然杀伤细胞(natural killer cell,NK细胞)是机体天然免疫力的重要效应细胞,其细胞表面上的CD94可识别多种癌细胞,并与其膜上的HSP70结合,启动癌细胞的有效溶解[27],且EHSP还可以增加NK细胞毒性功能和细胞增殖[38]。另有研究发现,HSP70可以保护大鼠胰岛B细胞免受IL-1β诱导的损伤,也能够保护大鼠肾小球系膜细胞免受IL-1β诱导的凋亡[39]。
EHSP的胞外免疫调控作用另一方面是会激活免疫细胞膜上的Toll样受体(toll-like receptors, TLR)和晚期糖基化终末产物受体(receptor for advanced glycation endproducts,RAGE),提高胞内促炎细胞因子的分泌来加强免疫反应[40]。孙海阁等[41]研究发现,在小鼠皮下注射HSP65后,血清抗炎细胞因子IL-10浓度下降,促炎细胞因子干扰素(IFN)-γ浓度升高,诱发机体炎症反应。Fang等[42]研究发现,HSP70样蛋白1(HSP70-like protein 1,HSP70L1)可以直接与DC表面的TLR4结合,激活NF-κB通路,上调CD40、CD80和CD86表达,并促进TNF-α、IL-1β和活性白细胞介素12(IL-12p70)的生成,而在TLR4缺陷的DC中HSP70L1未能诱导这种表型成熟及相关细胞因子产生。因此,EHSP可通过免疫细胞膜上的TLR2和TLR4诱导促炎细胞因子的分泌[43]。Somensi等[44]研究发现,体外EHSP70处理人肺癌上皮细胞后,可通过细胞模上的晚期糖基化终末产物受体(receptor for advanced glycation endproducts,RAGE)磷酸化ERK1/2激酶,激活NF-κB信号通路,提高TNF-α等促炎细胞因子的转录水平,而在RAGE受体阻断的细胞中,EHSP70处理对促炎细胞因子的分泌刺激减弱,上述激活途径的不同可能与不同细胞表面的受体有关。综上所述,EHSP可通过加强免疫细胞功能与抗原呈递,激活免疫细胞膜上的Toll样受体和RAGE受体,提高胞内促炎细胞因子的分泌来激发免疫反应。
3.2 胞内炎症缓解作用IHSP在胞内缓解炎症反应主要是通过NF-κB信号通路。NF-κB蛋白通常以无活性的形式与抑制蛋白κB(inhibitory κB,IκB)家族结合,以复合物的形式存在于细胞质中[45]。核苷酸结合寡聚结构域(nucleotide-binding, leucine-rich repeat-containing,NLR)家族成员(NOD1和NOD2)介导先天免疫基因的转录激活,并与其下游衔接蛋白受体相互作用蛋白(receptor-interacting proteins, RIP)2相互作用形成NOD1-RIP2 / NOD2-RIP2复合物,该复合物可以募集到IκBk(inhibitor of nuclear factor kappa-B kinase,IKK)抑制性复合物中激活NF-κB途径[46]。HSP90可以维持NOD1的稳定,使其处于失活状态[11, 47],减少NOD1 / NOD2与RIP2相互作用形成的NOD1-RIP2 / NOD2-RIP2复合物,从而抑制NF-κB的激活。肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factor-6,TRAF6)是一种重要的信号转导子,可调节多种生理和病理过程,并且可以磷酸化IKK,激活NF-κB信号通路。HSP70可以在TRAF-C域中与TRAF6发生物理结合,抑制TRAF6泛素化,从而抑制NF-κB活化,缓解炎症反应[48]。HSPs不仅可以通过NLR和TRAF6受体抑制NF-κB信号通路,还可以直接激活IκB磷酸化,抑制NF-κB于IKK抑制性复合物中,减少NF-κB通过核孔进入细胞核,下调TNF-α、IL-1β和IL-8基因的表达[49]。因此,由于HSP可通过下调NF-κB的激活来表现出免疫抑制,使其在许多发炎组织中过度表达,并参与调节慢性炎症,改善自身免疫疾病等[40]。Zhou等[50]研究发现,小鼠旋毛虫感染后显著降低了机体的HSP70丰度,并激活了NF-κB信号通路增强IL-10和IL-17的表达,诱导机体发生炎症反应。但是高温处理后,HSP70基因和蛋白的表达量提高抑制了NF-κB的活化。腹腔注射吡咯烷二硫代氨基甲酸酯(PDTC,NF-κB抑制剂)和N-硝基-1-精氨酸甲酯氢氯化物(1-NAME,iNOS抑制剂)后发现,回肠HSP70的表达提高和PDTC处理会进一步抑制NF-κB的活性,而1-NAME处理会降低HSP70对iNOS的激活,因此,HSP70会抑制NF-κB并激活NOS /一氧化氮(NO)信号途径,缓解机体炎症反应。同样,Shang等[51]研究建立了鸡卵清白蛋白诱导的哮喘小鼠模型,敲除HSF-1后会促进NF-κB信号通路的激活,加重小鼠气道炎症,说明HSF-1也可负调控NF-κB信号通路参与炎症反应。综上所述,HSPs可通过胞内胞外的不同作用双向调节免疫反应,这种相互矛盾的调节方式表明HSP可在细胞内外发挥双重作用,这可能与细胞类型、疾病类型、炎症部位、应激强弱和机体状况等有关[40, 43]。当机体处于冷应激下发生炎症反应时,HSPs会提高其内源性转录,减少胞外流出起到缓解炎症反应作用,而当机体长期处于炎症反应下,免疫系统受损,细胞因子分泌降低,免疫细胞活性抑制,细胞发生凋亡,HSPs可在应激下增加胞外流出起到保护免疫细胞,加强其免疫功能,提高细胞因子分泌等作用激发自身免疫反应,以此来控制自身免疫平衡。
4 氧化应激下HSP对机体抗氧化功能的调节作用冷应激下过量产生的ROS会引起氧化应激,同时HSPs表达的上调可与抗氧化防御系统协同缓解机体氧化应激。Rastogi与Haldar[34]研究发现,冷应激会引起松鼠脾和骨髓单核红细胞中抗氧化酶活性的降低,而皮下注射褪黑素可通过增加HSF-1 / HSP的表达提高抗氧化酶分泌和相关基因的表达。Jia等[12]发现,冷应激会引起鹌鹑脾组织的氧化损伤,而HSP70的表达增加会提高抗氧化酶活性来保护脾组织免受氧化损伤。不仅是冷应激,在生产中各种应激引起的氧化应激下,HSPs均是抗氧化网络组成的重要部分。Surai和Kochish等[32]指出,HO-1(HSP32)可有效降解血红素和ROS,维持机体抗氧化系统平衡。Hernández-Santana等[52]研究发现,在使用H2O2模拟的氧化应激培养的肌肉细胞中,添加红景天根提取物可通过提高HSP70的表达来保护细胞免受氧化应激的影响。Kong等[53]研究指出,HSP70过表达可缓解H2O2诱导的大鼠肝细胞凋亡,并增强抗凋亡蛋白B细胞淋巴瘤因子(B-cell leukemia /lymphoma 2,Bcl-2)的表达。因此,HSPs可通过提高抗氧化酶活性,降低ROS,保护细胞等作用,增强抗氧化功能。
HSPs还可通过Keap1-Nrf2-抗氧化反应元件(anti-oxidant response element,ARE)信号途径缓解机体的氧化损伤。正常生理条件下,Keap1通过与Nrf2的氨基末端Neh2域特异性结合形成复合物将其抑制于细胞质中,使Nrf2处于无活性状态[54]。HSP90可与Keap1相互作用,解离Keap1-Nrf2复合物释放Nrf2,Nrf2进入细胞核与ARE结合提高其下游抗氧化酶的基因转录[10]。Rastogi与Haldar[34]研究发现,褪黑素治疗可通过增加小鼠脾的HSF-1和HSP-70基因表达和蛋白表达,进而提高SOD、CAT和谷胱甘肽过氧化物酶(GSH-Px)的活性,缓解冷应激引起的氧化失衡。贾红豆[55]研究指出,HSPB7(heat shock protein family B member 7)过表达上调了Nrf2的蛋白和mRNA表达,且提高了下游靶基因HO-1和醌氧化还原酶1[NAD (P)H: quinone oxidoreductase 1,NQO1]的mRNA表达量,增强了SOD和GSH-Px的活性,进而缓解了H2O2诱导的氧化应激。HSP和Nrf2的表达提高是机体抵抗急、慢性冷应激引起的氧化/抗氧化系统失衡的重要保护机制。
5 HSP与炎症反应、氧化失衡的联系卢德勋[56]提出氧化应激-炎症反应-免疫功能失衡链是1个问题的3个相互联动方面,免疫系统和抗氧化系统是紧密联系的整体。细胞因子与ROS是机体代谢的产物,对于细胞功能、增殖和信号转导进程有重要作用,二者处于动态平衡的状态。低浓度的ROS可激活T细胞,促进细胞生长,而氧化应激会破坏机体自由基稳态,引起过量的ROS积累,进而激活大量的淋巴细胞和Mø发生炎症反应,诱导胰腺细胞、Mø和DC发生凋亡,抑制淋巴细胞的增殖和分化,减弱NK细胞的杀伤能力,抑制免疫功能[57],还会通过TLR2途径激活促炎细胞因子的转录和分泌加重氧化应激对机体的炎症损伤,ROS与炎症相互促进发展,从而引起免疫和抗氧化系统失衡[58]。炎症因子和ROS均可上调Nrf2和NF-κB的表达,Nrf2的激活会增强下游抗氧化酶相关基因的表达,清除自由基,保护细胞免受氧化损伤并抑制炎症。NF-κB的激活会提高促炎细胞因子基因的表达,增强炎症反应,且Nrf2的激活会抑制NF-κB通路的激活,从而降低ROS介导的NF-κB激活引起的炎症反应[59]。
HSPs具有免疫调控和增强抗氧化能力的作用,各类环境和生产管理应激引起的氧化应激与炎症均可促进HSPs的表达提高。HSPs在胞外调节、保护免疫细胞,结合多种细胞因子,参与抗原的成熟、加工和呈递,增强抗氧化酶活性[60],在胞内可与Keap1相互作用,解离激活Nrf2,提高抗氧化酶基因的表达,降低活性氧的产生,减少氧化应激[10],结合NOD1与TRAF6抑制NF-κB的激活,降低炎症损伤和免疫反应[11];还可发挥其分子伴侣功能参与其他大量的信号通路,调节、保护蛋白质,抗细胞凋亡等提高细胞抗应激能力。因此,HSP可通过调节免疫和抗氧化功能在保护细胞损伤及维持机体内环境稳态中发挥关键作用[47] (图 1)。为畜禽提供适宜生存的环境或提高HSPs的表达可能是激发机体自身潜能抵抗应激损害其机体健康的关键。Rastogi与Haldar[34]研究发现,皮下注射褪黑素会提高冷应激下松鼠脾HSF-1和HSP70的表达,Xu等[61]研究发现,使用1 mg·kg-1的阿司匹林可上调HSF-1和HSF-3的表达量,进而提高HSP的表达量,辅酶Q处理后的HSP70表达量较正常热应激组显著升高[62],Hernández-Santana等[52]在细胞培养液中添加红景天根提取物后,可上调HSP70 mRNA表达,保护细胞免受H2O2诱导的氧化应激。以上研究结果表明,褪黑素、阿司匹林、辅酶Q和红景天等激素和中西药不仅具有药理、抗氧化等作用,还可以通过提高HSP的表达来抵抗机体应激。
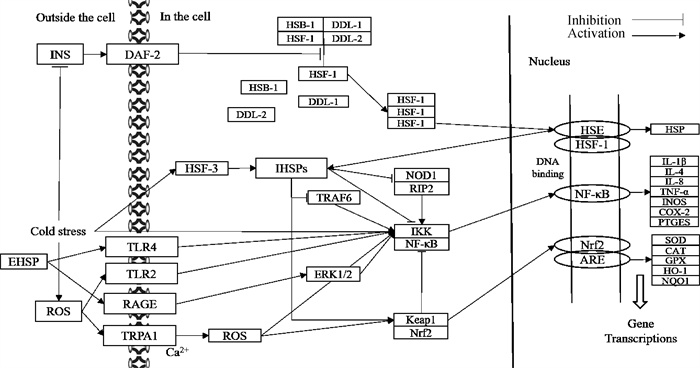
|
图 1 热休克蛋白在冷应激引起的炎症反应和抗氧化功能中的调节作用通路图 Fig. 1 Moderating role of heat shock protein under inflammatory response and oxidative stress caused by cold stress pathway diagram |
冷应激会诱发机体产生炎症反应和氧化失衡,且长期冷应激会造成机体免疫器官病变和免疫细胞凋亡,加剧氧化应激对机体的损害。其中,HSPs在机体维持内环境稳态和细胞保护中起重要作用,可通过胞内调控Nrf2和NF-κB信号通路来调节免疫细胞和免疫因子,提高机体抗氧化能力,抑制炎症反应,缓解氧化损伤,还可胞外保护免疫细胞、参与抗原呈递,激发免疫反应,以保护免疫系统功能不会过度抑制。目前关于冬季控制畜舍环境及营养调控提高动物免疫抗氧化功能已有大量报道,但如何提高冷应激条件下HSPs的表达和HSPs是否会在冷应激条件下参与调控动物代谢却少有研究,完成这些工作有助于全面了解冷应激下HSPs对机体的影响及作用。
致谢: 本研究由动物福利标准项目(Animal Welfare Standards Project by Good Ventures Foundation, in a grant administered through the School of Veterinary Science, University of Queensland)支持,特表感谢。
| [1] |
唐姝, 徐蛟, 狄良娇, 等. 热休克蛋白的功能及其在畜牧业中的应用[J]. 南京农业大学学报, 2018, 41(4): 605-615. TANG S, XU J, DI L J, et al. The function and application of heat shock protein in animal breeding and veterinary medicine[J]. Journal of Nanjing Agricultural University, 2018, 41(4): 605-615. (in Chinese) |
| [2] |
徐明, 吴淑云, 黄常宝, 等. 呼和浩特地区牛舍内温湿度变化规律和奶牛冷热应激判定[J]. 家畜生态学报, 2015, 36(2): 54-60. XU M, WU S Y, HUANG C B, et al. Cold or heat stress determination of barn cows on temperature and humidity index in hohhot[J]. Acta Ecologae Animalis Domastici, 2015, 36(2): 54-60. DOI:10.3969/j.issn.1673-1182.2015.02.010 (in Chinese) |
| [3] |
KANG H J, LEE J, PARK S J, et al. Effects of cold temperature and fat supplementation on growth performance and rumen and blood parameters in early fattening stage of Korean cattle steers[J]. Anim Feed Sci Technol, 2020, 269: 114624. DOI:10.1016/j.anifeedsci.2020.114624 |
| [4] |
PLUSH K J, BRIEN F D, HEBART M L, et al. Thermogenesis and physiological maturity in neonatal lambs: a unifying concept in lamb survival[J]. Anim Prod Sci, 2016, 56(4): 736-745. DOI:10.1071/AN15099 |
| [5] |
WANG Y, WANG W W, WANG R F, et al. Dietary supplementation of ferulic acid improves performance and alleviates oxidative stress of lambs in a cold environment[J]. Can J Anim Sci, 2019, 99(4): 705-712. DOI:10.1139/cjas-2018-0200 |
| [6] |
WEI H D, ZHANG R X, SU Y Y, et al. Effects of acute cold stress after long-term cold stimulation on antioxidant status, heat shock proteins, inflammation and immune cytokines in broiler heart[J]. Front Physiol, 2018, 9: 1589. DOI:10.3389/fphys.2018.01589 |
| [7] |
JIANG S S, GUO R, ZHANG Y M, et al. Heavy metal scavenger metallothionein mitigates deep hypothermia-induced myocardial contractile anomalies: role of autophagy[J]. Am J Physiol: Endocrinol Metab, 2013, 304(1): E74-E86. DOI:10.1152/ajpendo.00176.2012 |
| [8] |
WANG X P, YU X, YAN X J, et al. TRPM8 in the negative regulation of TNFα expression during cold stress[J]. Sci Rep, 2017, 7: 45155. DOI:10.1038/srep45155 |
| [9] |
SU Y Y, ZHANG X, XIN H W, et al. Effects of prior cold stimulation on inflammatory and immune regulation in ileum of cold-stressed broilers[J]. Poult Sci, 2018, 97(12): 4228-4237. DOI:10.3382/ps/pey308 |
| [10] |
NITURE S K, JAISWAL A K. Hsp90 interaction with INrf2(Keap1) mediates stress-induced Nrf2 activation[J]. J Biol Chem, 2010, 285(47): 36865-36875. DOI:10.1074/jbc.M110.175802 |
| [11] |
HAHN J S. Regulation of Nod1 by Hsp90 chaperone complex[J]. FEBS Lett, 2005, 579(20): 4513-4519. DOI:10.1016/j.febslet.2005.07.024 |
| [12] |
REN J Y, LIU C P, ZHAO D, et al. The role of heat shock protein 70 in oxidant stress and inflammatory injury in quail spleen induced by cold stress[J]. Environ Sci Pollut Res, 2018, 25(21): 21011-21023. DOI:10.1007/s11356-018-2142-8 |
| [13] |
MITCHELL J P, CARMODY R J. NF-κB and the transcriptional control of inflammation[J]. Int Rev Cell Mol Biol, 2018, 335: 41-84. DOI:10.1016/bs.ircmb.2017.07.007 |
| [14] |
GUO J R, LI S Z, FANG H G, et al. Different duration of cold stress enhances pro-inflammatory cytokines profile and alterations of Th1 and Th2 type cytokines secretion in serum of wistar rats[J]. J Anim Vet Adv, 2012, 11(10): 1538-1545. DOI:10.3923/javaa.2012.1538.1545 |
| [15] |
庄德葆. 环境温度变化及LPS、ConA共刺激大鼠致脾脏免疫功能变化的形态学研究[D]. 南昌: 南昌大学, 2012. ZHUANG D B. A morphological study on the changes of splenic immune function caused by ambient temperature change alone and in combination with LPS/Con A stimulation in rats[D]. Nanchang: Nanchang University, 2012. (in Chinese) |
| [16] |
臧树成. miR-383在急性冷暴露诱导大鼠肝脏氧化应激中的作用[D]. 大庆: 黑龙江八一农垦大学, 2019. ZANG S C. The role of miR-383 on oxidative damage of rat liver by acute cold exposure[D]. Daqing: Heilongjiang Bayi Agricultural University, 2019. (in Chinese) |
| [17] |
JIA Z F, CHEN A, WANG C J, et al. Amelioration effects of Kaempferol on immune response following chronic intermittent cold-stress[J]. Res Vet Sci, 2019, 125: 390-396. DOI:10.1016/j.rvsc.2019.08.012 |
| [18] |
SUN W W, WANG Z H, CAO J P, et al. Cold stress increases reactive oxygen species formation via TRPA1 activation in A549 cells[J]. Cell Stress Chaperones, 2016, 21(2): 367-372. DOI:10.1007/s12192-015-0663-3 |
| [19] |
PAMOK S, AENGWANICH W, KOMUTRIN T. Adaptation to oxidative stress and impact of chronic oxidative stress on immunity in heat-stressed broilers[J]. J Therm Biol, 2009, 34(7): 353-357. DOI:10.1016/j.jtherbio.2009.06.003 |
| [20] |
丛培芳, 柳云恩, 施琳, 等. Nrf2信号通路对极寒环境致小鼠心肌损伤影响[J]. 创伤与急危重病医学, 2016, 4(6): 351-354. CONG P F, LIU Y E, SHI L, et al. Effect of Nrf2 signaling pathway on cold stress induced myocardial injury in mice[J]. Trauma and Critical Care Medicine, 2016, 4(6): 351-354. (in Chinese) |
| [21] |
FRIGAULT J J, GAUDET J D, MORIN P JR. Investigating Nrf2-associated non-coding RNAs in the hibernating ground squirrel, Ictidomys tridecemlineatus[J]. J Therm Biol, 2018, 75: 38-44. DOI:10.1016/j.jtherbio.2018.05.008 |
| [22] |
TREWEEK T M, MEEHAN S, ECROYD H, et al. Small heat-shock proteins: important players in regulating cellular proteostasis[J]. Cell Mol Life Sci, 2015, 72(3): 429-451. DOI:10.1007/s00018-014-1754-5 |
| [23] |
ZUEHLKE A D, MOSES M A, NECKERS L. Heat shock protein 90:its inhibition and function[J]. Philos Trans R Soc Lond B Biol Sci, 2018, 373(1738): 20160527. DOI:10.1098/rstb.2016.0527 |
| [24] |
DANGI S S, DANGI S K, CHOUHAN V S, et al. Modulatory effect of betaine on expression dynamics of HSPs during heat stress acclimation in goat (Capra hircus)[J]. Gene, 2016, 575(2): 543-550. DOI:10.1016/j.gene.2015.09.031 |
| [25] |
SURAI P F, KOCHISH I I, FISININ V I, et al. Antioxidant defence systems and oxidative stress in poultry biology: an update[J]. Antioxidants(Basel), 2019, 8(7): 235. |
| [26] |
LIU Q L, LIANG C, ZHOU L. Structural and functional analysis of the Hsp70/Hsp40 chaperone system[J]. Protein Sci, 2020, 29(2): 378-390. DOI:10.1002/pro.3725 |
| [27] |
BRENU E W, STAINES D R, TAJOURI L, et al. Heat shock proteins and regulatory T cells[J]. Autoimmune Dis, 2013, 2013: 813256. |
| [28] |
SINGH K M, SINGH S, GANGULY I, et al. Association of heat stress protein 90 and 70 gene polymorphism with adaptability traits in Indian sheep (Ovis aries)[J]. Cell Stress Chaperones, 2017, 22(5): 675-684. DOI:10.1007/s12192-017-0770-4 |
| [29] |
NIU D L, ZHAO Y E, GONG X J, et al. Stress response and silencing verification of heat shock proteins in Dermatophagoides farinae under temperature stress[J]. Int J Biol Macromol, 2020, 144: 351-361. DOI:10.1016/j.ijbiomac.2019.12.014 |
| [30] |
MANFREDI L H, ZANON N M, GARÓFALO M A, et al. Effect of short-term cold exposure on skeletal muscle protein breakdown in rats[J]. J Appl Physiol (1985), 2013, 115(10): 1496-1505. DOI:10.1152/japplphysiol.00474.2013 |
| [31] |
CHIANG W C, CHING T T, LEE H C, et al. HSF-1 regulators DDL-1/2 link insulin-like signaling to heat-shock responses and modulation of longevity[J]. Cell, 2012, 148(1-2): 322-334. DOI:10.1016/j.cell.2011.12.019 |
| [32] |
SURAI P F, KOCHISH I I. Antioxidant systems and vitagenes in poultry biology: heat shock proteins[M]//ASEA A A A, KAUR P. Heat Shock Proteins in Veterinary Medicine and Sciences. Cham: Springer, 2017: 123-177.
|
| [33] |
WANG X R, WANG C, BAN F X, et al. Genome-wide identification and characterization of HSP gene superfamily in whitefly (Bemisia tabaci) and expression profiling analysis under temperature stress[J]. Insect Sci, 2019, 26(1): 44-57. DOI:10.1111/1744-7917.12505 |
| [34] |
RASTOGI S, HALDAR C. Role of melatonin and HSF-1\\HSP-70 in modulating cold stress-induced immunosuppression in a tropical rodent- Funambulus pennant[J]. J Therm Biol, 2020, 87: 102456. DOI:10.1016/j.jtherbio.2019.102456 |
| [35] |
HECK T G, SCOMAZZON S P, NUNES P R, et al. Acute exercise boosts cell proliferation and the heat shock response in lymphocytes: correlation with cytokine production and extracellular-to-intracellular HSP70 ratio[J]. Cell Stress Chaperones, 2017, 22(2): 271-291. DOI:10.1007/s12192-017-0771-3 |
| [36] |
LU Y Y, EGUCHI T. HSP stimulation on macrophages and dendritic cells activates innate immune system[M]//ASEA AAA, KAUR P. Heat Shock Proteins in Inflammatory Diseases. Cham: Springer, 2020: 1-15.
|
| [37] |
吴盈盈, 胥文春, 尹一兵, 等. NF-κB和PI3K-Akt通路调节肺炎链球菌HSP40诱导小鼠巨噬细胞免疫应答[J]. 免疫学杂志, 2017, 33(1): 18-22. WU Y Y, XU W C, YIN Y B, et al. NF-κB and PI3K-Akt pathways regulate pneumococcal HSP40-induced immune response of mouse macrophage[J]. Immunological Journal, 2017, 33(1): 18-22. (in Chinese) |
| [38] |
KUPPNER M C, GASTPAR R, GELWER S, et al. The role of heat shock protein (hsp70) in dendritic cell maturation: hsp70 induces the maturation of immature dendritic cells but reduces DC differentiation from monocyte precursors[J]. Eur J Immunol, 2001, 31(5): 1602-1609. DOI:10.1002/1521-4141(200105)31:5<1602::AID-IMMU1602>3.0.CO;2-W |
| [39] |
CAO X, YUE L, SONG J Y, et al. Inducible HSP70 antagonizes IL-1β cytocidal effects through inhibiting NF-kB activation via destabilizing TAK1 in HeLa cells[J]. PLoS One, 2012, 7(11): e50059. DOI:10.1371/journal.pone.0050059 |
| [40] |
TUKAJ S. Heat shock protein 70 as a double agent acting inside and outside the cell: insights into autoimmunity[J]. Int J Mol Sci, 2020, 21(15): 5298. DOI:10.3390/ijms21155298 |
| [41] |
孙海阁, 田迪, 谭迎, 等. 皮下免疫热休克蛋白65对高密度脂蛋白抗炎抗氧化功能的影响[J]. 中国动脉硬化杂志, 2013, 21(11): 977-981. SUN H G, TIAN D, TAN Y, et al. Effect of heat shock protein-65 on the anti-oxidant and anti-inflammatory properties of high density lipoprotein[J]. Chinese Journal of Arteriosclerosis, 2013, 21(11): 977-981. (in Chinese) |
| [42] |
FANG H L, WU Y F, HUANG X H, et al. Toll-like receptor 4 (TLR4) is essential for Hsp70-like protein 1 (HSP70L1) to activate dendritic cells and induce Th1 response[J]. J Biol Chem, 2011, 286(35): 30393-30400. DOI:10.1074/jbc.M111.266528 |
| [43] |
HULINA A, RAJKOVIĆ M G, DESPOT D J, et al. Extracellular Hsp70 induces inflammation and modulates LPS/LTA-stimulated inflammatory response in THP-1 cells[J]. Cell Stress Chaperones, 2018, 23(3): 373-384. DOI:10.1007/s12192-017-0847-0 |
| [44] |
SOMENSI N, BRUM P O, DE MIRANDA RAMOS V, et al. Extracellular HSP70 activates ERK1/2, NF-kB and pro-inflammatory gene transcription through binding with RAGE in A549 human lung cancer cells[J]. Cell Physiol Biochem, 2017, 42(6): 2507-2522. DOI:10.1159/000480213 |
| [45] |
SUN S C. The non-canonical NF-κB pathway in immunity and inflammation[J]. Nat Rev Immunol, 2017, 17(9): 545-558. DOI:10.1038/nri.2017.52 |
| [46] |
LEE J H, JEON J, BAI F, et al. The Pseudomonas aeruginosa HSP70-like protein DnaK induces IL-1β expression via TLR4-dependent activation of the NF-κB and JNK signaling pathways[J]. Comp Immunol Microbiol Infect Dis, 2019, 67: 101373. DOI:10.1016/j.cimid.2019.101373 |
| [47] |
LEE K H, BISWAS A, LIU Y J, et al. Proteasomal degradation of Nod2 protein mediates tolerance to bacterial cell wall components[J]. J Biol Chem, 2012, 287(47): 39800-39811. DOI:10.1074/jbc.M112.410027 |
| [48] |
CHEN H Q, WU Y F, ZHANG Y Q, et al. Hsp70 inhibits lipopolysaccharide-induced NF-κB activation by interacting with TRAF6 and inhibiting its ubiquitination[J]. FEBS Lett, 2006, 580(13): 3145-3152. DOI:10.1016/j.febslet.2006.04.066 |
| [49] |
WANG H T, DONG Y, CAI Y H. Alanyl-glutamine prophylactically protects against lipopolysaccharide-induced acute lung injury by enhancing the expression of HSP70[J]. Mol Med Rep, 2017, 16(3): 2807-2813. DOI:10.3892/mmr.2017.6896 |
| [50] |
ZHOU X C, DONG L W, YANG B, et al. Preinduction of heat shock protein 70 protects mice against post-infection irritable bowel syndrome via NF-κB and NOS/NO signaling pathways[J]. Amino Acids, 2015, 47(12): 2635-2645. DOI:10.1007/s00726-015-2056-4 |
| [51] |
SHANG L Q, WANG L, SHI X L, et al. HMGB1 was negatively regulated by HSF1 and mediated the TLR4/MyD88/NF-κB signal pathway in asthma[J]. Life Sci, 2020, 241: 117120. DOI:10.1016/j.lfs.2019.117120 |
| [52] |
HERNÁNDEZ-SANTANA A, PÉREZ-LÓPEZ V, ZUBELDIA J M, et al. A rhodiola rosea root extract protects skeletal muscle cells against chemically induced oxidative stress by modulating heat shock protein 70 (HSP70) expression[J]. Phytother Res, 2014, 28(4): 623-628. DOI:10.1002/ptr.5046 |
| [53] |
KONG F Z, WANG H, GUO J R, et al. Hsp70 suppresses apoptosis of BRL cells by regulating the expression of Bcl-2, cytochrome C, and caspase 8/3[J]. In Vitro Cell Dev Biol Anim, 2016, 52(5): 568-575. DOI:10.1007/s11626-016-0005-5 |
| [54] |
PRESLEY T, VEDAM K, VELAYUTHAM M, et al. Activation of Hsp90-eNOS and increased NO generation attenuate respiration of hypoxia-treated endothelial cells[J]. Am J Physiol Cell Physiol, 2008, 295(5): C1281-C1291. DOI:10.1152/ajpcell.00550.2007 |
| [55] |
贾红豆. 热休克蛋白B7在酮病奶牛脂肪组织氧化应激中的作用研究[D]. 长春: 吉林大学, 2019. JIA H D. Effect of heat-shock protein B7 on oxidative stress in adipose tissue of ketotic dairy cows[D]. Changchun: Jilin University, 2019. (in Chinese) |
| [56] |
卢德勋. 动物营养学科发展在战略方向上的重大突破: 构建动物健康营养理论和技术体系及其实际应用[J]. 动物营养学报, 2021, 33(1): 1-12. LU D X. A major breakthrough in development of animal nutrition in strategic direction: building an animal health and nutrition theory and technology system and its application[J]. Chinese Journal of Animal Nutrition, 2021, 33(1): 1-12. DOI:10.3969/j.issn.1006-267x.2021.01.001 (in Chinese) |
| [57] |
ANDREYEV A Y, KUSHNAREVA Y E, STARKOVA N N, et al. Metabolic ROS signaling: to immunity and beyond[J]. Biochemistry (Moscow), 2020, 85(12-13): 1650-1667. DOI:10.1134/S0006297920120160 |
| [58] |
ZHAO G, JIANG K F, WU H C, et al. Polydatin reduces Staphylococcus aureus lipoteichoic acid-induced injury by attenuating reactive oxygen species generation and TLR2-NFκB signalling[J]. J Cell Mol Med, 2017, 21(11): 2796-2808. DOI:10.1111/jcmm.13194 |
| [59] |
SIVANDZADE F, PRASAD S, BHALERAO A, et al. NRF2 and NF-κB interplay in cerebrovascular and neurodegenerative disorders: molecular mechanisms and possible therapeutic approaches[J]. Redox Biol, 2019, 21: 101059. DOI:10.1016/j.redox.2018.11.017 |
| [60] |
MOLINA M N, FERDER L, MANUCHA W, et al. Emerging role of nitric oxide and heat shock proteins in insulin resistance[J]. Curr Hypertens Rep, 2016, 18(1): 1. DOI:10.1007/s11906-015-0615-4 |
| [61] |
XU J, TANG S, SONG E, et al. Hsp70 expression induced by Co-Enzyme Q10 protected chicken myocardial cells from damage and apoptosis under in vitro heat stress[J]. Poult Sci, 2017, 96(5): 1426-1437. DOI:10.3382/ps/pew402 |
| [62] |
XU J, TANG S, YIN B, et al. Co-enzyme Q10 and acetyl salicylic acid enhance Hsp70 expression in primary chicken myocardial cells to protect the cells during heat stress[J]. Mol Cell Biochem, 2017, 435(1-2): 73-86. DOI:10.1007/s11010-017-3058-1 |
(编辑 白永平)



