2. 农业微生物学国家重点实验室, 武汉 430070;
3. 生猪健康养殖协同创新中心,武汉 430070;
4. 中国农业大学动物医学院,北京 100193
2. State Key Laboratory of Agricultural Microbiology, Wuhan 430070, China;
3. The Cooperative Innovation Center for Sustainable Pig Production, Wuhan 430070, China;
4. College of Veterinary Medicine, China Agricultural University, Beijing 100193, China
非洲猪瘟(African swine fever, ASF)是由非洲猪瘟病毒(African swine fever virus, ASFV)引起猪的一种高度传染性疾病,临床症状以急性、热性、出血性、高发病率和高死亡率为特征。该病属于世界动物卫生组织(OIE)要求法定报告的动物疫病,我国动物病原微生物名录中将其列为一类动物病原[1-4]。本病2018年传入我国,给我国养猪业带来了巨大的经济损失[5-6]。无论在非洲猪瘟新发地区还是流行地区,疫情的暴发和流行都会对当地产生严重的社会经济影响[7-10]。ASF具有迅速传播的潜力,并且由于目前尚无相关疫苗,因此该病的防控依赖于疾病的快速诊断、无害化处理感染动物以及发病动物。
目前,我国出现了非洲猪瘟变异毒株,其毒力相对较弱,感染猪的临床症状不典型,有时呈间接性排毒[11-15],而猪在感染后7~9 d即可在血清中检测到抗体,且抗体阳性可持续终生[16-17]。目前,血清抗体的检测方法主要是ELISA,此方法操作简单、快速,易于标准化。研究表明p30、p54和p72、p35、pK205R、CD2v蛋白具有较高的免疫原性,用于制备的ELISA检测试剂盒均具有较好的敏感性和特异性[18-24]。但以上方法应用的抗原蛋白均含有标签蛋白,从而造成检测假阳性的情况。因此,建立敏感且特异性更强的ELISA抗体检测方法,在精准检测和扑杀感染猪中具有重要意义。
1 材料与方法 1.1 材料ASFV阳性核酸提取于区域性排查阳性样品,非洲猪瘟阳性和阴性血清均由中国动物卫生与流行病学中心非洲猪瘟国家参考实验室馈赠,非洲猪瘟动物实验感染血清由哈尔滨兽医研究所馈赠,非洲猪瘟阳性标准血清购于中国兽医药品监察所,ASFV为本实验室分离保存。pET-30a质粒由本实验室保存。E. coli DH5α、E. coli Transetta(DE3)感受态细胞和EasyPure Plasmid MiniPrep Kit(质粒小提试剂盒,EM101)等购自北京全式金生物技术有限公司;Biomiga Gel/PCR Extraction Kit(胶/PCR产物回收试剂盒,DC3511)购自美国Biomiga公司;牛血清白蛋白(BSA)购自美国MP Biomedicals公司;PVDF膜0.45 μm(IPVH00010),0.22 μm滤器和透析袋购自Millipore公司;DL2000 DNA Marker、T4 DNA Ligase(2001A)、限制性内切酶NcoⅠ和XhoⅠ均购自宝生物工程(大连)有限公司(TaKaRa),重组肠激酶购自上海李记生物科技有限公司,羊抗猪IgG二抗购自武汉三鹰生物技术有限公司(Proteintech);非洲猪瘟抗体检测试剂盒购自西班牙INGENASA公司;其余化学试剂均为国药产试剂。
猪瘟病毒、猪繁殖与呼吸综合征病毒、口蹄疫病毒、伪狂犬病病毒、猪圆环病毒病2型、猪流行性腹泻病毒等的阳性血清均为实验室保存。
1.2 引物设计参照GenBank数据库中ASFV-CP204L序列(GenBank No.: MK333180.1),根据基因序列设计上游引物F的序列:5′- GGCCATGGCTATGGATTTTATTTTAAATAT-3′,下游引物R的序列:5′- CCGCTCGAGCTTGTCGTCGTCGTCTT-TTTTTTTTAAAAGTTTA-3′。单下划线处分别是NcoⅠ和XhoⅠ的酶切位点序列,双下划线处为肠激酶(enterokinase)序列,并加入保护性碱基。上述引物由上海生物工程股份有限公司合成。预计扩增片段大小为616 bp,包含ASFV-p30的整个开放阅读框和一个enterokinase序列。
1.3 重组质粒pET30a-CP204L的构建以ASFV阳性核酸为模板扩增CP204L基因,反应体系:2×rTaq DNA聚合酶25 μL,上下游引物(10 pmol·μL-1)各1 μL,模板3 μL,ddH2O 20 μL; PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,53.6 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃延伸10 min,16 ℃保存。PCR产物电泳后用胶回收试剂盒纯化p30基因片段。将原核表达载体pET-30a与扩增的p30基因片段分别用NcoⅠ和XhoⅠ进行双酶切,并回收纯化。将回收得到的产物于4 ℃过夜连接并进行转化,PCR扩增鉴定克隆菌。将PCR阳性菌提取质粒进行双酶切鉴定,并送至生工生物工程(上海)股份有限公司进行测序分析。
1.4 重组ASFV p30蛋白的表达与纯化鉴定将测序正确的重组质粒pET-30a-CP204L转化到E.coli Transetta(DE3)表达感受态细胞,16 h后挑取阳性菌落,于含有卡那霉素的LB培养基中扩大培养,提取质粒再进行双酶切检测,将验证正确的菌液冷冻保存于-80 ℃。
培养鉴定正确的重组菌,加入IPTG诱导表达结束后离心收集菌体,将菌体高压破碎2~3次至菌液澄清明亮,4 ℃ 10 000 r·min-1离心5 min,弃上清,再用以下溶液洗涤包涵体,去除杂蛋白。洗涤液1: Buffer A+1%Triton-X100,4 ℃静置15 min;洗涤液2: Buffer A+2 mol·L-1尿素,4 ℃静置20 min;洗涤液3: Buffer A+4 mol·L-1尿素,4 ℃静置10 min。每步均离心留取沉淀做下一步。用19.7 mL Buffer A重悬蛋白沉淀,同时加入19.7 μL的DTT溶液。混匀后加入0.3 mL 20%的SKL贮存液,剧烈搅动,使其缓慢溶解,4 ℃过夜。之后4 ℃ 12 000 r·min-1离心15 min,取上清,加入20% PEG4000 210 μL至总浓度为0.2%,另外加入50 mmol·L-1(0.03 g·mL-1)氧化型谷胱甘肽420 μL和50 mmol·L-1(0.03 g·mL-1)还原型谷胱甘肽420 μL,4 ℃静置1~2 h。将蛋白装入透析袋中,使用TE Buffer溶液于4 ℃下透析48~72 h。
将透析好的蛋白使用Ni-NTA亲和层析柱纯化,纯化后使用肠激酶切除两端的His标签,使用透析袋透析后获得p30蛋白。取肠激酶酶切前后的蛋白样品进行SDS-PAGE验证,并分别使用His单抗和ASFV阳性猪血清作为一抗,进行Western blot鉴定。
1.5 间接ELISA检测方法的建立1.5.1 抗原最佳包被浓度和待检血清稀释度的选择 采用方阵滴定法,以碳酸盐缓冲液(0.05 mol·L-1, pH 9.6)为包被液,将纯化的p30蛋白稀释至终浓度分别为2、1、0.5、0.25、0.125、0.062 5 μg·mL-1,每个浓度包被1列,每孔100 μL,4 ℃包被12 h。PBST洗涤5次后拍干。每孔加入100 μL的1%脱脂牛奶溶液,37 ℃封闭1 h,取出洗涤,方法同上。将阴阳性血清按照1∶20、1∶40、1∶80和1∶160梯度倍比稀释后加入ELISA包被板中,100 μL·孔-1,37 ℃作用30 min,取出洗涤5次。拍干后加入1∶12 000倍稀释的HRP标记的羊抗猪IgG酶标二抗,100 μL·孔-1,37 ℃反应30 min,取出洗涤,方法同上。拍干后加入TMB底物液,100 μL·孔-1,25 ℃避光反应10 min。每孔加入50 μL氟化钠终止反应,测定OD630 nm值。以阳性血清OD630 nm值接近1,P/N值最大孔的抗原浓度和血清稀释度作为最佳抗原包被浓度和血清稀释度。
1.5.2 抗原最佳包被条件的选择 以最适抗原浓度包被酶标板之后,分别按照不同条件处理酶标板:4 ℃包被12 h;37 ℃孵育60 min之后,4 ℃包被12 h和37 ℃孵育120 min。比较各组阳、阴性血清的P/N值,以选择最佳包被时间和包被温度。
1.5.3 最佳封闭条件的选择 取包被好的酶标板,选择6组封闭液:0.5% BSA、1% BSA、2%BSA、1%脱脂牛奶、2%脱脂牛奶、5%脱脂牛奶,每组封闭液做3个重复,100 μL·孔-1。选择3组封闭时间:37 ℃孵育时间分别为60、90和120 min。待封闭完成后。计算其P/N值,选择最佳封闭液和封闭时间。
1.5.4 最佳反应时间的选择 血清按照确定的最佳稀释度加入包被的酶标板,37 ℃分别孵育30、45、60、90 min。将酶标抗体(二抗)按照推荐的稀释倍数1∶12 000加入酶标板后,37 ℃分别作用30、45、60、90 min。加入TMB底物液,100 μL·孔-1,25 ℃避光分别反应5、10、15 min,之后加入终止液50 μL·孔-1,于酶标仪630 nm波长读数,计算出对应的P/N值,选择最佳底物显色时间。
1.5.5 临界值的确定 检测经INGENASA非洲猪瘟抗体检测试剂盒确定阴阳性的240份样品,其中,89份阳性样品来自于临床样品,151份阴性样品来自于2017年保存血清。检测结果通过SPSS进行ROC曲线分析,计算ROC曲线下的面积(AUC),找到ROC曲线下面积最大时对应的Cut-off值,即为最佳阳性判定值。
1.5.6 批间、批内重复试验 批内重复试验:将同一批次纯化的蛋白包被ELISA板,取6份不同抗体水平的阳性血清样品和2份阴性血清样品,于3个不同时间点分别进行ELISA检测;批间重复试验:用不同批次制备的3批蛋白抗原分别包被ELISA板,对以上血清样品分别检测。分别计算批内和批间重复试验的标准差、平均值和变异系数。
1.5.7 实验室敏感性试验 用建立的间接ELISA方法检测购于中国兽医药品监察所的ASFV阳性标准血清(202101批)和中国动物卫生与流行病学中心国家非洲猪瘟参考实验室馈赠的阴性血清,各血清样品均倍比稀释至1 024倍,可检测到的最高稀释浓度即该方法的最高敏感度。
1.5.8 实验室特异性试验 用本方法分别检测PCV2阳性血清(PCV2+)、猪瘟阳性血清(CSFV+)、猪伪狂犬野毒阳性血清(PRV-gE+)和猪繁殖与呼吸综合征病毒阳性血清(PRRSV+),同时设阴、阳性对照,进行特异性试验分析。
1.6 动物感染血清检测使用本方法与本实验室基于p72蛋白制备的抗体检测试方法分别检测中国农业科学院哈尔滨兽医研究所馈赠的感染ASFV不同时间点的收集的血清,评价本方法临床敏感性及抗体变化情况。
1.7 对比试验使用本试剂盒与INGENASA非洲猪瘟抗体检测试剂盒对比检测180份临床样品,计算阴性和阳性符合率;对2个方法检测不一致的血清样品在华中农业大学生物安全三级实验室种使用间接免疫荧光试验(IFA)方法确定血清阴阳性,最终判定本方法的阴阳性符合率。
IFA试验具体步骤:将原代肺泡巨噬细胞(PAM)细胞培养于48孔培养板,待细胞稳定贴壁12 h后,按照0.1 MOI接种ASFV,36 h后用4%的多聚甲醛固定30 min,然后用PBS洗涤3次,每次5 min。分别加入待检血清和已知阴阳性血清,37 ℃温育60 min,PBS洗3次,加入FITC标记的羊抗猪IgG,37 ℃温育60 min,PBS洗3次,在倒置荧光显微镜下观察结果。IFA试验在华中农业大学生物安全三级实验室(ABSL-3)完成。
1.8 临床血清样品检测使用本试验建立的方法检测2020年收集的644份临床样品,其中母猪血清样品264份,后备母猪血清样品131份,仔猪样品81份,保育猪样品53份,育肥猪样品115份。
2 结果 2.1 ASFV CP204L基因的扩增从阳性模板PCR扩增特异性基因CP204L,经1.5% 琼脂糖凝胶电泳检测,目的片段大小为616 bp (图 1A),与预期结果一致。
|
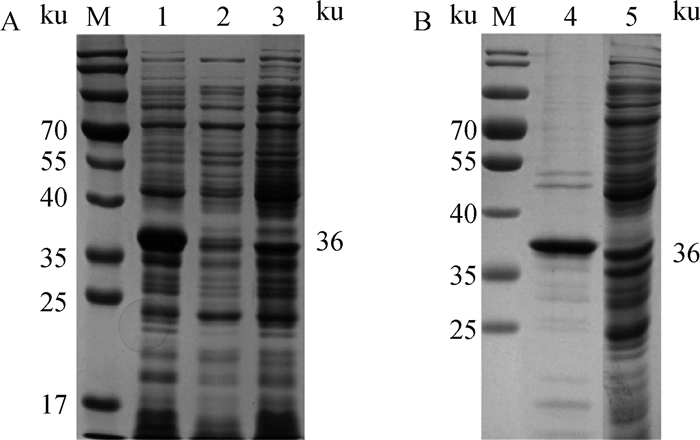
A. ASFV p30蛋白的表达;B. ASFV p30蛋白的纯化鉴定;M.蛋白质相对分子质量标准; 1.高压破碎后菌体沉淀; 2.高压破碎后上清; 3、5. pET-30a空载诱导后产物;4.纯化后的ASFV p30蛋白 A. Expression of ASFV p30 protein; B. Purification and identification of ASFV p30 protein; M. Protein marker; 1. Bacterial precipitation after high-pressure treatment; 2. Supernatant after high-pressure treatment; 3, 5. Proteins of pET-30a after induction; 4. Purified ASFV p30 protein 图 1 p30重组蛋白的SDS-PAGE鉴定 Fig. 1 Identification of p30 recombinant protein by SDS-PAGE |
将CP204L基因片段连接至pET-30a质粒中,重组表达质粒经限制性内切酶NcoⅠ和XhoⅠ双酶切后,获得616 bp的目的片段和约为5 400 bp的pET-30a载体片段,经测序可见核苷酸序列结果正确,表明重组质粒pET-30a-CP204L构建正确。经测序比较与Pig/HLJ/2018毒株的CP204L基因(GenBank No.: MK333180.1)完全一致。
2.3 重组蛋白的表达及鉴定SDS-PAGE结果显示,pET-30a-p30重组质粒经转化E. coli Transetta(DE3)感受态细胞后,诱导表达高压破碎后对上清和包涵体分别制样,经PAGE验证,该蛋白主要表达于包涵体中,相对分子质量约为36 ku,与预期大小相符。经纯化后得到相对分子质量约为36 ku的ASFV p30蛋白(图 1)。
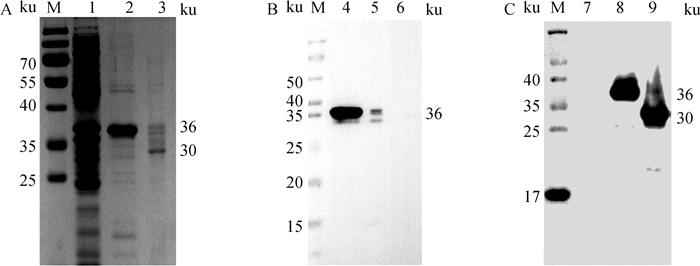
2.4 重组蛋白的纯化和Western blot分析使用肠激酶酶切前后的蛋白经PAGE和Western blot分析,结果显示(图 2),酶切后的重组蛋白不能与His抗体发生反应,但可以和ASFV阳性猪血清发生较强反应,说明酶切后的p30蛋白具有良好的反应原性,His标签已经切除。
|
A. SDS-PAGE验证;B. Western blot His标签检测;C. p30蛋白ASFV阳性血清Western blot验证;M. 蛋白质相对分子质量标准; 1、6、7. pET-30a空载诱导后产物; 2、4、8. 肠激酶酶切前的p30蛋白; 3、5、9. 肠激酶酶切后的p30蛋白 A. SDS-PAGE analysis of p30 protein digestion by enterokinase; B. His tag detection of p30 protein by Western blot; C. Western blot analysis of p30 protein using ASFV positive serum; M. Protein marker; 1, 6, 7. Proteins of pET-30a after inducement; 2, 4, 8. p30 protein before enterokinase digestion; 3, 5, 9. p30 protein after enterokinase digestion 图 2 使用肠激酶酶切后的p30蛋白鉴定 Fig. 2 Analysis of p30 protein digestion by enterokinase |
2.5.1 重组蛋白包被浓度和样品稀释度的确定 通过方阵滴定检测可知,当酶切后的p30蛋白抗原包被浓度为1 μg·mL-1,血清1∶40稀释时,此时P/N值最大,且此阳性血清OD630 nm值>1。所以采用1 μg·mL-1为最适包被浓度,血清1∶40稀释时为最适稀释倍数,如表 1所示。
|
|
表 1 基于OD630 nm确定最佳抗原包被浓度和血清稀释度 Table 1 Determination of the coating concentration of recombinant protein and sera dilution based on OD630 nm |
2.5.2 抗原最佳包被和封闭条件的选择 试验结果表明,抗原4 ℃包被12 h时P/N值最大,使用2%的脱脂奶粉封闭60 min时P/N值最大,因此确定最佳包被条件是4 ℃ 12 h,最佳的封闭条件使用2 %的脱脂奶粉封闭60 min。
2.5.3 最佳反应条件的选择 试验结果表明,样品在37 ℃孵育30 min、酶标二抗37 ℃孵育30 min、TMB避光显色10 min条件下P/N值最大,所以最佳的反应条件为一抗37 ℃孵育30 min,酶标二抗37 ℃孵育30 min,TMB底物避光显色10 min。
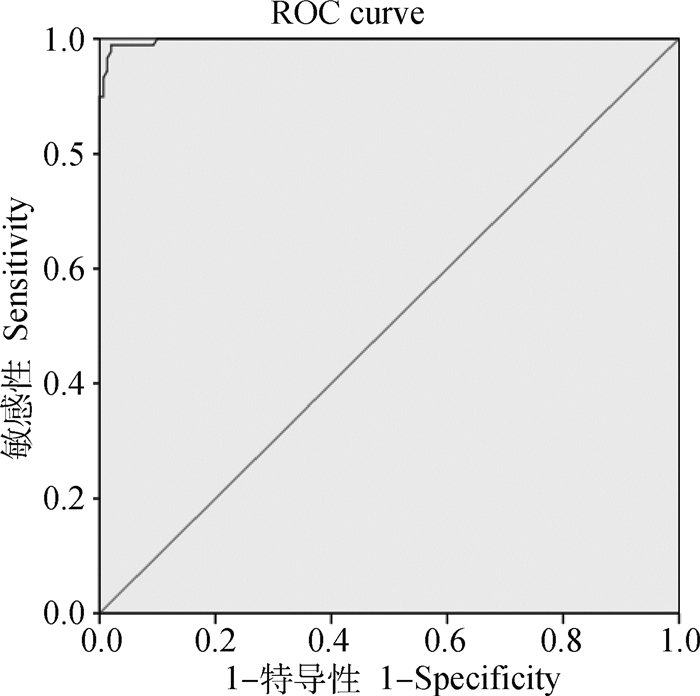
2.5.4 临界值的确定 使用本方法检测89份阳性和151份阴性共计240份样品,检测结果通过SPSS进行ROC曲线分析(图 3),计算ROC曲线下的面积(AUC),确定当Cut-off值确定为0.398 5时,ROC曲线下面积最大,为0.998,此时敏感性为98.9%,特异性为98.0%。
|
图 3 基于阴阳性血清的临界值ROC曲线图 Fig. 3 ROC curve graph of cutoff value based on negative and positive sera |
2.5.5 批内批间重复试验 批内重复试验显示,变异系数为1.06%~3.74%,批间重复试验显示,变异系数为2.51%~8.47%。批间和批内试验变异系数均小于10%,表明该方法重复性良好。
2.5.6 敏感性试验 用建立的间接ELISA方法检测不同稀释度的ASF标准阳性血清和阴性血清,同时设阳性、阴性对照。结果如表 2所示,该ELISA方法检测标准阳性血清的最大稀释度为1∶512,阴性血清在所有稀释度下结果均为阴性。
|
|
表 2 敏感性试验 Table 2 Sensitivity assay |
2.5.7 特异性试验 用建立的间接ELISA方法分别检测PCV2、CSFV、PRV-gE、PRRSV等病毒的阳性血清,同时设阳性、阴性对照。结果表明该ELISA方法检测其他病毒阳性血清均为阴性,无假阳性反应,表明此ASFV-p30-ELISA方法具有良好特异性。
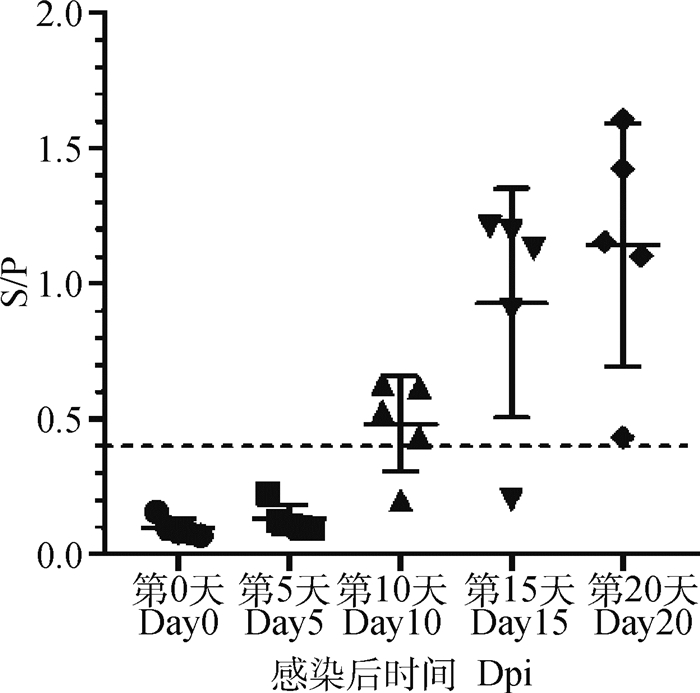
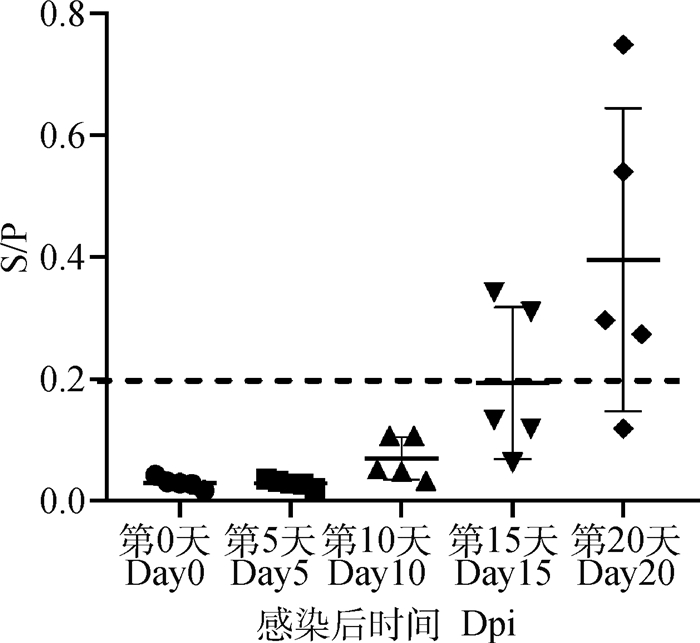
2.6 动物感染血清检测使用本研究建立的基于p30蛋白和本实验室基于p72蛋白建立的两种间接ELISA方法分别检测中国农业科学院哈尔滨兽医研究所馈赠的感染ASFV不同时间点的猪血清,在第10天时有80%(4/5)的感染动物针对p30蛋白抗体转阳,在第20天时所有感染动物抗体全部转阳(图 4);而针对p72蛋白(图 5),在第15天才有40%(2/5)的感染动物抗体转阳,在第20天还有20%(1/5)的感染动物p72蛋白抗体为阴性,表明p30蛋白相对于p72蛋白更适用于早期检测。
|
图 4 动物感染模型中p30蛋白抗体监测情况 Fig. 4 Anti-p30 antibody monitoring in animal experiment |
|
图 5 动物感染模型中p72抗体监测情况 Fig. 5 Anti-p72 antibody monitoring in animal experiment |
使用本试剂盒与INGENASA非洲猪瘟抗体检测试剂盒对比检测180份临床样品,对比可见(表 3)两种试剂盒总体符合率达97.78%,共有4份样品存在检测结果差异,经IFA检测可见在阴阳性对照均成立时,4份样品均未见有阳性信号。说明本方法敏感性较高,且特异性较好。
|
|
表 3 与商品化试剂盒的对比试验 Table 3 Contrast test of different methods |
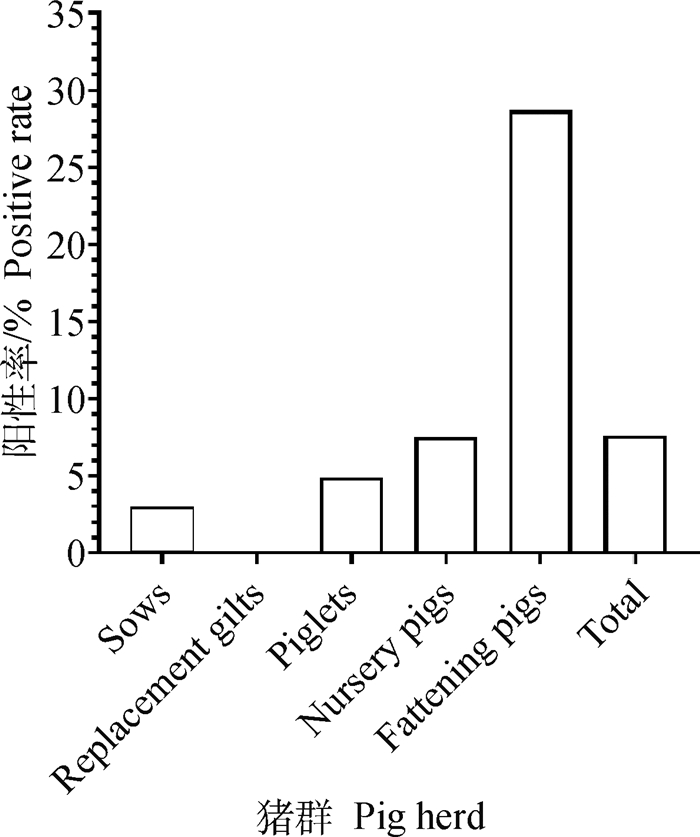
本研究累计收集猪血清样品644份,用本试验建立的间接ELISA抗体检测,总体阳性率为7.61%,其中,后备母猪中未检测到阳性,母猪、仔猪、保育猪和育肥猪抗体阳性率分别为3.03%、4.94%、7.55%和28.7%(图 6)。
|
图 6 各阶段猪群抗体阳性率 Fig. 6 Antibody positive rate of pig herd at each stage |
非洲猪瘟对养猪业的危害极其严重,自2018年8月ASFV传入我国以来,给我国养猪业造成了严重的损失,致死率可达100%,因此主要采取扑杀病猪和无害化处理的方式控制该病[9-10, 25-26]。目前国内出现部分弱毒株,其引起的临床症状不明显[19-22],但发病周期长,猪可在感染后7~9 d产生抗体[23-24],国际上商品化抗体检测试剂盒种类较少,国内同样缺乏成熟可靠的抗体检测方法,因此,急需建立一种用于ASFV的快速高效的抗体检测方法。目前,针对该病的抗体检测方法国内外多选用p72、p30、p54等具有较高免疫原性和反应原性的蛋白作为抗原,其中p72蛋白较多应用于国内外的研究中,该蛋白是ASFV的主要结构蛋白,其免疫原性好、保守性强、表达量高,西班牙INGENASA公司生产的ASF抗体检测试剂盒便是基于p72蛋白[11, 27],但该蛋白在病毒感染晚期才表达,相对检出时间较晚[28],故基于p72蛋白的抗体检测方法不利于临床早期检测。P54蛋白虽较p72蛋白在感染ASFV后表达较早,但在不同地区毒株的p54蛋白在氨基酸序列上存在一定的差异,易造成假阴性的产生,故通常不作为非洲猪瘟的检测抗原[28]。相较于p54和p72蛋白,p30蛋白产生时间较早,使用p30蛋白作为抗原比p72作为抗原检测时间可提前7 d[28],且能够在病毒与细胞吸附之前或之后中和病毒,同样是重要的病毒早期诊断靶点[29-31],中国动物卫生与流行病学中心起草的GB/T18648-2020《非洲猪瘟诊断技术》也推荐使用p30蛋白作为间接ELISA的检测抗原,所以本研究选用p30蛋白作为检测抗原。
本研究采用pET-30a作为载体表达p30蛋白,原核系统具有操作简便、表达量高的优点,虽然表达的重组蛋白以包涵体形式存在,但经包涵体的变性、复性和镍柱纯化后,大大减少了杂蛋白的含量。为避免表达蛋白两端his标签和载体蛋白对检测造成假阳性情况,有研究为减少his标签引起的假阳性反应,用Sepharose300凝胶过滤层析柱和DEAE Sepharose Fast Flow阴离子交换柱分离纯化无his组氨酸标签的p30蛋白,可得到纯度较高的无标签p30蛋白,使用该蛋白作为包被蛋白开展ELISA方法研究,结果表明该蛋白较具有his标签的蛋白效果更好[32],但该方法纯化的蛋白纯度较低,且纯化方式较为复杂。而本研究在表达蛋白时在p30蛋白两端均加上了enterokinase序列,该序列用重组肠激酶切除后,再使用透析袋可除去多余蛋白,最后可得到纯度较高的p30蛋白,为使用该蛋白作为检测抗原奠定了良好的基础。本研究建立的方法与INGENASA商品化试剂盒比较,总体符合率达97.78%,其中,共有4份血清样品检测结果不一致,经IFA检测4份血清均为阴性,可见本方法敏感性和特异性均高于INGENASA试剂盒,表明本研究建立的方法可应用于临床实践。
在中国农业科学院哈尔滨兽医研究所馈赠的动物感染模型中,感染后第10天有80%检测到抗体产生,而在第20天时试验动物抗体才全部转阳,此结果与OIE及FAO报道一致[23-24],结果显示,p30蛋白的抗体产生时间明显早于p72蛋白抗体的产生时间,表明p30蛋白相对于p72蛋白更适用于早期检测。大量临床样品检测结果可见,猪场中总体阳性率为7.61%,其中后备母猪未检测到抗体阳性,育肥猪抗体阳性率高达28.7%,经调查分析猪场背景信息,抗体阳性的猪场均出现或曾经出现异常猪,本次检测结束后抗体阳性猪场的猪按照OIE要求进行了无害化处理,表明目前养殖环节中商品猪的ASF防控工作急需加强。由于国内弱毒力毒株的出现,常导致猪感染后临床症状不典型[18-22],所以抗体检测方法也可作为疑似病例诊断和猪场引种检测感染情况的有效手段。
| [1] |
DE LA TORRE A, BOSCH J, IGLESIAS I, et al. Assessing the risk of african swine fever introduction into the European union by wild boar[J]. Transbound Emerg Dis, 2015, 62(3): 272-279. DOI:10.1111/tbed.12129 |
| [2] |
ZAKARYAN H, REVILLA Y. African swine fever virus: current state and future perspectives in vaccine and antiviral research[J]. Vet Microbiol, 2016, 185: 15-19. DOI:10.1016/j.vetmic.2016.01.016 |
| [3] |
GAUDREAULT N N, MADDEN D W, WILSON W C, et al. African swine fever virus: an emerging DNA arbovirus[J]. Front Vet Sci, 2020, 7: 215. DOI:10.3389/fvets.2020.00215 |
| [4] |
MAI N T A, VU X D, NGUYEN T T H, et al. Molecular profile of African swine fever virus (ASFV) circulating in Vietnam during 2019-2020 outbreaks[J]. Arch Virol, 2021, 166(3): 885-890. DOI:10.1007/s00705-020-04936-5 |
| [5] |
GE S Q, LI J M, FAN X X, et al. Molecular characterization of African swine fever virus, China, 2018[J]. Emerg Infect Dis, 2018, 24(11): 2131-2133. DOI:10.3201/eid2411.181274 |
| [6] |
王清华, 任炜杰, 包静月, 等. 我国首例非洲猪瘟的确诊[J]. 中国动物检疫, 2018, 35(9): 1-4. WANG Q H, REN W J, BAO J Y, et al. The first outbreak of African swine fever was confirmed in China[J]. China Animal Health Inspection, 2018, 35(9): 1-4. (in Chinese) |
| [7] |
EDELSTEN R M, CHINOMBO D O. An outbreak of African swine fever in the southern region of Malawi[J]. Rev Sci Tech, 1995, 14(3): 655-666. DOI:10.20506/rst.14.3.865 |
| [8] |
EBWANGA E J, GHOGOMU S M, PAESHUYSE J. African swine fever in Cameroon: a review[J]. Pathogens, 2021, 10(4): 421. DOI:10.3390/pathogens10040421 |
| [9] |
BISIMWA P N, ISHARA L K, WASSO D S, et al. Detection and genetic characterization of African swine fever virus (ASFV) in clinically infected pigs in two districts in South Kivu province, Democratic Republic Congo[J]. Heliyon, 2021, 7(3): e06419. DOI:10.1016/j.heliyon.2021.e06419 |
| [10] |
LIU H, SHI K C, SUN W C, et al. Development a multiplex RT-PCR assay for simultaneous detection of African swine fever virus, classical swine fever virus and atypical porcine pestivirus[J]. J Virol Methods, 2020, 287: 114006. |
| [11] |
LI L, REN Z W, WANG Q H, et al. Infection of African swine fever in wild boar, China, 2018[J]. Transbound Emerg Dis, 2019, 66(3): 1395-1398. DOI:10.1111/tbed.13114 |
| [12] |
GE S Q, LIU Y T, LI L, et al. An extra insertion of tandem repeat sequence in African swine fever virus, China, 2019[J]. Virus Genes, 2019, 55(11): 843-847. |
| [13] |
ZHAO D M, LIU R Q, ZHANG X F, et al. Replication and virulence in pigs of the first African swine fever virus isolated in China[J]. Emerg Microbes Infect, 2019, 8(1): 438-447. DOI:10.1080/22221751.2019.1590128 |
| [14] |
SUN E C, ZHANG Z J, WANG Z L, et al. Emergence and prevalence of naturally occurring lower virulent African swine fever viruses in domestic pigs in China in 2020[J]. Sci China Life Sci, 2021, 64(5): 752-765. DOI:10.1007/s11427-021-1904-4 |
| [15] |
张艳艳, 张静远, 杨金金, 等. 1株非洲猪瘟病毒自然变异毒株的鉴定[J]. 中国兽医学报, 2021, 41(2): 199-207. ZHANG Y Y, ZHANG J Y, YANG J J, et al. Identification of a natural variant of African swine fever virus in China[J]. Chinese Journal of Veterinary Science, 2021, 41(2): 199-207. (in Chinese) |
| [16] |
BELTRÁN-ALCRUDO D, KRAMER S A, KRAMER C, et al. African swine fever: detection and diagnosis[R]. Rome: FAO, 2017.
|
| [17] |
SÁNCHEZ-VIZCAÍNO J M, MUR L, GÓMEZ-VILLAMANDOS J C, et al. An update on the epidemiology and pathology of African swine fever[J]. J Comp Pathol, 2015, 152(1): 9-21. DOI:10.1016/j.jcpa.2014.09.003 |
| [18] |
杨文兵, 邹亚文, 蒋一凡, 等. 非洲猪瘟血清学诊断靶点的研究进展[J]. 畜牧兽医学报, 2021, 52(5): 1208-1217. YANG W B, ZOU Y W, JIANG Y F, et al. Advances research on African swine fever serological diagnostic targets[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(5): 1208-1217. (in Chinese) |
| [19] |
吴竞, 王西西, 吴映彤, 等. 非洲猪瘟病毒p30基因的原核表达及间接ELISA抗体检测方法的建立[J]. 中国畜牧兽医, 2018, 45(12): 3555-3562. WU J, WANG X X, WU Y T, et al. Prokaryotic expression of p30 gene of African swine fever virus and establishment of Indirect ELISA antibody detection method[J]. China Animal Husbandry & Veterinary Medicine, 2018, 45(12): 3555-3562. (in Chinese) |
| [20] |
靳雯雯, 杨俊兴, 花群俊, 等. 非洲猪瘟病毒抗体检测间接ELISA方法的建立[J]. 中国兽医学报, 2014, 34(7): 1043-1046. JIN W W, YANG J X, HUA Q J, et al. Development of an indirect enzyme-linked immunosorbent assay for detection antibody against African swine fever virus[J]. Chinese Journal of Veterinary Science, 2014, 34(7): 1043-1046. (in Chinese) |
| [21] |
庚辛, 孙明霞, 王淑杰, 等. 非洲猪瘟病毒p72蛋白间接ELISA抗体检测方法的建立[J]. 中国预防兽医学报, 2021, 43(9): 946-951. GENG X, SUN M X, WANG S J, et al. Prokaryotic expression of African swine fever p72 protein and development of indirect ELISA method[J]. Chinese Journal of Preventive Veterinary Medicine, 2021, 43(9): 946-951. (in Chinese) |
| [22] |
施磊, 田占成, 杨吉飞, 等. 非洲猪瘟病毒p35蛋白作为诊断抗原的抗原性比较[J]. 生物工程学报, 2021, 37(1): 187-195. SHI L, TIAN Z C, YANG J F, et al. Comparison of the antigenicity of African swine fever virus p35 protein as diagnostic antigen[J]. Chinese Journal of Biotechnology, 2021, 37(1): 187-195. (in Chinese) |
| [23] |
邬旭龙, 彭彬, 姜睿姣, 等. 以原核表达的非洲猪瘟病毒pK205R蛋白为包被抗原的间接ELISA抗体检测方法的建立[J]. 中国预防兽医学报, 2016, 38(10): 800-803. WU X L, PENG B, JIANG R J, et al. Development of an indirect ELISA for detection of antibody against African swine fever virus (ASFV) with prokaryotic expressed ASFV pK205R protein as the coating antigen[J]. Chinese Journal of Preventive Veterinary Medicine, 2016, 38(10): 800-803. (in Chinese) |
| [24] |
周晓慧, 肖景景, 张鑫宇, 等. 非洲猪瘟病毒强免疫原性重组CD2v抗原的制备与初步应用[J]. 畜牧兽医学报, 2020, 51(10): 2472-2480. ZHOU X H, XIAO J J, ZHANG X Y, et al. Preparation and preliminary application of highly immunogenic recombinant CD2v antigen of African swine fever virus[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(10): 2472-2480. (in Chinese) |
| [25] |
BLOME S, FRANZKE K, BEER M. African swine fever-a review of current knowledge[J]. Virus Res, 2020, 287: 198099. |
| [26] |
DAN L, LIU Y G, QI X L, et al. African swine fever virus MGF-110-9L-deficient Mutant has attenuated virulence in pigs[J]. Virol Sin, 2021, 36(2): 187-195. |
| [27] |
ASAMBE A, SACKEY A K B, TEKDEK L B. Prevalence of African swine fever virus and classical swine fever virus antibodies in pigs in Benue State, Nigeria[J]. Trop Anim Health Prod, 2018, 50(3): 689-692. |
| [28] |
GÓMEZ-PUERTAS P, RODRÍGUEZ F, OVIEDO J M, et al. The African Swine Fever Virus Proteins p54 and p30 are involved in two distinct steps of virus attachment and both contribute to the antibody-mediated protective immune response[J]. Virology, 1998, 243(2): 461-471. |
| [29] |
JIA N, OU Y W, PEJSAK Z, et al. Roles of African swine fever virus structural proteins in viral infection[J]. J Vet Res, 2017, 61(2): 135-143. |
| [30] |
LITHGOW P, TAKAMATSU H, WERLING D, et al. Correlation of cell surface marker expression with African swine fever virus infection[J]. Vet Microbiol, 2014, 168(2-4): 413-419. |
| [31] |
BARDERAS M G, RODRíGUEZ F, GÓMEZ-PUERTAS P, et al. Antigenic and immunogenic properties of a chimera of two immunodominant African swine fever virus proteins[J]. Arch Virol, 2001, 146(9): 1681-1691. |
| [32] |
荣明轩, 徐保娟, 南文龙, 等. 非洲猪瘟病毒抗体间接ELISA检测方法的建立与应用[J]. 中国动物检疫, 2021, 28(5): 109-118. RONG M X, XU B J, NAN W L, et al. Establishment and application of the iELISA for detection of antibodies against ASFV[J]. China Animal Health Inspection, 2021, 28(5): 109-118. (in Chinese) |
(编辑 白永平)



