麻醉剂自1842年就已经开始使用,乙醚最先被用于马和犬的麻醉,之后其他挥发性麻醉剂如氯仿、乙醚和笑气等被逐渐应用于动物麻醉[1]。多年来,人们普遍认为麻醉药没有特定的分子靶标,它们与神经元膜脂相互作用是非特异性的[2-3]。但是,目前的研究认为,麻醉药主要通过与受体蛋白相互作用发挥效应。全身麻醉能改变神经元活动,改变神经递质的基础细胞外活动:受体亲和力,以及递质诱导的突触后反应[4]。理解麻醉剂发挥麻醉作用的机制有助于指导临床正确用药,合理配伍能有效减少麻醉副作用的发生,在临床应用中有非常重要的意义。
根据本课题组先前的研究成果,赛拉嗪作为一种α-2肾上腺素能受体激动剂,对山羊具有较好的麻醉效果,主要通过影响山羊不同脑区ATP酶的活性、NE、DA、Asp、Glu等神经递质的含量发挥中枢麻醉效应[5-7]。但是,有研究报道,α2肾上腺素能受体激动剂单独使用,可引起山羊、绵羊等发生呼吸抑制、高碳酸血症和低氧血症等麻醉副反应[8-9]。咪达唑仑是苯二氮卓类麻醉剂,具有催眠、抗焦虑、肌肉松弛和抗惊厥作用,咪达唑仑单独作用于山羊,能引起山羊大脑、海马等组织中cAMP信号通路、GABA、Asp、Glu、Gly等神经递质的改变[10-11]。目前,赛拉嗪复合咪达唑仑对山羊的麻醉效果及麻醉机制仍然没有相关研究。本试验旨在明确赛拉嗪-咪达唑仑复合制剂对山羊的麻醉效果及发挥麻醉作用的机理,为临床小反刍动物麻醉奠定基础。
1 材料与方法 1.1 动物8月龄(体重范围13~15 kg)健康山羊25只,雌性12只,雄性13只,购自哈尔滨某养殖场。试验前适应性饲养1周,按照翻正反射变化将动物随机分为5组,分别为对照组(肌肉注射生理盐水)、诱导组(翻正反射还未消失)、麻醉组(翻正反射消失)、恢复Ⅰ组(轻微刺激后翻正反射恢复)和恢复Ⅱ组(动物苏醒且恢复运动),每组5只。
1.2 试剂去甲肾上腺素(NE)、多巴胺(DA)、5-羟色胺(5-HT)、5-羟基吲哚乙酸(5-HIAA)标准品购自Sigma公司,NOS、NO、考马斯亮蓝蛋白质含量测定试剂盒购自南京建成生物工程研究所,山羊cGMP测定试剂盒购自R&D systems公司,咪达唑仑及赛拉嗪由东北农业大学动物医学学院临床外科教研室提供。
1.3 行为学观察及样本采集山羊经肌肉注射赛拉嗪-咪达唑仑复合麻醉剂(1.31 mL·kg-1),对照组注射生理盐水,观察麻醉后动物的行为学变化,包括诱导时间(注射麻醉药后到山羊不能站立、倒地不再挣扎的时间)、麻醉维持时间及苏醒时间;评估复合制剂的麻醉效果(镇静、镇痛、肌松)并监测主要的生理参数(心率、血氧饱和度和呼吸频率),麻醉评分标准参照表 1。根据行为学变化分别于诱导期、麻醉期、恢复Ⅰ期和恢复Ⅱ期,山羊经击昏器击昏后断头处死,收集大脑前额叶皮质及海马组织,使用预冷(4 ℃)生理盐水冲洗血迹,之后放入冻存管中液氮冷冻。
|
|
表 1 镇痛、镇静及肌松评分标准 Table 1 Analgesia, sedation and muscle relaxation scoring criteria |
1.4.1 单胺类神经递质的测定 采用高效液相色谱(HPLC-荧光)法检测NE、DA、5-HT及5-HIAA的含量。HPLC条件:Symmetry C18(4.6 mm×150 mm,5 μm)为固定相;去离子水和甲醇(80∶20)为流动相;流速设置为0.6 mL·min-1,进样体积为20 μL;使用Warers2475荧光检测器,波长设置为λEX=280 nm,λEM=330 nm。
1.4.2 氨基酸类神经递质的测定 采用反相高效液相色谱(RP-HPLC)法检测Asp、Glu、Gly及GABA的含量。HPLC条件:流动相液体A和B分别为醋酸钠缓冲液(0.05 mol·L-1,pH=6.6),和乙腈/水(50∶50),流速及进样体积同上,波长为360 nm。
1.5 NO及cGMP含量的测定1.5.1 比色法测定NO含量及NOS活性 按照南京建成生物工程研究所总一氧化氮合成酶(NOS)测试盒提供的说明书操作,测定总NOS;使用考马斯亮蓝法测定蛋白质含量,之后按照说明书加入各试剂后,比色法测定各管的吸光度值并计算NO含量。
1.5.2 ELISA法测定cGMP含量 按照南京建成生物工程研究所试剂盒说明书操作,使用酶标仪测定波长450 nm时的OD值并计算cGMP浓度。
1.6 数据统计及分析结果表示为“均值±标准差(x±s)”,采用SPSS 22.0软件进行单因素方差分析(One-way ANOVA),各组间多重比较使用Student-Newman-Keuls事后检验,P<0.05表示有统计学意义。
2 结果 2.1 赛拉嗪-咪达唑仑合剂对山羊麻醉效果的影响对照组山羊肌肉注射生理盐水后行为无明显变化,赛拉嗪-咪达唑仑复合麻醉剂注射后,山羊逐渐出现反应迟钝及自主活动减少等现象,平稳进入麻醉状态。生物反射监测结果:光反射未消失,眼睑反射消失、角膜反射减弱。麻醉诱导时间(5.63±2.35) min,麻醉维持时间(56.72±5.38)min。如表 2所示,赛拉嗪-咪达唑仑复合麻醉剂在麻醉10~30 min出现心率、血氧饱和度及呼吸频率降低,但是总体影响较小;并且复合制剂具有较好的镇静、镇痛及肌松作用(表 3)。
|
|
表 2 复合麻醉剂对山羊心率、血氧饱和度及呼吸频率的影响(x±s) Table 2 Effect of combined anaesthetic on heart rate, oxygen saturation and respiration rate on goat |
|
|
表 3 复合麻醉剂对山羊镇痛、镇静及肌松效果的影响 Table 3 Effect of combined anaesthetic on analgesia, sedation and muscle relaxation on goat |
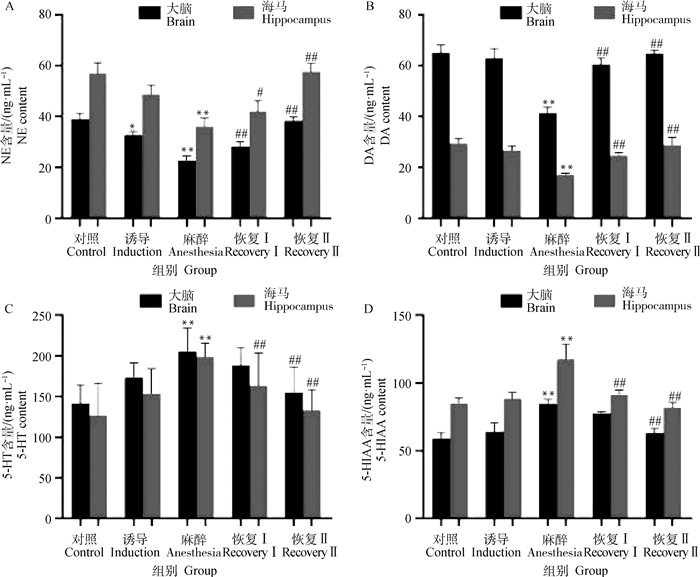
试验结果显示(图 1),肌肉注射赛拉嗪-咪达唑仑合剂后,儿茶酚胺类神经递质NE和DA在大脑和海马组织中呈现先降低后升高的趋势,与对照组相比,麻醉期表达量显著减少(P<0.01),而在恢复Ⅱ期(即苏醒后),含量恢复至正常水平。5-羟色胺类神经递质5-HT和5-HIAA呈现先升高后降低的趋势,麻醉期表达量最高,恢复Ⅱ期下降至正常水平。此外,NE和5-HIAA在大脑中的表达量较海马中更低,而DA和5-HT则相反。
|
A. 去甲肾上腺素;B. 多巴胺;C. 5-羟色胺;D. 5-羟吲哚乙酸。与对照组相比,*.P<0.05,**.P<0.01;与麻醉组相比,#.P<0.05,##.P<0.01;下同 A. Norepinephrine; B. Dopamine; C. Serotonin; D. 5-hydroxyindole acetic acid. Compared with control group, *. P < 0.05, **. P < 0.01; compared with anesthesia group, #. P < 0.5, ##. P < 0.01; the same as below 图 1 复合麻醉剂对单胺类神经递质的影响 Fig. 1 Effect of combined anaesthetic on monoamine neurotransmitter |
Asp和Glu是两种兴奋性氨基酸类神经递质,结果显示(图 2),赛拉嗪-咪达唑仑复合麻醉剂对大脑中Asp和Glu的含量无明显影响(P>0.05),而海马中Asp和Glu呈现先降低后升高的趋势,与对照组相比,麻醉期海马组织中Asp和Glu的含量显著减少(P<0.01),与麻醉期相比,恢复Ⅱ期这两种神经递质含量显著升高并恢复至正常水平。Gly和GABA是两种抑制性氨基酸类神经递质,复合制剂对大脑中Gly的影响呈现先抑制后增加的趋势,而对GABA则表现为先升高后抑制。此外,与对照组相比,复合制剂极显著增加麻醉期海马中Gly的含量(P<0.01),但不影响海马中GABA的表达。

|
A. 天门冬氨酸;B. 谷氨酸;C. 甘氨酸;D. γ-氨基丁酸 A. Aspartic acid; B. Glutamic acid; C. Glycine; D. γ-aminobutyric acid 图 2 复合麻醉剂对氨基酸类神经递质的影响 Fig. 2 Effect of combined anaesthetic on amino acid neurotransmitter |
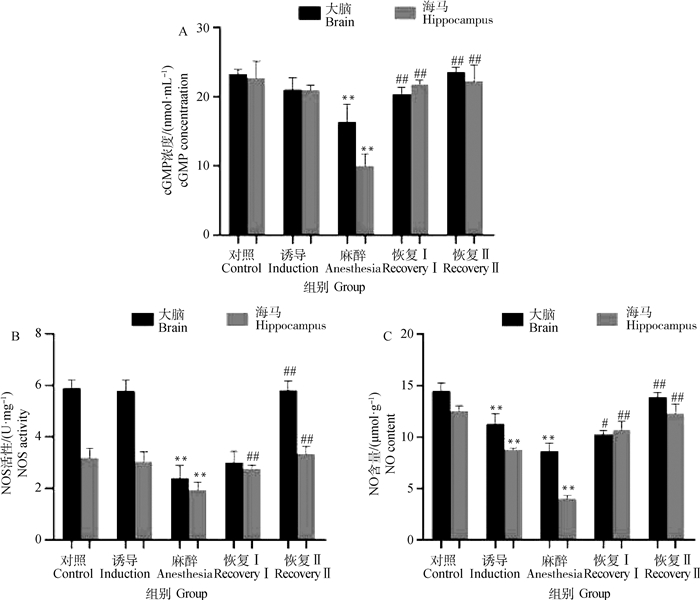
NO/cGMP信号转导系统参与很多全麻药物的中枢麻醉机制,结果(图 3)显示,赛拉嗪-咪达唑仑合剂在麻醉期,对大脑及海马中的NO/cGMP信号具有明显的抑制作用,与对照组相比差异极显著(P<0.01)。而在麻醉恢复期,cGMP、NOS及NO表达均上升至正常水平。
|
A.环磷酸鸟苷;B. 一氧化氮合酶;C. 一氧化氮 A. Cyclic guanosinemonophosphate; B. Nitric oxide synthase; C. Nitric oxide 图 3 复合麻醉剂对氨基酸类神经递质的影响 Fig. 3 Effect of combined anaesthetic on cGMP/NO signal transduction system |
复合麻醉包括化学药物复合麻醉和物理方式与化学药物复合麻醉。先前研究发现,电针复合静松灵[12]或电针复合隆朋[13]对山羊进行麻醉,对生理指标影响较小,麻醉药物用量显著减少。在兽医临床中,由于经济成本及技术操作的限制,小反刍动物通常使用化学药物复合麻醉。赛拉嗪是目前国内外应用最多的小反刍动物麻醉药,具有镇静、镇痛及肌松作用[14-15],但是有报道称,α2肾上腺素能受体激动剂单独使用可引起呼吸抑制,高碳酸血症和显著低氧血症[9, 16]。Mogoa等[17]发现赛拉嗪单独作用于山羊能发挥镇痛、镇静及肌松作用,但是会引起山羊通气率降低以及发生大量流涎;山羊对赛拉嗪敏感,镇痛作用主要与赛拉嗪对自主神经和中枢神经系统的作用有关。本试验将赛拉嗪与咪达唑仑联合使用,发现复合制剂对山羊能提供(56.72±5.38)min的麻醉维持时间,具有良好的镇静、镇痛及肌松作用,并且对心率、血氧饱和度以及呼吸频率影响较小,提示复合麻醉能够减轻赛拉嗪单独应用的副反应。
全身麻醉的作用机制至今还没有形成统一的观点,全麻药物对大脑中的神经递质活动有巨大的影响[18-19],单胺类神经递质可能是全身麻醉作用的重要靶点[20, 21]。本研究使用赛拉嗪-咪达唑仑复合制剂麻醉山羊,麻醉期山羊大脑及海马中DA和NE的水平被明显抑制,这种作用可能主要是赛拉嗪导致的,因为有研究者使用盐酸赛拉嗪麻醉大鼠,发现其大脑中DA和NE的含量显著降低[22]。此外,使用噻环乙胺和小型猪复合麻醉剂(XFM)麻醉大鼠,能显著增加5-HT的含量[23]。本研究使用赛拉嗪-咪达唑仑复合制剂能使山羊大脑及海马中5-HT的含量增加,可能是由于α2受体激动剂与大脑中的5-HT受体相互作用,从而增加了5-HT的含量。
氨基酸类神经递质与学习记忆、神经损伤、认知障碍等过程密切相关[24],海马和前额叶皮层在空间工作记忆和决策中起着至关重要的作用[25]。异氟醚能抑制突触前膜谷氨酸的释放并增加谷氨酸的摄取,使突触间隙谷氨酸水平减少[26],这可能是由于全麻药导致Glu与NMDA受体的结合被抑制,改变了神经元的兴奋性[27]。此外,氯胺酮复合苯巴比妥也被证明能够减少Glu含量,增加GABA含量[28]。本研究的结果与以上研究相一致,复合麻醉剂能降低海马中Glu含量,增加大脑中GABA含量。复合麻醉剂对氨基酸类神经递质的作用可能主要是由于苯二氮卓类药物能与GABAA受体相应位点结合,使受体发生变构,促进GABA与低亲和力的GABA位点结合来增加C1-内流[29]。
NO/cGMP信号转导系统可能与α2肾上腺素能受体有关[30]。大脑皮质、海马和尾状核等部位α2肾上腺素能受体含量较丰富,可乐定和右美托咪啶在一定的剂量范围内,能够引起这些中枢部位cGMP含量降低,且这种效应被育享宾逆转[30]。此外,NO/cGMP信号转导系统被认为与GABA受体相关[31]。GABAA受体与NOS在中枢具有相同的定位,在同一区域共同存在,并且GABAA受体活性能被NO和cGMP抑制,GABAA受体活化也能抑制NO/cGMP信号转导系统[32]。红藻氨酸能诱导小脑cGMP含量增加,而咪达唑仑能抑制这一效应,其潜在机制是通过激活GABAA受体,从而降低NOS活性、NO和cGMP的生成,使cGMP介导的通路被抑制[33]。作者的研究结果表明,赛拉嗪-咪达唑仑合剂可能通过激活GABA,抑制NO/cGMP信号转导系统,从而影响大脑及海马中的神经递质含量。
4 结论赛拉嗪-咪达唑仑复合麻醉剂对山羊生理指标影响较小,具有良好的镇静、镇痛及肌松作用。该复合制剂抑制大脑中NE、DA及Gly含量,增加5-HT、5-HIAA和GABA的含量;减少海马中DA、NE、兴奋性神经递质Asp及Glu含量,增加海马中5-HT、5-HIAA及Gly的含量,并通过抑制两种组织中的NO/cGMP信号转导系统,参与复合麻醉剂的中枢麻醉机理。
| [1] |
SMITHCORS J F. Etherization of animals, by CHARLES T. JACKSON, M. D., of Boston, Mass[J]. Vet Herit, 1993, 16(2): 66-70. |
| [2] |
MILLER K W, PANG K Y Y. General anaesthetics can selectively perturb lipid bilayer membranes[J]. Nature, 1976, 263(5574): 253-255. DOI:10.1038/263253a0 |
| [3] |
RUDOLPH U, ANTKOWIAK B. Molecular and neuronal substrates for general anaesthetics[J]. Nat Rev Neurosci, 2004, 5(9): 709-720. DOI:10.1038/nrn1496 |
| [4] |
MVLLER C P, PUM M E, AMATO D, et al. The in vivo neurochemistry of the brain during general anesthesia[J]. J Neurochem, 2011, 119(3): 419-446. DOI:10.1111/j.1471-4159.2011.07445.x |
| [5] |
贾冰. 山羊复合麻醉剂对山羊中枢NO信号转导通路的影响[D]. 哈尔滨: 东北农业大学, 2011. JIA B. Effects of the goat combined anaesthetic on NO signal transduction pathway in cental nervous system in goats[D]. Harbin: Northeast Agricultural University, 2011. (in Chinese) |
| [6] |
彭立颖. 赛拉嗪复合麻醉剂对山羊氨基酸类神经递质的影响[D]. 哈尔滨: 东北农业大学, 2012. PENG L Y. Effects of the xylazine combined anaesthetic on amino acid neurotransmitter in goats[D]. Harbin: Northeast Agricultural University, 2012. (in Chinese) |
| [7] |
张思学. 赛拉嗪复合麻醉剂对山羊中枢单胺类神经递质的影响[D]. 哈尔滨: 东北农业大学, 2012. ZHANG S X. Effects of the goat combined anaesthetic on the monoamine neurotransmitter in central nervous system in goats[D]. Harbin: Northeast Agricultural University, 2012. (in Chinese) |
| [8] |
CELLY C S, MCDONELL W N, YOUNG S S, et al. The comparative hypoxaemic effect of four α2 adrenoceptor agonists (xylazine, romifidine, detomidine and medetomidine) in sheep[J]. J Vet Pharmacol Ther, 1997, 20(6): 464-471. DOI:10.1046/j.1365-2885.1997.00097.x |
| [9] |
CARROLL G L, HARTSFIELD S M, CHAMPNEY T H, et al. Effect of medetomidine and its antagonism with atipamezole on stress-related hormones, metabolites, physiologic responses, sedation, and mechanical threshold in goats[J]. Vet Anaesth Analg, 2005, 32(3): 147-157. DOI:10.1111/j.1467-2995.2005.00187.x |
| [10] |
高利, 郭岑, 李欣然, 等. 咪达唑仑对山羊不同脑区单胺类神经递质影响的研究[J]. 中国兽医杂志, 2017, 53(10): 102-106. GAO L, GUO C, LI X R, et al. Effects of midazolam on monoamine neurotransmitters in different encephalic regions of goats[J]. Chinese Journal of Veterinary Medicine, 2017, 53(10): 102-106. (in Chinese) |
| [11] |
郭岑, 郑宇, 魏成威, 等. 咪达唑仑对山羊不同脑区cAMP含量的影响[J]. 中国兽医杂志, 2016, 52(11): 115-117. GUO C, ZHENG Y, WEI C W, et al. Effect of midazolam on cAMP content in different encephalic regions of goats[J]. Chinese Journal of Veterinary Medicine, 2016, 52(11): 115-117. (in Chinese) |
| [12] |
王贵波, 丁明星, 郭妮妮, 等. 电针复合静松灵麻醉对山羊痛阈及生理生化的影响[J]. 中国农业科学, 2010, 43(5): 1066-1074. WANG G B, DING M X, GUO N N, et al. Effects of electroacupuncture anesthesia combined with xylidinothiazoline on pain threshold and physiological and biochemical indexes in goats[J]. Scientia Agricultura Sinica, 2010, 43(5): 1066-1074. DOI:10.3864/j.issn.0578-1752.2010.05.023 (in Chinese) |
| [13] |
周治瑜, 李育林, 宋国亮. 电针复合隆朋对山羊麻醉效果观察[C]//全国兽医外科学第13次学术研讨会、小动物医学第1次学术研讨会暨奶牛疾病第3次学术讨论会论文集. 武汉: 中国畜牧兽医学会, 2006. ZHOU Z Y, LI Y L, SONG G L. Observation of anesthesia effect of electroacupuncture combined with xylazine on goats[C]//National Symposium of Veterinary Surgery, Symposium of Small Animal Medicine and Symposium of Dairy Cow Diseases. Wuhan: Chinese Society of Animal Husbandry and Veterinary Medicine, 2006. (in Chinese) |
| [14] |
GREENE S A, THURMON J C. Xylazine - a review of its pharmacology and use in veterinary medicine[J]. J Vet Pharmacol Ther, 1988, 11(4): 295-313. DOI:10.1111/j.1365-2885.1988.tb00189.x |
| [15] |
DEROSSI R, JUNQUEIRA A L, BERETTA M P. Analgesic and systemic effects of ketamine, xylazine, and lidocaine after subarachnoid administration in goats[J]. Am J Vet Res, 2003, 64(1): 51-56. DOI:10.2460/ajvr.2003.64.51 |
| [16] |
KÄSTNER S B R. A2-agonists in sheep: a review[J]. Vet Anaesth Analg, 2006, 33(2): 79-96. DOI:10.1111/j.1467-2995.2005.00243.x |
| [17] |
MOGOA E G, STEGMANN G F, GUTHRIE A J, et al. Clinical, cardiopulmonary and haemocytological effects of xylazine in goats after acute exposure to different environmental temperature and humidity conditions[J]. J South Afr Vet Assoc, 2000, 71(3): 153-159. DOI:10.4102/jsava.v71i3.705 |
| [18] |
LEUNG L S, PETROPOULOS S, SHEN B X, et al. Lesion of cholinergic neurons in nucleus basalis enhances response to general anesthetics[J]. Exp Neurol, 2011, 228(2): 259-269. DOI:10.1016/j.expneurol.2011.01.019 |
| [19] |
MVLLER C P, PUM M E, AMATO D, et al. The in vivo neurochemistry of the brain during general anesthesia[J]. J Neurochem, 2011, 119(3): 419-446. DOI:10.1111/j.1471-4159.2011.07445.x |
| [20] |
ROIZEN M F, WHITE P F, EGER E I, et al. Effects of ablation of serotonin or norepinephrine brain-stem areas on halothane and cyclopropane MACs in rats[J]. Anesthesiology, 1978, 49(4): 252-255. DOI:10.1097/00000542-197810000-00005 |
| [21] |
ANGEL A. Central neuronal pathways and the process of Anaesthesia[J]. Br J Anaesth, 1993, 71(1): 148-163. DOI:10.1093/bja/71.1.148 |
| [22] |
哈达, 戴波涛, 董慧, 等. 隆朋麻醉及其手术下对犬儿茶酚胺的影响[J]. 中国兽医杂志, 2010, 46(6): 34-35. HA D, DAI B T, DONG H, et al. Effect of Rompun anesthesia and surgical on catecholamines in dogs[J]. Chinese Journal of Veterinary Medicine, 2010, 46(6): 34-35. DOI:10.3969/j.issn.0529-6005.2010.06.012 (in Chinese) |
| [23] |
张燕, 王洪斌, 范宏刚. 噻环乙胺及小型猪复合麻醉剂(XFM)对大鼠不同脑区单胺类神经递质的影响[J]. 中国兽医科学, 2010, 40(1): 93-97. ZHANG Y, WANG H B, FAN H G. Effects of tiletamine and its compound preparation (XFM) on monoamine neurotransmitter contents in different encephalic regions of rat[J]. Chinese Veterinary Science, 2010, 40(1): 93-97. (in Chinese) |
| [24] |
ZHANG H N, ZHENG H. Effect of chronic stress on long-term potentiation of hippocampus and neurotransmitter of amino acid in rats[J]. Chin J Clin Rehabil, 2006, 10(6): 176-178. |
| [25] |
MARTÍNEZ M A, ARES I, RODRÍGUEZ J L, et al. Neurotransmitter changes in rat brain regions following glyphosate exposure[J]. Environ Res, 2018, 161: 212-219. DOI:10.1016/j.envres.2017.10.051 |
| [26] |
LARSEN M, HEGSTAD E, BERG-JOHNSEN J, et al. Isoflurane increases the uptake of glutamate in synaptosomes from rat cerebral cortex[J]. Br J Anaesth, 1997, 78(1): 55-59. DOI:10.1093/bja/78.1.55 |
| [27] |
疏树华, 潘建辉, 方才. 谷氨酸及N-甲基-D-门冬氨酸受体与全身麻醉药[J]. 中国临床保健杂志, 2007, 10(6): 652-654. SHU S H, PAN J H, FANG C. Glutamic acid and N-methyl-D-aspartate receptor and general anesthetics[J]. Chinese Journal of Clinical Healthcare, 2007, 10(6): 652-654. DOI:10.3969/j.issn.1672-6790.2007.06.041 (in Chinese) |
| [28] |
SURIA A, RASHEED F. Evidence for involvement of amino acid neurotransmitters in anesthesia and naloxone induced reversal of respiratory paralysis[J]. Life Sci, 1994, 54(25): 2021-2033. DOI:10.1016/0024-3205(94)90137-6 |
| [29] |
夏梦, 于布为. 作用于GABA-R的静脉麻醉药(异丙酚与咪唑安定)之间相互作用的研究进展[J]. 国外医学国际麻醉学与复苏分册, 2003, 24(4): 231-234. XIA M, YU B W. Research progress on the interaction between intravenous anesthetics (propofol and midazolam) acting on GABA-R[J]. International Journal of Anesthesiology and Resuscitation, 2003, 24(4): 231-234. (in Chinese) |
| [30] |
VULLIEMOZ Y, SHEN H, VIRAG L. Alpha-2 adrenoceptor agonists decrease cyclic Guanosine 3', 5'-monophosphate in the mouse brain[J]. Anesthesiology, 1996, 85(3): 544-550. DOI:10.1097/00000542-199609000-00013 |
| [31] |
WEXLER E M, STANTON P K, NAWY S. Nitric oxide depresses GABAA receptor function via coactivation of cGMP-dependent kinase and phosphodiesterase[J]. J Neurosci, 1998, 18(7): 2342-2349. DOI:10.1523/JNEUROSCI.18-07-02342.1998 |
| [32] |
CASTEL H, VAUDRY H. Nitric oxide directly activates GABAA receptor function through a cGMP/protein kinase-independent pathway in frog pituitary melanotrophs[J]. J Neuroendocrinol, 2001, 13(8): 695-705. DOI:10.1046/j.1365-2826.2001.00683.x |
| [33] |
MIYAWAKI I, NAKAMURA K, YOKUBOL B, et al. Suppression of cyclic guanosine monophosphate formation in rat cerebellar slices by propofol, ketamine and midazolam[J]. Can J Anaesth, 1997, 44(12): 1301-1307. DOI:10.1007/BF03012780 |
(编辑 白永平)



