2. 西南民族大学教学动物医院,成都 610041
2. Veterinary Teaching Hospital, Southwest Minzu University, Chengdu 610041, China
乳腺肿瘤为母犬最常见的肿瘤疾病之一,其恶性特征和不良预后与炎症信号分子的关系紧密[1]。在乳腺肿瘤发生的过程中,炎症相关免疫细胞(如巨噬细胞)可通过释放和激活炎症信号相关因子促进乳腺组织发生恶变[2],而这已成为目前临床抗肿瘤治疗的研究靶点之一[3]。随着研究的深入,一些新的炎症信号因子被聚焦,而核苷酸结合寡聚化结构域样受体3(NLRP3)炎症小体是近年来炎性疾病和肿瘤医学研究的热点之一,活化后的NLRP3炎症小体通过控制多级促炎性细胞因子(Caspase-1、IL-1β和IL-18)的成熟与分泌来调节肿瘤微环境,诱导组织细胞的DNA氧化损伤并发生失控性增殖,促进肿瘤的形成和发展[4]。由于犬乳腺肿瘤临床特征的多样性以及疾病背景的差异化,NLRP3炎症小体作为诊断标记的临床研究数据仍然缺乏。因此,本研究将采用RT-qPCR检测结合组织病理学评价的方法,分析NLRP3炎症小体及下游炎症因子的表达模式以及与犬乳腺肿瘤临床病理学特征的关系,为其作为潜在的分子诊断靶标提供基础数据。
1 材料与方法 1.1 样本资料45份犬乳腺肿瘤样本采自2018年11月—2020年1月在西南民族大学教学动物医院接受肿瘤切除术的患犬。同时,另取16份不重复的肿瘤旁正常乳腺组织作为对照。所有犬在手术前均接受胸部X线检查(排除可见的肺部转移灶)、腹部超声检查(检查是否有腹内转移灶)及相关术前评估。同时,登记患犬和肿瘤的信息,并在术后连续回访12个月,记录病例的预后情况。无菌采集患犬的乳腺肿瘤组织及部分肿瘤旁正常乳腺组织(辨别标准:眼观无异常形态变化,组织病理学显示为正常的乳腺组织结构),将样本无菌剪切为约0.5 cm3大小的组织块,并用4%多聚甲醛固定后,进行石蜡包埋和组织切片的制作。另外从同一病例中另取约0.3 cm3的组织样本,经液氮速冻后,放入冻存管中,于-80 ℃冰箱保存备用。
1.2 主要试剂和仪器Trizol试剂、TB GreenTM Premix Ex TaqTM Ⅱ、PrimeScriptTM first Strand cDNA合成试剂盒、DNA聚合酶、pMD19-T克隆载体、DH5ɑ感受态细胞等购自宝生物工程(大连)有限公司;PCR产物纯化和质粒提取试剂盒购自美国OMEGA公司;石蜡、二甲苯、乙醇、苏木素、伊红染液、4%多聚甲醛及中性树胶等均为国产试剂;QuantStudio 3荧光定量PCR仪购自美国ABI。
1.3 病理组织切片制备和评价将固定完成的组织样本修整后,用PBS彻底浸洗,然后经梯度浓度乙醇脱水后,置入系列二甲苯中透明。将透明好的组织块充分浸蜡,而后包埋置于室温冷却。将获得的组织蜡块上机连续切片(厚度为4 μm),并按照HE染色方法进行染片和用中性树胶封片,于显微镜下观察。根据Goldschmidt等[5]推荐的分类标准对犬乳腺肿瘤进行组织分型和恶性分级。
1.4 RNA提取和RT-qPCR反应采用Trizol法提取组织中的RNA,按照试剂盒操作说明反转录为cDNA,于-80 ℃保存备用。根据GenBank收录的基因序列,利用Primer premier 6.0软件设计RT-qPCR基因检测的特异性引物序列,并送生工生物工程(上海)股份有限公司合成。NLRP3(XM_00843 284.2),上游引物:5′-GCAACAGTGTGAGGTGAGGCTAC-3′,下游引物:5′-TGCAATGCTCTTGGAGACACAGG-3′,产物长度为114 bp;Caspase-1(NM_001003125.1),上游引物:5′-TCCTTCTAGGTGACAGCACCA-3′,下游引物:5′-TTCTGCTCCTCAACCCCACA-3′,产物长度为117 bp;IL-1β (NM_001037971.1),上游引物:5′-CTCCAGGAGGATGACCTGAAGAGC-3′,下游引物:5′-TGTAACTTGCAGTCCACCGATTGC-3′,产物长度为125 bp;IL-18 (XM_005619483.1),上游引物:5′-TGGCCTGGAACACTTCTCTGA-3′,下游引物:5′-AGCCTCACTAGAGGTCTGGC-3′,产物长度为164 bp;以β-actin(XM_025468289.1)为内参基因,上游引物:5′-GCTACAGCTTCACCACCACTGC-3′,下游引物:5′-GCCATCTCTTGCTCGAAGTCCAG-3′,产物长度为94 bp。将扩增得到特异性产物经琼脂糖凝胶电泳和测序验证后,克隆转化和构建质粒标准品,将cDNA经梯度稀释后进行RT-qPCR扩增,并根据结果绘制标准曲线和熔解曲线。RT-qPCR反应体系为TB GreenTM Premix Ex TaqTMⅡ 10 μL,上下游引物各0.5 μL,cDNA 2 μL,最后用ddH2O补足至20 μL。反应条件为95 ℃预变性10 min,95 ℃变性2 min:以优化后的退火温度延伸30 s,反应结束后温度降到60 ℃再以0.15 ℃·s-1升温至95 ℃,共40个循环。采用2—ΔΔCt法,以肿瘤旁正常乳腺(ANMGs)为对照,对良性肿瘤(BCMTs)和恶性肿瘤(MCMTs)目标基因的相对表达量进行计算。
1.5 统计学分析应用SPSS 19.0软件对结果进行统计学分析,数据以“x±s”表示。组间比较采用单因素方差分析和t检验,计数数据采用Fisher或χ2检验分析目标基因表达量与临床病理学特征的关系。采用Graphpad prism 8.0绘制图柱,P<0.05表示差异显著,P<0.001表示差异极显著。
2 结果 2.1 组织病理学分型和分级结果对收集的45份犬乳腺肿瘤样本进行组织病理学分类,其中15例为良性肿瘤(CBMTs),30例为恶性肿瘤(CMMTs)。良性肿瘤包括复合型腺瘤6例、导管型腺瘤4例、肌上皮瘤4例、简单型腺瘤1例;恶性肿瘤包括恶性肌上皮瘤10例、混合性癌6例、实体瘤5例、炎性癌3例、富脂癌2例、管状癌1例、导管乳头状癌1例、微乳头侵润性癌1例和未分化癌1例。恶性肿瘤中,6例为恶性一级(占比20%),12例为恶性二级(占比40%),12例为恶性三级(占比40%)(图 1)。

|
A. 肿瘤旁正常乳腺:小叶增生(小叶内腺管增多);B. 良性腺瘤(腺管内有分界明显的立方或柱状上皮细胞增殖,细胞分化良好);C. 混合性癌(恶性一级)(恶性上皮细胞在乳腺腺管的原位增殖,梭形细胞散在分布于黏液样基质内);D. 实体瘤(恶性二级)(细胞核深染、细胞质少,细胞呈实心样紧密排列呈无腺管结构的小叶外观);E. 炎性癌(恶性三级)(皮肤淋巴管内有大量的侵润性肿瘤细胞);F. 恶性肌上皮瘤(恶性三级)(无腺管结构,大量卵圆形或梭形肌上皮细胞增殖,细胞间有黏液样基质散在分布) A. Normal mammary gland: lobular hyperplasia (increased glandular ducts in lobules); B. Benign adenoma (Cuboidal or columnar epithelial cells with obvious boundary proliferated and differentiated well in the glandular duct); C. Mixed carcinoma (malignant grade I) (malignant epithelial cells proliferate in situ in breast gland tube, spindle cells are scattered in mucoid matrix); D. Solid tumor (malignant grade Ⅱ) (deep stained nucleus, few cytoplasm, solid cells closely arranged, and lobular appearance without glandular tube structure); E. Inflammatory carcinoma (malignant grade Ⅲ) (there are a large number of invasive tumor cells in skin lymphatic vessels); F. Malignant myoepithelioma (malignant grade Ⅲ) (no glandular tube structure, a large number of oval or spindle myoepithelial cells proliferate, and mucinous matrix is scattered among cells) 图 1 犬乳腺组织和乳腺肿瘤组织的病理学检查结果 Fig. 1 Histopathological findings of canine mammary gland and mammary tumor tissues |
目标基因和内参基因的凝胶电泳图结果显示,在预期大小位置获得清晰的单一扩增条带(图 2),经测序验证均为目标基因序列。各目标基因扩增曲线的相关系数(R2)均大于0.989,标准曲线可信度高,扩增效率相近。所有基因扩增的熔解曲线均为单峰,产物特异性高。
|
A. NLRP3;B. Caspase-1;C. IL-1β;D. IL-18;E. β-actin;M. DNA相对分子质量标准;—.阴性对照 A. NLRP3; B. Caspase-1; C. IL-1β; D. IL-18; E. β-actin; M. DNA relative molecular mass; —. Negative control 图 2 NLRP3炎症小体相关炎症因子和β-actin基因PCR扩增产物的凝胶电泳结果 Fig. 2 PCR products of NLRP3 inflammasome associated downstream inflammatory genes and β-actin |
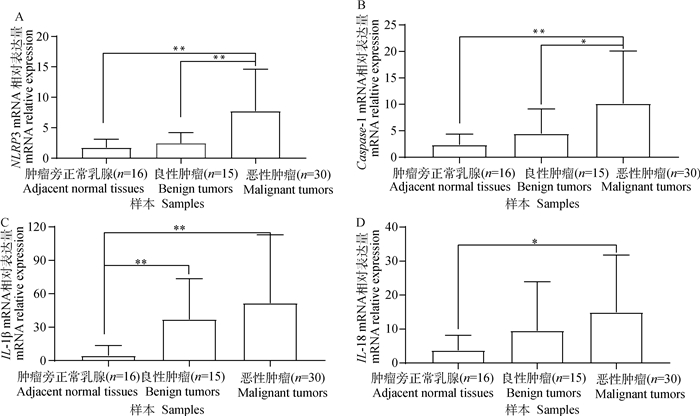
与对照组(肿瘤旁正常乳腺,ANMGs)相比,良性乳腺肿瘤和恶性乳腺肿瘤组织中的NLRP3炎症小体及下游炎症因子的相对转录量均存在不同程度的差异(图 3)。其中,恶性肿瘤的NLRP3转录量要显著高于对照组和良性肿瘤组[ANMGs(1.719±1.398) vs CBMTs(2.448±1.737) vs CMMTs(7.747±6.881)](P值分别为0.001和0.006),而Caspase-1[ANMGs(2.353±2.005) vs CBMTs(4.467±4.646) vs CMMTs(10.150±9.931)](P值分别为0.001和0.048)在组间的表达结果与NLRP3的一致。恶性肿瘤和良性肿瘤的IL-1β表达量要显著高于对照组[ANMGs(4.415±9.086) vs CBMTs(36.91±36.67) vs CMMTs(51.65±61.32)](P值分别为0.004和0.002),而IL-18的转录量仅在恶性肿瘤和对照组中存在显著差异[ANMGs(3.734±4.444) vs CBMTs (9.529 ±14.420) vs CMMTs (14.950±16.850)](P值为0.013)。在30例恶性肿瘤组织中,仅Ⅲ级的NLRP3的转录量显著高于Ⅰ级和Ⅱ级的表达量[Grade Ⅰ(3.079± 2.100)vs Grade Ⅱ (5.705±6.313) vs Grade Ⅲ (11.930 ± 6.852)](P值分别为0.008和0.030),其他因子在各组间均无差异(图 4)。
|
A. NLRP3; B. Caspase-1; C. IL-1β; D. IL-18. *.P < 0.05;**.P < 0.01 图 3 肿瘤旁正常乳腺、良性和恶性犬乳腺肿瘤中NLRP3炎症小体及下游炎症因子的转录差异 Fig. 3 Comparison of relative transcription of NLRP3 inflammasome and downstream inflammatory genes among ANMGs, CBMTs and CMMTs |

|
*.P < 0.05 图 4 NLRP3炎症小体信号相关因子在不同恶性等级犬乳腺肿瘤中的转录差异 Fig. 4 Comparison of relative transcription of NLRP3 inflammasome and downstream inflammatory genes among CMMTs in different malignant subgroups |
以CMMTs中NLRP3相对表达量的中位数作为分界点将其分为高表达和低表达组,统计分析结果显示,NLRP3的转录表达与肿瘤类型(P=0.029)和恶性等级(P=0.049)关系紧密,而与肿瘤大小和手术预后指标无统计学关系,见表 1。
|
|
表 1 NLRP3的相对转录量与犬恶性乳腺肿瘤的临床病理学特征关系 Table 1 Relationship between relative transcription of NLRP3 and clinicopathological features of CMMTs |
NLRP3炎症小体作为肿瘤组织微环境稳态和炎症反应的关键调控因子,其在肿瘤发展过程中的异常激活可促成炎症反应的级联放大,并进一步引起肿瘤细胞的失控性增殖和转移[3]。本研究首次对犬乳腺肿瘤中的NLRP3炎症小体及下游炎症因子的表达模式与肿瘤的临床病理学特征关系进行了分析,明确了上述因子在组织肿瘤化和肿瘤恶变时表达出现不同程度的上调,与部分人类肿瘤的相关研究结果一致[6-7],表明NLRP3炎症小体及相关炎症因子的表达失调是犬乳腺肿瘤发生发展的风险因素。NLRP3和Caspase-1在肿瘤旁正常乳腺组织、良性肿瘤和恶性肿瘤中呈现递增式表达上调,说明这些炎症因子可能参与促进了乳腺组织肿瘤化和恶变过程。此外,下游的IL-1β和IL-18的表达并未出现一致的变化趋势,这可能与肿瘤中的炎症反应存在多重调控通路有关[4]。He等[8]在人宫颈癌细胞中发现TLR4-NF-κB和NLRP3炎症小体信号通路均可介导LPS诱导的IL-1β激活,而Ranson等[9]也证实NLRP3依赖性和非依赖性激活的IL-1β均可促进活动性结肠炎的发病进程。此外,肿瘤相关巨噬细胞和成纤维细胞中的NLRP3炎症小体也可诱导IL-1β和IL-18可通过旁分泌或自分泌的方式促进肿瘤的增殖和转移[10-12],综合这些结果反映出NLRP3炎症小体及下游炎症因子可通过肿瘤微环境中的多信号轴交联来介导的肿瘤发生和发展。
根据Wang等[7]报道,NLRP3炎症小体可促进人口腔鳞状上皮癌的生长和转移,而另一份对人肝癌的临床调查结果却发现肝癌组织中的NLRP3炎症小体表达出现下调,且与临床分期和病理分级呈负相关[13],这些不一致的结果提示,NLRP3炎症小体在不同肿瘤疾病中可能发挥促进或抑制肿瘤发生的作用[14-15]。本研究中,混合性癌和实体癌的NLRP3炎症小体显著高表达,而其他类型的肿瘤中则多呈现低表达,提示NLRP3在不同类型的乳腺肿瘤发展进程中的生物学作用也并不一致。因此,有必要进一步研究NLRP3炎症小体表达与肿瘤疾病背景的关系。此外,NLRP3炎症小体在高恶性等级乳腺肿瘤中的表达显著上调,说明了NLRP3炎症小体的高表达可促成肿瘤的进一步恶变。综上可知,NLRP3炎症小体与犬乳腺肿瘤的发生发展关系紧密,可作为该类疾病临床评估和预后的重要指标之一。
4 结论NLRP3炎症小体的表达上调可能导致犬乳腺组织发生肿瘤化和肿瘤恶变,是疾病诊断和恶性特征评估的重要指标之一。
| [1] |
MILLANTA F, ASPRONI P, CANALE A, et al. COX-2, mPGES-1 and EP2 receptor immunohistochemical expression in canine and feline malignant mammary tumours[J]. Vet Comparat Oncol, 2016, 14(3): 270-280. DOI:10.1111/vco.12096 |
| [2] |
MONTEIRO L N, DOS REIS D C, SALGADO B S, et al. Clinical significance and prognostic role of tumor-associated macrophages infiltration according to histologic location in canine mammary carcinomas[J]. Res Vet Sci, 2021, 135: 329-334. DOI:10.1016/j.rvsc.2020.10.010 |
| [3] |
DE M SOUZA C H, TOLEDO-PIZA E, AMORIN R, et al. Inflammatory mammary carcinoma in 12 dogs: Clinical features, cyclooxygenase-2 expression, and response to piroxicam treatment[J]. Can Vet J, 2009, 50(5): 506-510. |
| [4] |
FARIA S S, COSTANTINI S, DE LIMA V C C, et al. NLRP3 inflammasome-mediated cytokine production and pyroptosis cell death in breast cancer[J]. J Biomed Sci, 2021, 28(1): 26. DOI:10.1186/s12929-021-00724-8 |
| [5] |
GOLDSCHMIDT M, PEÑA L, RASOTTO R, et al. Classification and grading of canine mammary tumors[J]. Vet Pathol, 2011, 48(1): 117-131. DOI:10.1177/0300985810393258 |
| [6] |
YIN X F, ZHANG Q, CHEN Z Y, et al. NLRP3 in human glioma is correlated with increased WHO grade, and regulates cellular proliferation, apoptosis and metastasis via epithelial-mesenchymal transition and the PTEN/AKT signaling pathway[J]. Int J Oncol, 2018, 53(3): 973-986. |
| [7] |
WANG H, LUO Q Q, FENG X D, et al. NLRP3 promotes tumor growth and metastasis in human oral squamous cell carcinoma[J]. BMC Cancer, 2018, 18(1): 500. DOI:10.1186/s12885-018-4403-9 |
| [8] |
HE A Q, SHAO J, ZHANG Y, et al. CD200Fc reduces LPS-induced IL-1β activation in human cervical cancer cells by modulating TLR4-NF-κB and NLRP3 inflammasome pathway[J]. Oncotarget, 2017, 8(20): 33214-33224. DOI:10.18632/oncotarget.16596 |
| [9] |
RANSON N, VELDHUIS M, MITCHELL B, et al. NLRP3-dependent and -independent processing of interleukin (IL)-1β in active ulcerative colitis[J]. Int J Mol Sci, 2019, 20(1): 57. |
| [10] |
WEICHAND B, POPP R, DZIUMBLA S, et al. S1PR1 on tumor-associated macrophages promotes lymphangiogenesis and metastasis via NLRP3/IL-1β[J]. J Exp Med, 2017, 214(9): 2695-2713. DOI:10.1084/jem.20160392 |
| [11] |
ERSHAID N, SHARON Y, DORON H, et al. NLRP3 inflammasome in fibroblasts links tissue damage with inflammation in breast cancer progression and metastasis[J]. Nat Commun, 2019, 10(1): 4375. DOI:10.1038/s41467-019-12370-8 |
| [12] |
WANG Y H, ZHANG H N, XU Y J, et al. NLRP3 induces the autocrine secretion of IL-1β to promote epithelial-mesenchymal transition and metastasis in breast cancer[J]. Biochem Biophys Res Commun, 2021, 560: 72-79. DOI:10.1016/j.bbrc.2021.04.122 |
| [13] |
WEI Q, MU K, LI T, et al. Deregulation of the NLRP3 inflammasome in hepatic parenchymal cells during liver cancer progression[J]. Lab Investigat, 2014, 94(1): 52-62. DOI:10.1038/labinvest.2013.126 |
| [14] |
HUANG Z, CHEN H, WANG S L, et al. NLRP3 overexpression associated with poor prognosis and presented as an effective therapeutic target in osteosarcoma[J]. Front Pharmacol, 2021, 12: 724923. DOI:10.3389/fphar.2021.724923 |
| [15] |
LU F, ZHAO Y A, PANG Y H, et al. NLRP3 inflammasome upregulates PD-L1 expression and contributes to immune suppression in lymphoma[J]. Cancer Lett, 497: 178-189. DOI:10.1016/j.canlet.2020.10.024 |
(编辑 白永平)



