2. 武汉科缘生物发展有限责任公司,武汉 430206
2. Wuhan Keyuan Biological Development Co. Ltd., Wuhan 430206, China
球虫病是由艾美耳球虫感染引起的鸡肠道重要寄生虫病,目前公认有7种艾美耳球虫可以引起鸡球虫病,其中柔嫩艾美耳球虫(Eimeria tenella)寄生于盲肠,是危害最为严重的一种[1]。E. tenella感染会降低肉鸡生长性能、引起出血性腹泻、降低机体对其他病原体的抵抗力[2],发病率高达70%,死亡率为30%,严重时可达80%,给世界养禽业造成巨大经济损失[3]。随着化学药物的不断使用,耐药性问题愈发严重,人们对绿色健康食品的迫切需求使球虫病的防控面临新的挑战,因此,家禽养殖业亟需一种安全有效的新型抗球虫方法。
屎肠球菌是从健康动物和人体发现的一种产乳酸的革兰阳性菌,属于乳酸菌,是一种对动物健康有益的益生菌,于1989年被美国食品药品监督管理局(FDA)批准为可直接进行饲喂的益生菌,我国于1999年确定屎肠球菌可以添加于动物饲料中[4]。作为益生菌,屎肠球菌可以促进肉鸡生长性能、改善肠道形态、调节肠道微生物组成[5]。近年来的研究显示,屎肠球菌可以通过调节免疫反应、维持肠道完整性来促进感染大肠杆菌肉鸡的生长并降低死亡率[6],还有研究表明,屎肠球菌、动物双歧杆菌和唾液乳杆菌的混合添加可以产生与拉沙里菌素相似的抗混合球虫的效果[7]。但是目前缺乏关于屎肠球菌单独添加在球虫病感染中的研究,因此,本研究在饲粮中添加不同水平的屎肠球菌,通过分析鸡的日增重、球虫卵囊排出量、肠道损伤和病理变化、盲肠肠道iNOS和屏障蛋白相关基因的表达量来探究屎肠球菌对感染E. tenella肉鸡的有益作用,以期为鸡球虫病的防治提供思路。
1 材料与方法 1.1 试验动物和菌种制备1日龄罗斯308白羽肉鸡,购自河南省丰园禽业有限公司。饲养于甲醛熏蒸消毒的无球虫房间(笼养),鸡笼经火焰灼烧灭菌。试验用屎肠球菌(EF1)由武汉科缘生物发展有限责任公司保存;盐霉素购自大连荣海生物科技有限公司。
1.2 试验设计采用单因素试验设计,选取体重相近、健康状况良好的1日龄白羽肉鸡180羽,随机分为5组,包括空白对照组(NC组)、阳性对照组(PC组)、抗生素组(SAL组)和两个试验组(EA、EB组),每组3个重复,每个重复12羽。空白对照和阳性对照组均饲喂基础饲粮,其组成及营养水平见表 1;抗生素组饲喂在基础饲粮中添加70 mg·kg-1盐霉素的试验饲粮;两个试验组(EA、EB组)分别饲喂在饲粮中添加1.0×108、2.5×109 CFU·kg-1屎肠球菌的试验饲粮。饲喂14 d后,除空白对照组,其余各组鸡经口人工感染E. tenella孢子化卵囊(经口灌入200 μL,含1.0×105个孢子化卵囊)。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of basal diets (air-dry basis) |
试验使用4层的层叠式鸡笼进行笼养,每笼(70 cm×70 cm×35 cm)12羽,试验重复均匀分布,鸡舍温度第1周为33~35 ℃,之后每周下降2 ℃。肉鸡自由采食和饮水。
1.4 样品采集22日龄时每组随机取5羽,断颈处死后剖开腹腔,剪取约2 cm的盲肠肠段,用预冷至4 ℃的灭菌PBS将肠内容物冲洗干净,液氮速冻后保存于-80 ℃用于RNA的提取,另取2 cm固定于10%福尔马林中,用于盲肠组织病理学检测。
1.5 测定指标及方法1.5.1 生长性能 1日龄时称雏鸡体重,将体重相近的雏鸡随机分组,分组后NC和PC组饲喂基础饲粮,SAL、EA和EB组分别饲喂含盐霉素和屎肠球菌的饲粮,分别于第14(感染前)、22(感染第8天)天称重记录,计算平均日增重(ADG)。
1.5.2 球虫卵囊排出数 麦克马斯特法[8](McMaster’s method):计数时,每份粪便充分混匀后,称取5 g用烧杯盛装粪便样本,先加入30 mL饱和食盐水,充分搅匀;过80目钢筛去除粪便杂质,剩余沉淀再加入10 mL饱和食盐水重复过筛;将粪液混匀后立即吸取加入到计数板的计数室内,静置5 min;在100倍(10×目镜,10×物镜)视野下镜检,计数两个计数室的卵囊数,然后取平均值。计数室可容纳0.15 mL溶液。计算公式:克粪便卵囊数(OPG)=(A×稀释倍数×溶液体积)/(0.15×粪便重量),A=1个计数池中的所有球虫卵囊数。卵囊值根据OPG进行评价,OPG(×106)在0~0.10、0.11~1.00、1.10~1.90、2.00~5.90、6.0~10.90之间和>11.00时,分别记为0、5、10、20、30、40分。在感染后第5天开始采集粪便,收集感染后第5、6、7天的粪便分别进行卵囊计数,最终以其总数计算OPG。
1.5.3 盲肠病变评分 感染第8天对各组所有存活鸡进行安乐死,对盲肠进行病变记分,并将其换算成病变值。盲肠病变记分标准[9]:0分,盲肠壁厚度正常,无肉眼可见病变;1分,盲肠黏膜有点状出血,盲肠壁不增厚;2分,盲肠内容物为黏液,有少许血丝,盲肠壁略增厚,黏膜散在出血点;3分,盲肠内有大量血液或有肠芯(血凝块或灰白色干酪样的香蕉型块状物),盲肠壁肥厚明显,盲肠变形;4分,盲肠壁极度增厚,形成干酪样肠芯,黏膜布满出血点、出血斑。死亡鸡病变也记为4分。记录各组评分(Grade),然后计算病变值(Lesion score)。Lesion score=各试验组内的平均病变记分(Grade)×10。
1.5.4 组织病理学检测 10%福尔马林中固定的盲肠组织用于苏木精和伊红染色(hematoxylin-eosin staining, HE)、阿利新蓝(alcian blue, AB)和过碘酸雪夫染色(periodic acid schiff, PAS)染色。组织块脱水75%、85%、95%、95%、100%、100%的乙醇各1 h,二甲苯Ⅰ、二甲苯Ⅱ、二甲苯Ⅲ各20 min,之后再进入石蜡Ⅰ、石蜡Ⅱ、石蜡Ⅲ各1 h,将包埋好的蜡块进行切片。HE染色如下:切片依次放入二甲苯Ⅰ 10 min、Ⅱ 10 min、100%、95%、75%的乙醇中各5 min,自来水冲洗5 min,苏木精染色5 min、流水冲洗5 min,1%的盐酸酒精分化数秒、自来水冲洗、0.6%氨水返蓝、流水冲洗、伊红染色5 min、再75%、95%、100%的乙醇各5 min脱水后置二甲苯Ⅰ、Ⅱ各5 min,滴上中性树胶封片。使用正置显微镜(奥林巴斯BX53,目镜10×,物镜40×)进行观察,通过HE染色观察盲肠结构,AB-PAS染色观察肠道酸性蛋白和杯状细胞。
1.5.5 肠道细胞因子和蛋白的表达 用TRIzol法提取总RNA,取100 mg盲肠组织于1.5 mL离心管中,并加入大小钢珠各1个,再加入1 mL TRIzol,用组织破碎仪进行匀浆,静置5 min后加入200 μL氯仿,震荡混匀后静置3 min,12 000×g 4 ℃离心15 min,取500 μL上清液于新的离心管中,加入等体积的异丙醇,涡旋后静置10 min,12 000×g 4 ℃离心10 min,沉淀RNA,弃上清,加入1 mL 75%的乙醇涡旋,7 500×g 4 ℃离心5 min,弃上清,置超净台风干,加适量DEPC水溶解沉淀,用Nanodrop one测定RNA浓度,将提取的RNA进行反转录,得到的cDNA保存于-20 ℃。将cDNA用于肠道iNOS,黏蛋白MUC2,紧密连接蛋白Occludin、JAM2和ZO-1基因表达量的检测,参照文献设计所需引物(表 2),并由擎科生物科技有限公司合成。用2-ΔΔCt法计算目的基因mRNA的相对表达量。
|
|
表 2 qRT-PCR引物 Table 2 Sequences of primers used for quantitative real-time PCR |
1.5.6 数据统计分析 试验数据用SPSS 22软件进行分析(SPSS Inc., Chicago, IL, USA)。对平均体重、增重、病变评分和肠道iNOS和MUC2、Occludin、JAM2、ZO-1的表达量进行单因素方差分析,Dunnett’s事后多重比较来分析组间的差异性水平,结果用“平均数±标准差”表示。
2 结果 2.1 屎肠球菌对E. tenella感染肉鸡生长性能的影响由表 3可知,在E. tenella感染前(1~15日龄),与PC组相比,SAL组肉鸡平均日增重没有明显变化(P>0.05),EA和EB组雏鸡平均日增重显著增加(P < 0.05)。在15~22日龄(E. tenella感染期间),PC组肉鸡增重显著低于NC组(P < 0.05),但是相比于PC组,SAL、EB组均能显著改善E. tenella感染引起的增重减少(P < 0.05),并且屎肠球菌添加组与抗生素添加组ADG无统计学差异(P>0.05)。除此之外,分析整个试验期间(1~22日龄)肉鸡平均日增重发现,EB组平均日增显著高于其他感染组(P < 0.05),日增重达到NC组日增重的水平。
|
|
表 3 屎肠球菌对肉鸡生长性能的影响 Table 3 Effects of E. faecium on growth performance of broilers |
E. tenella感染后第3天可以观察到感染组肉鸡精神沉郁,并于感染后第4天发现有血便排出,第5天血便更加严重。E. tenella感染引起盲肠损伤,甚至死亡(表 4)。对盲肠进行剖检发现,添加盐霉素和屎肠球菌虽然能够降低肠道损伤分数,但是并没有明显改善E. tenella感染引起的盲肠损伤(P>0.05);收集肉鸡粪便,进行卵囊计数发现,添加盐霉素和屎肠球菌均可以明显减少粪便中卵囊数(P < 0.05),其中EB组OPG最小。除此之外,E. tenella感染导致PC组肉鸡平均死亡5羽,相比于PC组,EA组也是平均死亡5羽, SAL组平均死亡仅2羽, EB组仅平均死亡3羽。
|
|
表 4 屎肠球菌对E. tenella感染肉鸡的OPG、盲肠病变评分和死亡数的影响 Table 4 Effects of E. faecium on OPG, cecal lesion score and mortality of broilers challenged with E. tenella |
通过HE染色对盲肠组织病理学切片观察发现,PC组肠绒毛断裂、无法观察到正常的腺体结构、存在明显的炎性浸润,并且发现大量寄生虫寄生(图 1 C和D)。相比于PC组,SAL和EA、EB组肠绒毛结构相对完整,并且仅发现少量炎性细胞和球虫卵囊。AB-PAS染色在PC组仅可以看到大量卵囊寄生,但NC和SAL、EA、EB组可以观察到肠道分泌较多的酸性蛋白,并且有较多的杯状细胞。
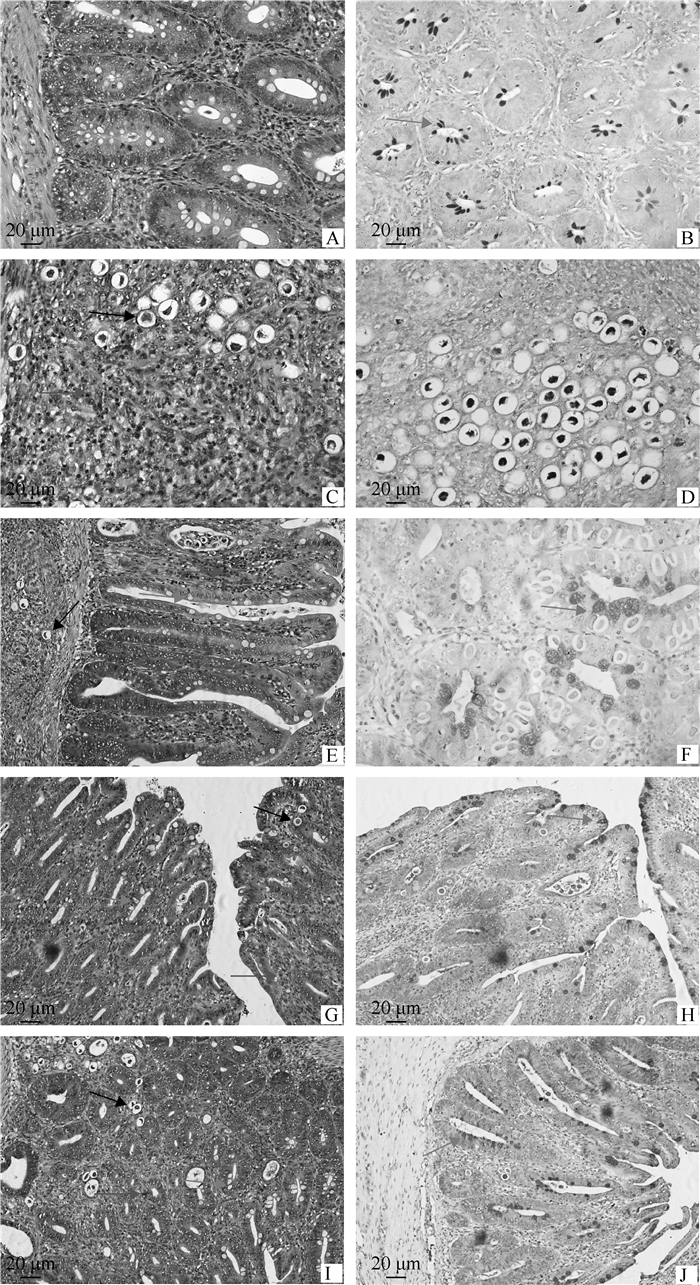
|
A、B.空白对照组;C、D. 感染对照组;E、F. 盐霉素添加组;G、H. 1.0×108 CFU·kg-1屎肠球菌添加组;I、J. 2.5×109 CFU·kg-1屎肠球菌添加组;其中A、C、E、G、I为HE染色,B、D、F、H、J为AB-PAS染色。绿色箭头为杯状细胞,黑色为卵囊,红色为炎性细胞 A, B. NC group; C, D. PC group; E, F. SAL group; G, H. EA group; I, J. EB group. A, C, E, G and I are HE staining; B, D, F, H and J are AB-PAS staining. The green, black and red arrows pointed to goblet cells, oocysts and inflammatory cells, respectively 图 1 盲肠组织病理学对比 Fig. 1 Histopathological comparison of cecum tissues |
诱导型一氧化氮合酶(iNOS)在肠道的表达水平高,则表明肠道中NO水平较高。如图 2所示,E. tenella感染使肠道iNOS表达水平显著下降(P < 0.05);但是相比于PC组,SAL、EA和EB组可以显著提高肠道iNOS的表达量(P < 0.05),并且屎肠球菌添加呈现出剂量依赖性。
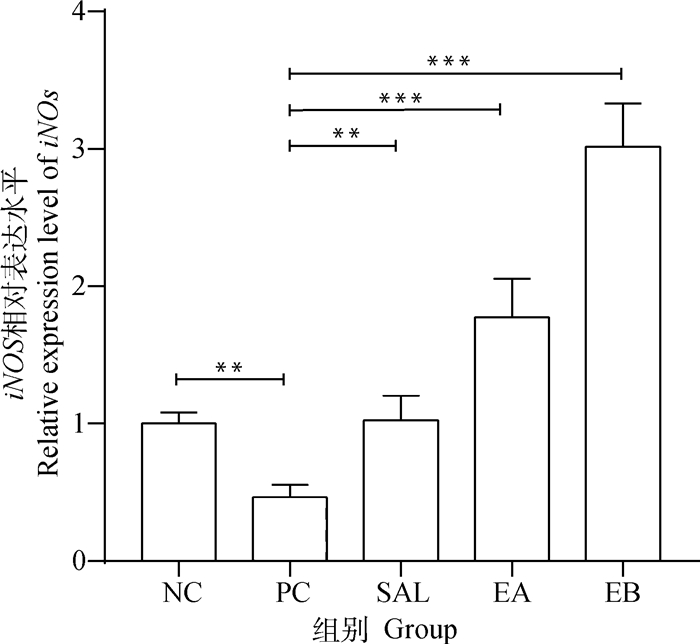
|
*. P < 0.05;**. P < 0.01;***. P < 0.001。下同 *. P < 0.05;**. P < 0.01;***. P < 0.001. The same as below 图 2 盲肠中iNOS的表达水平 Fig. 2 The expression level of intestinal iNOS in cecum |
由图 3可知,E. tenella感染可以导致肠道黏蛋白MUC2、紧密连接蛋白Occludin、JAM2和ZO-1的表达量显著降低(P < 0.05)。相比于PC组,SAL组显著增加MUC2、JAM2和ZO-1的表达量(P < 0.05),同样地,屎肠球菌添加组EA和EB也显著增加黏蛋白MUC2和JAM2的表达量(P < 0.05), 但ZO-1与阳性对照组并无统计学差异(P>0.05);如图 3B所示,仅有EB组能显著增加肠道Occludin的表达(P < 0.05)。
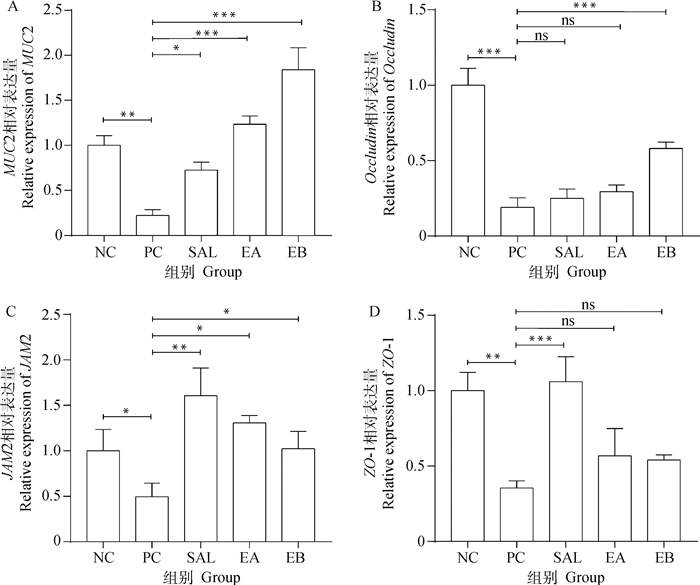
|
图 3 盲肠中屏障蛋白基因表达水平 Fig. 3 The gene expression level of intestinal barrier proteins in cecum |
养鸡业是世界上最重要的食物供应产业之一,据估计,世界上每年大约生产鸡肉900亿kg,占人类摄入动物蛋白质和脂肪来源的1/3以上[10-11]。鸡球虫病是严重危害养殖业的重要疾病之一,由几种不同种类的艾美耳球虫寄生于肠道上皮细胞引起,E. tenella主要在盲肠上皮细胞定殖引起肠道损伤,导致排血便、生长性能降低、肠道微生物失调、免疫功能遭到破坏等,且极易引起继发感染。益生菌指通过摄取适当的量对食用者的身体健康能发挥有益作用的活菌,在宿主体内通过调控肠道微生态平衡、改善肠道形态结构、促进饲料摄入和消化、增强宿主免疫功能等方式促进宿主的健康[12],因此推测,益生菌可能具有一定的抗球虫效果。生产性能被普遍认为是评价肉鸡特定经济价值的方法,已有研究发现,饲喂含有罗伊乳酸杆菌、屎肠球菌、动物双歧杆菌、乳酸球菌和唾液乳酸杆菌等益生菌添加的饲料会提高肉鸡的生长性能[13];张利环等[14]证明,将干酪乳杆菌、嗜酸乳杆菌和双歧杆菌以2:1:1的比例混合对肉鸡进行饲喂,可以显著提高肉鸡平均日增重。当肉鸡受到E. tenella感染后增重会显著降低,饲喂屎肠球菌有利于肠道健康、促进肠道消化吸收、改善肉鸡生长性能,减少E. tenella感染引起的损失。在本研究中,屎肠球菌能够改善肉鸡早期生长性能,显著提高雏鸡1~15 d的平均日增重,并且在整个试验期间2.5×109 CFU·kg-1添加组可以预防E. tenella感染引起的增重减少,显著提高肉鸡的增重;曹广添等[15]也发现,相比于阴性和阳性对照组,肉鸡饲喂屎肠球菌可以显著提高大肠杆菌感染肉鸡的生长性能,这些均表明屎肠球菌对肉鸡具有较好的促生长作用。根据上述结果认为,屎肠球菌可以通过改善肉鸡生长性能减少E. tenella感染引起的损失,可分为两个阶段:一是在感染前促进雏鸡生长发育,促进免疫系统的成熟,从而预防E. tenella感染;其次,还可能在肉鸡感染后通过促进肠道对营养的消化吸收进而减少E. tenella感染导致的损失。
本研究对感染E. tenella后OPG、死亡率和盲肠损伤进行分析发现,屎肠球菌可以显著减少感染后粪便中的卵囊排出数、降低死亡率,虽然盲肠病变评分没有明显降低,但是通过对组织病理学观察发现,屎肠球菌添加可以在一定程度上抑制E. tenella感染对肠道绒毛和腺体的破坏,维持了肠道结构的完整性。已有研究也表明,屎肠球菌可以显著减少粪便中卵囊数,减少感染肉鸡的死亡率(3.33%~10.00%)[16],Giannenas等[17]研究也发现,屎肠球菌可以显著减少粪便中卵囊数(P < 0.05),并且具有剂量依赖性,结论与本试验结果相同:屎肠球菌添加组的盲肠损伤评分与感染组没有显著性差异,但是可以显著减少粪便中卵囊数。iNOS可以诱导精氨酸氧化为NO,协助巨噬细胞产生免疫应答。饲料添加枯草芽孢杆菌可诱导NO产生,调控巨噬细胞的免疫功能[18],添加鼠李糖乳杆菌可使巨噬细胞产生的NO增加,增强宿主免疫功能[19],充分显示益生菌可以通过增加NO的产生来增强机体先天性免疫。本试验则通过检测肠道iNOS的表达水平间接反映出屎肠球菌可以促进肠道NO的产生,结果显示,E. tenella感染使PC组肠道iNOS表达水平显著低于NC组(P < 0.05);EA和EB组同SAL组可以显著提高肠道iNOS的表达(P < 0.05),表明在屎肠球菌可以诱导iNOS的高表达来促进肠道NO的产生,从而促进宿主免疫反应。推测屎肠球菌可能通过其某种代谢产物直接抑制卵囊的增殖或者是刺激机体免疫反应来阻止卵囊增殖、甚至消灭入侵的卵囊。
肠道屏障和紧密连接是防止病原侵害、维持上皮完整性的主要防御机制。MUC2是主要的分泌性黏蛋白,在维持肠道表面黏液层结构和防止病原入侵内部黏液层中起重要作用[20]。炎症会减少肠道分泌MUC2蛋白的杯状细胞数量,导致黏液层得不到补充,增加了进一步感染、细菌移位和炎症的机会。艾美耳球虫感染可以显著降低空肠杯状细胞的数量,下调MUC2基因的表达[21],但是乳酸菌可以增加杯状细胞数量,枯草芽孢杆菌可以提高MUC2的表达水平[22],本研究也得出相同的结论。肠上皮细胞在保护肠道免受病原侵害中扮演重要角色,紧密连接可以调节肠道对营养物质的吸收、调节内稳态、抵御肠道病原体入侵,并且是肠道上皮细胞健康的重要指标。Occludin和JAM蛋白是重要的跨膜蛋白,是紧密连接的主要结构,ZO-1蛋白是连接三者和上皮细胞肌动蛋白的枢纽[23]。混合艾美耳球虫和产气荚膜梭菌感染导致空肠中紧密连接蛋白Occludin、JAM2、ZO-1的表达明显下调[24],而枯草芽孢杆菌添加可以显著增加肠道JAM2和ZO-1的表达[25];坏死性肠炎病例的肠道MUC2、Occludin的表达明显减少,但添加解淀粉芽孢杆菌可以显著增加其表达量[26],地衣芽孢杆菌也可以显著增加球虫感染后JAM2和Occludin在盲肠的表达[27]等。这些研究结果均表明,益生菌可以通过调节肠道黏蛋白和紧密连接蛋白的表达进而增强宿主肠道屏障功能,减少病原引起的肠道损伤。与已有研究相似,本研究也发现屎肠球菌可以显著提高Occludin和JAM2的表达量。结合本研究证实,屎肠球菌可以通过调节肠道屏障蛋白的表达来维持肠道屏障的正常功能,在一定程度上抵御球虫入侵,对肠道组织造成损伤。
4 结论综上所述,饲粮中添加E. faecium能够改善肉鸡的生长性能,维持E. tenella感染后盲肠的完整性,通过调节肠道iNOS、黏蛋白MUC2、紧密连接蛋白Occludin、JAM2和ZO-1的基因表达水平增强肉鸡肠道屏障功能,减少E. tenella感染引起的死亡和卵囊排出,对鸡球虫病具有一定的防治作用,可以减少球虫病带来的经济损失,在肉鸡生产中具有较大应用前景。
| [1] |
MENGISTU B M, BITSUE H K, HUANG K H. The effects of selenium-enriched probiotics on growth performance, oocysts shedding, intestinal cecal lesion scores, antioxidant capacity, and mRNA gene expression in chickens infected with Eimeria tenella[J]. Biol Trace Elem Res, 2021, 199(1): 278-291. DOI:10.1007/s12011-020-02118-7 |
| [2] |
WEI Z K, ZHAO Y C, ZHANG N, et al. Eimeria tenella induces the release of chicken heterophil extracellular traps[J]. Vet Parasitol, 2019, 275: 108931. DOI:10.1016/j.vetpar.2019.108931 |
| [3] |
ZHANG X S, LI S, ZHENG M X, et al. Effects of the PI3K/Akt signaling pathway on the apoptosis of early host cells infected with Eimeria tenella[J]. Parasitol Res, 2020, 119(8): 2549-2561. DOI:10.1007/s00436-020-06738-9 |
| [4] |
黄怡, 郭乾鹏, 梁世忠, 等. 屎肠球菌对仔猪肠道健康的影响[J]. 动物营养学报, 2016, 28(4): 968-973. HUANG Y, GUO Q P, LIANG S Z, et al. Influence of Enterococcus faecium on gut health of piglets[J]. Chinese Journal of Animal Nutrition, 2016, 28(4): 968-973. DOI:10.3969/j.issn.1006-267x.2016.04.002 (in Chinese) |
| [5] |
WANG W W, CAI H Y, ZHANG A R, et al. Enterococcus faecium modulates the gut microbiota of broilers and enhances phosphorus absorption and utilization[J]. Animals (Basel), 2020, 10(7): 1232. |
| [6] |
HUANG L Q, LUO L P, ZHANG Y R, et al. Effects of the dietary probiotic, Enterococcus faecium NCIMB11181, on the intestinal barrier and system immune status in Escherichia coli O78-challenged broiler chickens[J]. Probiotics Antimicrob Proteins, 2019, 11(3): 946-956. DOI:10.1007/s12602-018-9434-7 |
| [7] |
GIANNENAS I, TSALIE E, TRIANTAFILLOU E, et al. Assessment of probiotics supplementation via feed or water on the growth performance, intestinal morphology and microflora of chickens after experimental infection with Eimeria acervulina, Eimeria maxima and Eimeria tenella[J]. Avian Pathol, 2014, 43(3): 209-216. DOI:10.1080/03079457.2014.899430 |
| [8] |
HAUG A, WILLIAMS R B, LARSEN S. Counting coccidial oocysts in chicken faeces: a comparative study of a standard McMaster technique and a new rapid method[J]. Vet Parasitol, 2006, 136(3-4): 233-242. DOI:10.1016/j.vetpar.2005.11.024 |
| [9] |
JOHNSON J, REID W M. Anticoccidial drugs: lesion scoring techniques in battery and floor-pen experiments with chickens[J]. Exp Parasitol, 1970, 28(1): 30-36. DOI:10.1016/0014-4894(70)90063-9 |
| [10] |
TANG X M, SUO J X, LI C, et al. Transgenic Eimeria tenella expressing profilin of Eimeria maxima elicits enhanced protective immunity and alters gut microbiome of chickens[J]. Infect Immun, 2018, 86(9): e00888-17. |
| [11] |
MUTHAMILSELVAN T, KUO T F, WU Y C, et al. Herbal remedies for coccidiosis control: A review of plants, compounds, and anticoccidial actions[J]. Evid Based Complement Alternat Med, 2016, 2016: 2657981. |
| [12] |
KABIR S M L. The role of probiotics in the poultry industry[J]. Int J Mol Sci, 2009, 10(8): 3531-3546. DOI:10.3390/ijms10083531 |
| [13] |
MOUNTZOURIS K C, TSIRTSIKOS P, KALAMARA E, et al. Evaluation of the efficacy of a probiotic containing Lactobacillus, Bifidobacterium, Enterococcus, and Pediococcus strains in promoting broiler performance and modulating cecal microflora composition and metabolic activities[J]. Poult Sci, 2007, 86(2): 309-317. DOI:10.1093/ps/86.2.309 |
| [14] |
张利环, 张若男, 贾浩, 等. 益生菌互作对肉鸡生长性能、肠道消化吸收及糖转运蛋白GLUT2影响的研究[J]. 畜牧兽医学报, 2020, 51(9): 2165-2176. ZHANG L H, ZHANG R N, JIA H, et al. Effects of probiotics interaction on growth performance, intestinal digestion and absorption, and sugar transporter GLUT2 in broilers[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(9): 2165-2176. (in Chinese) |
| [15] |
曹广添, 代兵, 张玲玲, 等. 屎肠球菌对大肠杆菌感染肉鸡生长性能、血清生化指标和盲肠菌群结构的影响[J]. 畜牧兽医学报, 2018, 49(5): 962-970. CAO G T, DAI B, ZHANG L L, et al. Effects of Enterococcus faecium on the growth performance, serum biochemical parameters and the structure of cecal microflora in the E. coli-challenged broilers[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(5): 962-970. (in Chinese) |
| [16] |
EL-SAWAH A A, ABOELHADID S M, EL-NAHASS E N, et al. Efficacy of probiotic Enterococcus faecium in combination with diclazuril against coccidiosis in experimentally infected broilers[J]. J Appl Microbiol, 2020, 129(4): 1020-1028. DOI:10.1111/jam.14691 |
| [17] |
GIANNENAS I, PAPADOPOULOS E, TSALIE E, et al. Assessment of dietary supplementation with probiotics on performance, intestinal morphology and microflora of chickens infected with Eimeria tenella[J]. Vet Parasitol, 2012, 188(1-2): 31-40. DOI:10.1016/j.vetpar.2012.02.017 |
| [18] |
LEE K W, LI G X, LILLEHOJ H S, et al. Bacillus subtilis-based direct-fed microbials augment macrophage function in broiler chickens[J]. Res Vet Sci, 2011, 91(3): e87-e91. DOI:10.1016/j.rvsc.2011.01.018 |
| [19] |
KORHONEN R, KORPELA R, SAXELIN M, et al. Induction of nitric oxide synthesis by probiotic Lactobacillus rhamnosus GG in J774 macrophages and human T84 intestinal epithelial cells[J]. Inflammation, 2001, 25(4): 223-232. DOI:10.1023/A:1010971703271 |
| [20] |
ZHAO X N, YANG J, JU Z J, et al. Clostridium butyricum ameliorates Salmonella enteritis induced inflammation by enhancing and improving immunity of the intestinal epithelial barrier at the intestinal mucosal level[J]. Front Microbiol, 2020, 11: 299. DOI:10.3389/fmicb.2020.00299 |
| [21] |
KHATLAB A D S, DEL VESCO A P, NETO A R O, et al. Dietary supplementation with free methionine or methionine dipeptide improves environment intestinal of broilers challenged with Eimeria spp.[J]. J Anim Sci, 2019, 97(12): 4746-4760. DOI:10.1093/jas/skz339 |
| [22] |
ALIAKBARPOUR H R, CHAMANI M, RAHIMI G, et al. The Bacillus subtilis and lactic acid bacteria probiotics influences intestinal mucin gene expression, histomorphology and growth performance in broilers[J]. Asian-Australas J Anim Sci, 2012, 25(9): 1285-1293. DOI:10.5713/ajas.2012.12110 |
| [23] |
MEMON F U, YANG Y, LV F, et al. Effects of probiotic and Bidens pilosa on the performance and gut health of chicken during induced Eimeria tenella infection[J]. J Appl Microbiol, 2021, 131(1): 425-434. DOI:10.1111/jam.14928 |
| [24] |
STEFANELLO C, ROSA D P, DALMORO Y K, et al. Protected blend of organic acids and essential oils improves growth performance, nutrient digestibility, and intestinal health of broiler chickens undergoing an intestinal challenge[J]. Front Vet Sci, 2020, 6: 491. DOI:10.3389/fvets.2019.00491 |
| [25] |
GADDE U, OH S T, LEE Y S, et al. The effects of direct-fed microbial supplementation, as an alternative to antibiotics, on growth performance, intestinal immune status, and epithelial barrier gene expression in broiler chickens[J]. Probiotics Antimicrob Proteins, 2017, 9(4): 397-405. DOI:10.1007/s12602-017-9275-9 |
| [26] |
GHARIB-NASERI K, DE PAULA DORIGAM J C, DORANALLI K, et al. Modulations of genes related to gut integrity, apoptosis, and immunity underlie the beneficial effects of Bacillus amyloliquefaciens CECT 5940 in broilers fed diets with different protein levels in a necrotic enteritis challenge model[J]. J Anim Sci Biotechnol, 2020, 11: 104. DOI:10.1186/s40104-020-00508-4 |
| [27] |
CHAUDHARI A A, LEE Y, LILLEHOJ H S. Beneficial effects of dietary supplementation of Bacillus strains on growth performance and gut health in chickens with mixed coccidiosis infection[J]. Vet Parasitol, 2020, 277: 109009. DOI:10.1016/j.vetpar.2019.109009 |
(编辑 范子娟)



