2. 河北省兽药监察所,石家庄 050051;
3. 顺平县动物疫病预防与控制中心,保定 072250;
4. 瑞普生物药业有限公司,保定 071000
2. Hebei Provincial Institute of Veterinary Drug Control, Shijiazhuang 050051, China;
3. Shunping County Animal Disease Prevention and Control Center, Baoding 072250, China;
4. Ringpu biological pharmaceutical Co., LTD, Baoding 071000, China
非洲猪瘟(Africa swine fever, ASF)是由非洲猪瘟病毒(Africa swine fever virus, ASFV)引起猪和野猪的一种高度接触传染性的烈性传染病,以全身组织器官广泛出血、脾急性肿大呈黑色为主要特征,病死率高达100%[1-2]。世界动物卫生组织(OIE)将该病列为法定报告动物疫病,我国将其列为一类动物传染病。2018年8月我国辽宁沈阳市首次发生ASF疫情,随后在全国范围内迅速传播,给我国养猪业造成极其巨大的经济损失[3]。
ASFV是非洲猪瘟病毒科(Asfarviridae)非洲猪瘟病毒属(Asfivirus)的成员,也是目前发现的可以在软蜱体内复制的唯一虫媒DNA病毒[4]。ASFV为双股DNA病毒,病毒粒子外周直径约200 nm,结构复杂,由含病毒基因组DNA的拟核、内核芯壳(基质层)、内囊膜、二十面体对称的衣壳和外囊膜5部分组成[5]。病毒基因组170~193 kb,有151~167个开放阅读框(ORFs),编码150~200种蛋白,其中p72与p30、p54、p12等蛋白抗原性好,可用于ASF的血清学诊断[6-7]。p72蛋白(73.2 ku)由B646L基因编码,在病毒感染晚期表达,是ASFV衣壳的主要组成部分,占病毒粒子总质量的33%,并且该蛋白在不同ASFV毒株之间高度保守[6]。因此,p72是ASFV病原学和血清学诊断以及流行毒株遗传进化分析的首选靶标。
目前尚无有效的商品化疫苗和药物用于ASF的预防与治疗,加强检疫、早期发现和快速确诊是当前防控ASF的主要措施[8-11]。本研究体外表达了全长和截短的p72蛋白,分析比较了两者的免疫原性和反应原性,旨在为建立敏感、特异的ASFV抗体检测方法提供必要实验材料。
1 材料与方法 1.1 载体、菌株与实验动物pET-28a(+)原核表达质粒、E. coli DH5α和Rosetta(DE3)感受态细胞,均由河北农业大学传染病实验室保存;SPF级BALB/c小鼠,购于河北医科大学实验动物中心。
1.2 主要试剂和血清T4 DNA连接酶,购自美国Promega公司;琼脂糖凝胶DNA回收试剂盒和质粒提取试剂盒,购自天根生化科技有限公司;HRP标记的(HRP-)山羊抗兔IgG(H+L)、抗His标签的兔多克隆抗体及Ni-Agarose His标签蛋白纯化试剂盒,购自北京康为世纪生物科技有限公司;HRP-标记的羊抗猪IgG,购自北京索莱宝生物技术有限公司;限制性内切酶Xho Ⅰ和EcoR Ⅰ,购自宝生物工程(大连)有限公司;弗氏完全佐剂、弗氏不完全佐剂和IPTG,购自美国Sigma公司;ASFV-ELISA抗体检测试剂盒为法国爱迪威(ID.Vet)产品;ASFV基因II型毒株抗体阳性、阴性猪血清,由河北骥才中科基因技术有限公司提供;猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)和猪伪狂犬病病毒(PRV)抗体阳性血清,为IDEXX公司产品;猪圆环病毒2型(PCV2)抗体阳性血清,由本实验室制备并保存。
1.3 基因序列合成与引物设计ASFV中国分离株Pig/HLJ/2018(GenBank ID: MK333180)的p72基因序列及其重组质粒(T-p72),由生工生物工程(上海)股份有限公司合成与构建。利用Primer 5.0软件设计2对带有酶切位点EcoR Ⅰ和Xho Ⅰ的引物,分别用于扩增p72全基因和截短基因(p72s)(表 1)。引物由生工生物工程(上海)股份有限公司合成。
|
|
表 1 PCR扩增全长p72和截短p72(p72s)基因用引物 Table 1 Primers for PCR amplification of full length p72 and truncated p72 (p72s) genes |
以T-p72重组质粒为模板,分别用引物eU-p72-eL-p72和eU-p72s-eL-p72s,经PCR扩增p72基因和截短基因p72s。PCR反应体系(50 μL)如下:2×Mix 25 μL、上下游引物各1 μL、模板1 μL、ddH2O 22 μL。PCR反应程序:94 ℃预变性3 min;94 ℃变性45 s,57 ℃退火45 s,72 ℃延伸2 min,共30个循环;72 ℃终延伸10 min。PCR产物经1.0%琼脂糖凝胶电泳后,按照琼脂糖凝胶DNA纯化回收试剂盒说明,回收PCR产物,用于重组表达质粒构建。
用限制性核酸内切酶EcoR Ⅰ和Xho Ⅰ酶切p72、p72s基因及原核表达载体pET-28a(+) 2 h;回收目的DNA片段和质粒;将目的基因分别插入到pET-28a(+)载体中,得到重组质粒pET-28a-p72和pET-28a-p72s,进一步经PCR和酶切(EcoR Ⅰ和Xho Ⅰ)鉴定后,送往生工生物工程(上海)股份有限公司进行序列测定。
1.5 重组蛋白的表达与纯化将构建的重组表达质粒pET-28a-p72和pET-28a-p72s分别转化Rosetta(DE3)感受态细胞,37 ℃培养过夜,挑取阳性单菌落,接种于3 mL Kana+/LB液体培养基中,37 ℃活化过夜,按照1:100的比例接种到8 mL Kan+/LB液体培养基中,37 ℃振摇培养至对数生长期(OD600 nm=0.6~0.8),加入终浓度为0.1、0.25或0.5 mmol·L-1的IPTG,在18、20、24、26、28、30、32或35 ℃下,诱导表达3、4、5或6 h。离心收集菌体,SDS-PAGE分析,确定蛋白表达的最佳条件。
超声裂解收集诱导表达的菌体,4 ℃ 12 000 r·min-1离心20 min,分别取上清液和沉淀进行SDS-PAGE,检测重组蛋白的表达形式。随后,按照Ni-Agarose His标签蛋白纯化试剂盒推荐的步骤纯化目的蛋白。纯化蛋白经浓度递减(4.5、3.5、2.5、1.5、0.5和0 mol·L-1)的尿素溶液透析复性(每个浓度的尿素溶液内透析8~12 h)。透析结束后,用PEG20000浓缩蛋白液,4 ℃ 3 000 r·min-1离心10 min,收取上清,通过SDS-PAGE检测与浓度测定后,分装,冻存于-80 ℃,备用。
1.6 重组蛋白的鉴定1.6.1 Western blot 用蛋白半干转印仪将表达的p72或p72s蛋白转印到PVDF膜上,将膜放入封闭液(含5%脱脂奶粉、0.05% Tween-20的Tris-HCl缓冲液,pH 7.4)中于4 ℃下孵育过夜;弃去封闭液,洗膜;加入兔抗His标签多克隆抗体(1:3 000稀释),室温下反应1.5 h;洗膜,加入H RP-标记的羊抗兔IgG(1:4 000倍稀释),室温下反应1 h;洗膜,将膜置于DAB显色液中显色3 min。
1.6.2 液相色谱-质谱联用技术鉴定与蛋白抗原表位分析 分别用胰蛋白酶(trypsin)和糜蛋白酶(chymotrypsin)酶解处理纯化的重组蛋白(酶与底物质量比为1:40);取处理好的样品通过液相色谱-质谱联用(LC-MS/MS)分析,获得质谱原始数据;用MaxQuant(Version 1.6.2.10)软件分析,数据库检索与数据匹配,分析蛋白序列。随后将蛋白的氨基酸序列提交到网站(http://www.cbs.dtu.dk/services/SignalP/)在线预测分析表达蛋白的抗原表位。
1.7 蛋白的免疫原性与反应原性检测1.7.1 动物接种与特异性抗体检测 分别取50 μg的重组p72和p72s蛋白与等量弗氏佐剂乳化后,经背部皮下注射BALB/c小鼠,首次免疫时重组蛋白与等体积的弗氏完全佐剂乳化,第2、3次免疫时与等体积的弗氏不完全佐剂乳化,共免疫3次,每次免疫间隔2周,每次每只小鼠接种50 μg重组蛋白。第3次免疫后10 d,应用ELISA检测并比较两组小鼠的血清特异性抗体效价。ELISA的主要步骤:分别用0.1 μg的p72和p72s蛋白包被酶标板反应孔,37 ℃孵育1 h后4 ℃过夜;洗涤,加入封闭液于37 ℃封闭1 h后,加入倍比稀释的p72或p72s蛋白免疫小鼠血清,37 ℃孵育1 h,同时设立未免疫小鼠血清作为阴性对照;洗涤后加入100 μL HRP-标记的羊抗小鼠IgG(1:5 000稀释),37 ℃孵育45 min;洗涤,加入100 μL TMB底物显色液,避光反应15 min,终止反应,用酶标仪测定OD450 nm值。当样本OD值≥0.3时,判为p72或p72s特异性抗体阳性。
1.7.2 猪血清中特异性抗体的ELISA检测 分别用0.1 μg的p72和p72s蛋白包被酶标板的反应孔,检测50份ASFV阴性血清。ELISA操作步骤与“1.7.1”中所述的相同,其中血清作1:100倍稀释,HRP标记羊抗猪IgG作1:5 000倍稀释。统计50份阴性血清的ELISA检测结果,计算血清OD值的平均值(x)和标准偏差(s);依据当待检血清的OD值≥x+3s时为抗体阳性的判定标准,计算得出p72-ELISA或p72s-ELISA的阴阳性临界值分别为0.400和0.326,即当待检血清的OD450 nm值≥0.400或0.326时,血清特异性抗体为阳性,当OD450 nm值<0.400和0.326时,血清特异性抗体为阴性。然后,用p72-ELISA和p72s-ELISA分别检测9份倍比稀释(1:100~1:3 200)的ASFV抗体阳性猪血清,比较全长与截短p72蛋白检测特异性抗体的敏感性。
为了分析基于全长和截短p72蛋白ELISA检测结果的一致性,分别用p72-ELISA和p72s-ELISA检测108份猪血清,同时设立CSFV、PRRSV、PRV、PCV2等抗体阳性血清对照。应用SPSS21.0数据统计分析软件对p72-ELISA与p72s-ELISA结果进行kappa一致性检验。整个检测过程严格按照生物安全管理制度执行。
1.7.3 p72和p72s蛋白与猪血清特异性抗体反应的Western blot检测 通过Western blot检测10份ASFV抗体阳性、2份ASFV抗体阴性猪血清,同时设立CSFV、PRRSV、PRV和PCV2抗体阳性血清对照。根据反应结果,分析p72和p72s蛋白与特异性抗体反应的敏感性。Western blot检测时,将猪血清作1:100倍稀释,于4 ℃孵育过夜;HRP-羊抗猪IgG作1:4 000稀释,于室温孵育2 h;其他步骤同“1.6.1”所述。
2 结果 2.1 重组质粒的鉴定分别以构建的重组表达质粒pET-28a-p72和pET-28a-p72s为模板,进行PCR,分别扩增出1 953 bp和1 098 bp的DNA条带,同时重组质粒经EcoR Ⅰ和Xho Ⅰ酶切后,分别得到与预期大小一致的核酸片段(图 1)。测序和序列比对分析发现,重组质粒中分别克隆有p72和p72s序列,与预期一致。
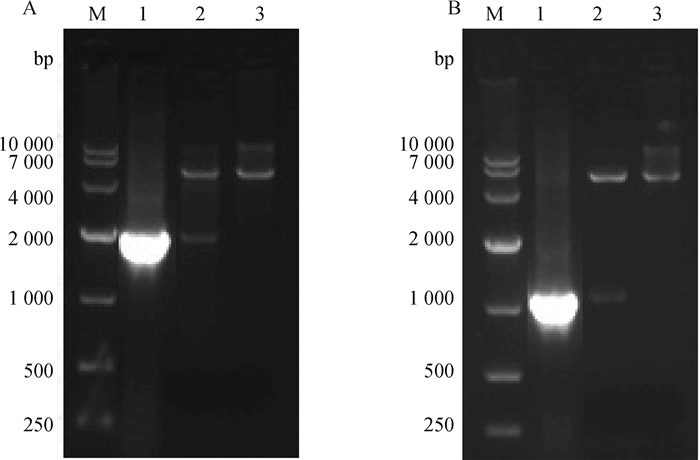
|
A. pET-28a-p72;B. pET-28a-p72s;M. DL10000 DNA相对分子质量标准;1.重组质粒的PCR鉴定;2.重组质粒的EcoR Ⅰ和Xho Ⅰ酶切鉴定;3.pET-28a(+)空质粒酶切对照 A. pET-28a-p72; B. pET-28a-p72s; M. DL10000 DNA marker; 1. PCR identification of recombinant plasmid; 2. Identification of recombinant plasmid by EcoR Ⅰ and Xho Ⅰ digestion; 3. The plasmid pET-28a (+) digested by EcoR Ⅰ and Xho Ⅰ 图 1 重组质粒的PCR和酶切鉴定 Fig. 1 Identification of recombinant plasmids by PCR and enzyme digestion |
在18~35 ℃下,用0.25 mmol·L-1的IPTG诱导表达4 h,收集菌体,经SDS-PAGE检测,可见重组质粒pET-28a-p72或pET-28a-p72s转化菌比空质粒pET-28a转化菌和大肠杆菌(Rosetta)对照的泳道中分别多出了与预期相符、相对分子质量约76或42 ku的蛋白条带(图 2)。
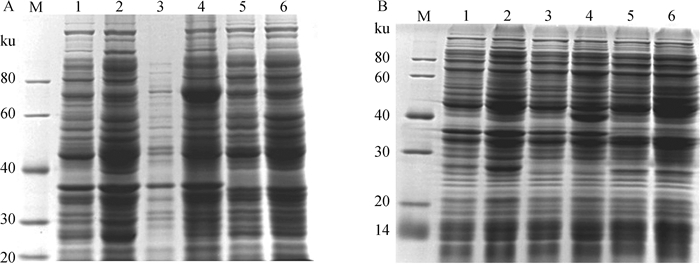
|
A. p72;B. p72s;M. 蛋白质相对分子质量标准(Protein Ruler I);1、2. 大肠杆菌;3、4. pET-28a-p72或pET-28a-p72s转化菌;5、6. pET28a空质粒转化菌;1、3、5. 诱导前;2、4、6.诱导后 A. p72; B. p72s; M. Protein marker (Protein Ruler I); 1, 2. E. coli Rosetta-(DE3); 3, 4. The pET-28a-p72 or pET-28a-p72s transformed E. coli; 5, 6. pET28a transformed E. coli; 1, 3, 5. Before induction; 2, 4, 6. After induction 图 2 p72和p72s重组蛋白的诱导表达 Fig. 2 Induced expression of p72 and p72s recombinant proteins |
通过比较在不同温度、IPTG诱导浓度和诱导时间下的蛋白表达量,发现当诱导温度分别为28和26 ℃、IPTG诱导浓度为0.5 mmoL·L-1及诱导时间为5 h时,p72和p72s蛋白的表达量最高。收集诱导表达菌体,超声波裂解后,在两个蛋白表达菌体的裂解沉淀中均检测到预期大小的蛋白条带,而在上清液中没有或仅有少量蛋白,表明p72和p72s蛋白主要以包涵体形式表达(图略)。SDS-PAGE检测显示,纯化的p72和p72s蛋白条带清晰,但在全长p72蛋白泳道有一条细小杂带,而截短蛋白泳道无肉眼可见杂带(图 3)。
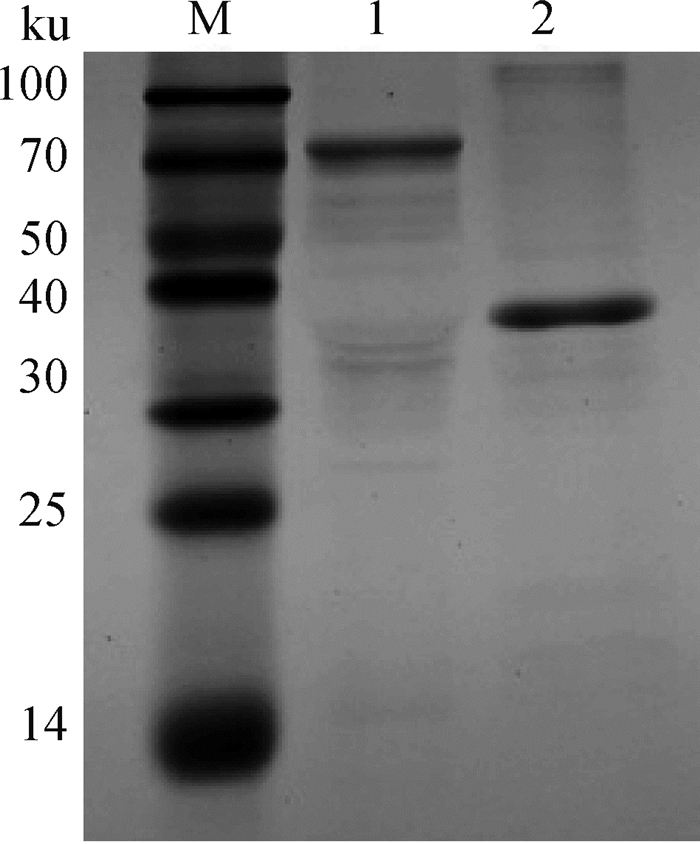
|
M. 蛋白质相对分子质量标准(Protein Ruler I);1. 纯化的p72蛋白;2.纯化的p72s蛋白 M. Protein marker; 1. Purified p72 protein; 2. Purified p72s protein 图 3 纯化蛋白的SDS-PAGE分析 Fig. 3 SDS-PAGE analysis of purified proteins |
重组p72和p72s蛋白与兔抗His标签多克隆抗体反应后,在相应泳道分别出现一条清晰的与预期大小相符的特异性反应条带,而相同条件下诱导后的空载体pET-28a转化菌未见相应大小的条带(图 4),表明筛选的携带重组质粒的大肠杆菌分别表达了重组p72和p72s蛋白。
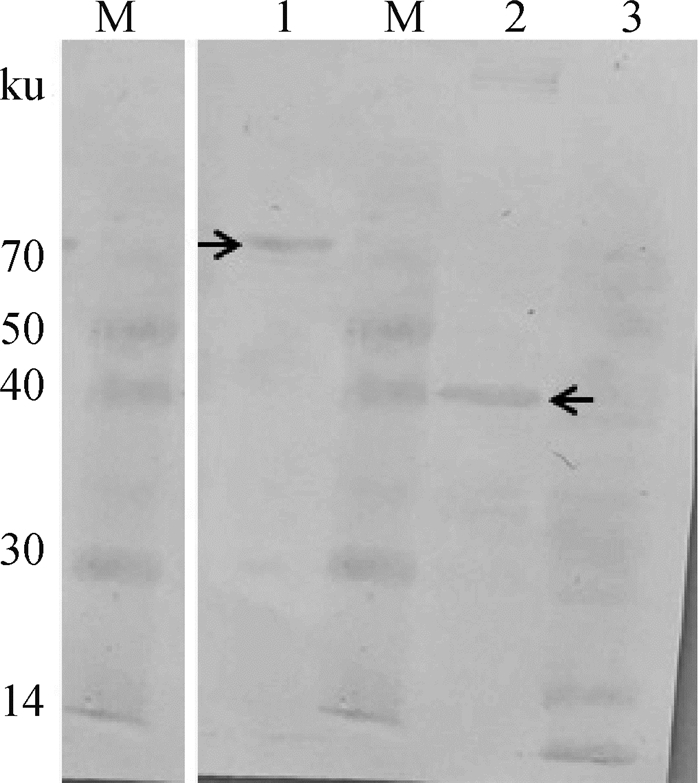
|
M. 蛋白质相对分子质量标准;1. 重组p72蛋白;2. 重组p72s蛋白;3. pET-28a空载体质粒转化大肠杆菌诱导产物;箭头分别指重组p72蛋白和p72s蛋白的免疫印迹 M. Protein marker; 1. Recombinant p72 protein; 2. Recombinant p72s protein; 3. Induced products of E. coli with vector plasmids (pET28a); The arrows indicate Western blot of recombinant p72 and P72s proteins 图 4 重组蛋白Western blot鉴定 Fig. 4 Identification of recombinant proteins by Western blot |
重组p72和p72s蛋白经胰蛋白酶和糜蛋白酶酶解处理后,LC-MS/MS技术分析发现,表达蛋白的酶解肽段对p72和p72s蛋白推测氨基酸序列的总覆盖度分别为89.3%和88.39%(图 5),表明表达蛋白分别为ASFV的全长和截短p72蛋白。抗原表位预测显示,p72蛋白共含有27个抗原表位,p72s覆盖其中的63%(17/27)的抗原表位(表 2)。

|
带下划线序列. 酶解肽段序列 Underlined sequence. Enzyme hydrolyzed peptide sequence 图 5 重组p72蛋白氨基酸序列的LC-MS/MS技术鉴定 Fig. 5 Identification of amino acid sequence of recombinant p72 protein by LC-MS/MS |
|
|
表 2 p72和p72s蛋白抗原表位的预测与比较 Table 2 Prediction and comparison of p72 and p72s protein epitopes |
在第3次免疫后9 d,p72蛋白与p72s蛋白免疫小鼠的抗体效价分别为1:200~1:25 600和1:12 800~1:409 600(图 6)。可见,p72s蛋白刺激小鼠产生的抗体效价高于p72蛋白。
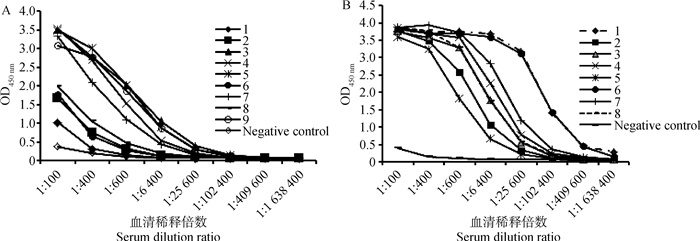
|
图 6 重组p72(A)或p72s(B)免疫小鼠的血清特异性抗体效价 Fig. 6 Specific antibody titers in sera of the mice immunized with the recombinant p72 (A) or p72s (B) proteins |
分别用基于p72蛋白和p72s蛋白的ELISA检测9份经倍比稀释的ASFV抗血清,结果如图 7所示,其中5份血清的抗体效价相同,分别为1:800(1份)、1:400(3份)和1:1 600(1份);针对另外4份血清,当用p72s蛋白检测时,抗体效价为1:400(3份)和1:200(1份);p72蛋白检测时,抗体效价为1:100(1份)、1:200(2份)和1:400(1份)。上述结果显示基于截短p72蛋白ELISA的敏感性较高。
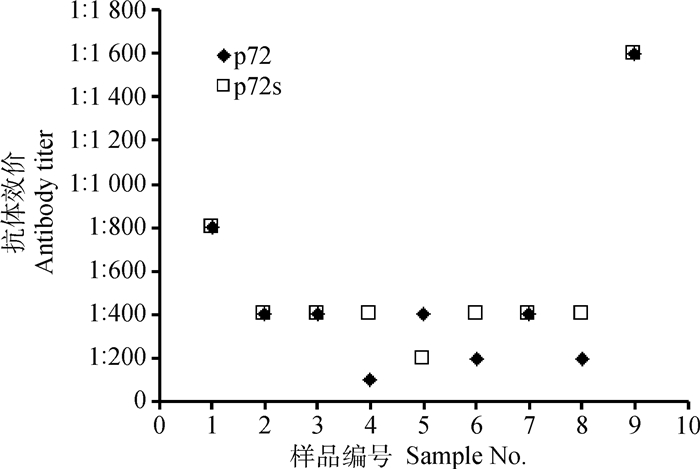
|
图 7 基于p72蛋白与截短p72蛋白的ELISA的敏感性比较 Fig. 7 Comparison of sensitivity between p72 protein and truncated p72 protein-based ELISA |
p72蛋白或p72s蛋白分别与CSFV、PRRSV、PRV和PCV2等抗血清没有交叉反应(图略)。对108份猪血清的检测结果显示,p72蛋白和p72s蛋白的抗体阳性检出率分别为72.2%(78/108)和78.7%(85/108),抗体阴性检出率分别为27.8%和21.3%,总符合率为93.5%(101/108)。Kappa检验结果显示,基于p72与p72s蛋白ELISA结果的kappa=0.826 (P=0.016)。上述结果表明,基于截短与全长p72蛋白的ELISA结果高度一致,但截短p72蛋白的阳性检出率较高。
2.7 基于重组p72s蛋白的Western blot的敏感性更高Western blot检测结果如图 8所示,10份ASFV抗体阳性血清中有7份与p72蛋白反应,全部与p72s蛋白反应(5号血清为弱阳性)。两份阴性血清及CSFV、PRRSV、PRV和PCV2等抗血清与p72和p72s均不发生反应。该结果表明,Western blot检测猪血清特异性ASFV抗体时,p72s蛋白的敏感性更高。

|
M. 蛋白质相对分子质量标准(由高到低依次为100、70、50、40、30和25 ku);1~10. ASFV抗体阳性猪血清;11~12. ASFV抗体阴性猪血清;13~16. p72蛋白分别与CSFV、PRRSV、PRV和PCV2抗血清的反应;17~20. 截短p72蛋白分别与CSFV、PRRSV、PRV和PCV2抗血清的反应 M. Protein marker with molecular weights of 100, 70, 50, 40, 30 and 25 ku from high to lower; lanes 1-10. ASFV-antibody positive porcine serum; lanes 11-12. ASFV-antibody negative porcine serum; lanes 13-16. The reaction of p72 protein with anti-CSFV, PRRSV, PRV and PCV2 sera, respectively; lanes 17-20. The reaction of truncated p72 protein with anti-CSFV, PRRSV, PRV and PCV2 sera, respectively 图 8 ASFV抗体的Western blot检测 Fig. 8 Detection of ASFV antibodies by Western blot |
目前,ASFV的检测技术主要有针对病毒DNA的分子生物学检测方法和针对病毒的抗原或抗体的免疫学检测技术两大类[11]。ASFV检测方法主要有ELISA和PCR(荧光定量PCR和普通PCR)。p72蛋白在病毒感染晚期表达,该蛋白的表达是ASFV在宿主或细胞内复制的指示器,并且其免疫原性强且稳定,能诱导猪产生高效价的特异性抗体。此外,p72在不同毒株之间高度保守[6, 12],因此,p72蛋白是目前ASF分子生物学和血清学检测技术研究中最受关注的诊断靶标[13-14],国内也有关于表达全长或截短p72蛋白的研究报道[15-16],但尚未见到比较分析全长与截短p72蛋白抗原性的报告,而蛋白的抗原性对于制备多克隆抗体和建立抗体检测方法至关重要。同时,在试验过程中,作者发现p72蛋白相对分子质量较大,纯化相对困难。故本研究通过比较全长和截短p72蛋白的抗原性,筛选纯化方便、抗原性好的检测抗原,旨在为建立特异性与灵敏度高的抗体检测方法提供必要实验材料。
为了获得容易制备的检测ASFV-p72特异抗体的蛋白抗原,本研究在初步分析p72蛋白推导氨基酸序列及其抗原表位的基础上,设计了扩增全长和截短p72蛋白的引物,用于构建重组表达质粒。在设计蛋白表达引物时考虑到截短蛋白应包括p72蛋白的大部分主要抗原表位的基本原则,以保证截短蛋白既方便表达和纯化,又具有良好的抗原性。在表达蛋白的提取纯化过程中发现全长p72蛋白的杂蛋白含量高于p72s蛋白,即便是纯化后,蛋白电泳检测时,全长蛋白仍然有少量的杂蛋白存在,而截短蛋白则无可见杂蛋白。这表明,截短p72蛋白更方便制备与纯化。
据预测,p72蛋白含有27个抗原表位,Heimerman等[17]用杆状病毒表达系统表达部分p72蛋白(aa 20—303) 作为免疫原制备出6株单克隆抗体,分别识别p72蛋白上的4个线性表位:aa 165—171、aa 265—280、aa 280—294和aa 290—303。本研究表达的截短p72蛋白(aa 141—502)包含全长p72蛋白预测表位中的17个表位,同时包含上述单抗识别的4个表位,提示截短与全长p72蛋白一样,具有良好的抗原性。为了比较全长和截短p72蛋白的抗原性,本研究通过动物免疫、ELISA和Western blot等试验从免疫原性和反应原性两方面检测了两者的抗原性。动物免疫试验结果发现,截短p72蛋白能够诱导小鼠产生更高效价的特异性抗体。基于截短和全长p72蛋白ELISA检测猪血清ASFV特异性抗体时,两者的检测结果高度一致,并且截短p72s蛋白高于全长p72蛋白的抗体阳性检出率。此结果与截短p72蛋白抗原的检测敏感性较高有关。随后,当用Western blot检测猪血清特异抗体时,也发现截短p72蛋白的抗体检出率明显高于全长p72蛋白的检测结果,尤其当血清抗体水平较低时,全长p72蛋白则无法检测到相应抗体,但截短p72则可以检测到。该结果表明,进行Western blot时,截短p72蛋白的反应敏感性更高。此结果的出现可能与截短p72蛋白分子量小,单位体积内抗原性强的抗原表位摩尔分子数多于全长p72蛋白的相应表位分子数有关,对此需要进一步试验证实。
4 结论通过表达全长和截短非洲猪瘟病毒p72蛋白并比较其抗原性,发现截短p72蛋白比p72蛋白具有更好的抗原性,可以用截短p72蛋白作为检测抗原用于研发ASFV-ELISA抗体检测方法,当进行Western blot时,截短p72蛋白与特异性抗体反应的敏感性更高。
| [1] |
SÁNCHEZ-VIZCAÍNO J M, MUR L, GOMEZ-VILLAMANDOS J C, et al. An update on the epidemiology and pathology of African swine fever[J]. J Comp Pathol, 2015, 152(1): 9-21. DOI:10.1016/j.jcpa.2014.09.003 |
| [2] |
SÁNCHEZ-CORDÓN P J, MONTOYA M, REIS A L, et al. African swine fever: a re-emerging viral disease threatening the global pig industry[J]. Vet J, 2018, 233: 41-48. DOI:10.1016/j.tvjl.2017.12.025 |
| [3] |
ZHOU X T, LI N, LUO Y Z, et al. Emergence of African swine fever in China, 2018[J]. Transbound Emerg Dis, 2018, 65(6): 1482-1484. DOI:10.1111/tbed.12989 |
| [4] |
GAUDREAULT N N, MADDEN D W, WILSON W C, et al. African swine fever virus: an emerging DNA arbovirus[J]. Front Vet Sci, 2020, 7: 215. DOI:10.3389/fvets.2020.00215 |
| [5] |
REVILLA Y, PÉREZ-NÚEZ D, RICHT J A. African swine fever virus biology and vaccine approaches[J]. Adv Virus Res, 2018, 100: 41-74. |
| [6] |
JIA N, OU Y W, PEJSAK Z, et al. Roles of African swine fever virus structural proteins in viral infection[J]. J Vet Res, 2017, 61(2): 135-143. DOI:10.1515/jvetres-2017-0017 |
| [7] |
杨文兵, 邹亚文, 蒋一凡, 等. 非洲猪瘟血清学诊断靶点的研究进展[J]. 畜牧兽医学报, 2021, 52(5): 1208-1217. YANG W B, ZHOU Y W, JIANG Y F, et al. Advances research on African swine fever serological diagnostic targets[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(5): 1208-1217. (in Chinese) |
| [8] |
BOSCH-CAMÓS L, LÓPEZ E, RODRIGUEZ F. African swine fever vaccines: a promising work still in progress[J]. Porc Health Manag, 2020, 6(1): 17. DOI:10.1186/s40813-020-00154-2 |
| [9] |
DIXON L K, SUN H, ROBERTS H. African swine fever[J]. Antiviral Res, 2019, 165: 34-41. DOI:10.1016/j.antiviral.2019.02.018 |
| [10] |
TEKLUE T, SUN Y, ABID M, et al. Current status and evolving approaches to African swine fever vaccine development[J]. Transbound Emerg Dis, 2020, 67(2): 529-542. DOI:10.1111/tbed.13364 |
| [11] |
GALLARDO M C, DE LA TORRE REOYO A, FERNÁNDEZ-PINERO J, et al. African swine fever: a global view of the current challenge[J]. Porc Health Manag, 2015, 1(1): 21. DOI:10.1186/s40813-015-0013-y |
| [12] |
BAO J Y, WANG Q H, LIN P, et al. Genome comparison of African swine fever virus China/2018/AnhuiXCGQ strain and related European p72 genotype Ⅱ strains[J]. Transbound Emerg Dis, 2019, 66(3): 1167-1176. DOI:10.1111/tbed.13124 |
| [13] |
LUO Y Z, ATIM S A, SHAO L N, et al. Development of an updated PCR assay for detection of African swine fever virus[J]. Arch Virol, 2017, 162(1): 191-199. DOI:10.1007/s00705-016-3069-3 |
| [14] |
SASTRE P, PÉREZ T, COSTA S, et al. Development of a duplex lateral flow assay for simultaneous detection of antibodies against African and Classical swine fever viruses[J]. J Vet Diagn Invest, 2016, 28(5): 543-549. DOI:10.1177/1040638716654942 |
| [15] |
陈金凤, 乐伟, 何永, 等. 非洲猪瘟病毒p72蛋白的原核表达和多克隆抗体制备[J]. 江西农业大学学报, 2021, 43(1): 153-160. CHEN J F, LE W, HE Y, et al. Prokaryotic expression of African swine fever Virusp72 protein and preparation of polyclonal antibodies[J]. Acta Agriculturae Universitatis Jiangxiensis, 2021, 43(1): 153-160. (in Chinese) |
| [16] |
庚辛, 孙明霞, 王淑杰, 等. 非洲猪瘟病毒p72蛋白间接ELISA抗体检测方法的建立[J]. 中国预防兽医学报, 2021, 43(9): 946-951. GENG X, SUN M X, WANG S J, et al. Prokaryotic expression of African swine fever p72 protein and development of indirect ELISA method[J]. Chinese Journal of Preventive Veterinary Medicine, 2021, 43(9): 946-951. (in Chinese) |
| [17] |
HEIMERMAN M E, MURGIA M V, WU P, et al. Linear epitopes in African swine fever virus p72 recognized by monoclonal antibodies prepared against baculovirus-expressed antigen[J]. J Vet Diagn Invest, 2018, 30(3): 406-412. DOI:10.1177/1040638717753966 |
(编辑 白永平)



