2. 承德市农林科学院,承德 067000;
3. 内蒙古自治区农牧业科学院,呼和浩特 010031
2. Chengde Academy of Agriculture and Forestry Sciences, Chengde 067000, China;
3. Inner Mongolia Academy of Agricultural and Animal Husbandry Sciences, Hohhot 010031, China
可变剪切又叫选择性剪切(alternative splicing, AS),普遍存在于真核生物体内,是一种保守的生物学过程,指主要基因或者mRNA前体转录所产生的RNA的外显子以多种方式通过RNA剪切进行重连,由此产生的不同mRNA可能被翻译成不同的蛋白质构体。随着RNA-Seq测序技术的广泛应用,在人类基因组中发现参与编码蛋白质的基因大约有21 000个,约95%的基因可以发生可变剪切,且不同的可变剪切事件的调控方式也具有差异性[1-3]。因此,可变剪切对真核生物的生长繁殖、信号传导等生物学现象的研究有重要意义。
基因筛选中发现,控制哺乳动物减数分裂同源重组过程的关键基因主要有SPO11、MSH4、MSH5、RAD51、DMC1、MLH1和EXO1等[4],其中MEI1基因首次在胚胎干细胞化学诱变产生的不育小鼠体内筛选分离,也是在哺乳动物中发现的第一个通过正向遗传学方法确定的减数分裂特异性突变型基因,被初步描述为显示雄性减数分裂缺陷的突变体。研究发现,MEI1被定位在人类的22号染色体和小鼠的15号染色体上,分别在睾丸组织和性腺中高表达[5]。MEI1基因发生突变不仅可以引起复发性葡萄胎,其双等位基因突变也与早期胚胎阻滞和复发性着床失败有关[6]; 另外,Mathilde等[7]也发现,MEI1缺陷卵母细胞能够受精并启动胚胎发育过程,但大多数在2~4细胞期停止发育。在减数分裂过程中,重组是由蛋白SPO11诱导的双链断裂(DSBs)形成而开始的,研究发现MEI1是一个包含BRCA1 C端结构域的蛋白,特异性调控减数分裂细胞周期,并在一些不依赖于SPO11 DSBs重组修复的DNA修复事件中发挥关键作用,是脊椎动物精子发生过程中减数分裂前期DNA DSBs形成所必需的[8-9]。综上,MEI1基因参与调控精子生成和卵母细胞减数分裂过程。
睾丸作为雄性动物的重要生殖器官,有产生精子和雄性生殖激素的作用。睾丸细胞包括间质细胞、支持细胞(SC)和生殖细胞,且均对精子发生起调控作用[10]。其中SC附着在曲细精管基膜上,包围着不同生长阶段的生精细胞,内含发达的内质网、线粒体、核糖体和高尔基体等,有利于合成、运输多种促进生精细胞发生所必需的营养因子并参与构成血睾屏障(blood-testis barrier, BTB)[11-14]。研究发现,SC能促进精索形成,为生物体青春期精子发生过程中的细胞生理和代谢提供支持,保证生殖细胞分化、减数分裂和向精子转化过程的正常发生[15-16]。SC还通过活跃的自噬行为调节雄激素结合蛋白(ABP)代谢,为生精细胞提供高浓度雄激素环境[14]。此外,睾丸SC作为精原干细胞(SSCs)生态位和BTB结构的主要贡献者,在精原细胞生态位和BTB破坏和恢复的过程中发挥着核心作用,保证雄性生物体功能性睾丸的正常发育[17]。SC上还存在多种与精子发生相关的因子及其受体,例如:雄性激素(MH)、促卵泡激素(FSH)、胶质细胞源性神经营养因子(GDNF)、纤溶酶原激因子(PA)等,并促进几种生物活性肽生成,促进支持精子发生和生殖细胞之间的联系,从而支持生殖能力,参与调控精子发生过程[18-25]。
本课题组在前期转录组测序研究中发现,性成熟后的蒙古马睾丸组织中,发生可变剪切ES事件的MEI1基因在性成熟后的睾丸组织中表达量较高,且差异显著,说明MEI1基因的可变剪切方式可能与精子生成有关。因此,本试验以MEI1为目的基因,以未发生ES事件的MEI1-1为对照组,以发生ES事件的MEI1-2为试验组,设计构建MEI1-1-pIRES2-EGFP和MEI1-2-pIRES2-Dsred两种质粒并转染至蒙古马SC,CCK-8检测转染细胞的增殖及活力情况,qRT-PCR检测减数分裂相关基因在两类细胞中的差异表达情况。探索MEI1发生ES可变剪切事件对蒙古马精子生成的调控作用,实现利用分子调控技术提高马的精子数量和精液品质,有效提高繁殖效率,降低生产成本,加快遗传进展,促进种群繁衍。
1 材料与方法 1.1 试验材料1.1.1 试验对象 研究所需的支持细胞(SC)来源于两岁蒙古马的睾丸,细胞的分离及体外培养严格参照本实验室的操作进行[26]。
1.1.2 主要仪器、试剂 生物超净台(ESCO)、倒置荧光显微镜(OLYMPUS)、超低温冰箱-80 ℃(Haier)、高压灭菌锅(YAMATO)、恒温水浴锅(YiTong)、电子天平(OHAUS)、磁力搅拌器(LIA)、纯水仪(OLABO)、琼脂糖凝胶电泳仪(北京六一生物科技)、台式离心机(常州润华电器)、细胞培养皿(Corning); 凝胶成像仪、CFX实时荧光定量PCR仪、普通PCR反应扩增仪均购自Bio-Rad; 酶标仪、CO2恒温培养箱均购自Thermo; 不同规格的移液枪、高速冷冻离心机均购自Eppendorf。
Insulin、谷氨酰胺、DMEM/F12、NaHCO3、DMSO、G418均购自Sigma; DPBS、FBS、0.25% Trypsin-EDTA(1×)均购自Gibco; LipofectamineTM 3000、PureLinkTM HiPure Plasmid Maxiprep Kit、High-Capacity cDNA Reverse Transcription Kits均购自Thermo; miRNeasy Mini Kit(QIAGEN)、CCK-8细胞活力检测试剂盒(biosharp)、TB GreenTMPremix EX TaqTMⅡ (Tli RNaseH Plus, TaKaRa)。
1.2 试验方法1.2.1 MEI1发生和未发生可变剪切事件载体的构建 命名未发生ES事件的MEI1基因为MEI1-1,发生ES事件的MEI1基因为MEI1-2。
1.2.1.1 MEI1-1-pIRES2-EGFP载体的构建 从NCBI数据库中获取已公布的家马(equus caballus)MEI1基因序列(XM_023631220),用Primer 5.0软件进行引物设计。在空载体pIRES2-EGFP上插入长度为3 840 bp的MEI1序列,克隆位点为Xho l (CTCGAG)- Sma l(CCCGGG),测序并绘制重组质粒图谱。
1.2.1.2 MEI1-2-pIRES2-Dsred载体的构建 Premier 5.0软件进行引物设计(引物信息见表 1)。分别用MEI1-2-Xho l-F/MEI1-2up-R,MEI1-2 down-F/ MEI1-2-Sma l-R为引物,以MEI1基因合成的MEI1-1为模板扩增2个片段,琼脂糖凝胶电泳检测PCR扩增产物并将2个片段产物回收纯化备用。Overlapping PCR扩增MEI1-2基因,扩增产物经琼脂糖凝胶电泳检测,回收目的产物进行Xho l、Sma l双酶切,并构建到同样酶切的pIRES2-Dsred载体上,进行测序,绘制重组质粒图谱。
|
|
表 1 引物序列信息 Table 1 Primer sequence information |
1.2.2 两种质粒转染蒙古马支持细胞 质粒大提后酶标仪检测质粒的浓度及纯度,分装并于-20 ℃保存备用。实验室前期研究发现,第三代的蒙古马睾丸SC活性最高,因此复苏第二代SC,传代至大皿获得活性及长势较好的第三代蒙古马SC,待细胞长至70%~90%汇合度时用LipofectamineTM 3000将两种质粒转染于SC。在37 ℃,5% CO2的细胞培养箱培养6 h后换液,并在转染24、48、72 h时在荧光显微镜下记录转染情况。用CCK-8试剂盒分析转染细胞的活力及增殖,分析比较同一转染时间点两种质粒转染细胞的差异性。
1.2.3 CCK-8检测转染细胞的增殖及活性 96孔板中体外培养第三代蒙古马SC,待长至70%~90%细胞汇合度时转染两种质粒。分别再转染0、24、48、72 h时(每个时间点设置6个平行)加入100 μL新的完全培养液和10 μL CCK-8溶液(尽量不要在孔中生成气泡)并于恒温培养箱中孵育1~4 h,酶标仪测定在450 nm处的吸光度,检测转染细胞的增殖及活性情况。
1.2.4 G418筛选转染细胞 构建的两种载体均带有新霉素筛选标记(G418),便于提高转染效率,增加后续试验的准确性。预试验确定G418最佳筛选浓度,以便后续试验的连续性。在转染效率最高、细胞活性最好时添加最佳筛选浓度的G418筛选转染细胞,每3 d换液,待细胞长至90%时收集细胞,用于后续试验。
1.2.5 提取转染细胞的总RNA并反转录成cDNA 经G418筛选的转染细胞长至90%汇合度时进行胰酶消化、1 500 r·min-1离心5 min、小心弃上清收集细胞,标注转染质粒的名称; miRNeasy Mini Kit试剂盒提取细胞总RNA; 酶标仪检测RNA浓度及纯度,并迅速将RNA反转录成cDNA,-20 ℃保存备用。
1.2.6 qRT-PCR检测减数分裂相关基因在细胞中的差异表达情况 以转染MEI1-1-pIRES2-EGFP的SC细胞为对照组,转染MEI1-2-pIRES2-Dsred的SC细胞为试验组,GAPDH作为内参基因进行校正,检测减数分裂通路部分验证基因及支持细胞信号通路在精子发生减数分裂调节中的部分因子在两种细胞中的表达量。Primer premier5.0进行引物设计(表 2),并由上海生工生物工程有限公司合成。
|
|
表 2 引物序列信息 Table 2 Primer sequence information |
反应体系:TB Green 5 μL,上、下游引物各0.4 μL,cDNA模板1 μL,RNase-free ddH2O 3.2 μL。反应条件:94 ℃预变性4 min; 94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min 20 s,共30个循环; 60 ℃退火7 min; 4 ℃保存。反应结束后整理Ct值,采用单因素方差分析法进行数据分析。
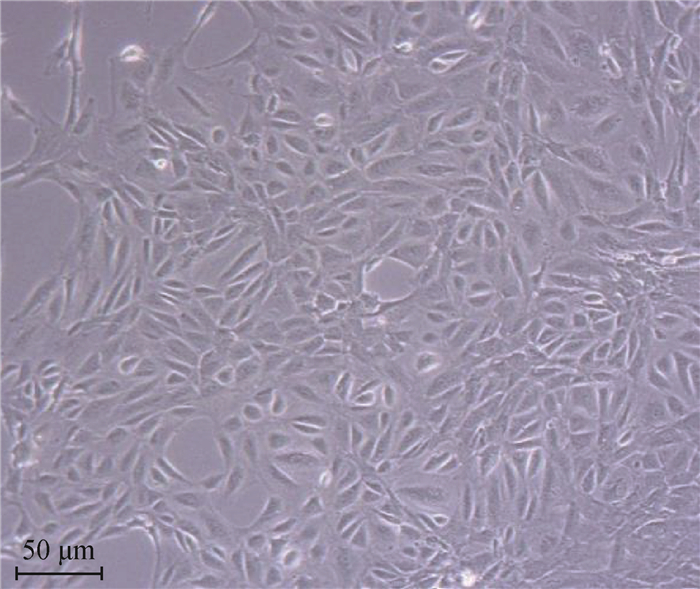
2 结果 2.1 第三代蒙古马SC培养复苏实验室冻存的第二代蒙古马SC,经一次传代继续培养,在光学显微镜下观察如图 1所示,细胞增殖速度快、长势较好、形态一致且未有老化的现象,符合后续细胞转染试验的要求。
|
图 1 培养第3天的第3代蒙古马SC Fig. 1 The 3rd generation of Mongolian horse SC on the 3rd day of culture |
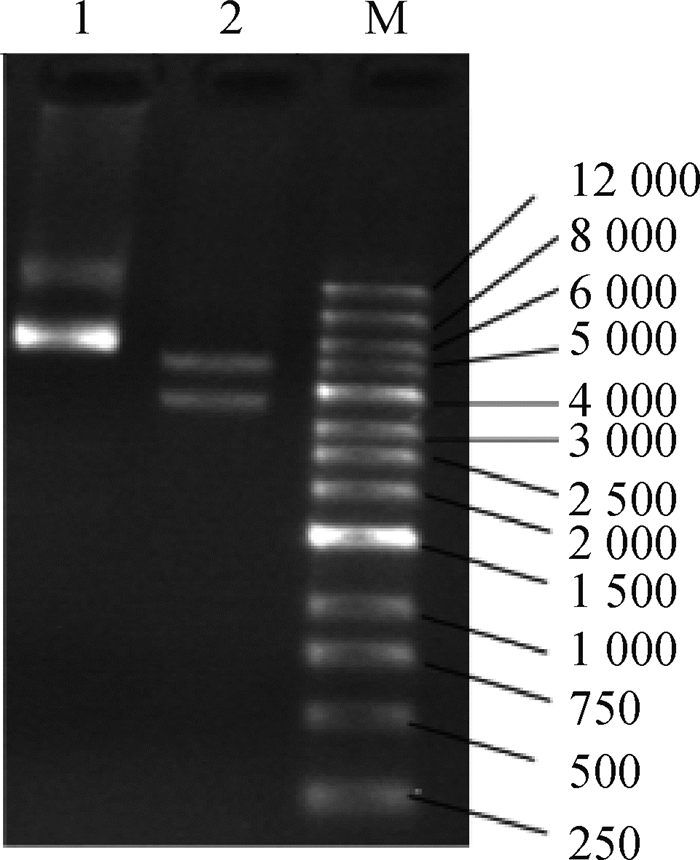
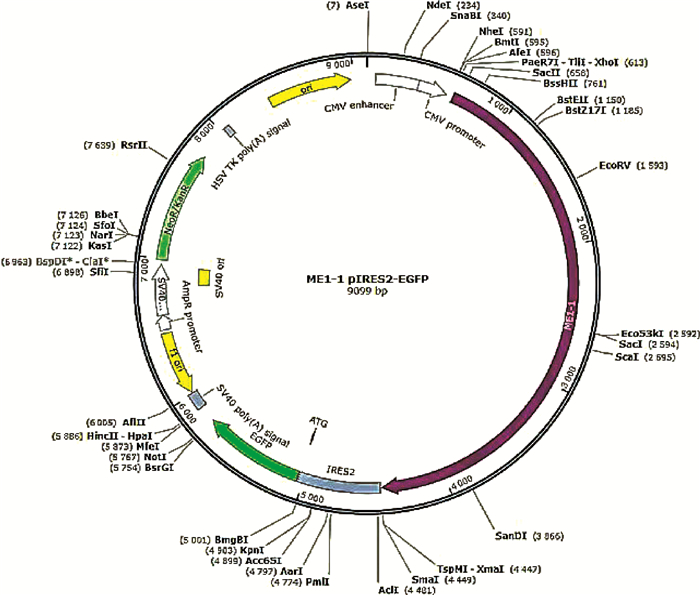
2.2.1 MEI1-1-pIRES-EGFP载体构建结果与分析 将合成的MEI1-1基因通过Xho l(CTCGAG)和Sma l(CCCGGG)克隆位点构建到pIRES2-EGFP空载体上。琼脂糖凝胶电泳检测构建结果如图 2所示,目的条带与目的基因片段的长度相一致,证明MEI1-1-pIRES2-EGFP质粒构建成功。绘制MEI1-1-pIRES2-EGFP重组质粒质谱图见图 3,MEI1-1基因通过Xho l和Sma l克隆位点插入带有绿色荧光蛋白并具有卡那抗性的pIRES2- EGFP空载体中,质粒全长9 099 bp,其中插入的MEI1-1基因3 840 bp。该载体同时具有新霉素(G418)筛选标记,便于提高转染效率和后续qRT-PCR的准确性。
|
1.质粒; 2. Xho l-Sma l酶切质粒; M. DNA相对分子质量标准 1. Plasmid; 2. Plasmid digested with Xho l-Sma l; M. DNA marker 图 2 MEI1-1-pIRES2-EGFP琼脂糖凝胶电泳检测 Fig. 2 MEI1-1-pIRES2-EGFP was detected by agarose gel electrophoresis |
|
图 3 MEI1-1-pIRES2-EGFP质粒图谱 Fig. 3 Plasmid profile of MEI1-1-pIRES2-EGFP |
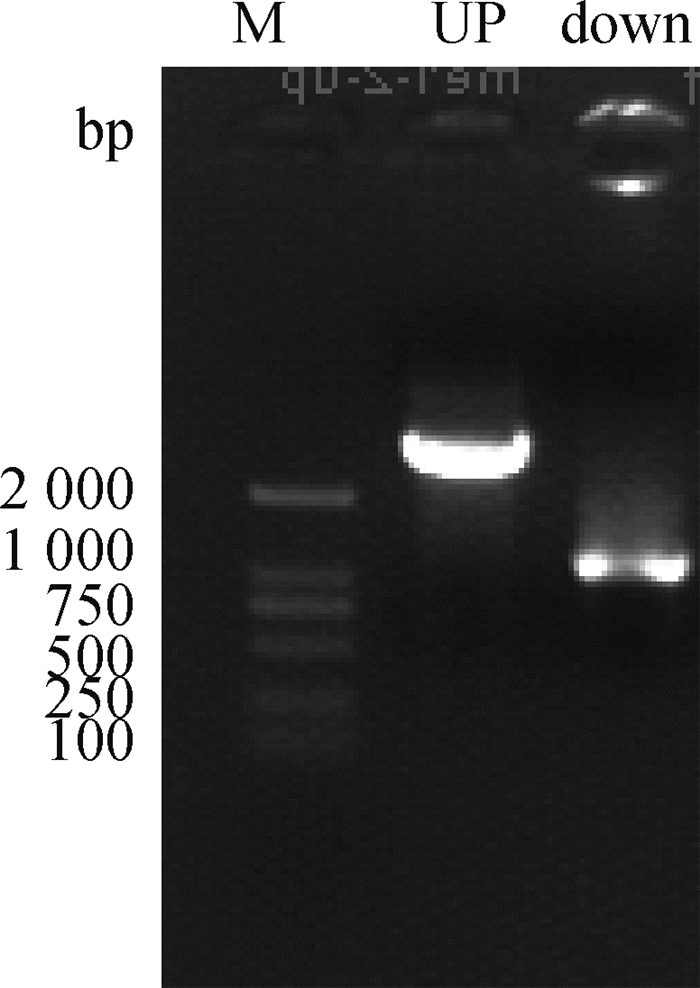
2.2.2 MEI1-2-pIRES2-Dsred载体构建结果与分析 分别以MEI1-2-Xho l-F/MEI1-2-up-R和MEI1-2-down-F/MEI1-2-Sma l-R为引物,以MEI1-1为模板扩增2个片段,琼脂糖凝胶电泳检测PCR扩增产物(图 4)。纯化扩增产物并用Overlapping PCR技术扩增MEI1-2基因,琼脂糖凝胶电泳检测扩增产物(图 5),将产物2纯化回收,经双酶切构建到同样酶切的空载体上。经测序构建重组质粒图谱(图 6),质粒全长8 951 bp,带有红色荧光蛋白并具有卡那抗性和新霉素筛选标记,便于后续转染试验的观察分析和筛选,提高转染效率,减少qRT- PCR的误差,保证试验的准确性。
|
Up. 以MEI1-2-Xho l-F/MEI1-2-up-R为引物扩增的产物; down. 以MEI1-2-down-F/MEI1-2-Sma l-R为引物扩增的产物 Up.The product was amplified with MEI1-2-Xho l-F/MEI1-2-up-R as primer; down. The product was amplified with MEI1-2-down-F/MEI1-2-Sma l-R as primer 图 4 MEI1-2-up片段及down片段扩增琼脂糖凝胶电泳检测 Fig. 4 Agarose gel electrophoresis detection of amplified MEI1-2-up and down fragments |
|
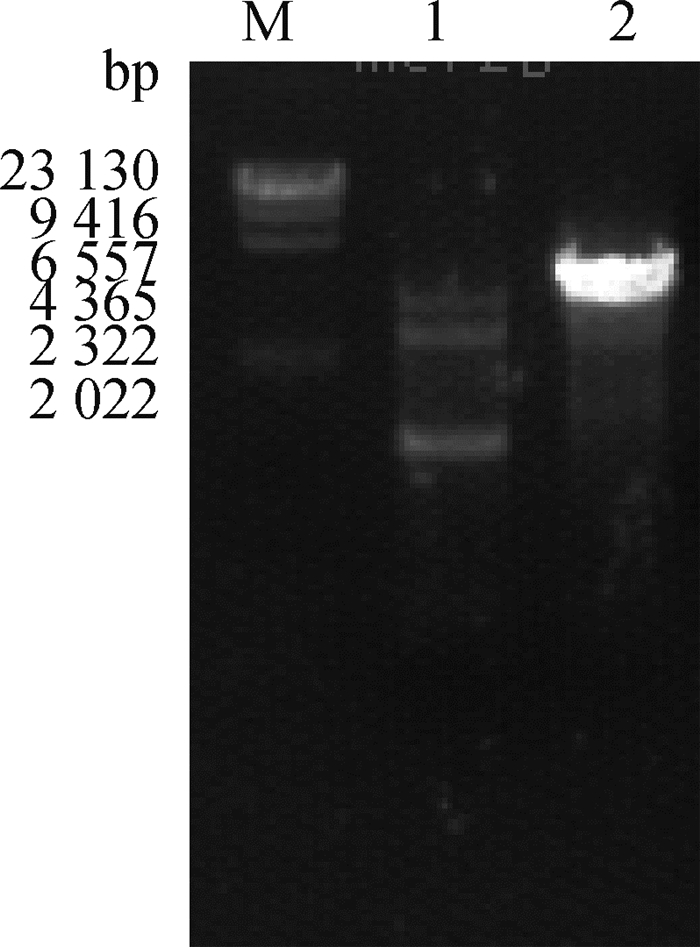
M. DNA相对分子质量标准; 1、2. 分别为不同融合的1个PCR产物 M. λDNA Hindiii digest marker; 1, 2. One PCR product of different fusion, respectively 图 5 MEI1-2融合扩增检测 Fig. 5 MEI1-2 overlamed PCR |
|
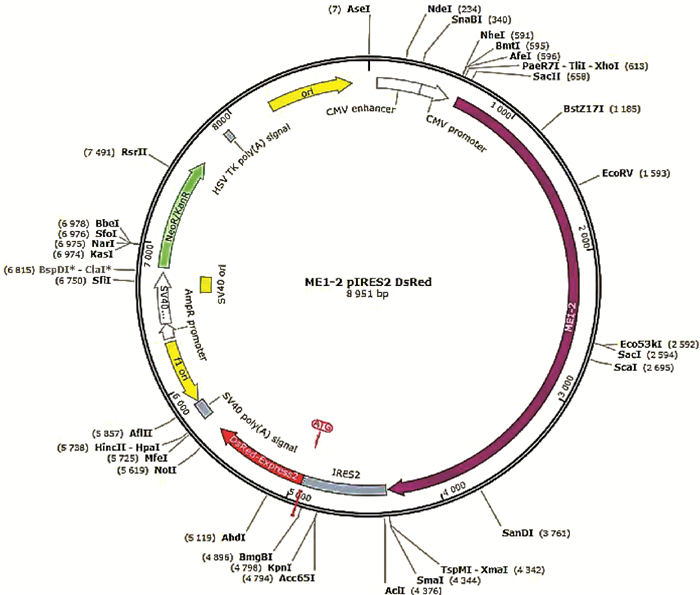
图 6 MEI1-2-pIRES2-Dsred质粒图谱 Fig. 6 Plasmid profile of MEI1-2-pIRES2-Dsred |
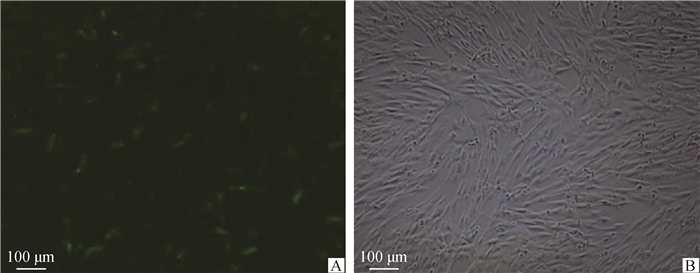
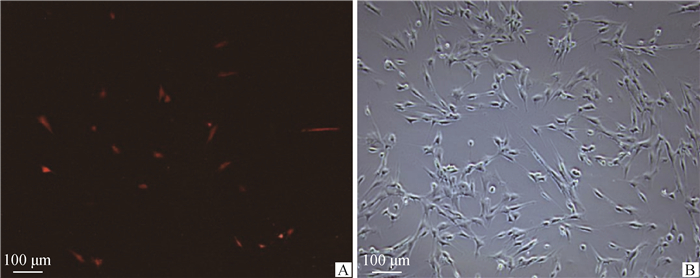
构建的两种质粒分别在转染SC 24、48、72 h时观察转染效率。比较发现,两种质粒均在转染48 h时转染效率最高(图 7、图 8)。
|
A.暗场像; B.明场像 A. Dark field image; B. Bright field image 图 7 MEI1-1-pIRES2-EGFP转染SC 48 h Fig. 7 MEI1-1-pIRES2-EGFP was transfected into SC for 48 hours |
|
A.暗场像; B.明场像 A. Dark field image; B. Bright field image 图 8 MEI1-2-pIRES2-Dsred转染SC 48 h Fig. 8 MEI1-2-pIRES2-Dsred was transfected into SC for 48 hours |
根据检测数据用XLSX工作表作图(图 9)显示,转染两种质粒的细胞在转染0~72 h之间细胞增殖及活力状况呈“S”形趋势,均先下降再上升再下降,其中在转染0~24 h曲线下降,但转染MEI1-1-pIRES-EGFP质粒的细胞活性高于转染MEI1-2-pIRES2-Dsred质粒的细胞; 在转染24~72 h曲线先上升后下降,且转染MEI1-2-pIRES2-Dsred质粒细胞的活性较转染MEI1-1-pIRES-EGFP质粒的细胞的活性增长速度快,并在48 h时两种质粒转染的细胞活性最高,可用于转染后细胞的筛选。

|
图 9 CCK-8检测转染细胞的增殖及活性折线图 Fig. 9 Proliferation and activity of transfected cells were detected by CCK-8 |
细胞转染48 h时添加预试验摸索的G418最佳筛选浓度(350 μg·mL-1),每3 d更换一次新的完全培养液直至细胞长至90%汇合度时荧光显微镜拍照观察(图 10、图 11)筛选结果并收集细胞。由图可知,经G418筛选的两种质粒转染的细胞,转染效率均明显提高,有利于减小后续qRT-PCR的误差。

|
A.暗场像; B.明场像 A. Dark field image; B. Bright field image 图 10 G418筛选MEI1-1-pIRES2-EGFP质粒转染SC Fig. 10 G418 screens SC with MEI1-1-pIRES2-EGFP plasmid |

|
A.暗场像; B.明场像 A. Dark field image; B. Bright field image 图 11 G418筛选MEI1-2-pIRES2-Dsred质粒转染SC Fig. 11 G418 screens SC with MEI1-2-pIRES2-Dsred plasmid |
利用荧光信号积累实时监测整个qRT-PCR过程,以F=2-ΔΔCt为运算公式并用SPSS进行单因素方差分析(ANOVA),并用Graphpad作图。如图 12所示,目的基因在两种细胞内表达量均差异显著,且在MEI1-2-pIRES2-Dsred转染的SC细胞内表达量均高于MEI1-1-pIRES2-EGFP转染SC细胞的表达量。证明发生ES事件的MEI1在SC中的表达量高于未发生ES事件的MEI1表达量,且经SC更有利于调控减数分裂和精子发生过程,影响精子生成。

|
A、B、C. 减数分裂通路部分验证基因检测结果; D. 支持细胞信号通路中调节精子发生减数分裂的部分因子检测结果 A, B, C. The results of partial verification of genes in the meiosis pathway; D. The detection results of some factors in sertoli cell signaling pathways that regulate spermatogenesis meiosis 图 12 qRT-PCR检测结果图 Fig. 12 Figure of qRT-PCR results |
随着测序技术的广泛应用,越来越多的研究表明正常的可变剪切事件可以丰富基因组和蛋白质组的多样性、调控生物体的生长发育过程,异常的可变剪切事件可能会引发生物体疾病[27]。有研究发现,SALL4可变剪切体调控损伤会导致心和肾发育缺陷,还可能会引起中国女性卵巢发育不成熟[28]; WT1突变体缺陷(-KTS)会影响生殖嵴细胞的增殖,增加性腺前部区域的凋亡细胞数量,影响原始生殖细胞的增殖[29-30]; 特异性敲除生殖细胞中Ranbp9后会导致精母细胞和精细胞大量缺失[31]; Rbm5缺失会导致大量功能性基因的pre-mRNA剪接发生异常,影响雄性动物生育功能[32]; 特异性敲除雄性生殖细胞中的PTBP2会造成精母细胞的大量凋亡和精细胞分化的停滞,并且伴随生殖细胞mRNA的可变剪接严重异常,影响雄性生殖细胞的存活等[33]。由此可见,可变剪接以其独特的调控方式广泛参与精子生成过程,为雄性生殖细胞的健康发育提供了坚实基础。
MEI1是已发现的正常减数分裂染色体突触中的必需基因,并可能参与生殖细胞减数分裂DSBs的形成过程。我们在前期转录组测序研究中发现,发生可变剪切ES事件的MEI1基因在性成熟后的睾丸组织中表达量较高,且差异显著,说明MEI1基因的可变剪切方式可能与精子生成有关。而睾丸SC作为唯一一种可以直接接触不同发育阶段的生精细胞的体细胞,不仅参与形成BTB,为精子发生提供稳定的微环境,还分泌多种营养因子促进精子的发生。因此,本试验以蒙古马SC为目的细胞,探索MEI1发生和不发生ES事件对精子生成的影响。结果表明,在细胞增殖检测结果中,转染发生可变剪切事件的MEI1过表达载体的SC生长情况明显优于转染未发生可变剪切的SC。说明MEI1基因可变剪切确实有效促进了支持细胞生长,从而促进成熟精子生成。
减数分裂发生期间非同源染色体自由组合、同源染色体非姐妹染色单体间部分片段发生交叉互换(基因重组)增加了基因变异种类和配子的遗传多样性,有利于物种适应不断发生变化的环境,保证物种的延续[34]。为了研究睾丸SC细胞与精子发生过程的关系,选取部分减数分裂通路上的关键基因,检测其在两类细胞中的差异表达情况。其中,PPP2R5C突变会影响细胞增殖、加速细胞凋亡速度并可能导致正常细胞转化为恶性细胞[35-36]; 下调SKP1会提高早期胚胎染色体结构或数目变异几率,促进胚胎早期发育的同时增加了早期胚胎的死亡率[37]; CUL1与SKP1共同介导蛋白质降解过程,调控细胞周期和早期胚胎发育过程[38-39]; 敲除雄性小鼠睾丸中的CCNB1和CCNB2后,精原细胞不能正常增殖,凋亡增加,导致不育[40-42]等。结果显示,目的基因表达量均在发生可变剪切的细胞上较高,且差异显著。说明MEI1基因的可变剪切确实上调了减数分裂相关基因的表达,从而影响精子生成活动。
睾丸支持细胞不仅为生精细胞的发生提供多种营养因子,并参与构成有利于精子发生的一种微环境,保护支持生精细胞的增殖和发育。为了研究发生ES事件的MEI1基因通过睾丸SC调控精子生成过程,选取支持细胞信号通路上与精子发生减数分裂调节中的部分因子检测其在两类细胞中的差异表达情况。其中,FSH可以提高动物的排卵数和繁殖率,当其作用于睾丸曲细精管时则可以提高精子的形成能力[43]; GDNF受FSH和睾酮的调控作用促进睾丸SC的增殖和BTB的形成[20, 44]; ARID家族参与调控细胞增殖发育过程,主要与基因表达及染色质重塑有关[45]; Stra8基因是启动减数分裂的重要基因,是保证精子发生过程正常进行的决定性因素[46]等。结果显示,目的基因均在发生可变剪切的细胞上表达较活跃,且差异显著。说明MEI1基因的可变剪切促进了支持细胞的活性,并最终促进精子生成。
4 结论本研究通过对MEI1-1-pIRES2-EGFP和MEI1-2-pIRES2-Dsred载体的构建,利用CCK-8试剂盒、实时荧光定量PCR等技术检测转染蒙古马睾丸支持细胞后SC的增殖及基因的表达情况,证实MEI1发生可变剪切事件有助于细胞的生长和增殖,与减数分裂相关的基因在转染后两类细胞中的表达量差异显著,且均在转染MEI1-2-pIRES2-Dsred的SC内表达量较高,证明发生ES事件的MEI1基因更有利于促进减数分裂和精子发生过程。本试验可为进一步的蒙古马育种工作提供依据,更加全面、深入探索基因可变剪切事件对精子生成的调控作用。
| [1] |
MORAES F, GÓES A. A decade of human genome project conclusion: Scientific diffusion about our genome knowledge[J]. Biochem Mol Biol Educ, 2016, 44(3): 215-223. DOI:10.1002/bmb.20952 |
| [2] |
PAN Q, SHAI O, LEE L J, et al. Deep surveying of alternative splicing complexity in the human transcriptome by high-throughput sequencing[J]. Nat Genet, 2008, 40(12): 1413-1415. DOI:10.1038/ng.259 |
| [3] |
PENNOCK N D, JINDAL S, HORTON W, et al. RNA-seq from archival FFPE breast cancer samples: molecular pathway fidelity and novel discovery[J]. BMC Med Genomics, 2019, 12(1): 195. DOI:10.1186/s12920-019-0643-z |
| [4] |
骆骅. 黄牛和犏牛睾丸组织中减数分裂同源重组基因表达、克隆与启动子区甲基化分析[D]. 南京: 南京农业大学, 2013. LUO H. Expression, cloning and promoter methylation status of the genes correlated with meiotic recombination in the testis of cattle and cattle-yak[D]. Nanjing: Nanjing Agricultural University, 2013. (in Chinese) |
| [5] |
DONG J, ZHANG H, MAO X Y, et al. Novel biallelic mutations in MEI1:expanding the phenotypic spectrum to human embryonic arrest and recurrent implantation failure[J]. Hum Reprod, 2021, 36(8): 2371-2381. DOI:10.1093/humrep/deab118 |
| [6] |
SATO H, MIYAMOTO T, YOGEV L, et al. Polymorphic alleles of the human MEI1 gene are associated with human azoospermia by meiotic arrest[J]. J Hum Genet, 2006, 51(6): 533-540. DOI:10.1007/s10038-006-0394-5 |
| [7] |
MATHILDE G, GHISLAINE G, DANIEL V, et al. The Arabidopsis MEI1 gene encodes a protein with five BRCT domains that is involved in meiosis‐specific DNA repair events independent of SPO11‐induced DSBs[J]. Plant J, 2003, 35(4): 465-475. DOI:10.1046/j.1365-313X.2003.01820.x |
| [8] |
LIBBY B J, REINHOLDT L G, SCHIMENTI J C. Positional cloning and characterization of Mei1, a vertebrate-specific gene required for normal meiotic chromosome synapsis in mice[J]. Proc Natl Acad Sci U S A, 2003, 100(26): 15706-15711. DOI:10.1073/pnas.2432067100 |
| [9] |
NGUYEN N M P, GE Z J, REDDY R, et al. Causative mutations and mechanism of androgenetic hydatidiform moles[J]. Am J Hum Genet, 2018, 103(5): 740-751. DOI:10.1016/j.ajhg.2018.10.007 |
| [10] |
GUO J, LIU X, YANG Y W, et al. miR-375 down-regulation of the rearranged L-myc fusion and hypoxia-induced gene domain protein 1A genes and effects on Sertoli cell proliferation[J]. Asian-Australas J Anim Sci, 2018, 31(8): 1103-1109. DOI:10.5713/ajas.17.0338 |
| [11] |
李丹婷, 白利鹏. 支持细胞功能状态调控精子发生的研究进展[J]. 中华男科学杂志, 2018, 24(9): 829-833. LI D T, BAI L P. Role of Sertoli cells in regulating spermatogenesis: An update[J]. National Journal of Andrology, 2018, 24(9): 829-833. (in Chinese) |
| [12] |
HEINRICH A, POTTER S J, GUO L, et al. Distinct roles for Rac1 in sertoli cell function during testicular development and spermatogenesis[J]. Cell Rep, 2020, 31(2): 107513. DOI:10.1016/j.celrep.2020.03.077 |
| [13] |
MATZUK M M, LAMB D J. The biology of infertility: research advances and clinical challenges[J]. Nat Med, 2008, 14(11): 1197-1213. DOI:10.1038/nm.f.1895 |
| [14] |
NI F D, HAO S L, YANG W X. Multiple signaling pathways in Sertoli cells: recent findings in spermatogenesis[J]. Cell Death Dis, 2019, 10(8): 541. DOI:10.1038/s41419-019-1782-z |
| [15] |
AITKEN R J, BAKER M A. Causes and consequences of apoptosis in spermatozoa; contributions to infertility and impacts on development[J]. Int J Dev Biol, 2013, 57(2-4): 265-272. |
| [16] |
YI X D, ZHANG Y N, XIAO S. Role and regulatory mechanism of glycometabolism of Sertoli cells in spermatogenesis[J]. National Journal of Andrology, 2019, 25(10): 923-927. |
| [17] |
ABSALAN F, MOVAHEDIN M, MOWLA S J. Spermatogonial stem cell transplantation and subsequent orchidopexy in the bilateral cryptorchid mouse model[J]. Cell J, 2011, 13(3): 143-148. |
| [18] |
WU S W, YAN M, GE R S, et al. Crosstalk between sertoli and germ cells in male fertility[J]. Trends Mol Med, 2020, 26(2): 215-231. DOI:10.1016/j.molmed.2019.09.006 |
| [19] |
ZHOU R, WU J R Z, LIU B, et al. The roles and mechanisms of Leydig cells and myoid cells in regulating spermatogenesis[J]. Cell Mol Life Sci, 2019, 76(14): 2681-2695. DOI:10.1007/s00018-019-03101-9 |
| [20] |
BUAGEAW A, SUKHWANI M, BEN-YEHUDAH A, et al. GDNF family receptor alpha1 phenotype of spermatogonial stem cells in immature mouse testes[J]. Biol Reprod, 2005, 73(5): 1011-1016. DOI:10.1095/biolreprod.105.043810 |
| [21] |
LOVELAND K L, HOGARTH C, MENDIS S, et al. Drivers of germ cell maturation[J]. Ann N Y Acad Sci, 2006, 1061(1): 173-182. |
| [22] |
LIU Y X, LIU K, QIANG F, et al. Tissue-type plasminogen activator and its inhibitor plasminogen activator inhibitor Type 1 are coordinately expressed during ovulation in the rhesus monkey[J]. Endocrinology, 2004, 145(4): 1767-1775. DOI:10.1210/en.2003-1327 |
| [23] |
RAMSDEN J D, YARRAM S, MATHEWS E, et al. Thyroid follicular cells secrete plasminogen activators and can form angiostatin from plasminogen[J]. J Endocrinol, 2002, 173(3): 475-481. DOI:10.1677/joe.0.1730475 |
| [24] |
MAK P H K, TUMBER P S. Postoperative sudden sensorineural hearing loss after posterior lumbar decompression: a case report[J]. Can J Anesth, 2003, 50(5): 519-521. DOI:10.1007/BF03021068 |
| [25] |
LEE J. Roles of cohesin and condensin in chromosome dynamics during mammalian meiosis[J]. J Reprod Dev, 2013, 59(5): 431-436. DOI:10.1262/jrd.2013-068 |
| [26] |
宋连杰, 崔迎迎, 赵一萍, 等. 蒙古马睾丸支持细胞的体外分离培养与鉴定[J]. 中国畜牧兽医, 2020, 47(9): 2751-2758. SONG L J, CUI Y Y, ZHAO Y P, et al. Isolation, culture and identification of testis sertoli cells in mongolian horses in vitro[J]. Chineseanimal Husbandry and Veterinary Medicine, 2020, 47(9): 2751-2758. (in Chinese) |
| [27] |
GRABOWSKI P J, BLACK D L. Alternative RNA splicing in the nervous system[J]. Prog Neurobiol, 2001, 65(3): 289-308. DOI:10.1016/S0301-0082(01)00007-7 |
| [28] |
王亚娴. SALL4可变剪切体的验证及其对OTX2的调控[D]. 杨凌: 西北农林科技大学, 2016. WANG Y N. Identifycation of SALL4 alternative splicings and their function to regulate OTX2 expression[D]. Yangling: Northwest A&F University, 2016. (in Chinese) |
| [29] |
孟凯. WT1基因调控牛卵泡颗粒细胞和膜细胞类固醇激素生成的研究[D]. 杨凌: 西北农林科技大学, 2019. MENG K. Research of WT1 gene on bovioe granulosa cells and theca cells steroidogenesis[D]. Yangling: Northwest A&F University, 2019. (in Chinese) |
| [30] |
HUMMITZSCH K, IRVING-RODGERS H F, HATZIRODOS N, et al. A new model of development of the mammalian ovary and follicles[J]. PLoS One, 2017, 8(2): e55578. |
| [31] |
PIPREK R P. Molecular mechanisms of cell differentiation in gonad development[M]. Switzerland: Springer International Publishing, 2016.
|
| [32] |
苟兰涛, 康俊炎, 刘默芳. 人Piwi基因突变致男性不育的机制研究[J]. 中国细胞生物学学报, 2017, 39(9): 1135-1138. GOU L T, KANG J Y, LIU M F. The study of human Piwi mutations in male infertility[J]. Chinese Journal of Cell Biology, 2017, 39(9): 1135-1138. (in Chinese) |
| [33] |
ZAGORE L L, GRABINSKI S E, SWEET T J, et al. RNA binding protein Ptbp2 is essential for male germ cell development[J]. Mol Cell Biol, 2015, 35(23): 4030-4042. DOI:10.1128/MCB.00676-15 |
| [34] |
CHENG C Y, MRUK D D. The blood-testis barrier and its implications for male contraception[J]. Pharmacol Rev, 2012, 64(1): 16-64. DOI:10.1124/pr.110.002790 |
| [35] |
SONTAG E. Protein phosphatase 2A: the Trojan Horse of cellular signaling[J]. Cell Signal, 2001, 13(1): 7-16. DOI:10.1016/S0898-6568(00)00123-6 |
| [36] |
李扬秋, 周羽竝, 杨力建. PPP2R5C基因结构特点和生物学功能[J]. 中国实验血液学杂志, 2009, 17(5): 1127-1129. LI Y Q, ZHOU Y B, YANG L J. Structural feature and biological function of PPP2R5C gene[J]. Journal of Experimental Hematology, 2009, 17(5): 1127-1129. (in Chinese) |
| [37] |
张万. PDRG1在中国卤虫胚胎滞育解除过程中的作用[D]. 大连: 辽宁师范大学, 2018. ZHANG W. The potential roles of the apoptosis related protein PDRG1 in diapause embryo restarting of Artemia sinica[D]. Dalian: Liaoning Normal University, 2018. (in Chinese) |
| [38] |
周代志. 合浦珠母贝BMP3和BMP10基因的克隆与功能初步研究[D]. 上海: 上海海洋大学, 2016. ZHOU D Z. Moleculer cloning and preliminary functional studies of BMP3 and BMP10 gene from pearl oyster, Pinctada fucata[D]. Shanghai: Shanghai Ocean University, 2016. (in Chinese) |
| [39] |
陈雷, 姚锋, 唐爽, 等. 刺参多功能表皮生长因子6(megf6)cDNA克隆及在肠再生过程中的表达分析[J]. 大连海洋大学学报, 2020, 35(2): 239-246. CHEN L, YAO F, TANG S, et al. cDNA cloning and expression of multiple epidermal growth factor 6(megf6) gene in sea cucumber Apostichopus japonicus during intestine regeneration[J]. Journal of Dalian Fisheries University, 2020, 35(2): 239-246. (in Chinese) |
| [40] |
刘亚男. RNA甲基化识别蛋白YTHDC2调控CCNB在锰致精子发生障碍中的作用[D]. 沈阳: 中国医科大学, 2020. LIU Y N. The role of RNA methylation recognition protein YTHDC2 in regulating CCNB in manganese-induced spermatogenesis disorders[D]. Shenyang: China Medical University, 2020. (in Chinese) |
| [41] |
TANG J X, LI J, CHENG J M, et al. Requirement for CCNB1 in mouse spermatogenesis[J]. Cell Death Dis, 2017, 8(10): e3142. DOI:10.1038/cddis.2017.555 |
| [42] |
BRANDEIS M, ROSEWELLl I, CARRINGTON M, et al. Cyclin B2-null mice develop normally and are fertile whereas cyclin B1-null mice die in utero[J]. Proc Natl Acad Sci U S A, 1998, 95(8): 4344-4349. DOI:10.1073/pnas.95.8.4344 |
| [43] |
吕松杰, 牛志刚, 丁煜恭, 等. 不同FSH处理方法对多浪羊同期发情效果的影响[J]. 草食家畜, 2021(2): 20-24. LV S J, NIU Z G, DING Y G, et al. Effects of different FSH treatments on synchronous estrus of Duolang sheep[J]. Grass-Feeding Livestock, 2021(2): 20-24. (in Chinese) |
| [44] |
STAUB C, JOHNSON L. Review: Spermatogenesis in the bull[J]. Animal, 2018, 12(S1): S27-S35. |
| [45] |
CAJUSO T, HÄNNINEN U A, KONDELIN J, et al. Exome sequencing reveals frequent inactivating mutations in ARID1A, ARID1B, ARID2 and ARID4A in microsatellite unstable colorectal cancer[J]. Int J Cancer, 2014, 135(3): 611-623. DOI:10.1002/ijc.28705 |
| [46] |
马海涛. Stra8在精子发生中作用机制的初步研究[D]. 扬州: 扬州大学, 2017. MA H T. Preliminary researches on the functional mechanism of Stra8 during-spermatogenesls[D]. Yangzhou: Yangzhou University, 2017. (in Chinese) |
(编辑 郭云雁)



