沙门菌(Salmonella)作为公共卫生学领域重要的人兽共患病原菌之一,广泛存在于自然界中,通过污染食物、水源等致人兽食物中毒和感染性腹泻[1-2]。沙门菌是导致我国人兽食源性细菌中毒的首要致病菌[3],目前已发现超过2 600种血清型[4],每年可造成全球至少9 300万人感染[5]。氟喹诺酮类(FQs)药物因其抗菌谱广、抗菌活性强、交叉耐药率低等优点,被认为是防治沙门菌感染的首选抗菌药物之一[6]。然而随着临床上滥用抗菌药物以及耐药基因的水平转移,沙门菌多重耐药现象日益严重,威胁到畜牧养殖业的生产和公共卫生健康,因此研究沙门菌的耐药机制,寻找抗菌药物新靶点,成为亟待解决的问题。
双组分系统(two component system,TCS)是细菌感应、传导外界信号,调节多种生命活动的基因表达调控系统[7]。BaeSR由组氨酸蛋白激酶感受元件BaeS和应答调控元件BaeR组成[8],在环境压力下,活化的BaeS导致BaeR磷酸化,从而激活靶基因转录,达到调控细菌耐药性或毒力的目的。BaeSR是鼠伤寒沙门菌中重要的双组分系统,最初在大肠杆菌中发现[9],与细菌毒力、耐药性密切相关。有研究表明,BaeSR可通过上调多重耐药泵AcrD和MdtABC的表达量来调控沙门菌的多重耐药[10]。BaeR通过降低大肠杆菌acrB缺失株外膜蛋白的表达水平来降低菌株对头孢菌素的敏感性[11]。目前有很多关于BaeSR对细菌耐药性调控机制的研究,然而BaeSR对鼠伤寒沙门菌耐药性调控的分子机制尚未完全清楚,因此拟探索鼠伤寒沙门菌BaeSR对耐药性的调控机制,寻找BaeR的潜在靶基因,丰富其调控通路。
本实验室在前期研究中构建了鼠伤寒沙门菌体外诱导环丙沙星耐药株(CR),并在CR基础上成功构建了baeSR和acrB基因双缺失株(CR△baeSR△acrB)、baeR过表达株(CRpbaeR△baeSR△acrB)及baeR回补株(CRcbaeR△baeSR△acrB),通过菌株生物学特性测定以及对采用转录组学技术筛选与耐药相关的差异表达基因的分析,发现BaeSR和AcrB外排泵影响耐药基因的表达。因此,本研究对BaeR进行表达、纯化与验证,并结合LacZ报告基因融合试验及凝胶阻滞试验(EMSA),旨在寻找BaeR的潜在靶基因,为深入阐明BaeSR对鼠伤寒沙门菌的耐药调控机制提供理论依据。
1 材料与方法 1.1 菌株鼠伤寒沙门菌体外诱导环丙沙星耐药株CR由本实验室保存,baeSR和acrB基因双缺失株(CR△baeSR△acrB)及baeR基因过表达株(CRpbaeR△baeSR△acrB)均由本实验室构建。
1.2 主要试剂LB肉汤培养基购自生工生物工程(上海)股份有限公司,质粒小量提取试剂盒、DNA凝胶回收试剂盒均购自康宁生命科学(吴江)有限公司,β-半乳糖甘酶活性检测试剂盒购自美国Promega公司,山羊抗兔IgG H&L(HRP)购自英国Abcam公司。
1.3 BaeR蛋白的表达、纯化与验证1.3.1 BaeR蛋白的表达 根据NCBI公布的鼠伤寒沙门菌ATCC13311中baeR的基因组序列设计引物(表 1),以CR为模板,进行PCR扩增。使用PCR产物纯化试剂盒纯化目的基因,用质粒提取试剂盒提取pCold Ⅰ质粒。将纯化后的baeR与pCold Ⅰ载体进行双酶切(限制性核酸内切酶为BamHⅠ和HindⅢ)、回收纯化与连接,将连接产物命名为pCold Ⅰ-baeR,并转入E. coli BL21感受态细胞,提取重组质粒,并送生工生物工程股份有限公司测序。
|
|
表 1 引物种类和序列 Table 1 Primer types and sequence |
将转化后的菌液按1∶100比例接种于LB(Amp50 μg·mL-1/氯霉素20 μg·mL-1/Tet5 ng·mL-1)培养基中,37 ℃培养至OD600 nm=0.4~0.6。取部分菌液作为未诱导对照,另一部分菌液中加入终浓度为0.1 mmol·L-1 IPTG诱导剂,15 ℃ 180 r·min-1诱导24 h,离心收集沉淀,用PBS重悬后超声破碎,离心,取超声后的上清和沉淀,进行SDS-PAGE检测。
1.3.2 BaeR蛋白的纯化 取上述收集的蛋白与Ni-binding buffer按照1∶5混合后,上Ni-His resin柱进行亲和纯化,收集洗脱的目的蛋白,用透析袋除去高浓度的咪唑和盐,用PBS透析置换洗脱液,最后目的蛋白溶解于PBS中。
1.3.3 Western blot验证 将纯化后的BaeR蛋白进行BCA蛋白浓度测定后再进行SDS-PAGE。将PAGE胶与PVDF膜根据目的蛋白和内参的分子量大小裁剪,并使大小一致。采用湿转印系统,将膜于300 mA恒流转印35~40 min。完成后用0.5‰TBST冲洗,4 ℃封闭过夜。孵育一抗:使用封闭液将抗His标签抗体(Abcam,兔多抗)稀释至1∶4 000,4 ℃静止孵育过夜;用TBST洗涤5次,置于水平摇床上剧烈洗涤3 min·次-1。孵育二抗:使用封闭液将HRP标记二抗(山羊抗兔IgG抗体)稀释至1∶8 000,常温孵育1~2 h;洗涤条件同上。最后进行显色检测。
1.4 LacZ报告基因融合试验采用BPROM程序预测sodB、tolC、spy、mdtD、ompW和marR基因的启动子区,设计引物(表 1),进行PCR扩增。反应体系:PrimeSTAR Max DNA polymerase 25 μL,上下游引物(各基因引物见表 1)各1 μL,模板2 μL,ddH2O 21 μL,共50 μL。反应程序:95 ℃ 3 min; 95 ℃ 15 s, 62 ℃ 15 s,72 ℃ 1 min,30个循环;72 ℃ 5 min。将上述PCR产物与pACYC184-LacZ质粒进行双酶切。酶切产物进行鉴定、纯化与连接,构建重组质粒pACYC184-LacZ-spy、pACYC184-LacZ-ompW、pACYC184-LacZ-tolC、pACYC184-LacZ-marR、pACYC184-LacZ-mdtD和pACYC184-LacZ-sodB,用引物lacZ-BF/BR进行PCR鉴定(方法同上)。将鉴定后的重组质粒电转入CR△baeSR△acrB和CRpbaeR△baeSR△acrB中得到LacZ菌株,用引物lacZ-BF/BR进行PCR鉴定(方法同上)后送至生工生物工程股份有限公司进行测序。将测序正确的LacZ菌株培养至OD600nm≈1后,离心收集菌体,超声破碎,按照β-半乳糖苷酶试剂盒说明书操作,对各菌株进行酶活性检测。
1.5 EMSA根据LacZ报告基因融合试验中预测的ompW、mdtD、tolC、sodB、spy和marR的启动子区域,设计探针,探针由江苏凯基生物技术股份有限公司合成,序列见表 2。合成带有生物素标记的双链探针并稀释。配制6%的非变性聚丙烯酰胺凝胶,预电泳10 min。探针与纯化蛋白进行结合反应,然后依次进行SDS-PAGE、转膜、紫外交联与发光检测。为了验证EMSA试验结果的可靠性,同时进行竞争性EMSA试验。
|
|
表 2 各探针序列 Table 2 Probe sequence used for EMSA |
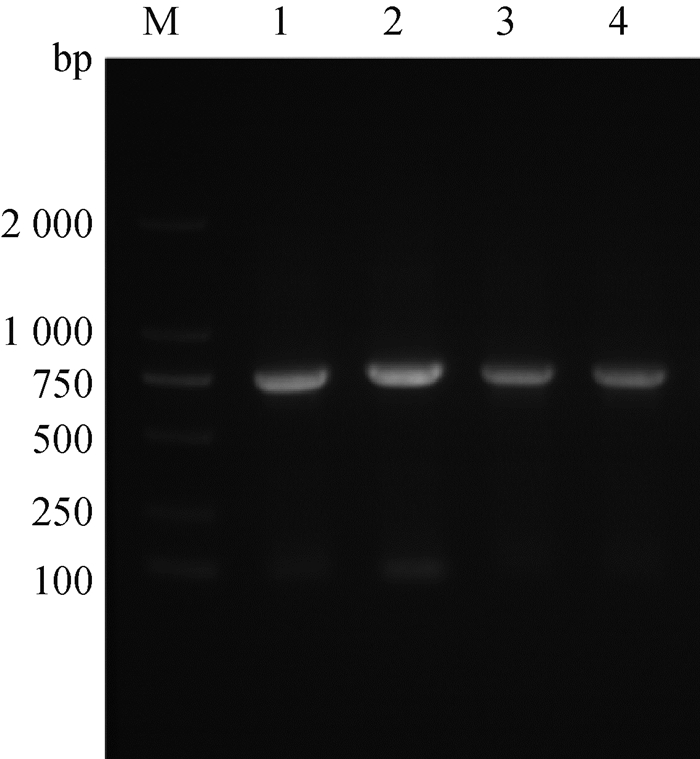
2.1.1 baeR基因的PCR扩增结果 经PCR扩增后,得到1条750 bp的条带(图 1),符合预期目的片段的大小。
|
M. DL2000 DNA相对分子质量标准; 1~4. baeR基因PCR扩增产物 M. DL2000 DNA marker; 1-4. PCR amplification of baeR gene 图 1 baeR基因的扩增 Fig. 1 PCR amplification of baeR |
2.1.2 重组质粒pCold Ⅰ-baeR的检测 对重组质粒pCold Ⅰ-baeR及其酶切产物进行10 g·L-1琼脂糖凝胶得到约750 bp(目的基因)和约4 200 bp(pCold Ⅰ) 的条带,符合预期目的片段的大小(图 2)。重组质粒测序结果正确,未出现缺失或突变。

|
M. DL12000 DNA相对分子质量标准; 1.重组质粒pCold Ⅰ-baeR; 2. pCold Ⅰ-baeR经BamH Ⅰ和HindⅢ双酶切 M. DL12000 DNA marker; 1. Recombinant plasmid pCold Ⅰ-baeR; 2. pCold Ⅰ-baeR digested by BamH Ⅰ and HindⅢ 图 2 重组质粒pCold Ⅰ-baeR双酶切鉴定 Fig. 2 Identification of recombinant pCold Ⅰ-baeR by double enzyme digestion |
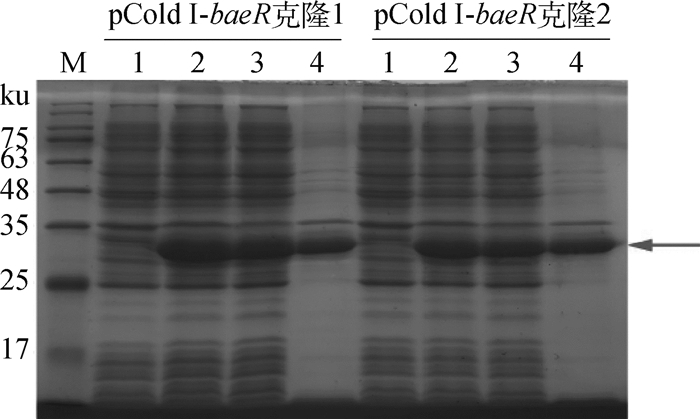
2.1.3 BaeR蛋白的诱导表达及SDS-PAGE分析 取诱导前对照、诱导后全菌、诱导后上清和诱导后沉淀进行SDS-PAGE分析。诱导后全菌、诱导后上清和诱导后沉淀在28 ku处出现1条特异性条带,且条带大小和位置符合预期,诱导前对照未出现该条带,说明BaeR蛋白成功表达,且在上清和沉淀中均有分布(图 3)。
|
M.180 ku蛋白质相对分子质量标准;1.诱导前对照;2.诱导后全菌;3.诱导后上清;4.诱导后沉淀 M. 180 ku protein marker; 1. Control before induction; 2. Bacterial proteins after induction; 3. Supernatant after induction; 4. Precipitation after induction 图 3 重组蛋白的表达鉴定 Fig. 3 The detection of recombinant protein expression |
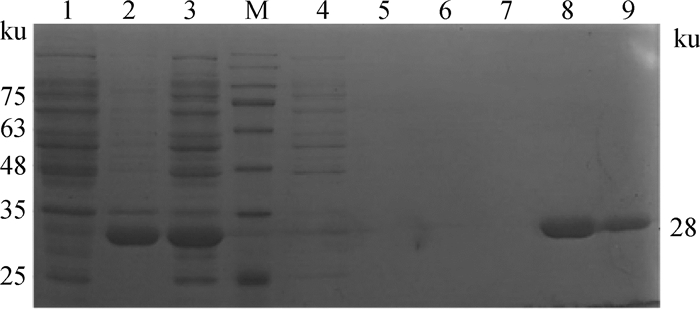
2.1.4 BaeR蛋白的纯化 取上清中的目的蛋白经Ni-His resin柱亲和层析,进行SDS-PAGE分析,在28 ku处得到单一、清晰的蛋白条带,表明成功获得纯化后BaeR蛋白(图 4)。
|
M.180 ku蛋白质相对分子质量标准;1.诱导前对照;2.诱导后沉淀;3.诱导后上清;4.纯化流穿液;5、7.空白泳道(未加样品);6.洗杂液;8.纯化后洗脱(2 μg); 9.纯化后洗脱(1 μg) M. 180 ku protein marker; 1. Control before induction; 2. Precipitation after induction; 3. Supernatant after induction; 4. Flow-through fluid; 5, 7. Blank lane (No sample added); 6. Impurity washing liquid; 8. Elution after purification (2 μg); 9. Elution after purification (1 μg) 图 4 重组蛋白的纯化后鉴定 Fig. 4 Identification of recombinant protein after purification |
2.1.5 BaeR蛋白的Western blot验证 表达的重组蛋白分别用兔多抗和山羊抗兔IgG抗体进行Western blot分析。结果显示,在28 ku处出现目的条带(图 5)。

|
M. 蛋白质相对分子质量标准; 1. 纯化前上清; 2.纯化后BaeR; 3.未诱导对照 M. Protein marker; 1. Supernatant before purification; 2. Purified BaeR; 3. Uninduced control 图 5 BaeR蛋白的Western blot检测 Fig. 5 Western blot detection of BaeR protein |
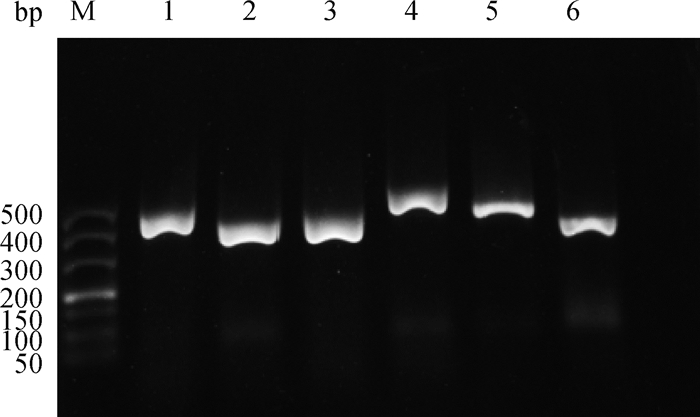
2.2.1 启动子区的扩增 根据鼠伤寒沙门菌ATCC13311的基因组序列,设计特异性引物,扩增ompW、sodB、tolC、mdtD、marR和spy基因的启动子区,扩增片段大小分别约为410、360、370、480、440、390 bp(图 6)。
|
M. DL500 DNA相对分子质量标准; 1. ompW; 2. sodB; 3. tolC; 4. mdtD; 5. marR; 6. spy M. DL500 DNA marker; 1. ompW; 2. sodB; 3. tolC; 4. mdtD; 5. marR; 6. spy 图 6 启动子扩增 Fig. 6 The PCR products of promoter |
2.2.2 重组质粒的构建及转化 将纯化后的基因分别与pACYC184-LacZ质粒进行双酶切,构建重组质粒pACYC184-LacZ-spy、pACYC184-LacZ-ompW、pACYC184-LacZ-tolC、pACYC184-LacZ-marR、pACYC184-LacZ-mdtD和pACYC184-LacZ-sodB,用引物lacZ-BF/BR对各基因进行PCR鉴定,片段分别约为790、810、770、840、880、760 bp(图 7)。

|
M. DL10000 DNA相对分子质量标准; 1. spy; 2. ompW; 3. tolC; 4. marR; 5.mdtD; 6. sodB M. DL10000 DNA marker; 1. spy; 2. ompW; 3. tolC; 4. marR; 5. mdtD; 6. sodB 图 7 重组质粒PCR鉴定结果 Fig. 7 PCR products of recombinant plasmid |
2.2.3 LacZ菌株的构建及检测 通过电转化法将重组质粒pACYC184-LacZ-spy、pACYC184-LacZ-tolC、pACYC184-LacZ-ompW、pACYC184-LacZ-marR、pACYC184-LacZ-sodB和pACYC184-LacZ-mdtD分别转入CR △baeSR△acrB与CRpbaeR△baeSR△acrB感受态细胞中,构建LacZ菌株,用引物lacZ-BF/BR进行PCR鉴定,片段分别约为790、770、810、840、760、880 bp(图 8),测序鉴定结果正确。

|
M. DL2000 DNA相对分子质量标准; 1、2. spy; 3、4. tolC; 5、6. ompW; 7、8. marR; 9、10. sodB; 11、12. mdtD; 1、3、5、7、9、11. CR△baeSR△acrB株; 2、4、6、8、10、12. CRpbaeR△baeSR△acrB株 M. DL 2000 DNA marker; 1-2. spy; 3-4. tolC; 5-6. ompW; 7-8. marR; 9-10. sodB; 11-12. mdtD; 1, 3, 5, 7, 9, 11. CR△baeSR△acrB strain; 2, 4, 6, 8, 10, 12. CRpbaeR△baeSR△acrB strain 图 8 CR △baeSR△acrB与CRpbaeR△baeSR△acrB LacZ菌株PCR鉴定结果 Fig. 8 PCR results of LacZ strain CR △baeSR△acrB and strain CRpbaeR△baeSR△acrB |
2.2.4 β-半乳糖苷酶活性检测 按照β-半乳糖苷酶活性检测试剂盒说明书操作,检测各菌株的β-半乳糖苷酶活性,由图 9可知,与双缺失株CR△baeSR△acrB相比,过表达株CRpbaeR△baeSR△acrB的LacZ菌株的β-半乳糖苷酶活性极显著升高(P<0.01),表明baeR对spy、tolC、ompW、marR、sodB和mdtD具有正调控作用。
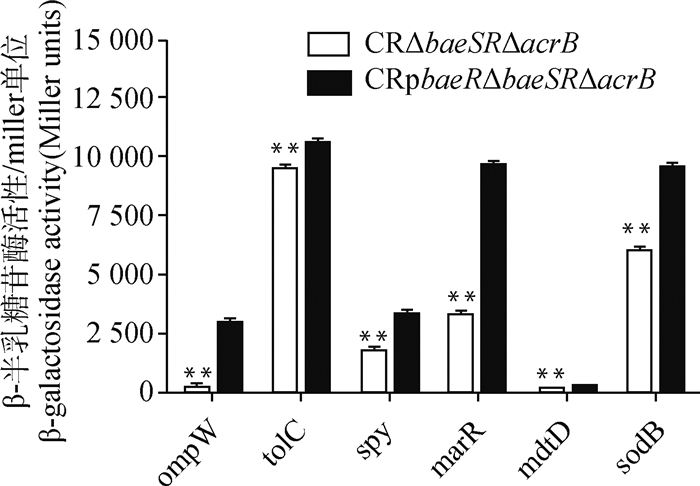
|
通过检测各菌株的β-半乳糖苷酶活性评估baeR基因过表达对pACYC184-LacZ-spy、pACYC184-LacZ-tolC、pACYC184-LacZ-ompW、pACYC184-LacZ-marR、pACYC184-LacZ-sodB和pACYC184-LacZ-mdtD的影响;**表示与CR△baeSR△acrB相比差异极显著(P<0.01) Effect of baeR gene overexpression on pACYC184-LacZ-spy, pACYC184-LacZ-tolC, pACYC184-LacZ-ompW, pACYC184-LacZ-marR, pACYC184-LacZ-sodB and pACYC184-LacZ-mdtD were determined by detection of β-galactosidase activity; ** means that the extremely significant difference compared with CR△baeSR△acrB (P < 0.01) 图 9 各菌株的β-半乳糖苷酶活性 Fig. 9 β-galactosidase activity of each strain |
2.3.1 BaeR蛋白可以调控marR基因的表达 为了寻找BaeR调控的靶基因,根据预测到的ompW、mdtD、tolC、sodB、spy和marR的启动子区域,设计含有生物素标记的探针,探明BaeR蛋白能否与生物素标记探针的DNA片段结合。根据迁移快慢情况分析,BaeR蛋白与marR有明显结合的迁移阻滞条带,与ompW、mdtD、tolC、sodB和spy无明显结合的迁移阻滞条带(图 10)。结果表明:BaeR蛋白可以直接调控marR基因的表达,间接调控ompW、mdtD、tolC、sodB和spy的表达。

|
1. mdtD探针; 2. mdtD探针+BaeR蛋白; 3. ompW探针; 4. ompW探针+BaeR蛋白; 5. tolC探针; 6. tolC探针+BaeR蛋白; 7、14. 对照; 8. marR探针; 9. marR探针+BaeR蛋白; 10. spy探针; 11. spy探针+BaeR蛋白; 12. sodB探针; 13. sodB探针+BaeR蛋白 1. mdtD probe; 2. mdtD probe+BaeR protein; 3. ompW probe; 4. ompW probe+BaeR protein; 5. tolC probe; 6. tolC probe+BaeR protein; 7, 14. Control; 8. marR probe; 9. marR probe+BaeR protein; 10. spy probe; 11. spy probe+BaeR protein; 12. sodB probe; 13. sodB probe+BaeR protein 图 10 BaeR与调控靶基因启动子的互作 Fig. 10 Interaction between BaeR and target gene promoter |
2.3.2 竞争性EMSA 为了验证EMSA结果的可靠性以及蛋白与非竞争性探针的结合情况,将试验中可以与蛋白结合的探针marR,设计了不加生物素标记的竞争性探针,试验结果表明,随着非竞争性探针浓度的增加,结合的迁移阻滞条带越明显。当竞争性探针为50倍时,仅仅竞争掉部分标记探针,当竞争性探针为100倍时,可以竞争掉全部的标记探针(图 11)。

|
1.对照; 2. 1 μmol·L-1 marR探针+BaeR蛋白; 3. 2 μmol· L-1 marR探针+BaeR蛋白; 4. 4 μmol·L-1 marR探针+BaeR蛋白; 5. 8 μmol·L-1 marR探针+BaeR蛋白; 6. 50倍竞争性探针+ marR标记探针+BaeR蛋白; 7. 100倍竞争性探针+ marR标记探针+BaeR蛋白 1. Control; 2. 1 μmol·L-1 marR probe+BaeR protein; 3. 2 μmol·L-1 marR probe+BaeR protein; 4. 4 μmol·L-1 marR probe+BaeR protein; 5. 8 μmol·L-1 marR probe+BaeR protein; 6. 50 fold competitive probe + marR labeled probe+BaeR protein; 7. 100 fold competitive probe+marR labeled probe+BaeR protein 图 11 BaeR与marR启动子的互作 Fig. 11 Interaction between BaeR and marR promoter |
沙门菌是常见的食源性致病菌之一[12],通过多种途径直接或间接感染人和动物[13],临床常用FQs防治沙门菌病。近年来,由于FQs的不合理使用,临床耐药菌株快速增长,耐药机制主要包括靶点突变、质粒转移、外排泵过表达、细胞膜通透性改变及生物膜的形成等,这些机制常协同发挥作用。在实验室前期研究中发现,在鼠伤寒沙门菌中,BaeSR和AcrB外排泵与菌株对FQs的耐药性密切相关且BaeR过表达后可通过调节外排泵、生物膜和鞭毛等相关基因的表达来影响细菌的耐药性。为阐明鼠伤寒沙门菌的耐药调控机制,本研究进一步探索BaeR对潜在靶基因的调控作用。
自1969年首次分离到LacZ报告基因后,该基因被广泛用于基因表达调控的研究之中[14]。LacZ报告基因的表达产物是β-半乳糖苷酶,该酶存在于多种生物体内,是由4条相同肽链构成的四聚体,具有高生产率和低成本的优点[15],常用于启动子的筛选、验证或效能测定中[16],它可将邻硝基苯基-β-半乳糖苷(ONPG)水解为半乳糖和黄色的邻硝基苯酚[17-18],因为后者的产生量与β-半乳糖苷酶的浓度成正比,所以可以通过黄色产生量间接确定LacZ表达水平。通过分光光度计(A420nm)的黄色出现率可以测量酶活性[19]。仇越等[20]研究发现,副溶血弧菌aphA缺失株的β-半乳糖苷酶活性显著低于野生株,表明AphA可正向调控exsA和exsD的转录表达。EMSA是体外检测RNA与特定目标蛋白结合的有效方法[21],具有高灵敏度、高分辨率以及快速准确等诸多优点,被广泛应用于细菌转录调控研究[22]。Yu等[23]通过EMSA证明BasR可以直接与emrD启动子结合激活其转录表达,降低了大肠杆菌对多种抗菌剂的敏感性。此外,Yu等[24]还指出McbR可以结合到acrAB、acrD、acrR、emrD和mdtD的启动子区,直接激活这些外排泵基因的转录从而在细菌耐药性调节中起重要作用。为了探究BaeSR在沙门菌耐药性中发挥的作用,作者进行BaeR蛋白的表达与纯化,并应用LacZ报告基因融合技术和EMSA去寻找BaeR调控的潜在靶基因。从转录组筛选到的耐药相关基因中,选取外膜蛋白相关基因ompW、tolC,生物膜相关基因sodB、spy,外排泵相关基因mdtD和marR作为BaeR的潜在靶基因。研究发现在鼠伤寒沙门菌baeR过表达株中,ompW、sodB、tolC、mdtD、marR和spy的β-半乳糖苷酶活性明显高于双缺失株。这表明BaeR可以正向调控ompW、sodB、tolC、mdtD、marR和spy的表达。BaeR可以结合到marR的启动子区,直接调控其表达,不能或间接调控ompW、sodB、tolC、mdtD和spy的表达。
革兰阴性菌存在一层阻碍外界有毒化学物质渗入胞内的外膜屏障,孔蛋白是与细菌渗透性和抗生素耐药性调节息息相关的外膜蛋白。BaeR过表达使外膜通道tolC基因表达增加,这是MdtABC和AcrD多药输出系统功能所必需的[25]。阪崎肠杆菌ompW缺失株受硫酸新霉素的胁迫后,生物膜形成能力显著增强[26],提示外膜蛋白OmpW可能与氨基糖苷类抗生素耐药性有关。sodB基因的缺失会增强细菌的生物膜形成能力[27]。外排泵与细菌多重耐药性密切相关,本试验筛选的外排泵相关基因主要有marR、mdtD与spy。mdtD属于MFS超家族转运蛋白,是MdtABCD-baeSR操纵子的一部分,受到baeR的调控[28]。Spy是一种小周质蛋白,spy启动子上游具有BaeR结合位点,BaeR可以直接与spy的启动子区结合调控其表达。当baeR基因缺失后,spy的表达量下降[29]。MarR是一种阻遏因子,属于marRAB操纵子,与MarO结合后抑制自身及构成操纵子的其它基因表达来阻碍marRAB操纵子的转录。MarA和MarR同属marRAB操纵子,MarA是一种全局调控蛋白,胞内水平受MarR调控,高水平的MarA可以与AcrAB基因上游的marbox结合并激活其转录,同时也可与TolC附近特异性DNA结合位点结合,上调TolC的表达量,从而引起细菌对抗生素耐药[30-31]。沙门菌中,marR基因突变与FQs耐药性及Mar表型相关[32]。在本试验中,BaeR可以直接与marR的启动子区结合并调控其表达,由此推测BaeR与marR结合后使marR与marO结合体解离,从而激活MarRAB转录,MarA表达量上升,导致细菌耐药性增强,这一发现为沙门菌耐药调控机制的研究奠定了基础,为药物靶点的开发提供了思路。
4 结论成功表达BaeR蛋白,同时对LacZ报告基因融合试验及EMSA的结果进行分析,发现BaeR可正向调控ompW、mdtD、tolC、sodB、spy和marR的表达,并直接调控marR的表达,表明BaeSR可能通过调控这些靶基因的表达来影响鼠伤寒沙门菌对FQs的耐药性,为深入阐明BaeSR对鼠伤寒沙门菌的耐药调控机制提供理论依据。
| [1] |
吕强华. 丁香醛对沙门氏菌Ⅲ型分泌系统的抑制作用及机制[D]. 长春: 吉林大学, 2020. LV Q H. Inhibitory effect and mechanism of syringaldehyde against Salmonella type Ⅲ secretion system[D]. Changchun: Jilin University, 2020. (in Chinese) |
| [2] |
程春荣, 安戈, 罗琦, 等. 145株沙门氏菌耐药性分析[J]. 河南预防医学杂志, 2012, 23(4): 256-258, 261. CHENG C R, AN G, LUO Q, et al. Analysis of antimicrobial susceptibility of 145 Salmonella isolates[J]. Henan Journal of Preventive Medicine, 2012, 23(4): 256-258, 261. (in Chinese) |
| [3] |
XIA S L, HENDRIKSEN R S, XIE Z Q, et al. Molecular characterization and antimicrobial susceptibility of Salmonella isolates from infections in humans in Henan Province, China[J]. J Clin Microbiol, 2009, 47(2): 401-409. DOI:10.1128/JCM.01099-08 |
| [4] |
FERRARI R G, ROSARIO D K A, CUNHA-NETO A, et al. Worldwide epidemiology of Salmonella serovars in animal-based foods: a meta-analysis[J]. Appl Environ Microbiol, 2019, 85(14): e00591-19. |
| [5] |
CASTRO-VARGAS R E, HERRERA-SÁNCHEZ M P, RODRÍGUEZ-HERNÁNDEZ R, et al. Antibiotic resistance in Salmonella spp. isolated from poultry: a global overview[J]. Vet World, 2020, 13(10): 2070-2084. DOI:10.14202/vetworld.2020.2070-2084 |
| [6] |
李琳, 沈建忠, 吴永宁, 等. 耐环丙沙星沙门菌marA、soxS和ramA基因以及外排泵基因acrA和acrB的表达水平分析[J]. 中国兽医科学, 2009, 39(10): 928-932. LI L, SHEN J Z, WU Y N, et al. Expression of marA, soxS and ramA genes and efflux pump genes acrA and acrB in ciprofloxacin-resistant Salmonella[J]. Chinese Veterinary Science, 2009, 39(10): 928-932. (in Chinese) |
| [7] |
孟娇, 陈晶瑜. Rcs双组分调节系统对细菌环境应答的分子调控研究进展[J]. 微生物学通报, 2021, 48(1): 210-222. MENG J, CHEN J Y. Role of Rcs two-component regulatory system in environmental responses of bacteria: a review[J]. Microbiology China, 2021, 48(1): 210-222. (in Chinese) |
| [8] |
STOCK A M, ROBINSON V L, GOUDREAU P N. Two-component signal transduction[J]. Annu Rev Biochem, 2000, 69: 183-215. DOI:10.1146/annurev.biochem.69.1.183 |
| [9] |
BARANOVA N, NIKAIDO H. The baeSR two-component regulatory system activates transcription of the yegMNOB (mdtABCD) transporter gene cluster in Escherichia coli and increases its resistance to novobiocin and deoxycholate[J]. J Bacteriol, 2002, 184(15): 4168-4176. DOI:10.1128/JB.184.15.4168-4176.2002 |
| [10] |
NISHINO K, NIKAIDO E, YAMAGUCHI A. Regulation of multidrug efflux systems involved in multidrug and metal resistance of Salmonella enterica serovar Typhimurium[J]. J Bacteriol, 2007, 189(24): 9066-9075. DOI:10.1128/JB.01045-07 |
| [11] |
WANG S Y, YOU C B, MEMON F Q, et al. BaeR participates in cephalosporins susceptibility by regulating the expression level of outer membrane proteins in Escherichia coli[J]. J Biochem, 2021, 169(1): 101-108. DOI:10.1093/jb/mvaa100 |
| [12] |
ISLAM S, ZHOU Y, LIANG L, et al. Application of a phage cocktail for control of Salmonella in foods and reducing biofilms[J]. Viruses, 2019, 11(9): 841. DOI:10.3390/v11090841 |
| [13] |
RUGBJERG H, WINGSTRAND A, HALD T, et al. Estimating the number of undetected multi-resistant Salmonella Typhimurium DT104 infected pig herds in Denmark[J]. Prev Vet Med, 2004, 65(3-4): 147-171. DOI:10.1016/j.prevetmed.2004.07.001 |
| [14] |
贾瑞瑞. Dip2a-LacZ报告基因小鼠模型的制作及表达分析[D]. 长春: 东北师范大学, 2015. JIA R R. Generation of Dip2a-LacZ reporter mouse model and analyzing Dip2a expression pattern[D]. Changchun: Northeast Normal University, 2015. (in Chinese) |
| [15] |
HAMED A A, KHEDR M, ABDELRAOF M. Activation of LacZ gene in Escherichia coli DH5α via α-complementation mechanism for β-galactosidase production and its biochemical characterizations[J]. J Genet Eng Biotechnol, 2020, 18(1): 80. DOI:10.1186/s43141-020-00096-w |
| [16] |
付立霞, 徐敬潇, 韩先干, 等. 一种基于lacZ基因和pUC复制子的原核启动子报告系统的构建及评价[J]. 生物工程学报, 2021, 37(1): 321-330. FU L X, XU J X, HAN X G, et al. Construction and evaluation of a pUC-type prokaryotic promoter reporter system based on lacZ gene[J]. Chinese Journal of Biotechnology, 2021, 37(1): 321-330. (in Chinese) |
| [17] |
AVIV G, GAL-MOR O. lacZ reporter system as a tool to study virulence gene regulation in bacterial pathogens[J]. Methods Mol Biol, 2018, 1734: 39-45. |
| [18] |
JUERS D H, MATTHEWS B W, HUBER R E. LacZ β-galactosidase: structure and function of an enzyme of historical and molecular biological importance[J]. Protein Sci, 2012, 21(12): 1792-1807. DOI:10.1002/pro.2165 |
| [19] |
王慧琦. 野油菜黄单胞菌β半乳糖苷酶缺失菌株的构建及双组分系统RavA/RavR调控鞭毛合成通路的初步研究[D]. 海口: 海南大学, 2019. WANG H Q. Construction of a galactosidase-deficient strain of Xanthomonas campestris and preliminary study on the regulation of flagellar synthesis by the two-component system RavA/RavR[D]. Haikou: Hainan University, 2019. (in Chinese) |
| [20] |
仇越, 杜天钰, 王迎, 等. 副溶血弧菌密度感应系统调控exsA和exsD的分子机制[J]. 军事医学, 2020, 44(10): 740-745. QIU Y, DU T Y, WANG Y, et al. Regulation of exsA and exsD by quorum sensing in Vibrio parahaemolyticus[J]. Military Medical Sciences, 2020, 44(10): 740-745. (in Chinese) |
| [21] |
陈冠霖, 王怡旻, 范静, 等. RNA结合蛋白研究技术[J]. 生命科学, 2021, 33(3): 303-311. CHEN G L, WANG Y M, FAN J, et al. Technologies of studying RNA binding proteins[J]. Chinese Bulletin of Life Sciences, 2021, 33(3): 303-311. (in Chinese) |
| [22] |
陈传荣. 鼠伤寒沙门氏菌HilD对ssrAB的调控作用[D]. 合肥: 安徽农业大学, 2017. CHEN C R. Regulation of Salmonella typhimurium HilD on ssrAB[D]. Hefei: Anhui Agricultural University, 2017. (in Chinese) |
| [23] |
YU L M, LI W C, XUE M, et al. Regulatory role of the two-component system BasSR in the expression of the EmrD multidrug efflux in Escherichia coli[J]. Microb Drug Resist, 2020, 26(10): 1163-1173. DOI:10.1089/mdr.2019.0412 |
| [24] |
YU L M, LI W C, LIU Z C, et al. Role of McbR in the regulation of antibiotic susceptibility in avian pathogenic Escherichia coli[J]. Poult Sci, 2020, 99(12): 6390-6401. DOI:10.1016/j.psj.2020.09.048 |
| [25] |
NISHINO K, HONDA T, YAMAGUCHI A. Genome-wide analyses of Escherichia coli gene expression responsive to the BaeSR two-component regulatory system[J]. J Bacteriol, 2005, 187(5): 1763-1772. DOI:10.1128/JB.187.5.1763-1772.2005 |
| [26] |
YE Y W, LING N, GAO J N, et al. Roles of outer membrane protein W (OmpW) on survival, morphology, and biofilm formation under NaCl stresses in Cronobacter sakazakii[J]. J Dairy Sci, 2018, 101(5): 3844-3850. DOI:10.3168/jds.2017-13791 |
| [27] |
陈妍妍. 溶藻弧菌定植因子AcfA的功能及其对SOD、Flg和Dct的调控[D]. 湛江: 广东海洋大学, 2019. CHEN Y Y. Study on the function and regulation of accessory colonization factor AcfA of Vibrio alginolyticus to SOD, Flg and Dct[D]. Zhanjiang: Guangdong Ocean University, 2019. (in Chinese) |
| [28] |
LEBLANC S K D, OATES C W, RAIVIO T L. Characterization of the induction and cellular role of the BaeSR two-component envelope stress response of Escherichia coli[J]. J Bacteriol, 2011, 193(13): 3367-3375. DOI:10.1128/JB.01534-10 |
| [29] |
ROSNER J L, MARTIN R G. Reduction of cellular stress by TolC-dependent efflux pumps in Escherichia coli indicated by BaeSR and CpxARP activation of spy in efflux mutants[J]. J Bacteriol, 2013, 195(5): 1042-1050. DOI:10.1128/JB.01996-12 |
| [30] |
张传珍, 常满霞, 杨磊, 等. MarA和SoxS共同调节大肠杆菌K12外排泵AcrAB-TolC的表达[J]. 中国兽医学报, 2017, 37(12): 2370-2377. ZHANG C Z, CHANG M X, YANG L, et al. Co-regulation of MarA and SoxS on expression of AcrAB-TolC in development of ciprofloxacin resistance in E. coli K12[J]. Chinese Journal of Veterinary Science, 2017, 37(12): 2370-2377. (in Chinese) |
| [31] |
GRKOVIC S, BROWN M H, SKURRAY R A. Regulation of bacterial drug export systems[J]. Microbiol Mol Biol Rev, 2002, 66(4): 671-701. DOI:10.1128/MMBR.66.4.671-701.2002 |
| [32] |
李琳, 王玉平, 吴永宁, 等. 沙门氏菌环丙沙星诱导株marR, soxR和acrR基因突变与多重耐药性的相关性研究(英文)[J]. 食品安全质量检测技术, 2009, 1(1): 1-9. LI L, WANG Y P, WU Y N, et al. Association of marR, soxR and acrR mutations with multiple antibiotic resistance in ciprofloxacin-selected Salmonella mutants[J]. Food Safety and Quality Detection Technology, 2009, 1(1): 1-9. (in Chinese) |
(编辑 白永平)



