2. 贵州省动物疫病与兽医公共卫生重点实验室,贵阳 550025;
3. 贵州省动物疫病预防控制中心,贵阳 550008
2. Guizhou Key Laboratory of Animal Disease and Veterinary Public Health, Guiyang 550025, China;
3. Guizhou Center for Animal Disease Prevention and Control, Guiyang 550008, China
丝状支原体山羊亚种(Mycoplasma mycoides subsp. capri,Mmc)会引起山羊肺炎、乳腺炎、关节炎、角膜炎和败血症等,主要引起山羊发生肺炎,感染羊表现为严重呼吸窘迫、发热、黏液性鼻液和死亡,可侵害不同年龄、性别的山羊,发病率为45%~90%,死亡率为14%~50%[1-2]。Mmc和绵羊肺炎支原体(Mycoplasma ovipneumoniae,Mo)均可引起羊支原体肺炎(mycoplasmal pneumonia of sheep and goats,MPSG),据流行病学调查显示,Mmc是引起山羊支原体肺炎的病原之一[3],Mmc具有广泛的地理分布性,只感染山羊且致病性强于Mo,由于贵州省当前大力发展养羊业,育有贵州黑山羊、贵州白山羊、黔北麻羊等优秀地方品种,必须重视Mmc的危害[4-5]。
当前对Mmc的研究主要集中于菌株的分离鉴定[6]、基因序列分析[7]及检测方法的建立[8],对如何阻断Mmc传播的研究仍然是空白,Mmc虽然致死率不高,但感染羊的精液或者乳制品质量下降,并且通过精液和乳汁传播该病,感染严重的羊甚至发生流产[9]。因此,急需找到防控Mmc传播的手段,本研究基于Mmc贵州株的LppA蛋白N末端基因通过分子生物学技术构建真核重组表达质粒pVAX1-LppA,以期作为DNA疫苗有效防控羊支原体肺炎。
1 材料与方法 1.1 菌株、细胞及动物大肠杆菌感受态细胞DH5α、pMD19-T-LppA克隆质粒、真核表达载体pVAX1、MDBK细胞、羊源LppA蛋白、Mmc贵州株均由贵州大学预防兽医学实验室提供;Mmc羊源阳性/阴性血清来源为中国农业科学院兰州兽医研究所惠赠间接血凝试验(IHA)阳性血清/阴性血清,4~5周龄BALB/c小鼠购自贵州医科大学实验动物中心。
1.2 主要试剂限制性内切酶Hind Ⅲ、XhoⅠ、LipofecttamineTM3000、无内毒素质粒大、小量提取试剂盒购自Invitrogen公司;白细胞介素-2(IL-2)、IL-4、干扰素-γ(IFN-γ)检测试剂盒均购自上海酶联生物科技有限公司;兔抗羊IgG-HRP、羊抗鼠IgG-HRP、兔抗羊IgG-FITC均购自上海碧云天生物技术有限公司;PE标记CD4+抗体、CY5标记的CD8+抗体购自北京博奥森生物技术有限公司。
1.3 重组质粒pVAX1-LppA构建结合Mmc标准株PG3(登录号:NZ_JFAE01000018.1)LppA基因序列和pVAX1载体酶切位点,设计一对特异性引物(F: 5′-AAGCTTACCACCATGAGTTTGCAAGAAACAGACAAAGATG-3′, R: 5′-CTCGAGCTATCCCCTAGAATCAATACCAAAATC-3′,下划线示酶切位点),预扩期增片段为450 bp,PCR扩增LppA基因片段,胶回收目的基因并纯化,用限制性内切酶HindⅢ和XhoⅠ分别对pVAX1载体和纯化产物进行双酶切,T4连接酶连接过夜,连接产物转化至大肠杆菌感受态细胞DH5α中,通过重组质粒PCR、双酶切及测序进行鉴定。
1.4 重组质粒pVAX1-LppA体外表达鉴定经无内毒素质粒小量提取试剂盒提取质粒DNA并测定浓度,将转染试剂、质粒按照比例混合制备脂质体,室温稳定15 min,转染至长至80% MDBK细胞的6孔板中,同时设置空载体pVAX1转染组和未转染空白对照组,转染48 h后,提取重组质粒pVAX1-LppA组和空载体pVAX1组细胞RNA,反转录为cDNA,RT-PCR方法扩增LppA基因,检测其转录水平。以Mmc阳性血清为一抗,FITC-兔抗羊IgG为二抗,对pVAX1-LppA组、空载体pVAX1对照组以及空白对照组MDBK细胞分别进行间接免疫荧光检测(IFA)。
1.5 动物免疫试验1.5.1 小鼠分组与免疫 为评价重组质粒pVAX1-LppA的免疫效果及最佳接种剂量,试验选用100只6周龄BALB/c小鼠,随机分为5组,每组20只,分别于肌肉接种无菌PBS 100 μL、空载体pVAX1 100 μg、重组质粒pVAX1-LppA 50 μg、重组质粒pVAX1-LppA 100 μg、重组质粒pVAX1-LppA 150 μg,首次免疫后每间隔1周以相同途径、剂量加强免疫,共免疫3次。
1.5.2 血清抗体水平检测 免疫后连续8周采集小鼠血清样本,用LppA蛋白(0.2 μg·mL-1)包被酶标板、3%BSA封闭、加入待检样本(1∶50稀释)、HRP-羊抗兔IgG(1∶1 000稀释)作为二抗标记、显色后用酶标仪检测样本OD630 nm值以检测特异性抗体水平。
1.5.3 细胞因子分泌水平测定 为了评价血清中细胞因子的水平,免疫后连续8周采用ELISA试剂盒分别检测血清中IL-2、IL-4和IFN-γ 3种细胞因子水平,根据标准曲线计算各细胞因子含量。
1.5.4 脾淋巴细胞增殖检测 免疫后连续8周每组随机取2只小鼠,无菌分离脾淋巴细胞,细胞计数调整细胞悬液浓度为104cell·mL-1,取96孔板每孔接种100 μL细胞悬液,试验组每孔再加入50 μL刀豆素(ConA 25 μg·mL-1)、空白组加入等体积细胞培养液,5% CO2、37 ℃培养48 h后,每孔加入10 μL噻唑蓝溶液(MTT 5 mg·mL-1),继续孵育4 h,每孔加入100 μL二甲基亚砜(DMSO)培养1 h后测OD490 nm值。
1.5.5 脾T淋巴细胞亚群检测 流式染色缓冲液调整脾淋巴细胞为107 cell·mL-1,通过流式细胞术分选CD3+、CD4+T淋巴细胞和CD3+、CD8+T淋巴细胞,并以PE-CD4+和CY5-CD8+细胞抗体检测CD4+ T淋巴细胞和CD8+ T淋巴细胞分别占总细胞数的比例。
1.6 攻毒保护性试验末次免疫后第14天,每组随机取5只小鼠分别接种Mmc菌液(1×108 CCU·mL-1),攻毒后进行隔离饲养,每日观察并记录攻毒后小鼠的临床症状,攻毒后第14天处死所有小鼠并解剖,通过眼观和病理切片观察肺病理变化,并以采食下降、精神沉郁等临床症状为感染标准,统计分析重组质粒pVAX1-LppA的攻毒保护效果。
1.7 统计分析通过SPSS软件和GraphPad Prism软件进行数据统计,数据间比较采用配对t检验,数值以平均值±标准差(x±s)表示,以P < 0.05为差异有统计学意义。
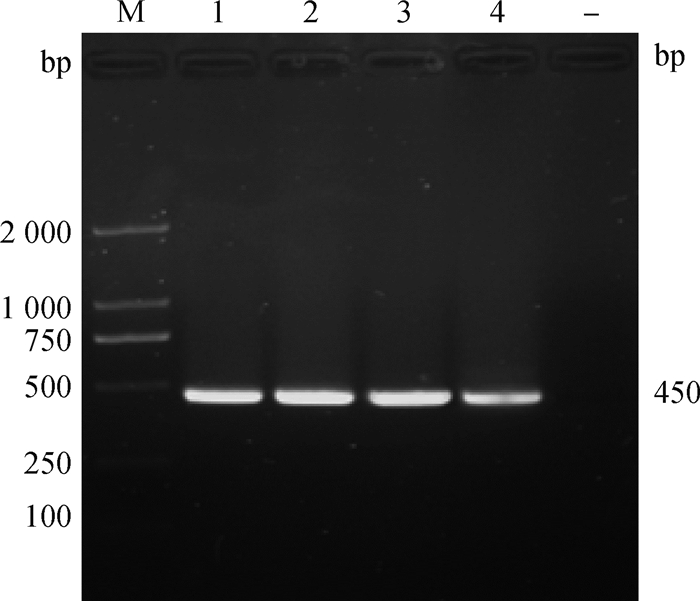
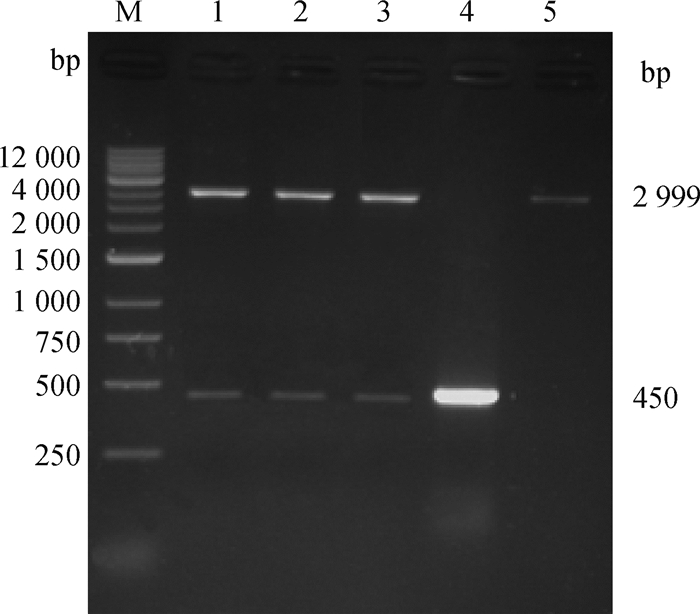
2 结果 2.1 重组质粒pVAX1-LppA构建将LppA基因片段连至真核载体pVAX1,提取重组质粒进行PCR和双酶切鉴定。重组质粒PCR扩增出现450 bp大小目的条带,空白对照无条带(图 1);双酶切呈现两条DNA带,即载体条带(2 999 bp)和目的条带(450 bp),空载体对照只有载体条带2 999 bp(图 2)。并将PCR和双酶切鉴定均为阳性的重组质粒送往生物公司测序,测序结果经过比对正确,提示pVAX1-LppA重组质粒构建成功。
|
M. 2 000 bp DNA相对分子质量标准;1~3. 重组质粒pVAX1-LppA;4. PCR对照;-. 空白对照 M. 2 000 bp DNA marker; 1-3. Recombinant plasmid pVAX1-LppA; 4. PCR amplification products; -. Blank control 图 1 重组质粒pVAX1-LppA PCR鉴定 Fig. 1 Identification of the recombinant plasmid pVAX1-LppA by PCR |
|
M. 1 kb-Ⅳ DNA相对分子质量标准;1~3. 重组质粒pVAX1-LppA;4. PCR对照;5. 空载体对照 M. 1kb-Ⅳ DNA ladder; 1-3. Recombinant plasmid pVAX1-LppA; 4. PCR amplification products; 5. Empty vector control 图 2 重组质粒pVAX1-LppA双酶切鉴定 Fig. 2 Identification of the recombinant plasmid pVAX1-LppA by double enzyme digestion |
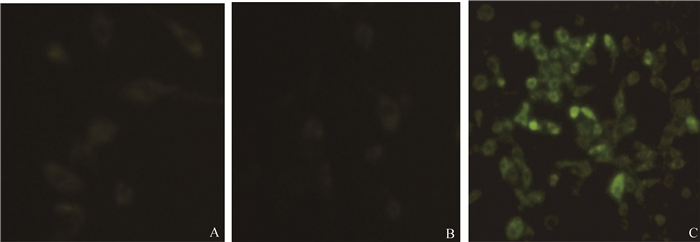
RT-PCR方法检测结果显示pVAX1-LppA转染MDBK细胞后,可扩增到大小为450 bp目的条带(图 3),而空载体对照组未扩增出条带,提示目的基因转录mRNA的存在。采用间接免疫荧光方法检测重组质粒的表达情况,转染pVAX1-LppA组可见绿色荧光,空载体对照组未见绿色荧光,提示构建pVAX1-LppA可在MDBK细胞内有效表达(图 4)。

|
M. 2 000 bp DNA相对分子质量标准;1、2. pVAX1-LppA;3. pVAX1空载体对照;4. 空白对照 M. 2 000 bp DNA marker; 1, 2. Recombinant plasmid pVAX1-LppA; 3. pVAX1 Empty vector control; 4. Blank control 图 3 pVAX1-LppA体外表达RT-PCR检测结果 Fig. 3 Identification of the recombinant plasmid pVAX1-LppA expression in vitro by RT-PCR |
|
A. 空白组细胞;B. pVAX1转染细胞;C. pVAX1-LppA转染细胞 A. Blank; B. pVAX1 transfected cells; C. Recombinant plasmid pVAX1-LppA transfected cells 图 4 重组质粒pVAX1-LppA在MDBK细胞中的表达鉴定(400×) Fig. 4 Expression of the recombinant plasmid pVAX1-LppA in MDBK cells(400×) |
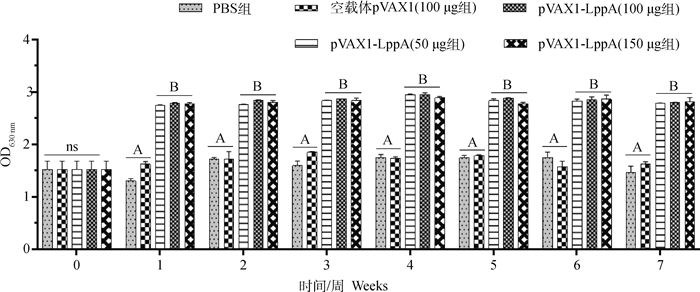
在免疫重组质粒pVAX1-LppA后14 d内未发现试验小鼠有任何临床异常现象,通过间接ELISA方法对采集的不同时间点各组小鼠血清进行特异性抗体检测。结果如图 5,pVAX1-LppA DNA疫苗组小鼠血清中抗体水平均在免疫后1周显著提高并在7周内保持较高水平,且均显著高于PBS和空载体对照组,但不同剂量组间抗体水平无差异。
|
字母一致或ns表示差异不显著(P>0.05),字母不一致表示差异显著(P < 0.05);样本OD630 nm值≥2.325时为阳性;样本OD630 nm值< 2.325时为阴性。下图同 letter consistency or ns means no significant difference (P>0.05), letter inconsistency indicates significant difference (P < 0.05), sample OD630 nmvalue ≥ 2.325 is positive, sample OD630 nmvalue < 2.325 is negative. The same as below 图 5 小鼠血清中特异性抗体检测结果 Fig. 5 Detection of specific antibody in mouse serum by ELISA |
采集不同时间点的各组小鼠血清样本,应用细胞因子ELISA检测试剂盒检测血清中IL-2、IL-4、IFN-γ细胞因子含量。结果如图 6所示,与PBS和空载体pVAX1对照组相比,免疫重组质粒pVAX1-LppA(50、100、150 μg)的小鼠血清中细胞因子分泌水平均显著升高,在免疫后第4周达到巅峰后略有下降,但整体维持在较高水平,重组质粒pVAX1-LppA的免疫剂量不同对细胞因子分泌水平影响不显著,提示重组质粒pVAX1-LppA可以提高细胞因子(IL-2、IL-4、IFN-γ)分泌水平,增强机体免疫应答。
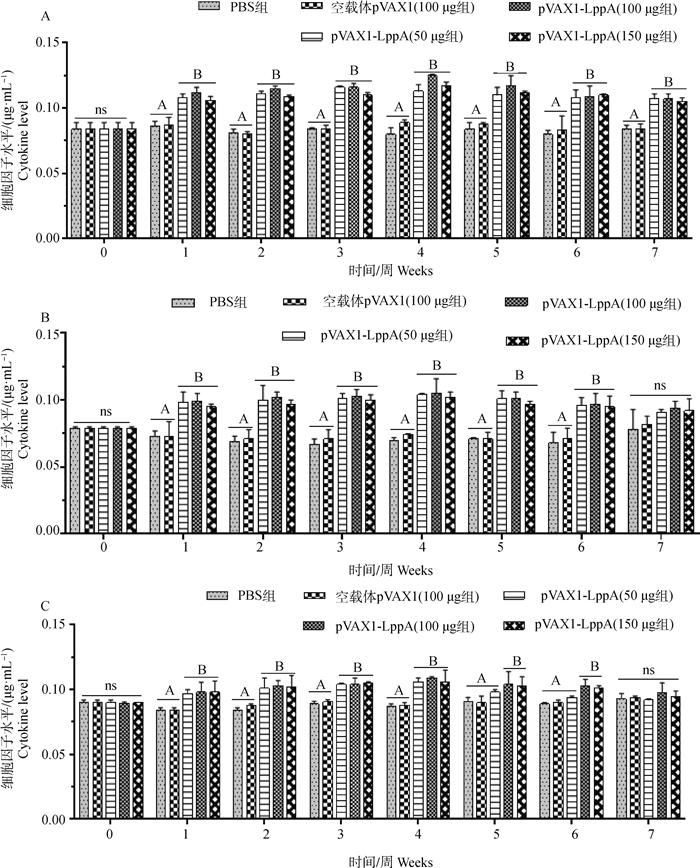
|
图 6 小鼠血清中IL-2(A)、IL-4(B)和IFN-γ(C)分泌水平检测结果 Fig. 6 Detection of IL-2 (A), IL-4 (B) and IFN- γ (C) secretion in serum of mice |
利用MTT比色法检测不同时间各组小鼠脾淋巴细胞增殖情况,结果见图 7,在免疫后1周重组质粒pVAX1-LppA组小鼠脾淋巴细胞增殖速度加快,2~6周均显著高于对照组,免疫后2周达到巅峰维持3周后缓慢下降,7周时仍保持较高水平并显著高于对照组,其中pVAX1-LppA(100 μg)组小鼠脾淋巴细胞增殖能力显著高于其余两个剂量组。
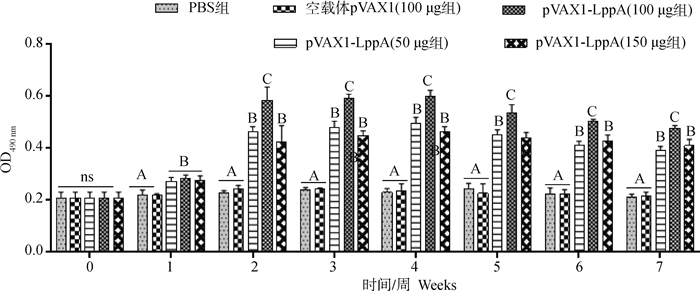
|
图 7 小鼠脾淋巴细胞增殖检测结果 Fig. 7 Detection of splenic lymphocyte proliferation in mice |
流式细胞仪检测小鼠脾淋巴细胞中T淋巴细胞亚群(CD4+、CD8+ T淋巴细胞)占总细胞数的比例。结果见图 8,PBS组、空载体组、pVAX1-LppA 50 μg组、pVAX1-LppA 100 μg组、pVAX1-LppA 150 μg组CD4+ T淋巴细胞百分比分别为9.7%、9.8%、12.3%、21.7%、14.9%,CD8+ T淋巴细胞的百分比分别为5.1%、5.2%、7.8%、8.9%、8.1%,pVAX1-LppA组CD4+、CD8+ T淋巴细胞数量显著高于对照组,提示pVAX1-LppA DNA疫苗可引起免疫反应,其中CD4+T细胞较CD8+T细胞比重更大。
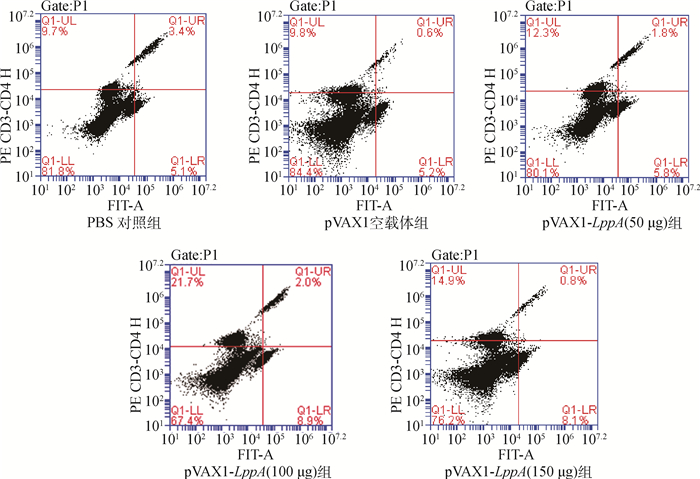
|
图 8 免疫小鼠T淋巴细胞CD4+、CD8+T淋巴细胞占总细胞的变化情况 Fig. 8 Changes of CD4+ and CD8+ T lymphocytes in total cells of the immunized mice |
人工感染Mmc后,PBS和空载体pVAX1对照组小鼠均出现精神沉郁、食欲下降等临床症状判定为发病,保护率为0%,免疫pVAX1-LppA(50、100、150 μg)组部分小鼠出现临床症状,保护率分别为40%、80%、60%,发病小鼠数量明显少于对照组,其中免疫pVAX1-LppA(100 μg)小鼠保护率最高为80 %(表 1)。取人工感染后各组小鼠的肺进行病理切片观察,结果如图 9,PBS和空载体pVAX1对照组肺泡出现融合性病灶,肺泡壁断裂,肺泡结构退化或消失,渗出大量炎性细胞;pVAX1-LppA(50、100、150 μg)组症状明显减轻,炎性渗出物减少,肺泡结构相对比较完整。
|
|
表 1 小鼠Mmc攻毒保护结果 Table 1 The protective results of the immunized mice following challenge with Mmc |

|
图 9 小鼠肺组织切片(HE,400×) Fig. 9 Microscopic histological observation of the lungs of the immunized mice (HE, 400×) |
丝状支原体山羊亚种是引起我国山羊支原体性肺炎的病原之一,传染性较强,危害严重,给不同品种山羊大规模养殖带来严重的防控挑战[10]。由于支原体的培养困难,培养周期长、营养要求高,导致传统疫苗研究进展缓慢,目前尚未有针对防控此病原感染的相关疫苗,所以临床上养殖户们常选用喹诺酮类、大环内酯类等药物控制该病,但药物无法根除病原且只在初次感染有一定作用,发生耐药性、药物残留等情况也屡见不鲜,因此,为解决目前传统疫苗研究的困境,急需研制一种安全有效的疫苗[11-12]。
随着生物技术的发展,亚单位疫苗、DNA疫苗、mRNA疫苗、活载体疫苗等新型疫苗逐渐引领当前疫苗研究的新风向,较传统疫苗新型疫苗具有易于构建、免疫原性和生物安全稳定性更高等优点[13-14]。结合前期对Mmc LppA基因的生物信息学分析,发现LppA基因N末端的B细胞表位区域较大且稳定,是优势抗原表位的潜在区域,张玲等[15]构建LppA重组原核表达质粒pET-LppA证明LppA具有良好的免疫原性,因此本研究针对引起山羊支原体肺炎的主要病原Mmc,基于Mmc的LppA蛋白N末端基因研制DNA疫苗,并分析其免疫效果。
高水平体液和细胞免疫反应被认为是疫苗介导最有效的免疫反应,但不同种类疫苗的免疫效果存在差异,灭活疫苗主要激活宿主产生高水平的体液免疫应答,基因工程疫苗可同时刺激机体的体液和细胞免疫[16-17]。IFN-γ和IL-2主要由Th1型细胞分泌,IFN-γ是细胞免疫应答的标志,IL-2是一种T细胞生长因子,参与抗原特异性T细胞和CD4+ T细胞的克隆性扩增,促进CD4+T淋巴细胞大量增殖[18],CD4+T细胞和CD8+T细胞协同T细胞抗原受体激活细胞免疫应[19],但CD8+T细胞在某些趋化因子诱导具有抑制作用[20]。本研究发现pVAX1-LppA DNA疫苗免疫小鼠后血清中细胞因子IL-2和IFN-γ的分泌水平和CD4+、CD8+T细胞占总细胞数的百分比均高于对照组,且CD4+T细胞的占比高于CD8+T细胞,提示pVAX1-LppA DNA疫苗对机体的保护作用是由T细胞介导的,并且主要以CD4+T辅助淋巴细胞为主。IL-4是Th2型细胞因子,通过刺激记忆B细胞增殖、分化成浆细胞分泌抗体,参与调控体液免疫[21],结果表明在免疫pVAX1-LppA DNA疫苗后血清中Mmc LppA特异性抗体水平显著上升,并与进一步检测IL-4分泌水平的结果一致,由此推测IL-4的表达增多促进了特异性抗体的分泌,提示pVAX1-LppA DNA疫苗可以引起体液免疫应答。综上所述,提示pVAX1-LppA DNA疫苗可同时激发细胞和体液免疫应答以防御病原入侵。
攻毒保护效率也是检验疫苗免疫效果的重要指标,人工感染试验结果显示,小鼠接种pVAX1-LppA DNA疫苗后刺激机体产生一定的免疫应答,Mmc感染小鼠后机体可特异性识别病原并快速清除,因此感染后不同试验组小鼠症状表现不一,所以疫苗免疫组小鼠临床症状和病理损伤明显减轻,发病数量减少,总体来看pVAX1-LppADNA疫苗剂量为100 μg的免疫效果最佳,略好于150 μg。一般来说免疫效果与疫苗剂量呈正相关,本研究结果中接种剂量100 μg效果却好于150 μg,可能的原因有几点:一是免疫的群体数量还不够大,结果存在一定的偏差;二是疫苗的剂量越高,对小鼠造成的不良反应和副作用也随之增大[22]。研究发现强大的免疫应答可以帮助机体抵御病原入侵减少损伤[23],pVAX1-LppA DNA疫苗激活的免疫应答水平不足以完全抵御侵染,未达到100%的保护率,但其引起高水平的特异性抗体也显示了LppA蛋白良好的免疫原性,疫苗的效果或许与免疫的程序、未使用佐剂等因素有关,对免疫途径、佐剂等进行优化期望pVAX1-LppA DNA疫苗免疫能成为有效防控山羊支原体肺炎的方法。
4 结论Mmc脂蛋白LppA具有良好的免疫原性,重组质粒pVAX1-LppA能激活小鼠体内的免疫应答反应抵御Mmc感染,可作为防控羊支原体肺炎的候选疫苗。
| [1] |
KUSILUKA L J M, SEMUGURUKA W D, KAZWALA R R, et al. Demonstration of Mycoplasma capricolum subsp. Capripneumoniae and Mycoplasma mycoides subsp. mycoides, small colony type in outbreaks of caprine pleuropneumonia in eastern Tanzania[J]. Acta Vet Scand, 2000, 41(3): 311-319. DOI:10.1186/BF03549639 |
| [2] |
陈芙, 袁婷, 郝华芳, 等. 丝状支原体山羊亚种对山羊的致病性观察[J]. 畜牧与兽医, 2021, 53(10): 72-76. CHEN F, YUAN T, HAO H F, et al. Pathogenic observation on experimental infection of Mycoplasma mycoides subsp. capri in goats[J]. Animal Husbandry & Veterinary Medicine, 2021, 53(10): 72-76. (in Chinese) |
| [3] |
冯杰, 崔燕, 余四九, 等. 贵州高海拔山区羊疫病血清学调查[J]. 贵州农业科学, 2016, 44(6): 103-107. FENG J, CUI Y, YU S J, et al. Serological test of main goat epidemic diseases in high-elevation mountainous area in Guizhou[J]. Guizhou Agricultural Sciences, 2016, 44(6): 103-107. (in Chinese) |
| [4] |
SUBBAIYAN A, THOMAS P, SANKAR M, et al. Multilocus sequence typing of pathogenic Mycoplasma mycoides subsp. capri reveals the predominance of a novel clonal complex among isolates from goats in India[J]. Arch Microbiol, 2021, 203(3): 1149-1157. DOI:10.1007/s00203-020-02100-w |
| [5] |
徐春光, 郝永清, 王明莹, 等. 羊支原体肺炎防治研究进展[J]. 动物医学进展, 2014, 35(1): 81-85. XU C G, HAO Y Q, WANG M Y, et al. Advance in treatment and prevention of mycoplasmal pneumonia of sheep and goat[J]. Progress in Veterinary Medicine, 2014, 35(1): 81-85. (in Chinese) |
| [6] |
谷奎, 杨睿, 高飞, 等. 山羊支原体山羊肺炎亚种野毒株的分离鉴定[J]. 动物医学进展, 2020, 41(4): 27-32. GU K, YANG R, GAO F, et al. Isolation and identification of Mycoplasma capricolum subsp. capripneumoniae wild strain[J]. Progress in Veterinary Medicine, 2020, 41(4): 27-32. (in Chinese) |
| [7] |
徐春光, 郝永清, 郝瑞霞, 等. 丝状支原体山羊亚种PG3株的全基因组序列测定与分析[J]. 微生物学通报, 2017, 44(11): 2669-2678. XU C G, HAO Y Q, HAO R X, et al. Complete genome sequence and analysis of Mycoplasma mycoides subsp. capri str. PG3[J]. Microbiology China, 2017, 44(11): 2669-2678. (in Chinese) |
| [8] |
林裕胜, 江锦秀, 张靖鹏, 等. 山羊支原体山羊亚种TaqMan荧光定量PCR检测方法的建立[J]. 中国预防兽医学报, 2020, 42(12): 1250-1254, 1281. LIN Y S, JIANG J X, ZHANG J P, et al. Establishment of a TaqMan fluorescence quantitative PCR assay for rapid detection of Mycoplasma capricolum subsp. capricolum[J]. Chinese Journal of Preventive Veterinary Medicine, 2020, 42(12): 1250-1254, 1281. (in Chinese) |
| [9] |
罗意, 周碧君, 张华, 等. 贵州省7个地区主要山羊流产疫病的流行病学调查[J]. 畜牧与兽医, 2013, 45(6): 62-65. LUO Y, ZHOU B J, ZHANG H, et al. An Epidemiological investigation on the main Goat abortion diseases in 7 areas of Guizhou province[J]. Animal Husbandry & Veterinary Medicine, 2013, 45(6): 62-65. (in Chinese) |
| [10] |
储岳峰, 高鹏程, 赵萍, 等. 应用双重PCR方法检测羊支原体肺炎病原[J]. 畜牧与兽医, 2009, 41(12): 23-26. CHU Y F, GAO P C, ZHAO P, et al. Development of a duplex polymerase chain reaction assay for the detection of pathogens for Mycoplasmal pneumonia of sheep and goats[J]. Animal Husbandry & Veterinary Medicine, 2009, 41(12): 23-26. (in Chinese) |
| [11] |
闭炳芬, 陶立, 李军, 等. 马山黑山羊支原体肺炎病原的鉴定[J]. 中国畜牧兽医, 2014, 41(9): 249-253. BI B F, TAO L, LI J, et al. Identification of Mycoplasma pneumonia pathogen of Mashan black goat[J]. China Animal Husbandry & Veterinary Medicine, 2014, 41(9): 249-253. (in Chinese) |
| [12] |
党斌, 潘玉坤, 吴禹熹. 山羊主要支原体感染的研究[J]. 黑龙江畜牧兽医, 2016(1): 155-158. DANG B, PAN Y K, WU Y X, et al. Study on mycoplasma infection in goats[J]. Heilongjiang Animal Science and Veterinary Medicine, 2016(1): 155-158. (in Chinese) |
| [13] |
王洪梅, 宋玲玲, 李瑞国, 等. 新型动物疫苗研究进展[J]. 家畜生态学报, 2010, 31(4): 109-112. WANG H M, SONG L L, LI R G, et al. Research progress on new generation animal vaccines[J]. Journal of Domestic Animal Ecology, 2010, 31(4): 109-112. (in Chinese) |
| [14] |
陈胜利, 郝华芳, 季文恒, 等. 动物支原体相关蛋白的免疫原性研究进展[J]. 畜牧兽医学报, 2021, 52(5): 1230-1237. CHEN S L, HAO H F, JI W H, et al. Research advances in immunogenicity of related proteins of animal Mycoplasmas[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(5): 1230-1237. (in Chinese) |
| [15] |
张玲, 郝永清, 徐春光, 等. 丝状支原体山羊亚种脂蛋白LPPA基因的定点突变及原核表达[J]. 畜牧与兽医, 2013, 45(10): 74-76. ZHANG L, HAO Y Q, XU C G, et al. Site-directed mutagenesis and prokaryotic expression of lipoprotein LPPA gene of Mycoplasma mycoides subsp. capri[J]. Animal Husbandry & Veterinary Medicine, 2013, 45(10): 74-76. (in Chinese) |
| [16] |
LAM J H, SMITH F L, BAUMGARTH N. B cell activation and response regulation during viral infections[J]. Viral Immunol, 2020, 33(4): 294-306. |
| [17] |
赵萍, 陈胜利, 郝华芳, 等. 一种山羊支原体山羊肺炎亚种多重抗原肽的小鼠免疫试验[J]. 畜牧兽医学报, 2016, 47(12): 2476-2482. ZHAO P, CHEN S L, HAO H F, et al. Immune responses in mice immunized with a recombinant multiple antigenic peptide from Mycoplasma capricolum Subsp. capripneumoniae[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(12): 2476-2482. (in Chinese) |
| [18] |
FUJIMURA K, OYAMADA A, IWAMOTO Y, et al. CD4 T cell-intrinsic IL-2 signaling differentially affects Th1 and Th17 development[J]. J Leukoc Biol, 2013, 94(2): 271-279. |
| [19] |
GIBBINGS D, BEFUS A D. CD4 and CD8:an inside-out coreceptor model for innate immune cells[J]. J Leukoc Biol, 2009, 86(2): 251-259. |
| [20] |
FLIPPE L, BÉZIE S, ANEGON I, et al. Future prospects for CD8+ regulatory T cells in immune tolerance[J]. Immunol Rev, 2019, 292(1): 209-224. |
| [21] |
HO I C, MIAW S C. Regulation of IL-4 expression in immunity and diseases[M]//MA X J. Regulation of Cytokine Gene Expression in Immunity and Diseases. Dordrecht: Springer, 2016, 941: 31-77.
|
| [22] |
钟代彬. 不同剂量口蹄疫疫苗对种公牛精液品质的影响[J]. 黑龙江畜牧兽医, 2021(15): 125-129. ZHONG D B. Effect of different doses of foot-and-mouth disease vaccine on the semen quality of breeding bull[J]. Heilongjiang Animal Science and Veterinary Medicine, 2021(15): 125-129. (in Chinese) |
| [23] |
VITLIC A, LORD J M, PHILLIPS A C. Stress, ageing and their influence on functional, cellular and molecular aspects of the immune system[J]. Age (Dordr), 2014, 36(3): 9631. |
(编辑 白永平)



