2. 深圳海关动植物检验检疫技术中心,深圳 518045;
3. 岭南现代农业科学与技术广东省实验室,广州 510642;
4. 广东海大畜牧兽医研究院有限公司,广州 511400
2. Shenzhen Customs Animal and Plant Inspection and Quarantine Technology Center, Shenzhen 518045, China;
3. Lingnan Laboratory of Modern Agricultural Science and Technology of Guangdong Province, Guangzhou 510642, China;
4. Guangdong Haid Institute Co.Ltd. of Animal Husbandry & Veterinary, Guangzhou 511400, China
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒科非洲猪瘟病毒属唯一成员非洲猪瘟病毒(African swine fever virus,ASFV)引起的一种烈性、接触性传染病。ASFV不仅能感染家猪、野猪,还能使软蜱带毒成为传播媒介[1-3]。猪感染ASFV后的临床特征是内脏器官出血、高热不退,死亡率高达100%[4]。世界动物卫生组织(OIE)将ASF列为法定报告动物疫病[5],中国也将其列为一类动物疫病。1921年全球首次报道了发生于1910年肯尼亚的ASF疫情,中国在2018年8月3日首次报道ASF感染后半年内便蔓延到河南、江苏等31个省份,疫情几乎波及整个中国,造成直接经济损失达数百亿元,对我国生猪产业造成极大损失[6-7]。ASFV是目前已知的唯一一种DNA虫媒病毒,该病毒较大且带有囊膜、外壳呈二十面体对称(260~300 nm),基因组全长为170~190 kb[8],编码50多种结构蛋白和100多种非结构蛋白[9-10]。
目前,ASF的流行出现了新的特点,ASFV自然弱毒株与强毒株同时存在,感染猪出现超长潜伏期,精准剔除难度增加,因此监测ASFV抗体成为早期发现ASF的重要手段[11]。而抗体监测的成效取决于监测手段的便捷性和准确性。由于ELISA检测成本低廉且操作简便,OIE将其作为检测ASF的首选血清学方法,国内外常将p30、p72作为检测抗原的蛋白[12]。目前,国外进口的试剂盒价格昂贵,操作复杂,在非规模化养猪场难以推广[13]。因此,研制适用于我国临床使用的ASFV检测试剂盒十分必要。目前已经建立针对ASFV核酸、蛋白和抗体的检测方法,大部分检测方法以ASFV蛋白p72等作为检测对象[14]。p54存在于病毒衣壳的内部,具有和8 ku的细胞动力蛋白轻链(DLC8)直接结合从而使病毒进入宿主细胞复制位点的功能[15]。有研究表明,猪免疫重组p54蛋白后,机体会产生一定量的中和抗体,ASFV与细胞吸附之前可以被针对p54的抗体中和[16-17]。因此,p54蛋白具有较好的抗原性,是理想的检测抗原,但基于p54建立的阻断ELISA检测方法报道较少。
基于此,本研究以ASFV p54蛋白为包被抗原,利用制备的1株mAb建立了检测ASFV抗体的阻断ELISA方法,并进行了验证,该方法具有较好的特异性和敏感性,为我国ASF的防控提供了技术支持。
1 材料与方法 1.1 血清、细胞和试剂盒非洲猪瘟标准阳性血清购自西班牙ASF参考实验室;商品化试剂盒购自西班牙INGENASA公司;猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪圆环病毒2型(PCV2)、口蹄疫病毒(FMDV)、猪流感病毒(SIV)、猪伪狂犬病病毒(PRV)阳性血清均购自中国兽医药品监察所;SP2/0细胞由本实验室保存。
1.2 主要试剂大肠杆菌由深圳市康百得生物科技有限公司供应;LB培养基购自北京奥博星生物技术有限公司;氨苄青霉素抗生素购自Sigma公司;纯化Ni柱购自GE Healthcare;HRP快速标记试剂盒购自湖州英创生物科技有限公司;HAT、HT、弗氏完全佐剂、弗氏不完全佐剂聚乙二醇(PEG)均购自Sigma公司;可拆卸ELISA酶标板购自Costar公司;TMB购自上海西宝生物科技有限公司。
1.3 包被抗原的制备1.3.1 重组菌株的构建与鉴定 基于流行病学调查分析选择GenBank中已登录的ASFV p54蛋白基因序列作为参考(GenBank序列号:FJ174405.1),委托苏州金唯智生物科技有限公司合成携带p54基因的质粒,并将质粒中p54基因片段转入pUC57载体,构建包含ASFV p54序列的重组质粒pUC57-ASFVp54。胶回收目的片段和载体片段后,分别取目的基因6 μL、载体片段2 μL、T4 DNA Ligase 1 μL、10×T4 Ligation Buffer 1 μL混匀,在16 ℃连接4 h。将连接产物转入大肠杆菌BL21(DE3)中,并涂布于含100 μg·mL-1氨苄青霉素的LB琼脂平板上,在37 ℃培养12 h后,挑取单个菌落于含50 μg·mL-1氨苄青霉素的LB液体培养基中,37 ℃培养12 h后,对菌液进行PCR鉴定,利用质粒上的T7引物(F: TAATACGACTCAC-TATAGGG, R: GCTAGTTATTGCTCAGCGG)进行PCR扩增,随后进行凝胶电泳检测。菌液鉴定体系组分如下:Accurate Taq Mix (2×)10 μL,菌液2 μL,引物F、R各0.5 μL, 去离子水7 μL,随后将PCR产物送生工生物(上海)公司进行测序,测序结果与GenBank中的序列进行比对。
1.3.2 ASFV p54蛋白的表达、纯化与鉴定 挑取单个菌落,接种于含氨苄青霉素的LB液体培养基中,37 ℃恒温摇床振荡培养至OD600 nm值为0.6~1.0,加入异丙基硫代-β-D-半乳糖苷(IPTG)诱导表达(终浓度为1 mmol·L-1),表达2 h后收集菌液。将菌液在4 ℃、10 000 r·min-1离心15 min后去除上清并收集菌体。用PBS洗涤菌体,再次离心去除上清。加入破菌缓冲液重悬菌体,冰上超声破碎,破碎后4 ℃、10 000 r·min-1离心15 min,收集上清,采用Ni Sepharose 6 Fast Flow进行蛋白亲和层析纯化,收集洗脱物,进行SDS-PAGE分析和Western blot鉴定。纯化的蛋白,利用Pierce BCA Protein Assay Kit测定含量。
1.4 单克隆抗体(mAb)的制备1.4.1 抗原免疫 取3只6周龄的BALB/c小鼠,3只小鼠分别标记为A、B、C。每两周免疫1次,共免疫3次。第一次免疫用PBS将原核表达且纯化好的p54蛋白稀释至200 μg·mL-1。取100 μL与完全弗氏佐剂按体积比1∶1混合均匀,乳化30 min。取200 μL乳化好的抗原在小鼠背部和大腿进行肌内注射,第二、三次免疫则采用不完全弗氏佐剂混匀的抗原。对照组注射等体积的PBS乳化液。从第一次免疫开始每次免疫后14 d将小鼠断尾取血制备血清,用间接ELISA方法检测血清抗体效价。选择抗体效价最高的小鼠,在融合前3 d加强免疫。
1.4.2 检测p54蛋白的间接ELISA方法 根据间接酶联免疫吸附试验(iELISA)方法的一般操作程序,将纯化的p54蛋白稀释至2.5 μg·mL-1,包被酶联免疫吸附试验微孔板,并用脱脂奶粉封闭。将ASFV阳性血清加入包被板,在37 ℃孵育45 min,用PBST洗涤3次后,加入HRP标记的兔抗猪IgG,在37 ℃孵育15 min。最后用显色底物溶液显色,读取OD450 nm值[18]。阴性对照OD450 nm<0.2时试验成立:S/N(待检样品OD450 nm/阴性对照OD450 nm)≥ 2.1,判定结果为阳性。
1.4.3 杂交瘤细胞的筛选及克隆 细胞融合前1 d制备好饲养细胞,将骨髓瘤细胞SP2/0和免疫后小鼠脾细胞进行常规PEG融合。并采用间接ELISA方法检测每孔杂交瘤细胞培养上清,对能产生抗体的阳性孔利用有限稀释法进行亚克隆,杂交瘤细胞筛选,利用有限稀释法对杂交瘤细胞进行单克隆[14]。
1.4.4 腹水型mAb制备、纯化 采用10周龄的BALB/c雌鼠,每只小鼠腹腔注射0.5 mL液体石蜡,7 d后再次通过腹腔注射阳性杂交瘤细胞(约5×106个)。每天定时观察小鼠的身体状况,约1周后小鼠会出现腹部膨胀的情况,此时收集腹水并离心,上清液即为含ASFV p54 mAb的腹水。利用Thermod单抗纯化试剂盒对收集到的腹水进行纯化。
1.5 mAb亚类鉴定与Western blot分析用Sigma公司的单抗亚类鉴定试剂盒进行mAb亚类鉴定。将鉴定好亚型的mAb与转至硝酸纤维膜上的原核表达的p54蛋白进行杂交,同时用大肠杆菌细胞超声破碎上清作为阴性对照,用纯化得到的mAb作为一抗进行孵育,用HRP标记的羊抗鼠IgG作为二抗进行孵育显色,验证mAb的特异性。
1.6 阻断ELISA检测方法的建立及初步应用1.6.1 最佳工作条件的确定 采用方阵法确定阻断ELISA方法的最佳反应条件:最佳包被抗原浓度(5、2.5、2.0、1.25、1、0.625 μg·mL-1,50 μL·孔-1,4 ℃包被过夜),HRP-mAb-p54最佳稀释度(1∶200、1∶400、1∶800、1∶1 000、1∶1 200),待检血清(1∶40、1∶80、1∶160、1∶320),HRP-mAb-p54最佳孵育时间(15、30、60 min),最佳底物显色时间(3、6、10 min)。
1.6.2 临界值的确定 按照“1.6.1”确定的阻断ELISA方法检测58份已知ASFV阴性血清,读取OD450 nm值,对其进行统计学分析,计算平均阻断率(x)和标准差(s),根据统计学原理,将x+2s和x+3s作为阴、阳性血清的临界值。大于临界值判定为阳性,小于临界值判定为阴性。阻断率%(PI%)=(阴性对照平均OD450 nm—样品血清平均OD450 nm)/阴性血清对照平均OD450 nm。
1.6.3 特异性试验 选取猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪圆环病毒2型(PCV2)、口蹄疫病毒(FMDV)、猪流感病毒(SIV)、猪伪狂犬病病毒(PRV)6种常见猪病病原的阳性血清作为样品,根据阻断率临界值判断该方法的特异性。
1.6.4 敏感性试验 将标准ASFV阳性血清做1∶80、1∶160、1∶320、1∶640、1∶1 280倍比稀释,利用建立的阻断ELISA方法进行检测,确定该方法敏感性。
1.6.5 重复性试验 采取同一批次包被的ELISA板,用ASFV阴、阳性血清各3份进行批内重复试验;取不同批次包被的ELISA板,用ASFV阴、阳性血清各3份进行批间重复试验。分别计算各血清样品的平均抑制率、标准方差和变异系数。
1.6.6 初步应用和符合性试验 使用采集自广东、云南等省份的猪血清1 000份,利用本研究建立的阻断ELISA方法进行检测。再选取部分阴性样品和全部阳性样品利用商品化检测试剂盒(西班牙INGENASA)进行验证,并计算二者的符合率。
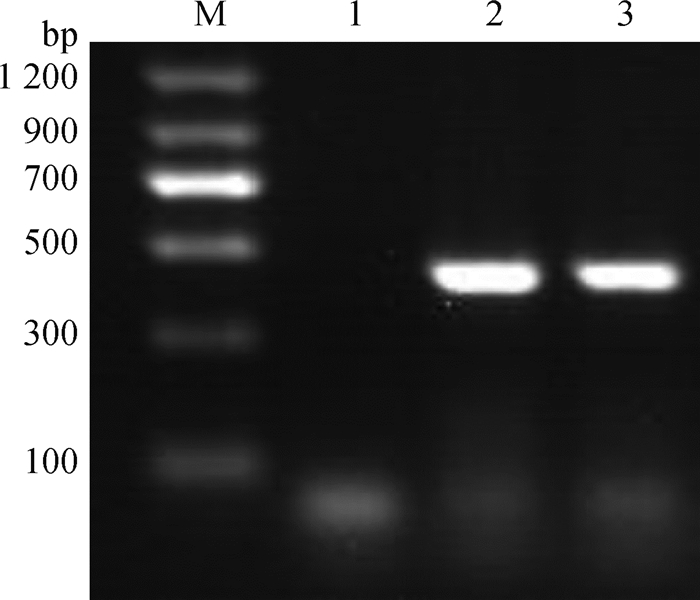
2 结果 2.1 包被抗原制备2.1.1 重组菌株的构建与鉴定结果 将菌液进行PCR扩增和测序鉴定,结果显示(图 1),在预期462 bp处出现了目的条带,表明重组菌株构建成功。序列比对结果显示,p54基因与ASFV SY18株相似性达100%。
|
M. DNA marker Ⅱ相对分子质量标准;1.阴性对照;2.阳性对照;3.菌液 M. DNA marker Ⅱ; 1. Negative control; 2. Positive control; 3. Bacteria liquid 图 1 菌液PCR扩增结果图 Fig. 1 PCR amplification of bacterial fluid |
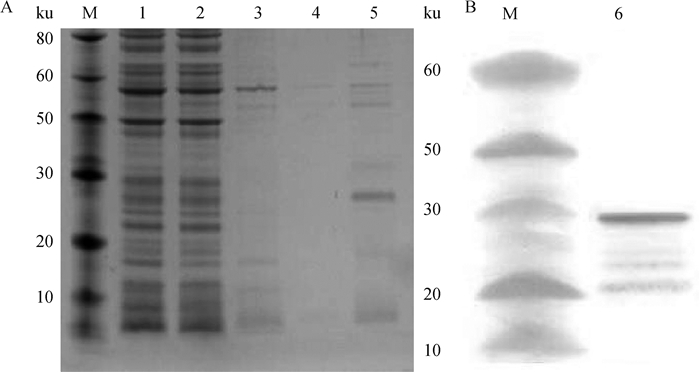
2.1.2 ASFV p54蛋白的表达、纯化与鉴定结果 将经Ni柱亲和层析纯化过程中每一步骤上清液收集起来,分别进行SDS-PAGE检测分析,结果显示(图 2A),最终产生的柱脱液在预期的28 ku处出现了目的条带,纯化得到的蛋白纯度较高、杂蛋白少。Western blot进一步分析,结果显示(图 2B), 重组的p54蛋白能够与ASF阳性血清反应,预期目标处出现特异性条带。利用Pierce BCA Protein Assay Kit测定p54蛋白的浓度为2.5 mg·mL-1。
|
M.蛋白质相对分子质量标准;1.裂解上清;2.过柱穿透液;3.第1次洗脱组分;4.第2次洗脱组分;5、6.纯化的p54蛋白 M. Protein molecular weight marker; 1. Lysate supernatant; 2. Flow-through fraction; 3. First time wash fraction; 4. Second time wash fraction; 5, 6. Purified p54 protein 图 2 纯化的p54蛋白SDS-PAGE和Western blot分析 Fig. 2 SDS-PAGE and Western blot analysis of purified p54 protein |
2.2.1 免疫小鼠的选择及血清效价的测定结果 相同的方法3次免疫3只小鼠后,经过间接ELISA分析,编号为C的BALB/c小鼠在第3次免疫后血清测得的OD450 nm值最高,血清效价可以达到6.4×104,故选择C小鼠脾用作细胞融合。
2.2.2 杂交瘤细胞的筛选及克隆结果 经间接ELISA筛选获得2株阳性杂交瘤细胞,经过6次筛选后阳性率为100%。选取其中1株进行试验,并命名为mAb-p54。
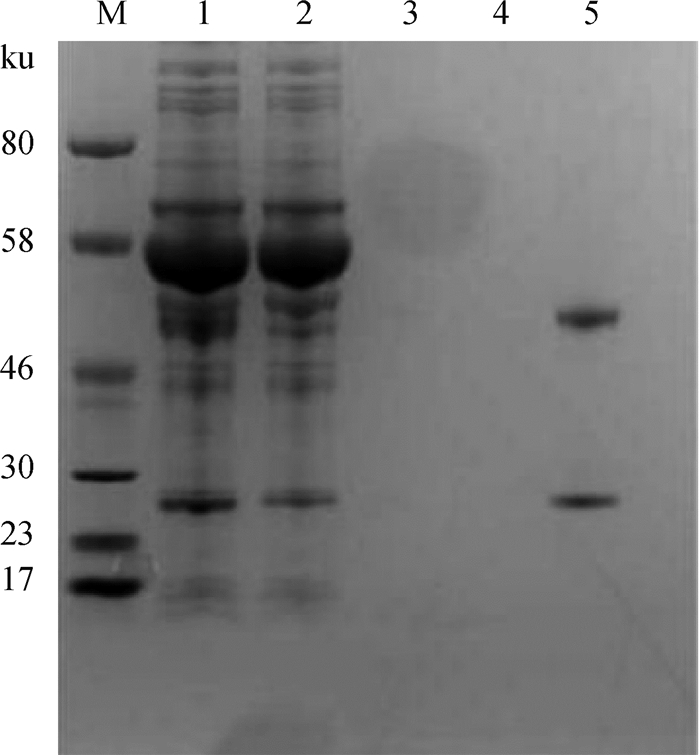
2.2.3 腹水型单抗的制备、纯化结果 测定腹水型单抗效价为1.28×105,利用Thermod单抗纯化试剂盒纯化,结果显示(图 3),经过纯化后mAb中的杂蛋白明显减少,纯化效果好。纯化后测定mAb的浓度为1 mg·mL-1,制备的mAb可以满足免疫学检测方法的建立和免疫检测产品的研发。对mAb进行HRP标记,以此作为阻断ELISA方法建立时的阻断酶标二抗。
|
M.蛋白质相对分子质量标准;1.腹水;2.过柱穿透液;3.第一次洗脱组分;4.第二次洗脱组分;5.洗脱液 M. Protein molecular weight marker; 1. Ascites; 2. Flow-through fraction; 3. First time wash fraction; 4. Second time wash fraction; 5. Elution fraction 图 3 腹水型单抗纯化 Fig. 3 Purification of ascites mAb |
2.2.4 单克隆抗体亚类鉴定与Western blot结果 用Sigma公司的单抗亚类鉴定试剂盒进行单克隆抗体亚类鉴定,经鉴定单克隆抗体亚型为IgG1型。Western blot结果表明(图 4),单抗不与大肠杆菌蛋白结合,可以和原核表达的重组蛋白p54结合,表明得到的单抗特异性较好。

|
M.蛋白质相对分子质量标准;1.大肠杆菌总蛋白;2.原核表达p54 M. Protein molecular weight marker; 1. The total protein of E. coil; 2. The prokaryotic expressed protein p54 图 4 单抗的Western blot分析 Fig. 4 Western blot analysis of monoclonal antibody |
2.3.1 最佳反应条件的确定 根据方阵滴定及优化后的各反应条件,确定阻断ELISA方法最优条件如表 1所示。
|
|
表 1 阻断ELISA检测方法的反应条件优化结果 Table 1 The optimization of reaction conditions for blocking ELISA assay |
2.3.2 临界值的判定 按照确定的阻断ELISA程序检测58份已知ASFV阴性血清,读取OD450值,结果经统计学分析,计算出血清样品的平均阻断率(x)为19.8%,标准差(s)为0.118,根据计算结果确定判定标准,x+2s=43.4%,x+3s=55.2%,即当阻断率≥55.2%时,判定结果为阳性,当阻断率 < 43.4%时,判定结果为阴性,介于两者之间判定为可疑,需重复检测一次。
2.3.3 特异性试验 利用建立的阻断ELISA方法检测CSFV、PRRSV、PCV2、FMDV、SIV、PRV 6种猪常见病毒阳性血清样本各2份及ASFV阳性血清1份,共计13份样品,结果显示:仅ASFV阳性血清阻断率达80%以上;其余均低于40%。表明该方法特异性较强。
2.3.4 敏感性试验 利用建立的阻断ELISA方法检测倍比稀释的ASFV阳性血清(稀释倍数为1∶80、1∶160、1∶320、1∶640、1∶1 280),结果显示,当阳性血清1∶640稀释时,阻断率为55.5%,仍为阳性结果,表明该方法敏感性较高。
2.3.5 重复性试验 利用建立的阻断ELISA方法对6份血清样品的批内重复试验及批间重复试验的变异系数均在10%以内,表明该方法重复性较好。
2.3.6 初步应用和符合性试验结果 采用100份从广东、云南等地区采集的猪血清样品,利用进口商品化的非洲猪瘟抗体ELISA检测试剂盒和本研究建立的阻断ELISA方法进行检测,结果显示,进口商品化的非洲猪瘟抗体ELISA检测试剂盒检测呈阳性的样品数为26,阴性的样品数为74;本研究建立的阻断ELISA方法检测呈阳性的性样品数为26,阴性样品数为72。通过计算,两个试剂盒的阳性符合率为100%, 阴性符合率为97.3%,总符合率为98%(表 2)。临床应用证明,本研究建立的阻断ELISA方法敏感性好,特异性强,与进口商品化试剂盒符合率高,可适用于临床血清学样品的非洲猪瘟抗体检测。
|
|
表 2 符合率试验结果 Table 2 Conformity test results |
当前我国部分省区出现了低致死率的ASFV基因Ⅱ型自然变异流行株,相比典型强毒株致病力降低,主要引起持续感染和慢性病程,具有很强的水平传播能力,这些变异株临床表现具有一定的隐蔽性,早期诊断难度加大,给我国ASF防控带来全新的挑战[19-20]。鉴于ASF流行出现的新特点,对ASF早期诊断除了检测ASFV外,检测ASF抗体显得尤为重要。2021年3月7日,农业农村部印发了《非洲猪瘟疫情应急实施方案(第五版)(农牧发[2021]7号),提出了对ASFV抗体检测可采用阻断ELISA、间接ELISA、抗原夹心ELISA、间接免疫荧光等方法。因此,研制敏感性、特异性和稳定性好的ASFV抗体检测技术迫在眉睫。
使用ASFV结构蛋白建立ELISA检测方法具有成本低、特异性好、灵敏度高和检测速度快等优势,能够用于大量样品的自动化检测,是目前应用最广泛的检测方法[21-23]。本研究筛选出的ELISA包被抗原为原核表达的ASFV p54蛋白,p54蛋白是ASFV主要的结构蛋白之一,包含假定的跨膜域,对病毒形态的形成至关重要[24-26]。本研究中采用的酶标单抗所针对的抗原位点非常保守,理论上能检测到世界目前所有流行非洲猪瘟病毒株的阳性血清。有研究表明,p54的缺失会影响ASFV的稳定性,在病毒复制、转染、维持结构稳定性方面p54都发挥着重要作用,是ASFV的主要免疫原蛋白。p54蛋白抗原性良好,当猪被ASFV感染后其抗体大概在1周后出现,且持续数周[24, 27-30],作为包被抗原建立的ELISA检测方法可以用于ASFV感染后全程的监测。
4 结论基于ASFV主要的结构蛋白p54蛋白建立检测ASFV的阻断ELISA方法,该方法特异性好、重复性好、灵敏度高,与国外同类商品化试剂盒具有良好的符合性。建立的检测方法为我国ASFV防控提供了技术支持,可用于ASFV免疫检测和血清流行病学调查。
| [1] |
SANG H, MILLER G, LOKHANDWALA S, et al. Progress toward development of effective and safe African swine fever virus vaccines[J]. Front Vet Sci, 2020, 7: 84. DOI:10.3389/fvets.2020.00084 |
| [2] |
姜林林, 宋帅, 蔡汝健, 等. 非洲猪瘟病毒p72蛋白N末端的原核表达及间接ELISA检测方法的建立[J]. 中国兽医科学, 2021, 51(2): 144-152. JIANG L L, SONG S, CAI R J, et al. Prokaryotic expression of N-terminus of African swine fever virus p72 protein and establishment of an indirect ELISA detection method[J]. Chinese Veterinary Science, 2021, 51(2): 144-152. (in Chinese) |
| [3] |
曹琛福, 梁云浩, 陶虹, 等. 非洲猪瘟病毒p54基因的原核表达及其抗体的间接ELISA检测方法的建立[J]. 动物医学进展, 2014, 35(2): 6-10. CAO C F, LIANG Y H, TAO H, et al. Prokaryotic expression of p54 gene of African swine fever virus and establishment of indirect ELISA for detection of its antibody against p54[J]. Progress in Veterinary Medicine, 2014, 35(2): 6-10. DOI:10.3969/j.issn.1007-5038.2014.02.002 (in Chinese) |
| [4] |
杨文兵, 邹亚文, 蒋一凡, 等. 非洲猪瘟血清学诊断靶点的研究进展[J]. 畜牧兽医学报, 2021, 52(5): 1208-1217. YANG W B, ZOU Y W, JIANG Y F, et al. Advances research on African swine fever serological diagnostic targets[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(5): 1208-1217. (in Chinese) |
| [5] |
GAUDREAULT N N, MADDEN D W, WILSON W C, et al. African swine fever virus: an emerging DNA arbovirus[J]. Front Vet Sci, 2020, 7: 215. DOI:10.3389/fvets.2020.00215 |
| [6] |
REVILLA Y, PÉREZ-NVÑEZ D, RICHT J A. African swine fever virus biology and vaccine approaches[J]. Adv Virus Res, 2018, 100: 41-74. |
| [7] |
PENRITH M L, VOSLOO W. Review of African swine fever: transmission, spread and control: review article[J]. J S Afr Vet Assoc, 2009, 80(2): 58-62. DOI:10.4102/jsava.v80i2.172 |
| [8] |
郑丁丁, 逄文强, 王衡, 等. 非洲猪瘟病毒p54蛋白单克隆抗体的制备与鉴定[J]. 病毒学报, 2020, 36(6): 1143-1150. ZHENG D D, PANG W Q, WANG H, et al. Preparation and identification of monoclonal antibodies against the recombinant p54 protein of African swine fever virus[J]. Chinese Journal of Virology, 2020, 36(6): 1143-1150. (in Chinese) |
| [9] |
GÓMEZ-PUERTAS P, RODRÍGUEZ F, OVIEDO J M, et al. The African swine fever virus proteins p54 and p30 are involved in two distinct steps of virus attachment and both contribute to the antibody-mediated protective immune response[J]. Virology, 1998, 243(2): 461-471. DOI:10.1006/viro.1998.9068 |
| [10] |
BARDERAS M G, RODRÍGUEZ F, GÓMEZ-PUERTAS P, et al. Antigenic and immunogenic properties of a chimera of two immunodominant African swine fever virus proteins[J]. Arch Virol, 2001, 146(9): 1681-1691. DOI:10.1007/s007050170056 |
| [11] |
GALLARDO C, SOLER A, NURMOJA I, et al. Dynamics of African swine fever virus (ASFV) infection in domestic pigs infected with virulent, moderate virulent and attenuated genotype Ⅱ ASFV European isolates[J]. Transbound Emerg Dis, 2021, 68(5): 2826-2841. DOI:10.1111/tbed.14222 |
| [12] |
ALCARAZ C, RODRIGUEZ F, OVIEDO J M, et al. Highly specific confirmatory Western blot test for African swine fever virus antibody detection using the recombinant virus protein p54[J]. J Virol Methods, 1995, 52(1-2): 111-119. DOI:10.1016/0166-0934(94)00150-F |
| [13] |
CHAPMAN D A G, DARBY A C, DA SILVA M, et al. Genomic analysis of highly virulent Georgia 2007/1 isolate of African swine fever virus[J]. Emerg Infect Dis, 2011, 17(4): 599-605. DOI:10.3201/eid1704.101283 |
| [14] |
敖大, 陈南华, 钱莺娟, 等. 非洲猪瘟病毒与宿主细胞相互作用研究进展[J]. 中国动物传染病学报, 2020, 28(3): 110-118. AO D, CHEN N H, QIAN Y J, et al. Progress of interactions of African swine fever virus with host cells[J]. Chinese Journal of Veterinary Parasitology, 2020, 28(3): 110-118. (in Chinese) |
| [15] |
GALLARDO C, SOLER A, NIETO R, et al. Comparative evaluation of novel African swine fever virus (ASF) antibody detection techniques derived from specific ASF viral genotypes with the OIE internationally prescribed serological tests[J]. Vet Microbiol, 2013, 162(1): 32-43. DOI:10.1016/j.vetmic.2012.08.011 |
| [16] |
梁云浩. 非洲猪瘟病毒蛋白p54原核真核表达、间接ELISA检测方法建立及单克隆抗体制备[D]. 广州: 暨南大学, 2014. LIANG Y H. The prokaryotic and eukaryotic expression of ASFV protein p54, development of indirct ELISA method and generation of p54 monoclonal antibody[D]. Guangzhou: Jinan University, 2014. (in Chinese) |
| [17] |
梁云浩, 曹琛福, 叶奕优, 等. 非洲猪瘟病毒p72蛋白的真核表达及反应原性鉴定[J]. 动物医学进展, 2015, 36(6): 29-33. LIANG Y H, CAO C F, YE Y Y, et al. Eucarytotic expression and reactogenicity identification of African swine fever protein p72[J]. Progress in Veterinary Medicine, 2015, 36(6): 29-33. DOI:10.3969/j.issn.1007-5038.2015.06.006 (in Chinese) |
| [18] |
栾宇轩, 张毫, 王承宝. 非洲猪瘟血清学诊断和疫苗研究进展[J]. 动物医学进展, 2021, 42(3): 78-82. LUAN Y X, ZHANG H, WANG C B. Progress on serological diagnosis and vaccines of African swine fever[J]. Progress in Veterinary Medicine, 2021, 42(3): 78-82. DOI:10.3969/j.issn.1007-5038.2021.03.016 (in Chinese) |
| [19] |
冯尧. 非洲猪瘟病毒p54重组蛋白的原核表达及其单克隆抗体制备[D]. 扬州: 扬州大学, 2014. FENG Y. Expression and monoclonal antibody preparation of the p54 recombinant protein of African swine fever virus[D]. Yangzhou: Yangzhou University, 2014. (in Chinese) |
| [20] |
向文杰, 李德栋, 林俊, 等. 牛传染性鼻气管炎病毒单克隆抗体的制备及阻断ELISA方法的建立[J]. 中国预防兽医学报, 2020, 42(1): 33-39. XIANG W J, LI D D, LIN J, et al. Preparation of monoclonal antibodies against bovine infectious rhinotracheitis virus and development of a blocking ELISA[J]. Chinese Journal of Preventive Veterinary Medicine, 2020, 42(1): 33-39. (in Chinese) |
| [21] |
张睿, 黄旖童, 鲍晨沂, 等. 非洲猪瘟流行病学及其在中国扩散的因素分析[J]. 病毒学报, 2019, 35(3): 512-522. ZHANG R, HUANG Y T, BAO C Y, et al. Epidemiology of African swine fever and analysis of risk factors of its spread in China: an overview[J]. Chinese Journal of Virology, 2019, 35(3): 512-522. (in Chinese) |
| [22] |
PETRINI S, FELIZIANI F, CASCIARI C, et al. Survival of African swine fever virus (ASFV) in various traditional Italian dry-cured meat products[J]. Prev Vet Med, 2019, 162: 126-130. DOI:10.1016/j.prevetmed.2018.11.013 |
| [23] |
SUN E C, ZHANG Z J, WANG Z L, et al. Emergence and prevalence of naturally occurring lower virulent African swine fever viruses in domestic pigs in China in 2020[J]. Sci China Life Sci, 2021, 64(5): 752-765. DOI:10.1007/s11427-021-1904-4 |
| [24] |
GE S Q, LI J M, FAN X X, et al. Molecular characterization of African swine fever virus, China, 2018[J]. Emerg Infect Dis, 2018, 24(11): 2131-2133. DOI:10.3201/eid2411.181274 |
| [25] |
ZHOU X T, LI N, LUO Y Z, et al. Emergence of African swine fever in China, 2018[J]. Transbound Emerg Dis, 2018, 65(6): 1482-1484. DOI:10.1111/tbed.12989 |
| [26] |
龚振华, 王丽萍, 臧京帅, 等. 非洲猪瘟病毒p54蛋白的高效表达及在ELISA中的应用[J]. 畜牧兽医学报, 2013, 44(11): 1832-1837. GONG Z H, WANG L P, ZANG J S, et al. Studies on the efficient expression of African swine fever virus p54 protein and its antigenic analysis in ELISA[J]. Acta Veterinaria Et Zootechnica Sinica, 2013, 44(11): 1832-1837. (in Chinese) |
| [27] |
姜睿姣, 张鹏飞, 朱光恒, 等. 非洲猪瘟检测技术进展[J]. 病毒学报, 2019, 35(3): 523-532. JIANG R J, ZHANG P F, ZHU G H, et al. Diagnostic assays for African swine fever[J]. Chinese Journal of Virology, 2019, 35(3): 523-532. (in Chinese) |
| [28] |
GOATLEY L C, REIS A L, PORTUGAL R, et al. A pool of eight virally vectored African swine fever antigens protect pigs against fatal disease[J]. Vaccines (Basel), 2020, 8(2): 234. DOI:10.3390/vaccines8020234 |
| [29] |
吴继阳. 非洲猪瘟病毒p30基因的原核表达及间接ELISA抗体检测方法的建立[J]. 新农业, 2020(11): 64-65. WU J Y. Prokaryotic expression of p30 gene of African swine fever virus and establishment of indirect ELISA antibody detection method[J]. Modern Agriculture, 2020(11): 64-65. (in Chinese) |
| [30] |
SÁNCHEZ-CORDÓN P J, MONTOYA M, REIS A L, et al. African swine fever: a re-emerging viral disease threatening the global pig industry[J]. Vet J, 2018, 233: 41-48. DOI:10.1016/j.tvjl.2017.12.025 |
(编辑 白永平)



