乳脂在乳中主要存在形式为乳脂肪球(milk fat globules,MFG),核心为甘油三酯,外面由三层膜包裹,称为乳脂肪球膜(milk fat globule membrane,MFGM)[1-2]。乳脂肪球粒径大小从0.2到15 μm不等。MFGM中最重要的极性脂质是磷脂[3]。磷脂可分为甘油磷脂和鞘磷脂两大类,约占乳脂总量的1%[4]。国外研究发现,MFG的粒径和乳脂肪球膜的磷脂含量受到季节因素和饮食的影响[5]。在天然牛乳中,乳脂肪球粒径大小的分布会影响牛乳中极性脂质、膜结合蛋白与甘油三酯的比值[6]。Loperz等[7]发现,饲喂奶牛亚麻籽增加了牛乳中的MFGM磷脂含量,这与较小粒径的乳脂肪球有关。大粒径和小粒径乳脂肪球含有不同数量的极性脂质[8]。Lopez和Ménard等[9]研究发现,MFGM磷脂组合物的含量在不同粒径的MFG之间也有所差异[10-11]。MFG主要来源于乳腺上皮细胞内的脂滴(lipid droplet,LD),已有研究证明,膜中磷脂的组成和生物利用度可以对LD的大小和融合发挥调控作用[12-13],增加磷脂酰乙醇胺(PE)与磷脂酰胆碱(PC)的比例可以促进膜融合,进而促进脂滴融合使LD直径增加[14]。
共轭亚油酸(conjugated linoleic acid,CLA)是一种主要从反刍动物脂肪和牛奶产品中发现的天然活性物质,是含有共轭双键的十八碳二烯酸的所有立体和位置异构体混合物的总称[15-16]。研究发现,瘤胃中多不饱和脂肪酸的生物合成过程中产生脂肪酸中间体,这些中间体被吸收,对奶牛乳腺脂肪的合成具有直接的抑制作用[17-18],其中Trans-10, cis-12 CLA已经被确定为瘤胃脂肪酸氧化的中间体,可以抑制牛奶脂肪的合成,形成低脂乳症[19]。本实验室前期研究发现,不同剂量CLA能诱导奶牛低脂乳症,影响MFG粒径D[3,2]和D[4, 3]的大小[20],但低脂乳是否引起了脂肪球膜的甘油磷脂含量差异目前国内外还未见报道。本研究试验设计为自身前后对照,试验组奶牛先饲喂CLA日粮6 d,然后恢复为基础日粮饲喂6 d,采用液相色谱-质谱分析牛乳中甘油磷脂含量的变化趋势。
1 材料和方法 1.1 试验材料1.1.1 试剂 共轭亚油酸微囊粉购于青岛澳海生物科技有限公司,脂肪酸组成如表 1所示;甲醇、乙腈、异丙醇(色谱纯)购于Merck,甲酸铵、氯仿(色谱纯)购于Fisher,甲酸(色谱纯)购于中国Sigma-Aldrich公司,甲基叔丁基醚(色谱纯)购于CNW,甘油磷脂标准品(15:0/18:1-d7-PE, 15:0/18:1-d7-PS, 15:0/18:1-d7-PG, 15:0/18:1-d7-PI, 15:0/18:1-d7-PA, 15:0/18:1-d7-PC, 18:1(d7) Lyso PE, 18:1(d7) Lyso PC)购于美国Avanti Polar Lipids公司。
|
|
表 1 共轭亚油酸钙(CLA-Ca)的脂肪酸组成 Table 1 Fatty acid composition of conjugated linoleic acid-Ca (CLA-Ca) |
1.1.2 主要仪器 乳成分分析仪(Foss 120 Milko-Scan,丹麦),倒置荧光显微镜(OLYMPUS 1X73,日本)、马尔文3000激光粒度仪(Mastersizer3000,英国)、移液枪(Eppendorf,德国),离心机(Eppendorf,德国),LC-MS/MS(SCIEX,QTRAP 6500+,美国)。
1.2 试验设计1.2.1 试验动物和饲养管理 本试验在河南农业大学奶牛场进行。试验所用奶牛在同一双列式牛舍内饲养,试验期间采用全混日粮(total mixed ration,TMR),按照自由采食、自由饮水的方式进行饲养,所有试验奶牛统一管理。泌乳母牛每天早上6:00、下午15:00和晚上20:00挤奶3次,在6:00和15:00挤奶后饲喂基础日粮,日粮营养成分见表 2。
|
|
表 2 奶牛基础日粮成分和化学组成 Table 2 Ingredient and chemical composition of basal diets of cows |
1.2.2 样品采集 随机选取身体状况相近的泌乳中期10头荷斯坦奶牛,试验设计前后自身对照,共持续12 d。第1~6天处理期每头奶牛饲喂基础日粮+CLA 400 g ·d-1,第7~12天恢复期奶牛饲喂基础日粮,每天记录每头牛的产奶量与采食量,每天下午15:00挤奶时采集乳样200 mL,一部分送到河南DHI检测乳脂肪、乳蛋白、乳糖等乳成分含量。另一部分立即用马尔文3000激光粒度仪进行粒径参数测量。取第1、6、12天的乳样提取脂质,用液相色谱-质谱进行甘油磷脂含量分析。
1.2.3 乳脂肪球粒径测量 乳脂肪球粒径使用激光粒度仪进行分析,根据Mastersizer 3000湿法单元的基本指南,点击“手动测量”,设置折射率(纯水1.330,牛奶1.560),搅拌器速度2 000 r·min-1。设置完成后,在500 mL烧杯中加入超过400 mL的水,并将搅拌器放入烧杯中。并点击开始按钮初始化仪器,设置测量背景,然后将大约1 mL的纯牛奶样品加入烧杯,直到激光遮蔽条指示大约10%~20%。然后开始测量,系统将自动测量3次并计算平均值。用Mastersizer软件对每个样品的测量值进行分析,生成的数据包括:表面积相关直径D[3,2]、体积相关直径D[4, 3]、10%粒子体积径Dv(10)、50%粒子体积径Dv(50)、90%粒子体积径Dv(90)和比表面积SSA。根据所测脂肪球粒径大小将乳脂肪球分为3部分,小脂肪球(small MFG)粒径范围为1.0~2.0 μm;中脂肪球(medium MFG)粒径范围为2.0~4.0 μm;大脂肪球(large MFG)粒径范围为4.0~8.0 μm,并计算各自所占比例。
1.2.4 甘油磷脂含量分析1.2.4.1 磷脂样品的提取 将乳样从-80 ℃冰箱取出,在冰上溶解;溶解混匀后取0.2 mL,加入2 mL甲醇于-20 ℃冰箱中静置12 h用于沉淀蛋白。同时每个样本中取500 μL混合均匀后取3份,每份200 μL,作为提取质控样本(TT-QC),与样本用相同方法提取。加入100 μL(10 μg·mL-1)内标,2 mL二氯甲烷,涡旋1 h;再加入2 mL二氯甲烷,1.6 mL超纯水,涡旋离心,将下清转移到新的EP管中;剩余上清再加入4 mL二氯甲烷提取,重复2次,与上述下清混合,氮吹;用1 mL异丙醇复溶,过0.22 μm有机滤膜,所有样本取200 μL混合均匀作为质控样本QC,上机。
1.2.4.2 色谱质谱分析 色谱系统:shimadzu UPLC LC-30A;色谱柱:Phenomenex Kinete C18 column (100×2.1 mm,2.6 μm);进样量:1 μL;流速:0.4 mL;柱温:60 ℃;样品室温度:4 ℃。
溶剂体:A相∶H2O∶MeOH∶ACN(1∶1∶1含5 mmol·L-1 NH4Ac);B相:IPA:CAN(5∶1) (含5 mmol·L-1 NH4Ac);梯度洗脱条件:0.5 min,20% B相;1.5 min 40% B相;3 min 60% B相;13 min 98% B相, 13.1 min 20% B相, 17 min 20% B相。
质谱系统:AB SciexTripleTOF ® 6600,ESI离子源;质谱采集的质量数范围:100~1200 m·z-1;Curtain Gas: 35.000 psi;Ion Source Gas1: 50.000; Ion Source Gas2: 50.00; IonSpray Voltage: 5500.00 V; Temperature: 600 ℃。磷脂的定性及定量分析采用MS-DIAL、PeakView、MasterView和MultiQuant(SCIEX)软件进行。
1.3 数据分析产奶量、乳成分、粒径参数和甘油磷脂含量采用SPSS25软件(SPSS/ibmcorp.,Chicago,IL)中一般线性模型(GLM)的重复测量方差进行显著性分析,以P<0.05表示差异显著。
2 结果 2.1 生产性能及乳成分分析由图 1可知,饲喂CLA处理前后对奶牛的产奶量、采食量、乳糖、乳蛋白含量没有显著差异(P>0.05),显著降低了乳脂肪的含量(P < 0.05)。第1天乳脂肪为每100 mL 3.86 g,饲喂CLA后乳脂肪含量开始下降,到第6天降至每100 mL 1.99 g,停止饲喂后乳脂肪含量慢慢上升,到第12天恢复至每100 mL 2.86 g,同样,脂肪蛋白比值也表现为先降低后升高的趋势(P < 0.05)。

|
A. 产奶量;B. 采食量;C. 乳蛋白;D. 乳脂肪;E. 乳糖;F. 脂肪/蛋白比率 A. Milk production; B. Feed intake; C. Milk protein content; D. Milk fat content; E. Lactose content; F. Fat/protein ratio 图 1 共轭亚油酸对奶牛生产性能及乳成分的影响 Fig. 1 Effect of CLA on production performance and milk composition of dairy cows |
由图 2可知,饲喂CLA处理前后D[3,2]的值有显著差异(P < 0.05),D[3,2]由第1天的3.72 μm降低到第6天的3.05 μm,第12天恢复至3.14 μm,表明所有脂肪球颗粒的平均直径显著减少。CLA处理过程中粒径参数Dv(10)、Dv(50)保持先降低后升高的趋势(P < 0.05),对Dv(90)没有显著影响(P>0.05),表明CLA的处理能够降低牛乳中50%以上脂肪球的粒径。比表面积(SSA) 显示为先升高后降低(P < 0.05),由第1天的1 797.075 m2·kg-1升高到第6天的2 244.795 m2·kg-1,第12天降低至2 127.07 m2·kg-1。

|
A. D[3,2]: 表面积平均直径;B. D[4, 3]: 体积相关的等效直径;C. Dv(10): 10%粒子的体积径;D. Dv(50): 50%粒子的体积径;E. Dv(90): 90%的粒子的体积径;F. SSA: 比表面积 A. D[3,2]: surface area-related equivalent diameter; B. D[4, 3]: volume-related equivalent diameter; C. Dv(10): 10% of the particle size; D. Dv(50): 50% particle size; E. Dv(90): 90% of the particle size; F. SSA: specific surface area 图 2 共轭亚油酸对乳脂肪球粒径参数的影响 Fig. 2 The effect of CLA on the size parameters of milk fat globules |
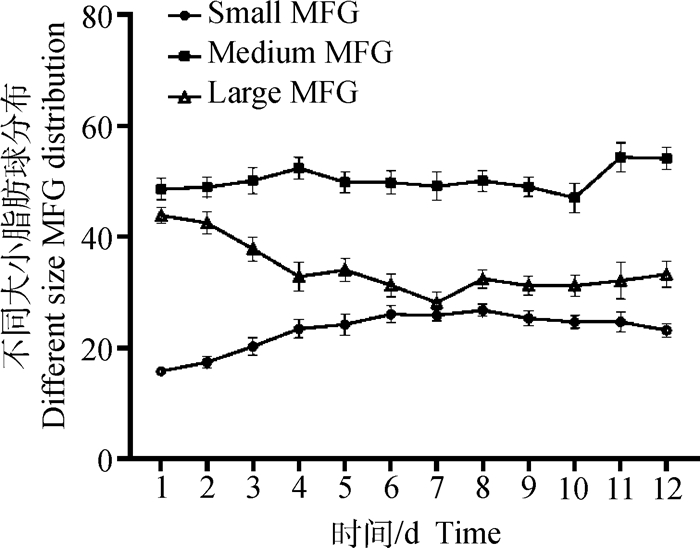
将脂肪球按照粒径分为大、小、中脂肪球,粒径1.0~2.0 μm的为小脂肪球,粒径2.0~4.0 μm之间的为中脂肪球,粒径4.0~8.0 μm的为大脂肪球。如图 3所示,饲喂CLA处理前后,小粒径脂肪球的比例先增加后降低(P < 0.05),大粒径脂肪球的比例为先降低后升高(P < 0.05),而中粒径脂肪球比例差异不明显(P>0.05)。
|
图 3 共轭亚油酸对大、中和小粒径脂肪球比例的影响 Fig. 3 The effect of CLA on the proportion of large, medium and small size fat globules |
甘油磷脂是由甘油作为骨架,与两种脂肪酸和一种磷酸盐分子酯化而成,后者又与其他极性基团(如胆碱、丝氨酸、乙醇胺或肌醇)结合,分别为溶血磷脂酰胆碱(LPC)、磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、溶血磷脂酰乙醇胺(LPE)、磷脂酰肌醇(PI)和磷酯酰丝氨酸(PS)等。在本试验中,通过UPLC/QTOF-MS鉴定了来自乳脂的77种甘油磷脂(图 4),在不同饲喂时期甘油磷脂的含量变化如表 3所示。与第1天相比,LPC18:1、PC 28:0、PC 30:0、PC 32:0、PC 34:1、PC 36:4和PC 38:5的含量在第6天降低,到了第12天又升高(P < 0.05);LPE 18:2、PE 28:0、PE 30:0、PE 31:1e、PE 32:0、PE 32:2e、PE 33:2e、PE 34:0、PE 34:1、PE 34:2、PE 34:2e、PE 34:4e、PE 34:5e、PE 35:1、PE 35:3e、PE 35:5e、PE 36:2e、PE 36:4、PE 36:5e、PE 38:3、PE 38:4也呈现先降低后升高的变化趋势,而PI化合物(PI 34:1、PI 34:2、PI 36:1、PI 36:2、PI 36:3、PI 38:3)从第1天开始随着时间逐渐升高,到第12天浓度达到最高。计算甘油磷脂总含量变化发现,随着CLA的处理,PC、PE的总含量和PC/PE呈先降低后升高趋势,而PI、PS总化合物含量持续增加。PC和PE等磷脂是脂肪球膜的重要组成成分,这些结果表明CLA处理影响了牛乳脂肪球膜的磷脂组成。

|
图 4 甘油磷脂化合物数目 Fig. 4 Number of glycerophospholipid compounds |
|
|
表 3 共轭亚油酸对乳脂肪球膜甘油磷脂含量的影响 Table 3 The effect of conjugated linoleic acid on glycerophospholipid content of MFG membrane |
大量研究证明,经过CLA处理的奶牛一般在5~7 d内就具有抑制脂肪合成的作用,会导致乳脂含量降低,形成低脂乳症[21-22]。韩雪峰等[23]在奶牛日粮中添加不同水平的CLA,发现能显著降低乳脂率。Chouinard等[24]研究发现,给奶牛真胃灌注CLA会使乳脂含量大幅下降,且乳脂率呈剂量依赖性降低。与这些结果类似,本研究发现在CLA处理前后对奶牛采食量、产奶量、乳糖和乳蛋白含量没有显著影响,但能显著降低乳脂率,同时也显著降低了乳脂球粒径参数D[3,2]、Dv(10)和Dv(50),表明脂肪含量的降低引起粒径的减小[25]。有研究发现,牛奶中的脂肪/蛋白质比率(fat/protein ratio)可作为衡量脂肪球大小的指标[26]。乳腺泌乳过程中,酪蛋白和脂肪球都在乳腺上皮细胞的顶端分泌,乳脂肪球通过出芽排出,并被顶端质膜包围,而与顶端质膜一起运输的囊泡中所含的酪蛋白则通过胞吐释放,脂肪/蛋白质比率体现了脂肪分泌和蛋白质分泌之间的膜平衡[26]。Couvreur和Hurtaud[26]分析了一个包含数百头奶牛的数据库发现,MFG粒径与乳脂含量和脂肪/蛋白质比率呈正相关。本研究也发现,CLA处理能够影响乳中脂肪/蛋白的比例,当MFG的粒径减小时,脂肪/蛋白质的比率也有显著差异(图 1F)。因此,脂肪/蛋白比率可以作为一个评估乳脂肪球粒径大小的指标。有趣的是,在本研究中发现,饲喂CLA引起脂肪球粒径减小的同时比表面积(SSA)显著升高。SSA定义为每质量单位材料的总表面积。已经发现,MFG的粒径大小决定了它们的表面积,从而影响牛奶MFGM中表层物质的含量[9]。有研究发现小粒径MFG的SSA比大粒径MFG要大[27]。Lopez等[8]研究也表明,大粒径脂肪球的比表面积较小,为0.98 m2·g-1,而小粒径脂肪球的比表面积较大,为4.36 m2·g-1。从不同尺寸MFG的总和分布(图 3)可以看出,CLA饲喂增加了小直径脂肪球的比例,减少了大直径脂肪球的比例,恢复为基础日粮后,小脂肪球比例随之降低而大脂肪球比例增加。可以推测,CLA处理抑制脂肪合成的同时导致奶牛乳腺上皮细胞合成和分泌更多比例的小脂滴,这也引起了脂肪球粒径的减少和比表面积的增加。
Lopez等[8]使用微滤法分离了正常牛乳中的大小脂肪球,发现极性脂质(PE、PI、PS、PC和SM)在小粒径MFG中高于正常牛乳和大粒径MFG的牛乳。Logan等[28]报道小脂肪球的总PL和PC相对含量与大脂肪球相比有所增加。然而,Mesilati-Stahy等[29]通过重力作用将不同大小的MFGs分离开来,发现平均直径接近或低于2 μm的小MFG中PI含量最高,PS含量最低,PE在大MFG中最高,而PC含量在大粒径和小粒径脂肪球之间没有显著变化。这些不同的结果表明,乳脂肪球磷脂的浓度可能不仅受MFG大小而影响,而且也受到试验设计和分离方法的影响[28, 30]。Foroutan等[31]通过质谱鉴定并定量了牛乳中82种LPC、PC和PE,本研究采用色谱-质谱技术定量了77种甘油磷脂。分析发现,与乳脂肪球粒径变化类似,牛乳中PC和PE的含量也呈现先降低再升高的趋势(表 3)。
Kinsella和Houghton[32]发现,在泌乳期间脂肪的产量和磷脂分泌均降低,因此在整个泌乳期间磷脂与脂肪的比率也比较稳定,且Bitman和Wood[33]也研究发现,从哺乳第42到180天总脂质中磷脂和胆固醇的百分比降低。PS的脱羧作用可以产生PE,PE可以通过磷脂酰乙醇胺N-甲基转移酶的作用转化为PC[34]。脂滴作为乳脂肪球的前体物,在乳腺细胞合成时需要包裹磷脂膜,磷脂含量的多少会影响脂滴大小[12-13],进而直接调控脂肪球的粒径。因此这些结果强调了PE和PC代谢在调节乳腺细胞形成MFG粒径中的作用。在脂滴生成脂肪球的过程中,脂肪球膜的外层主要由含有磷脂酰胆碱(PC)的甘油磷脂组成,并朝向水环境,而内表面含有PE、PI和PS。PC占总磷脂的35%,其功能是维持膜的通透性[35]。PI是阴离子磷脂,不对称地分布在MFGM的内部单层中[36]。本研究中还发现,磷脂酰肌醇(PI)则呈现出与PC和PE完全不同的变化趋势,其浓度在整个试验处理中呈现一直上升的趋势。对不同粒径牛乳中PI含量的研究很少,Lu等[37]对正常牛乳离心获得的两种不同粒径大小的MFG进行了研究,发现大粒径MFG中的PI浓度较高。所以在本研究中PI含量增加所代表的科学意义,还有待进一步深入研究。
4 结论综上,本试验发现,给奶牛饲喂CLA可以减少脂肪球粒径,使小脂肪球比例增加,大脂肪球比例减少,减少了PC和PE含量,增加了PI含量,这些试验结果揭示CLA在造成低脂乳症的过程中影响了脂肪球膜的磷脂组成。
| [1] |
LEE H, PADHI E, HASEGAWA Y, et al. Compositional dynamics of the milk fat globule and its role in infant development[J]. Front Pediatr, 2018, 6: 313. DOI:10.3389/fped.2018.00313 |
| [2] |
MARTINI M, SALARI F, ALTOMONTE I. The macrostructure of milk lipids: the fat globules[J]. Crit Rev Food Sci Nutr, 2016, 56(7): 1209-1221. DOI:10.1080/10408398.2012.758626 |
| [3] |
CONTARINI G, POVOLO M. Phospholipids in milk fat: composition, biological and technological significance, and analytical strategies[J]. Int J Mol Sci, 2013, 14(2): 2808-2831. DOI:10.3390/ijms14022808 |
| [4] |
DEWETTINCK K, ROMBAUT R, THIENPONT N, et al. Nutritional and technological aspects of milk fat globule membrane material[J]. Int Dairy J, 2008, 18: 436-457. DOI:10.1016/j.idairyj.2007.10.014 |
| [5] |
COUVREUR S, HURTAUD C, MARNET P G, et al. Composition of milk fat from cows selected for milk fat globule size and offered either fresh pasture or a corn silage-based diet[J]. J Dairy Sci, 2007, 90(1): 392-403. DOI:10.3168/jds.S0022-0302(07)72640-1 |
| [6] |
HEID H W, KEENAN T W. Intracellular origin and secretion of milk fat globules[J]. Eur J Cell Biol, 2005, 84(2-3): 245-258. DOI:10.1016/j.ejcb.2004.12.002 |
| [7] |
LOPEZ C, BRIARD-BION V, MENARD O, et al. Phospholipid, sphingolipid, and fatty acid compositions of the milk fat globule membrane are modified by diet[J]. J Agric Food Chem, 2008, 56(13): 5226-5236. DOI:10.1021/jf7036104 |
| [8] |
LOPEZ C, BRIARD-BION V, MÉNARD O, et al. Fat globules selected from whole milk according to their size: different compositions and structure of the biomembrane, revealing sphingomyelin-rich domains[J]. Food Chem, 2011, 125(2): 355-368. DOI:10.1016/j.foodchem.2010.09.005 |
| [9] |
LOPEZ C, MÉNARD O. Human milk fat globules: polar lipid composition and in situ structural investigations revealing the heterogeneous distribution of proteins and the lateral segregation of sphingomyelin in the biological membrane[J]. Colloids Surf B: Biointerfaces, 2011, 83(1): 29-41. DOI:10.1016/j.colsurfb.2010.10.039 |
| [10] |
COHEN B C, RAZ C, SHAMAY A, et al. Lipid droplet fusion in mammary epithelial cells is regulated by phosphatidylethanolamine metabolism[J]. J Mammary Gland Biol Neoplasia, 2017, 22(4): 235-249. DOI:10.1007/s10911-017-9386-7 |
| [11] |
MESILATI-STAHY R, MOALLEM U, MAGEN Y, et al. Altered concentrate to forage ratio in cows ration enhanced bioproduction of specific size subpopulation of milk fat globules[J]. Food Chem, 2015, 179: 199-205. DOI:10.1016/j.foodchem.2015.01.138 |
| [12] |
ARGOV-ARGAMAN N. Symposium review: milk fat globule size: practical implications and metabolic regulation[J]. J Dairy Sci, 2019, 102(3): 2783-2795. DOI:10.3168/jds.2018-15240 |
| [13] |
ARGOV-ARGAMAN N, MESILATI-STAHY R, MAGEN Y, et al. Elevated concentrate-to-forage ratio in dairy cow rations is associated with a shift in the diameter of milk fat globules and remodeling of their membranes[J]. J Dairy Sci, 2014, 97(10): 6286-6295. DOI:10.3168/jds.2014-8174 |
| [14] |
COHEN F S, AKABAS M H, ZIMMERBERG J, et al. Parameters affecting the fusion of unilamellar phospholipid vesicles with planar bilayer membranes[J]. J Cell Biol, 1984, 98(3): 1054-1062. DOI:10.1083/jcb.98.3.1054 |
| [15] |
LEHNEN T E, DA SILVA M R, CAMACHO A, et al. A review on effects of conjugated linoleic fatty acid (CLA) upon body composition and energetic metabolism[J]. J Int Soc Sports Nutr, 2015, 12: 36. DOI:10.1186/s12970-015-0097-4 |
| [16] |
IBRAHIM K S, EL-SAYED E M. Dietary conjugated linoleic acid and medium-chain triglycerides for obesity management[J]. J Biosci, 2021, 46(1): 12. DOI:10.1007/s12038-020-00133-3 |
| [17] |
卜登攀, 王加启. 共轭亚油酸调控牛奶乳脂合成的机理[J]. 中国畜牧兽医, 2004, 31(9): 13-14. BU D P, WANG J Q. Conjugated linoleic acid(CLA) and milk fat synthesis of dairy cattle[J]. China Animal Husbandry & Veterinary Medicine, 2004, 31(9): 13-14. DOI:10.3969/j.issn.1671-7236.2004.09.004 (in Chinese) |
| [18] |
BERNARD L, LEROUX C, CHILLIARD Y. Expression and nutritional regulation of lipogenic genes in the ruminant lactating mammary gland[J]. Adv Exp Med Biol, 2008, 606: 67-108. |
| [19] |
HARVATINE K J, ROBBLEE M M, THORN S R, et al. Trans-10, cis-12 CLA dose-dependently inhibits milk fat synthesis without disruption of lactation in C57BL/6 J mice[J]. J Nutr, 2014, 144(12): 1928-1934. DOI:10.3945/jn.114.198911 |
| [20] |
黄啟雪, 张梦璐, 张志锦, 等. 共轭亚油酸对奶牛乳脂肪球粒径及分布的影响[J]. 畜牧兽医学报, 2021, 52(5): 1432-1438. HUANG Q X, ZHANG M L, ZHANG Z J, et al. Effect of conjugated linoleic acid on the size and distribution of milk fat globule in dairy cows[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(5): 1432-1438. (in Chinese) |
| [21] |
PETERSON D G, MATITASHVIL E A, BAUMAN D E. Diet-induced milk fat depression is characterized by increased milk fat content of t10, c12 CLA and corresponding reductions in mammary tissue expression of lipogenic genes[J]. FASEB J, 2002, 16: A232. |
| [22] |
PERFIELD J W, LOCK A L, GRⅡNARI J M, et al. Trans-9, cis-11 conjugated linoleic acid reduces milk fat synthesis in lactating dairy cows[J]. J Dairy Sci, 2007, 90(5): 2211-2218. DOI:10.3168/jds.2006-745 |
| [23] |
韩雪峰, 谭支良, 汤少勋, 等. 日粮中添加共轭亚油酸对奶牛产奶量及乳品质的影响[C]//中国畜牧兽医学会动物营养学分会第十一次全国动物营养学术研讨会论文集. 北京: 中国农业科学技术出版社, 2012: 1. HAN X F, TAN Z L, TANG S X, et al. Effects of adding conjugated linoleic acid in diets on milk yield and quality of dairy cows[C]//Animal Nutrition Branch of Chinese Society of Animal Husbandry and Veterinary Medicine. Beijing: China Agricultural Science and Technology Press, 2012: 1. (in Chinese) |
| [24] |
CHOUINARD P Y, CORNEAU L, BARBANO D M, et al. Conjugated linoleic acids alter milk fatty acid composition and inhibit milk fat secretion in dairy cows[J]. J Nutr, 1999, 129(8): 1579-1584. DOI:10.1093/jn/129.8.1579 |
| [25] |
XING Z Y, ZHANG M L, WANG Y Y, et al. Short communication: a decrease in diameter of milk fat globules accompanies milk fat depression induced by conjugated linoleic acid supplementation in lactating dairy cows[J]. J Dairy Sci, 2020, 103(6): 5143-5147. DOI:10.3168/jds.2019-17845 |
| [26] |
COUVREUR S, HURTAUD C. Relationships between milks differentiated on native milk fat globule characteristics and fat, protein and calcium compositions[J]. Animal, 2017, 11(3): 507-518. DOI:10.1017/S1751731116001646 |
| [27] |
WALTER L, NARAYANA V K, FRY R, et al. Milk fat globule size development in the mammary epithelial cell: a potential role for ether phosphatidylethanolamine[J]. Sci Rep, 2020, 10(1): 12299. DOI:10.1038/s41598-020-69036-5 |
| [28] |
LOGAN A, AULDIST M, GREENWOOD J, et al. Natural variation of bovine milk fat globule size within a herd[J]. J Dairy Sci, 2014, 97(7): 4072-4082. DOI:10.3168/jds.2014-8010 |
| [29] |
MESILATI-STAHY R, MIDA K, ARGOV-ARGAMAN N. Size-dependent lipid content of bovine milk fat globule and membrane phospholipids[J]. J Agric Food Chem, 2011, 59(13): 7427-7435. DOI:10.1021/jf201373j |
| [30] |
MESILATI-STAHY R, ARGOV-ARGAMAN N. The relationship between size and lipid composition of the bovine milk fat globule is modulated by lactation stage[J]. Food Chem, 2014, 145: 562-570. DOI:10.1016/j.foodchem.2013.08.077 |
| [31] |
FOROUTAN A, GUO A C, VAZQUEZ-FRESNO R, et al. Chemical composition of commercial cow's milk[J]. J Agric Food Chem, 2019, 67(17): 4897-4914. DOI:10.1021/acs.jafc.9b00204 |
| [32] |
KINSELLA J Е, HOUGHTON G. Phospholipids and fat secretion by cows on normal and low fiber diets: lactational trends[J]. J Dairy Sci, 1975, 58(9): 1288-1293. DOI:10.3168/jds.S0022-0302(75)84708-4 |
| [33] |
BITMAN J, WOOD D L. Changes in milk fat phospholipids during lactation[J]. J Dairy Sci, 1990, 73(5): 1208-1216. DOI:10.3168/jds.S0022-0302(90)78784-X |
| [34] |
HÖRL G, WAGNER A, COLE L K, et al. Sequential synthesis and methylation of phosphatidylethanolamine promote lipid droplet biosynthesis and stability in tissue culture and in vivo[J]. J Biol Chem, 2011, 286(19): 17338-17350. DOI:10.1074/jbc.M111.234534 |
| [35] |
VISWANADHA S, GIESY J G, HANSON T W, et al. Dose response of milk fat to intravenous administration of the trans-10, cis-12 isomer of conjugated linoleic acid[J]. J Dairy Sci, 2003, 86(10): 3229-3236. DOI:10.3168/jds.S0022-0302(03)73926-5 |
| [36] |
ORTEGA-ANAYA J, JIMÉNEZ-FLORES R. Symposium review: the relevance of bovine milk phospholipids in human nutrition-Evidence of the effect on infant gut and brain development[J]. J Dairy Sci, 2019, 102(3): 2738-2748. DOI:10.3168/jds.2018-15342 |
| [37] |
LU J, ARGOV-ARGAMAN N, ANGGREK J, et al. The protein and lipid composition of the membrane of milk fat globules depends on their size[J]. J Dairy Sci, 2016, 99(6): 4726-4738. |
(编辑 范子娟)



