神经生长因子(nerve growth factor-β, NGF)是神经营养因子家族中最早被研究的一类生物活性分子,由意大利科学家丽塔·莱维-蒙塔尔奇尼发现并被美国科学家斯坦利·科恩首次分离纯化[1]。NGF是一种分子量为26~28 ku的同源二聚体,由α、β和γ三个亚基组成,其中γ亚基是一种高度特异性的活性蛋白酶,α亚基无显著活性[2]。NGF在发现之初被认为仅对神经元的生长、发育、分化和功能特性的表达等具有调控作用[3],但进一步研究发现NGF在其他生理活动中也发挥着重要作用,如促进成骨细胞增殖分化、改变细胞极性和诱导血管生成等方面[4-6]。研究表明NGF主要通过神经营养受体酪氨酸激酶1 (neurotrophic receptor tyrosine kinase 1, NTRK1,也称TrkA)和神经生长因子受体(nerve growth factor receptor, NGFR,也称p75 NTR)来发挥生物学功能,NGF以高亲和力与NTRK1的胞外结构域结合,使NTRK1二聚体化并激活其细胞内激酶,从而诱导细胞的增殖和分化;NGF以低亲和力与NGFR结合,通过激活NF-κB、Jun-N和神经酰胺信号通路来实现促细胞凋亡[5]。
研究还发现,NGF广泛存在于骆驼、公牛、羊驼等动物的精浆细胞中,它能够提高精子存活率,同时也是母畜发生促黄体素(LH)峰和诱发排卵所必需的生物分子,其在雌性动物的生殖调控中起着重要调控作用[7-8]。研究表明,NGF基因敲除小鼠的初级卵泡和次级卵泡的数量显著低于正常小鼠;利用马绒毛膜促性腺激素(equine chorionic gonadotropin,eCG)诱导大鼠超数排卵,在LH峰发生前注射NGF拮抗剂或TrkA阻滞剂,LH的峰值显著下降,同时排卵受到抑制[9-10]。骆驼和羊驼肌肉注射NGF会引起血浆中LH浓度激增;在母牛排卵前肌注NGF可以促进黄体的形成,LH释放量和LH峰值都显著增加;体外培养牛卵泡膜细胞时用NGF进行处理,细胞增殖速率明显增加,同时促进了前列腺素E2、雄烯二酮和孕酮(P4)的释放[7-8, 11]。目前,已经在牛[12]、大鼠[9]、松鼠[13]、人类[14]等动物的卵巢中检测到NGF及其受体的表达,进一步探究NGF及其受体在卵巢中的作用机制具有重要意义。
综上所述,NGF不仅在神经元的生长、发育、分化和功能特性的表达等具有调控作用,而且在多种非神经系统尤其是在促进排卵和黄体形成等方面也发挥重要作用。牦牛(Bos grunniens)是生活在高寒、低氧、高紫外线辐射等多种不利因素下的青藏高原特有畜种,其繁殖效率低下[15-17],目前有关牦牛NGF基因的研究尚未见报道。因此,本研究以牦牛作为研究对象,通过对牦牛NGF基因克隆测序、生物信息学分析和蛋白质结构功能预测,并采用RT-qPCR技术和对NGF基因在牦牛不同组织和不同生理期生殖器官的表达变化进行分析,再进一步利用免疫组化(immunohistochemistry, IHC)技术定位NGF蛋白在牦牛各生殖器官中的表达分布,为进一步探究NGF基因在牦牛生殖生理中的作用提供参考。
1 材料与方法 1.1 试验材料、试剂及主要仪器本试验样品均采自四川省成都市青白江区屠宰场,试验动物是同批次的青海高原牦牛。采用颈动脉放血法处死母牦牛后立即采集试验样品,其中包括:3头5~6岁黄体期(卵巢表面可见突出黄体)牦牛的心、肝、脾、肺、肾、卵巢、子宫和输卵管组织样(n=3),用眼科剪剪至约1 cm×0.5 cm×0.5 cm大小后放入RNase free冻存管,置于液氮带回实验室保存备用;用同样方法分别采集3头卵泡期(卵巢表面分布多个明显有腔卵泡)牦牛、3头妊娠期(妊娠3~4月)牦牛以及3头胎牛(3~4月龄)的卵巢、子宫和输卵管组织样(n=3);同时采集3头黄体期牦牛卵巢、子宫、输卵管组织样(n=3),用4%的多聚甲醛进行固定,待固定完成后用于IHC试验。
TRIzol、总量RNA提取试剂盒购自北京天漠科技开发有限公司;RevertAidTM Master Mix反转录试剂盒、Phusion Green Hot Start II High-Fidelity PCR Master Mix(2×)、PowerUpTM SYBRTM Green Master Mix购自Thermo Scientific(美国)公司;NGF一抗购自Affinity(中国)公司;4%多聚甲醛固定液购自博士德生物工程有限公司;柠檬酸(PH6.0)抗原修复液、苏木素染液、苏木素分化液、中性树胶、组化试剂盒DAB显色剂、HRP标记的山羊抗兔购自武汉赛维尔生物科技有限公司;DNA纯化回收试剂盒、大肠杆菌DH5α感受态细胞、pMD19-T载体、DL-2000 Marker购自成都擎科梓熙生物技术有限公司。PCR仪(ETC811)购自苏州东盛兴业科学仪器有限公司;激光共聚焦显微镜(LSM800)购自ZEISS(德国)公司;组织切片机(RM2016)购自Leica(德国)公司;脱水机(JJ-12 J)、包埋机(JB-P5)购自武汉俊杰电子有限公司;实时荧光定量PCR仪(CFX6)购自伯乐公司;琼脂糖凝胶成像系统(CL1000)购自Thermo Scientific(美国)公司。
1.2 牦牛组织样RNA的提取及反转录根据TRIzol法提取牦牛组织样RNA,使用紫外分光光度计检测各组RNA的浓度和纯度,选OD260 nm/OD280 nm值在1.8~2.0间的备用,并使用1.5%琼脂糖凝胶电泳检测RNA的完整性。根据RevertAidTM Master Mix反转录试剂盒使用说明书将样品RNA进行反转录为cDNA,-20 ℃保存备用。
1.3 引物设计与合成参考GenBank中黄牛NGF基因(登录号:XM_010803102.3)mRNA序列,使用Primer Premier5.0软件设计NGF基因的PCR引物和RT-qPCR引物;根据GenBank中牦牛的GAPDH基因(登录号:EU195062.1)设计RT-qPCR内参基因GAPDH的引物。所有引物(表 1)由擎科梓熙(成都)生物技术有限公司合成。
|
|
表 1 引物序列信息 Table 1 Primer sequence information |
以黄体期牦牛卵巢cDNA为模板,对牦牛NGF基因进行PCR扩增。PCR反应为20 μL体系:ddH2O 6.4 μL,Phusion Green Hot Start II High-Fidelity PCR Master Mix(2×) 10 μL,上、下游引物各1 μL,cDNA模板1 μL,DMSO 0.6 μL。PCR扩增程序:预变性(98 ℃,30 s);变性(98 ℃,10 s),退火(66.2 ℃,30 s),延伸(72 ℃,20 s),共38个循环;延伸(72 ℃,10 min),最后4 ℃保存。用1.5%琼脂糖凝胶电泳检测PCR产物,根据DNA纯化试剂盒操作说明纯化收回目的片段。将纯化后的PCR产物与pMD-19T载体连接,随后转化到DH5α感受态细胞,再均匀涂布到含Amp抗生素的LB平板上,37 ℃培养箱倒置培养过夜,挑取白色单菌落,接种到含Amp抗生素的LB液体培养基中摇床培养6 h,利用菌液PCR鉴定阳性克隆,随后将阳性菌液送至擎科梓熙(成都)生物技术有限公司进行测序。
1.5 NGF基因的生物信息学分析对牦牛NGF基因特性进行生物信息学分析,分析的具体项目和软件见表 2。
|
|
表 2 生物信息学分析内容及对应软件 Table 2 Bioinformatics analysis contents and softwares |
采用RT-qPCR检测NGF基因的表达水平,反应体系为15 μL:上、下游引物各0.5 μL,ddH2O 5.5 μL,PowerUpTM SYBRTM Green Master Mix 7.5 μL,各组织cDNA 1 μL。RT-qPCR反应程序:预变性(95 ℃,3 min);变性(95 ℃,10 s),退火(59.5 ℃,30 s),共39个循环。
1.7 免疫组织化学(IHC)定位NGF蛋白在牦牛生殖器官中的分布将组织样在4%多聚甲醛中进行充分固定,后进行脱水,包埋,切片(4 μm),石蜡切片脱蜡至水,然后将组织切片置于盛有柠檬酸抗原修复缓冲液(pH 6.0)的修复盒中进行抗原修复;再将切片放入3%双氧水溶液,室温避光孵育25 min,将玻片放入PBS(pH 7.4)中置于脱色摇床上晃动洗涤,以阻断内源性过氧化物酶活性;随后滴加3% BSA均匀覆盖组织,室温封闭30 min;轻轻吸掉封闭液,在切片上滴加一抗(1∶100稀释),对照组添加等量PBS代替一抗,后在湿盒内4 ℃孵育过夜;洗掉一抗后滴加二抗(HRP标记)覆盖组织,室温孵育50 min;洗掉二抗后滴加新鲜配制的DAB显色液,显微镜下控制显色时间,阳性为棕黄色,流水冲洗切片终止显色;用苏木素复染,酒精脱水,二甲苯透明,最后用中性树胶封片。利用激光共聚焦显微镜观察染色结果,拍摄各组显微照片。
1.8 数据统计分析每个样品采用RT-qPCR重复检测3次,以牦牛GAPDH基因表达量为参照,记录每组数据的Ct值,根据2-△△Ct算法[18],求出各组组织样的相对表达量。利用SPSS 21.0软件进行Duncan’s分析检测不同组间的差异显著性,其中P < 0.01表示差异极显著,P < 0.05表示差异显著;表达差异图利用Graphpad prism 8.02软件进行绘制。
2 结果 2.1 牦牛NGF基因的克隆本研究以3头黄体期牦牛卵巢的cDNA为模板,通过RT-PCR扩增得到与预期长度大小一致的目的片段(图 1)。通过测序得到牦牛NGF基因长942 bp,CDS区全长726 bp, 共编码241个氨基酸(图 2)。已将牦牛NGF cDNA序列提交至NCBI,获得登录号MZ298995。
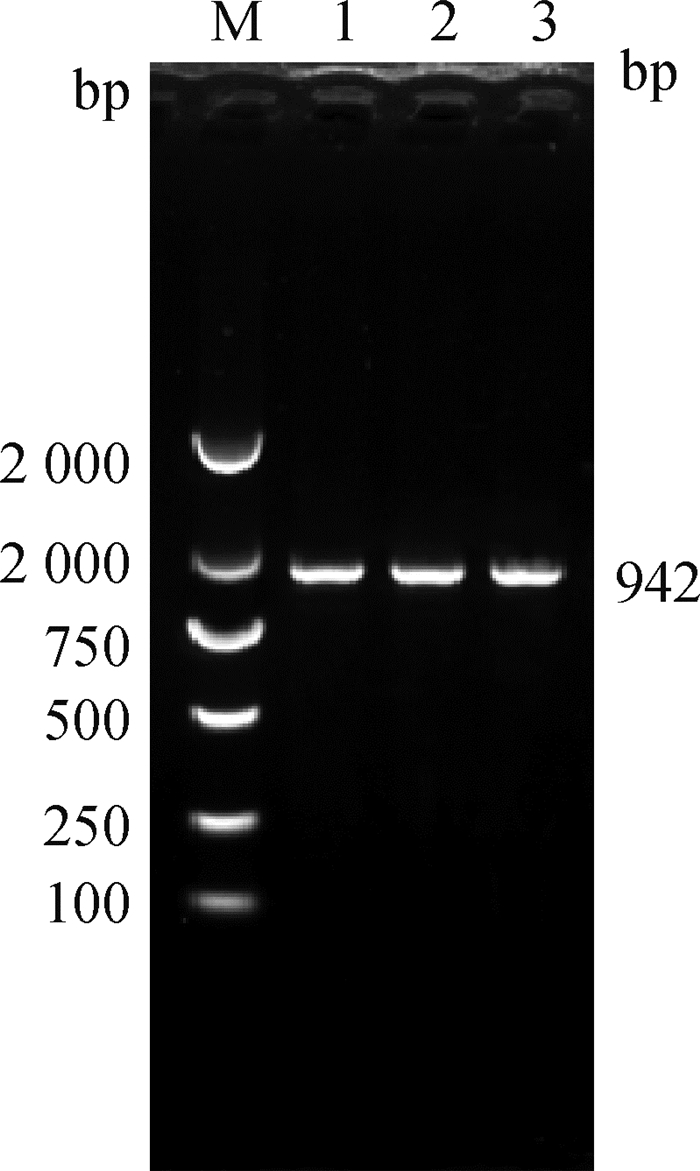
|
M. DNA相对分子质量标准;1~3. 3头牦牛的NGF目的片段 M. DL2000 DNA marker; 1-3. NGF gene fragment of 3 yaks 图 1 牦牛NGF基因的PCR扩增结果 Fig. 1 PCR amplification results of yak NGF gene |

|
加粗代表糖基化位点,斜体代表磷酸化位点,斜体加粗代表同时属于糖基化位点和磷酸化位点;下划线是起始密码子,*表示终止密码子 Bold represent glycosylation sites, italics represent phosphorylation sites, italics and bold together represent both glycosylation sites and phosphorylation sites; The underline is initiation codon, *indicates the termination codon 图 2 预测的牦牛NGF ORF及其编码的氨基酸序列 Fig. 2 The predicted yak NGF ORF and its encoded amino acid sequence |
利用ExPASy Protparam tool在线软件对牦牛NGF的氨基酸序列进行预测分析,结果显示该蛋白质分子式为C1179H1861N349O339S10,分子质量为26.67 ku;脂肪族系数为74.90、不稳定系数为44.16、亲水性总平均值为-0.293、理论等电点为9.72、在哺乳动物体内红细胞中的估计半衰期为30 h、消光系数为26 845;NGF蛋白共包含20种氨基酸,其中含量最高的是丙氨酸(Ala),其次是苏氨酸(Thr),占比分别为9.5%和8.3%,其他氨基酸含量均低于8%,带负电荷(Asp+Glu)的氨基酸残基总数和带正电荷(Arg+Lys)的氨基酸残基总数分别为19和31个。因此可以推断,NGF蛋白属于碱性不稳定亲水蛋白。
利用NetPhos 3.1预测牦牛NGF的磷酸化位点,结果显示其包含24个磷酸化位点,其中包含13个丝氨酸(Ser)磷酸化位点和11个苏氨酸(Thr)磷酸化位点;利用NetOGlyc4.0预测牦牛NGF的糖基化位点,结果显示其包含16个糖基化位点,其中包含15个O-糖基化位点和1个N-糖基化位点(图 2)。蛋白质的亚细胞定位显示,NGF蛋白在细胞中广泛分布,其中主要分布于线粒体和细胞外(包括细胞膜),占比分别为26.1%和17.4%,其次是细胞核、细胞质和内质网,占比均为13.0%,还存在于高尔基体和液泡中,占比分别为8.8%和8.7%。
2.3 牦牛NGF蛋白质同源性比对和系统进化树的构建利用DNAMAN将牦牛NGF基因所编码的氨基酸与其他物种进行同源性比对,结果显示,在进行比对的物种中,牦牛与黄牛(NP_001092832.1)的氨基酸序列相似性最高,为100%,与野牛(XP_010829044.1)、绵羊(XP_004002418.2)、野猪(XP_020945655.1)、赤狐(XP_025850472.1)的NGF氨基酸序列相似度依次为99%、98%、94%、92%,说明NGF基因在物种进化中具有高度保守性(图 3)。

|
黑色代表同源性为100%,粉色代表同源性大于75%,蓝色代表同源性大于50%, 白色同源性小于50% Black means homology was 100%, pink means homology higher than 75%, blue means homology higher than 50%, and white means homology lower than 50% 图 3 牦牛和其他物种间NGF氨基酸序列比对 Fig. 3 Alignment of amino acid sequence of NGF between yak and other species |
为了进一步研究牦牛NGF基因的进化过程,利用MEGA7.0构建牦牛NGF氨基酸的系统进化树,结果显示(图 4),牦牛首先与黄牛聚为一类,说明牦牛NGF基因与黄牛亲缘关系最近;其次与水牛、野牛、山羊、绵羊聚为一类,这些动物都属于反刍动物;再与野猪、虎鲸、小夜猴、金丝猴、东北虎和狗聚为一类;最后与蝙蝠聚为一类,与牦牛NGF基因亲缘关系最远的是蝙蝠,表明该基因的进化符合物种的进化规律。
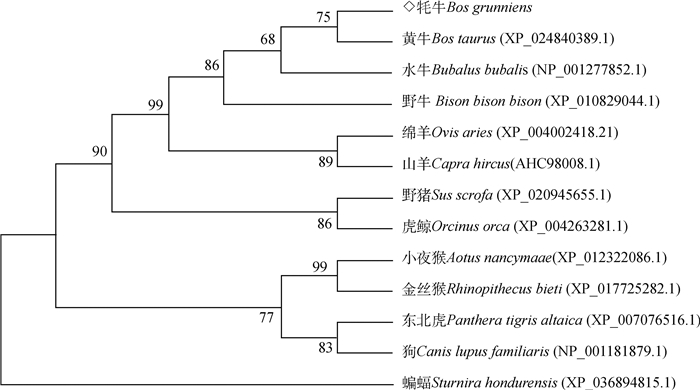
|
图 4 NGF蛋白系统进化树 Fig. 4 Phylogenetic tree of NGF protein |
利用PSIPRED和SWISS-MODE线上软件分别对牦牛NGF蛋白的二级结构和三级结构进行预测,结果显示NGF蛋白由β-转角、α-螺旋和无规则卷曲构成,占比分别为62.24%、14.11%和23.65%。不具有跨膜结构、胞外结构、无序结构等(图 5A),三级结构(图 5B)与二级结构相吻合,SignalP预测结果显示,牦牛NGF氨基酸18位和19位间可能存在Sec信号肽。
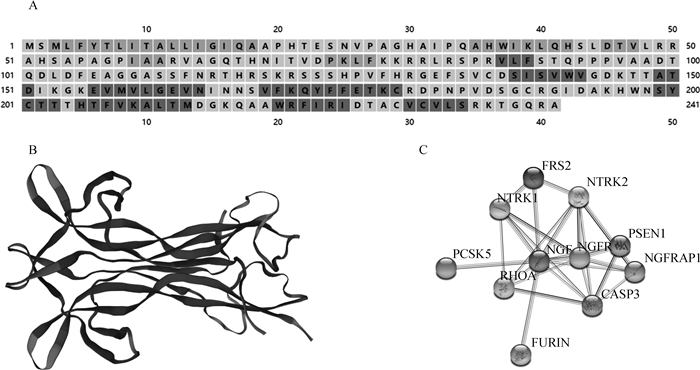
|
A. NGF蛋白的预测二级结构,其中黑色代表β-转角,浅黑色代表α-螺旋,灰色代表无规则卷曲; B. NGF蛋白的预测三级结构;C. 牦牛NGF蛋白互作网络分析图 A. The predicted secondary structure of NGF protein, in which the color black, light black and gray stand for β-sheet, α-helix and random coil, respectively; B. The predicted tertiary structure of NGF protein; C. Analysis of interaction network of yak NGF protein 图 5 牦牛NGF蛋白结构预测和互作网络分析图 Fig. 5 Structure prediction and interaction network of yak NGF protein |
利用STRING线上分析软件对牦牛NGF蛋白进行蛋白网络互作分析,结果显示NGF蛋白与神经营养受体酪氨酸激酶1(NTRK1)、神经生长因子受体(NGFR)、神经营养受体酪氨酸激酶2(NTRK2)、半胱氨酸天冬氨酸蛋白酶-3(CASP3)、前蛋白转化酶枯草溶菌素5(PCSK5)和弗林蛋白酶(FURIN)等蛋白互作紧密(图 5C),它们的相关性系数分别为0.999、0.992、0.988、0.967、0.948和0.941。
2.5 牦牛NGF基因在组织中的表达分析以输卵管中NGF基因的相对表达量作为参考,利用RT-qPCR技术对牦牛心、肝、脾、肺、肾、卵巢、子宫和输卵管中NGF基因mRNA的表达水平进行检测。结果显示(图 6),NGF基因在牦牛各组织中广泛表达,其中在卵巢中相对表达量最高,极显著高于其他组织(P < 0.01);其次在心和肾中表达较高,在心中的表达极显著高于子宫、输卵管、肝、脾和肺(P < 0.01),在肾中的表达量极显著高于输卵管、肝、脾和肺(P < 0.01);在子宫中表达量显著高于肺(P < 0.05);在输卵管、肝、脾和肺中表达量较低,且组织间表达差异不显著。
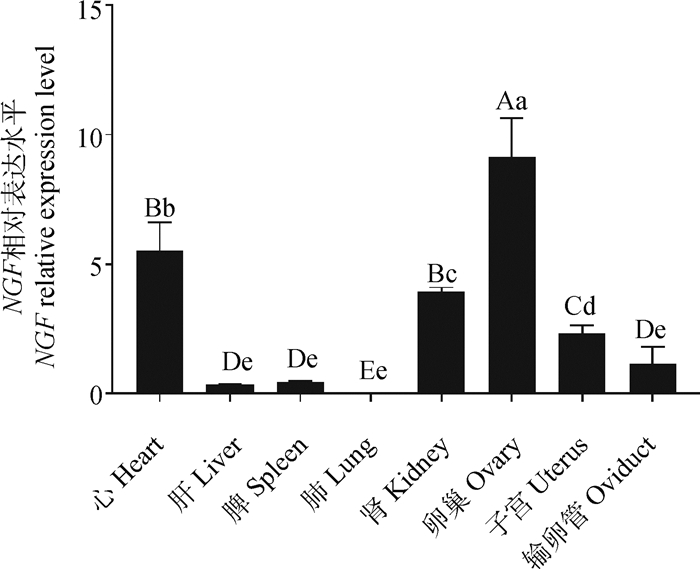
|
不同大写字母表示差异极显著(P < 0.01),不同小写字母表示差异显著(P < 0.05),字母相同表示差异不显著。下同 Different capital letters indicate extremely significant difference (P < 0.01), different small letters indicate significant difference (P < 0.05), and the same letter indicate no significant difference. The same as below 图 6 NGF基因在母牦牛不同组织的相对表达水平 Fig. 6 Relative expression level of NGF gene in different tissues of female yaks |
黄体期卵巢中NGF的相对表达量最高,极显著高于其他3个时期(P < 0.01),其他时期间表达差异不显著;在子宫中,NGF相对表达较高的是妊娠期,显著高于胎牛期和卵泡期(P < 0.05),卵泡期和胎牛期的表达差异不显著;在输卵管中,NGF mRNA各时期表达差异不显著(图 7)。另经统计分析发现,胎牛期卵巢中NGF的相对表达量显著高于输卵管(P < 0.05),卵泡期卵巢中NGF的相对表达量极显著高于子宫和输卵管(P < 0.01),黄体期卵巢中NGF的相对表达量极显著高于子宫和输卵管(P < 0.01),妊娠期卵巢和子宫中NGF的相对表达量极显著高于输卵管(P < 0.01)。
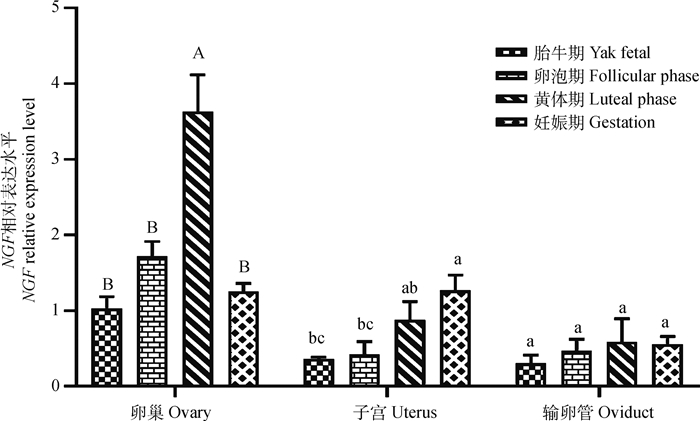
|
图 7 NGF基因在母牦牛生殖器官中的相对表达水平 Fig. 7 Relative expression level of NGF gene in reproductive organs of female yaks |
利用免疫组化技术定位NGF蛋白在牦牛生殖器官中的表达分布,其中棕黄色为NGF蛋白。NGF蛋白在牦牛颗粒层细胞和卵巢上皮层细胞均有表达,在颗粒层细胞表达强烈(图 8A, B, C, D);NGF蛋白在牦牛子宫内膜具有高表达(图 8E),在牦牛输卵管的黏膜上皮细胞高表达(图 8F)。

|
A~F. 免疫组化染色照片;A~D. 卵巢;E. 子宫;F. 输卵管;G~I. 卵巢、子宫、输卵管的阴性对照. SG. 颗粒层;TI. 卵泡膜内层;PF. 初级卵泡;OE. 卵巢上皮层;FA. 卵泡腔;E. 子宫内膜;EM. 黏膜上皮;L. 管腔 A-F. Immunohistochemical staining photos; A-D. Ovary; E. Uterus; F. Oviduct; G-I. Negative controls of ovary, uterus and oviduct, respectively. SG. Stratum granulosum; TI. Theca interna; PF. Primary follicle; OE. Ovarian epithelium; FA. Follicular antrum; E. Endometrium; EM. Epithelium mucosae; L. Lumen 图 8 NGF蛋白在母牦牛生殖器官中的分布 Fig. 8 Distribution of NGF proteins in reproductive organs of female yaks |
NGF对周围和中枢神经系统神经细胞的存活、生长和分化等具有重要的调节功能,在发育和神经生物学中扮演着重要的角色[3],NGF不仅对退化的周围神经细胞具有保护作用,而且对神经细胞合成神经递质和神经肽也起着调节作用[19]。临床研究表明,NGF局部给药对治疗人皮肤压疮、角膜溃疡、青光眼、视网膜黄斑病变、视网膜色素变性以及儿童视神经胶质瘤和脑外伤都具有积极作用[3]。NGF能诱导骆驼排卵的发现掀起了新的研究热潮,探讨NGF在雌性动物生殖系统中的潜在作用具有重要意义[8, 20-21]。鉴于牦牛的低繁殖率和高流产率,研究NGF基因在牦牛生殖器官的表达特性具有重要的现实意义,也为后续利用研究NGF提高牦牛繁殖效率提供一定的理论基础。
本研究成功克隆测序得到牦牛NGF基因完整的CDS区,其长度为726 bp,共编码241个氨基酸,在所编码的氨基酸中,丙氨酸和苏氨酸的含量较高,研究发现当NGF中丙氨酸发生突变时其对NGFR的结合亲和力降低4~10倍,生物学活性降低,说明丙氨酸对NGF的功能实现不可或缺[22]。BREK是一种具有催化活性的丝氨酸/苏氨酸激酶,BREK在受到NGF的刺激后迅速磷酸化,激活其酶活力,进而促进神经元突触的形成[23]。牦牛NGF蛋白质的亚细胞定位显示其主要存在于线粒体中。Ahluwalia等[24]在研究NGF对大鼠胃微血管细胞的保护机制时发现NGF的高亲和力受体TrkA主要存在于胃微血管细胞膜的线粒体中,NGF的保护机制是由TrkA对线粒体的直接作用所介导的。在NGF氨基酸序列比对中发现牦牛与黄牛的同源性最高,相似度为100%,系统进化树也显示牦牛首先与黄牛聚为一类,说明牦牛NGF基因与黄牛亲缘关系最近,再与同属于反刍动物的水牛、野牛、山羊、绵羊聚为一类,最后与同属于哺乳动物的野猪、虎鲸、小夜猴、金丝猴、东北虎、狗、蝙蝠聚为一类,在所进行比对的动物中氨基酸同源性均在87%以上。Ebendal等[25]也发现,NGF氨基酸在不同物种间具有高度的同源性,说明NGF基因在物种进化过程中高度保守。蛋白互作分析发现NGF蛋白与NTRK1、NGFR、NTRK2、Caspase-3、PCSK5和Furin等蛋白互作紧密。NTRK1和NGFR同属于NGF受体,NGF与NTRK1和NGFR特异性结合进而发挥其生物学功能[3];Caspase-3是细胞凋亡的关键执行者,在利用神经节苷脂治疗急性脊髓损伤大鼠时发现Caspase-3的表达下调,NGF基因表达上调,表明二者存在拮抗作用[26]。PCSK5是体内proNGF的加工酶,PCSK5加工与否决定了神经元细胞的存活及死亡,加工后的NGF与NTRK1以高亲和力结合,诱导细胞增殖分化,未加工的NGF与NGFR以低亲和力结合,促进细胞凋亡,同时NGF的成熟还需要Furin蛋白酶的内切作用实现[27-28]。
本研究的组织表达谱结果分析显示,NGF在牦牛各组织中广泛表达,其中在卵巢中的相对表达量最高,在心、肾和子宫的表达量较高,在肺、脾和肝的表达较低。在人[29]和小鼠[30]的研究中也发现,NGF mRNA广泛分布,并在卵巢和心高表达,对维持卵巢和心的生理功能具有重要作用。RT-qPCR结果显示牦牛黄体期卵巢中NGF mRNA的表达量显著高于卵泡期、妊娠期和胎牛期,说明NGF在维持牦牛黄体功能中发挥重要作用。牦牛卵巢IHC结果显示NGF蛋白广泛分布于卵泡的颗粒细胞和内膜细胞中,这与在人、松鼠和牛卵巢上的表达定位相似,证明NGF蛋白在牦牛卵巢的功能实现上不可缺少。已有研究发现,排卵后残留的颗粒细胞在LH的作用下形成富含毛细血管的黄体组织,NGF与VEGF协同促进血管细胞增殖,以形成黄体的血管系统[31]。研究还发现,NGF对LH峰和排卵的促进作用主要通过促进下丘脑促性腺激素释放激素(GnRH)神经元实现,卵巢在调节下丘脑或垂体对NGF的反应中起着重要作用,NGF促进垂体分泌LH[8]。羊驼NGF肌注治疗可以增加血浆中P4浓度,同时增加了黄体直径,扩大了黄体血管面积,延长了黄体退化时间[32]。Stewart等[33]对荷斯坦母牛进行同期发情处理时发现,GnRH配合NGF使用的试验组中LH的释放量和LH峰值都比仅用GnRH的处理组高。Silva等[34]向美洲驼肌肉、静脉或宫内注射NGF都会引起排卵前LH激增,进而诱发排卵和功能性黄体的发育,García-García等[35]向雌性兔子肌肉注射NGF后发现兔子排卵率有了显著提高。上述研究结果均证明,NGF会对雌性动物卵巢的生殖活动产生重要影响,但也有研究显示卵巢中NGF的过量表达会损害胚胎发育并导致成年雌性小鼠的生殖和代谢功能障碍;同时还会损害卵母细胞和卵丘细胞之间的双向交流,降低卵母细胞的发育能力[36-37]。牦牛黄体期卵巢中NGF的高表达说明NGF可能在促进牦牛黄体形成和促进排卵过程中发挥重要作用。
子宫是早期胚胎附植、发育的场所,还具有调节卵巢功能、帮助精子获能等功能[38]。Barraza等[39]在妊娠羊驼的子宫腔上皮细胞中发现了NGF和NTRK1的表达,怀孕15 d的羊驼的子宫中NGF和NTRK1的相对表达量显著高于未妊娠组,并观察到骆驼子宫内膜血管的增加,说明NGF参与了羊驼胚胎妊娠过程的血管发育。研究发现,妊娠过程中胎儿的发育、P4和雌激素分泌量的增加等都会损害子宫的交感神经系统,而妊娠期大鼠子宫中NGF的表达量显著增高有利于怀孕子宫交感神经系统的再生[40]。本研究RT-qPCR结果显示NGF在妊娠期子宫中的相对表达量最高,子宫IHC结果显示NGF蛋白在子宫内膜高表达,说明NGF参与了牦牛的妊娠过程,NGF可能参与母牦牛子宫内膜血管的形成和交感神经系统的恢复,为妊娠子宫的功能实现发挥重要作用。Li等[41]在牛输卵管上皮细胞中检测到NGF及其受体NTRK1的表达,并推测NGF/NTRK1可能通过与促性腺激素的相互作用来调节牛输卵管功能;Maruccio等[42]发现,NGF和NTRK1主要存在于日本鹌鹑输卵管的血管壁神经纤维中。输卵管是卵子进入子宫的通道,是精卵结合的受精部位,输卵管局部化境的变化主要发生在排卵前后和妊娠早期,其他时期差异不明显[43]。本研究发现,NGF在牦牛各时期输卵管中均有表达,但表达差异不显著,这与输卵管在这几个时期的功能没有显著差异一致。输卵管IHC结果显示,NGF蛋白主要存在于牦牛输卵管的黏膜上皮中,说明NGF蛋白参与了牦牛输卵管的生殖活动。
4 结论本研究成功克隆出牦牛NGF基因并通过测序获得其完整的CDS区,其长度为726 bp,共编码241个氨基酸,核苷酸序列比对发现该基因在进化过程中具有高度保守性;NGF基因在牦牛各组织中均有表达,在卵巢中表达量较高,尤其是在黄体期的卵巢和妊娠期的子宫中表达量高,IHC定位发现NGF蛋白主要在卵巢的颗粒细胞和子宫内膜中表达,说明NGF可能在维持母牦牛卵巢机能与妊娠以及促黄体作用发挥重要的调控作用。
| [1] |
TESSAROLLO L. Pleiotropic functions of neurotrophins in development[J]. Cytokine Growth Factor Rev, 1998, 9(2): 125-137. DOI:10.1016/S1359-6101(98)00003-3 |
| [2] |
ANGELETTI R H, BRADSHAW R A. Nerve growth factor from mouse submaxillary gland: amino acid sequence[J]. Proc Natl Acad Sci U S A, 1971, 68(10): 2417-2420. DOI:10.1073/pnas.68.10.2417 |
| [3] |
ROCCO M L, SOLIGO M, MANNI L, et al. Nerve growth factor: early studies and recent clinical trials[J]. Curr Neuropharmacol, 2018, 16(10): 1455-1465. DOI:10.2174/1570159X16666180412092859 |
| [4] |
ZHANG R, LIANG Y, WEI S X. The expressions of NGF and VEGF in the fracture tissues are closely associated with accelerated clavicle fracture healing in patients with traumatic brain injury[J]. Ther Clin Risk Manag, 2018, 14: 2315-2322. DOI:10.2147/TCRM.S182325 |
| [5] |
LIN H H, HUANG H J, YU Y H, et al. Nerve growth factor regulates liver cancer cell polarity and motility[J]. Mol Med Rep, 2021, 23(4): 288. DOI:10.3892/mmr.2021.11927 |
| [6] |
LIU Z X, WU H W, HUANG S Y. Role of NGF and its receptors in wound healing (review)[J]. Exp Ther Med, 2021, 21(6): 599. DOI:10.3892/etm.2021.10031 |
| [7] |
LIMA F S, STEWART J L, CANISSO I F. Insights into nerve growth factor-β role in bovine reproduction-review[J]. Theriogenology, 2020, 150: 288-293. DOI:10.1016/j.theriogenology.2020.01.076 |
| [8] |
SILVA M, PAIVA L, RATTO M H. Ovulation mechanism in south American camelids: the active role of β-NGF as the chemical signal eliciting ovulation in llamas and alpacas[J]. Theriogenology, 2020, 150: 280-287. DOI:10.1016/j.theriogenology.2020.01.078 |
| [9] |
DISSEN G A, HILL D F, COSTA M E, et al. A role for trkA nerve growth factor receptors in mammalian ovulation[J]. Endocrinology, 1996, 137(1): 198-209. DOI:10.1210/endo.137.1.8536613 |
| [10] |
DISSEN G A, ROMERO C, HIRSHFIELD A N, et al. Nerve growth factor is required for early follicular development in the mammalian ovary[J]. Endocrinology, 2001, 142(5): 2078-2086. DOI:10.1210/endo.142.5.8126 |
| [11] |
DISSEN G A, PARROTT J A, SKINNER M K, et al. Direct effects of nerve growth factor on thecal cells from antral ovarian follicles[J]. Endocrinology, 2000, 141(12): 4736-4750. DOI:10.1210/endo.141.12.7850 |
| [12] |
LEVANTI M B, GERMANÀ A, ABBATE F, et al. TrkA and p75NTR in the ovary of adult cow and pig[J]. J Anat, 2005, 207(1): 93-96. DOI:10.1111/j.1469-7580.2005.00423.x |
| [13] |
MARANESI M, PALERMO F A, BUFALARI A, et al. Seasonal expression of NGF and its cognate receptors in the ovaries of grey squirrels (Sciurus carolinensis)[J]. Animals (Basel), 2020, 10(9): 1558. |
| [14] |
ABIR R, FISCH B, JIN S, et al. Presence of NGF and its receptors in ovaries from human fetuses and adults[J]. Mol Hum Reprod, 2005, 11(4): 229-236. DOI:10.1093/molehr/gah164 |
| [15] |
杨远潇, 字向东. 玻璃化冷冻对牦牛未成熟卵母细胞发育能力及COC转录组的影响[J]. 畜牧兽医学报, 2020, 51(2): 288-298. YANG Y X, ZI X D. Effect of vitrification on developmental competence of immature oocytes and COC transcriptome of yaks[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(2): 288-298. (in Chinese) |
| [16] |
王琴, 熊燕, 字向东. 体外成熟液中添加PAF对牦牛卵母细胞发育能力及基因表达的影响[J]. 畜牧兽医学报, 2020, 51(3): 514-523. WANG Q, XIONG Y, ZI X D. Effects of PAF supplementation during in vitro maturation medium on yak oocyte development competence and gene expression[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(3): 514-523. (in Chinese) |
| [17] |
XIA Y, WANG Q, HE X D, et al. Cloning and expression analysis of the follicle-stimulating hormone receptor (FSHR) gene in the reproductive axis of female yaks (Bos grunniens)[J]. Domest Anim Endocrinol, 2020, 70: 106383. DOI:10.1016/j.domaniend.2019.07.011 |
| [18] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [19] |
LEVI-MONTALCINI R, DAL TOSO R, DELLA VALLE F, et al. Update of the NGF saga[J]. J Neurol Sci, 1995, 130(2): 119-127. DOI:10.1016/0022-510X(95)00007-O |
| [20] |
STEWART J L, MERCADANTE V R G, DIAS N W, et al. Nerve growth factor-beta, purified from bull seminal plasma, enhances corpus luteum formation and conceptus development in Bos taurus cows[J]. Theriogenology, 2018, 106: 30-38. DOI:10.1016/j.theriogenology.2017.10.007 |
| [21] |
GARCIA-GARCIA R M, ARIAS-ALVAREZ M, SANCHEZ-RODRIGUEZ A, et al. Role of nerve growth factor in the reproductive physiology of female rabbits: a review[J]. Theriogenology, 2020, 150: 321-328. DOI:10.1016/j.theriogenology.2020.01.070 |
| [22] |
RYDÉN M, IBÁÑEZ C F. A second determinant of binding to the p75 neurotrophin receptor revealed by alanine-scanning mutagenesis of a conserved loop in nerve growth factor[J]. J Biol Chem, 1997, 272(52): 33085-33091. DOI:10.1074/jbc.272.52.33085 |
| [23] |
KAWA S, FUJIMOTO J, TEZUKA T, et al. Involvement of BREK, a serine/threonine kinase enriched in brain, in NGF signalling[J]. Genes Cells, 2004, 9(3): 219-232. DOI:10.1111/j.1356-9597.2004.00714.x |
| [24] |
AHLUWALIA A, JONES M K, HOA N, et al. NGF protects endothelial cells from indomethacin-induced injury through activation of mitochondria and upregulation of IGF-1[J]. Cell Signal, 2017, 40: 22-29. DOI:10.1016/j.cellsig.2017.08.006 |
| [25] |
EBENDAL T, LARHAMMAR D, PERSSON H. Structure and expression of the chicken beta nerve growth factor gene[J]. EMBO J, 1986, 5(7): 1483-1487. DOI:10.1002/j.1460-2075.1986.tb04386.x |
| [26] |
YUAN B, PAN S, ZHANG W W. Effects of gangliosides on expressions of caspase-3 and NGF in rats with acute spinal cord injury[J]. Eur Rev Med Pharmacol Sci, 2017, 21(24): 5843-5849. |
| [27] |
LEE R, KERMANI P, TENG K K, et al. Regulation of cell survival by secreted proneurotrophins[J]. Science, 2001, 294(5548): 1945-1948. DOI:10.1126/science.1065057 |
| [28] |
URBAN D, LORENZ J, MEYBORG H, et al. Proprotein convertase furin enhances survival and migration of vascular smooth muscle cells via processing of pro-nerve growth factor[J]. J Biochem, 2013, 153(2): 197-207. DOI:10.1093/jb/mvs137 |
| [29] |
FAGERBERG L, HALLSTRÖM B M, OKSVOLD P, et al. Analysis of the human tissue-specific expression by genome-wide integration of transcriptomics and antibody-based proteomics[J]. Mol Cell Proteomics, 2014, 13(2): 397-406. DOI:10.1074/mcp.M113.035600 |
| [30] |
YUE F, CHENG Y, BRESCHI A, et al. A comparative encyclopedia of DNA elements in the mouse genome[J]. Nature, 2014, 515(7527): 355-364. DOI:10.1038/nature13992 |
| [31] |
JULIO-PIEPER M, LARA H E, BRAVO J A, et al. Effects of nerve growth factor (NGF) on blood vessels area and expression of the angiogenic factors VEGF and TGFbeta1 in the rat ovary[J]. Reprod Biol Endocrinol, 2006, 4: 57. DOI:10.1186/1477-7827-4-57 |
| [32] |
ADAMS G P, RATTO M H, HUANCA W, et al. Ovulation-inducing factor in the seminal plasma of alpacas and llamas[J]. Biol Reprod, 2005, 73(3): 452-457. DOI:10.1095/biolreprod.105.040097 |
| [33] |
STEWART J L, MERCADANTE V R G, DIAS N, et al. Nerve growth factor-β increases small luteal cell number and steroidogenic activity in the bovine corpus luteum[J]. J Dairy Sci, 2019, 102(1): 344. |
| [34] |
SILVA M, FERNÁNDEZ A, ULLOA-LEAL C, et al. LH release and ovulatory response after intramuscular, intravenous, and intrauterine administration of β-nerve growth factor of seminal plasma origin in female llamas[J]. Theriogenology, 2015, 84(7): 1096-1102. DOI:10.1016/j.theriogenology.2015.06.006 |
| [35] |
GARCÍA-GARCÍA R M, DEL MAR MASDEU M, RODRIGUEZ A S, et al. β-Nerve growth factor identification in male rabbit genital tract and seminal plasma and its role in ovulation induction in rabbit does[J]. Ital J Anim Sci,, 2018, 17: 442-453. DOI:10.1080/1828051X.2017.1382315 |
| [36] |
ZHAI Y W, YAO G D, RAO F, et al. Excessive nerve growth factor impairs bidirectional communication between the oocyte and cumulus cells resulting in reduced oocyte competence[J]. Reprod Biol Endocrinol, 2018, 16(1): 28. DOI:10.1186/s12958-018-0349-7 |
| [37] |
MANTI M, PUI H P, EDSTRÖM S, et al. Excess of ovarian nerve growth factor impairs embryonic development and causes reproductive and metabolic dysfunction in adult female mice[J]. Faseb J, 2020, 34(11): 14440-14457. DOI:10.1096/fj.202001060R |
| [38] |
WRAY S, PRENDERGAST C. The myometrium: from excitation to contractions and labour[J]. Adv Exp Med Biol, 2019, 1124: 233-263. |
| [39] |
BARRAZA D E, SARI L M, APICHELA S A, et al. New insights into the role of β-NGF/TrKA system in the endometrium of alpacas during early pregnancy[J]. Front Vet Sci, 2021, 7: 583369. DOI:10.3389/fvets.2020.583369 |
| [40] |
VAROL F G, DUCHEMIN A M, NEFF N H, et al. Nerve growth factor (NGF) and NGF mRNA change in rat uterus during pregnancy[J]. Neurosci Lett, 2000, 294(1): 58-62. DOI:10.1016/S0304-3940(00)01533-0 |
| [41] |
LI C J, MA Y H, YI K L, et al. The interactions between nerve growth factor and gonadotrophins in bovine oviduct[J]. Anim Reprod Sci, 2014, 149(3-4): 117-123. DOI:10.1016/j.anireprosci.2014.06.030 |
| [42] |
MARUCCIO L, CASTALDO L, D'ANGELO L, et al. Neurotrophins and specific receptors in the oviduct tracts of Japanese quail (Coturnix coturnix japonica)[J]. Ann Anat, 2016, 207: 38-46. DOI:10.1016/j.aanat.2016.04.033 |
| [43] |
HARRIS E A, STEPHENS K K, WINUTHAYANON W. Extracellular vesicles and the oviduct function[J]. Int J Mol Sci, 2020, 21(21): 8280. DOI:10.3390/ijms21218280 |
(编辑 郭云雁)



