牦牛是我国青藏高原及毗邻地区农牧民重要的生产生活物资,也是我国重要的特色遗传资源[1]。牦牛作为藏区重要的养殖畜种之一,为当地人民提供了丰富的肉、乳、毛等重要生活物资。牦牛肉风味独特,与普通肉牛相比,具有低脂肪、高蛋白、富含多种重要的维生素和矿物质等优势[2],但由于营养条件和品种原因,其生长速度缓慢且脂肪沉积效率低下,造成了牦牛肉嫩度较差,口感粗糙[3],这也就限制了牦牛肉产品经济效益的提高。牦牛肉中肌内脂肪(IMF)含量是影响牦牛肉产品口感的重要因素[4-6],并且与皮下脂肪(SF)相比,肌内脂肪能提供共轭亚油酸和单不饱和脂肪酸等营养物质,对降低心血管疾病发病率、抗动脉粥样硬化具有一定的益处[7]。因此,研究如何提高牦牛肉中的IMF含量,降低SF含量对提高牦牛肉口感和经济效益具有重要的意义。
动物体内脂肪组织的生长主要通过脂肪细胞的肥大和增殖[8],但成熟的脂肪细胞是有丝分裂之后形成,并不具有分裂能力,因此成熟脂肪细胞的数量在很大程度上取决于前体脂肪细胞的增殖分化[9]。前体脂肪细胞成熟的过程大概分为两个阶段:第一阶段是前体脂肪细胞的增殖;第二阶段是前体脂肪细胞分化为成熟的脂肪细胞,即永久性细胞周期停滞的前体脂肪细胞,细胞形态变为球形,摄取营养使其填充为成熟脂肪细胞[10]。体外成熟皮下和肌内脂肪细胞来源于皮下和肌内前体脂肪细胞的分化,而前体脂肪细胞的分化主要由分化关键因子过氧化物酶体增殖物激活受体γ(PPARγ)和CCAAT增强子结合蛋白α(C/EBPα)等调控[11]。脂肪组织的特征和功能存在区域差异,是由于发育过程中形成的前体脂肪细胞来源差异造成[12],这也说明不同部位来源的前体脂肪细胞在分化过程中也可能存在差异。
皮下和肌内脂肪细胞的体外模型建立多见于鼠、猪、肉牛、羊等动物,牦牛脂肪沉积率低,因此皮下脂肪模型的建立具有一定的难度,而牦牛肌内脂肪细胞体外模型的建立更鲜有报道。因此,本试验通过优化传统酶消化法消化成年牦牛的皮下脂肪组织以及背最长肌,建立牦牛体外皮下和肌内脂肪细胞模型,并进一步检测两部位前体脂肪细胞的增殖能力和分化过程中成脂关键基因的表达,对研究牦牛皮下和肌内脂肪的形成、特异性育肥以及改善牦牛肉质具有重要意义。
1 材料与方法 1.1 主要试验试剂DMEM-F12高糖培养基、无菌PBS购自上海培源生物有限公司;胎牛血清、3-异丁基-1-甲基黄嘌呤(IBMX)、罗格列酮(ROG)购自Sigma公司;青/链霉素(双抗)、地塞米松(DEX)、胰岛素、I型和II型胶原酶购自索莱宝公司;油红O染色试剂盒购自博奥森公司;RNA提取试剂盒购自美基生物科技公司;反转录和定量试剂盒购自艾科瑞公司。
1.2 样品采集及处理在都江堰辉润屠宰场采取5头18~22月龄健康麦洼公牦牛的腹部皮下脂肪组织和背最长肌组织,使用无菌PBS冲洗至表面无血污后,放置到含有5%三抗PBS的无菌袋中带回无菌细胞房。
1.3 牦牛皮下前体脂肪细胞分离培养将皮下脂肪组织使用含10%三抗的PBS浸泡3遍,再用含2%三抗的PBS冲洗至干净,用剪刀剔除血管、筋膜,随后用剪刀剪成1~3 mm3的组织颗粒,并与I型胶原酶(2 mg·mL-1)混合,37 ℃恒温气浴消化40~60 min,消化后的糜状物用40 μm的细胞筛进行过滤,收集滤液并及时终止消化。将得到的滤液以1 200 r·min-1离心10 min,弃去上清液,得到细胞团,使用红细胞裂解液重悬细胞,并以相同条件离心;将得到的细胞团用预热PBS重悬后,再800 r·min-1离心3 min,弃上清并重复上述清洗过程2次,最后将细胞用完全培养基(DMEM高糖培养基、2%双抗、10%胎牛血清)重悬后接种于培养瓶中,在37 ℃、CO2浓度为5%的培养箱中培养至传代或冻存备用。
1.4 牦牛肌内前体脂肪细胞分离培养将背最长肌组织使用含10%三抗的PBS交替清洗3次,用剪刀剔除肌肉和筋膜,随后用剪刀剪成1~3 mm3的组织颗粒,与II型胶原酶(1 mg·mL-1) 混合,之后37 ℃恒温气浴消化40~60 min,消化后的糜状物用40 μm的无菌细胞筛进行过滤,收集滤液并及时终止消化。将得到的滤液以1 200 r·min-1离心10 min,弃去上清液,得到细胞团, 使用红细胞裂解液重悬细胞,并以相同条件离心;将得到的细胞团用预热PBS重悬后,再800 r·min-1离心5 min,弃上清并重复上述清洗过程2次,最后将细胞用完全培养基重悬后接种于培养瓶中,通过差速贴壁法纯化2 h,随后在37 ℃、CO2浓度为5%的培养箱中培养至传代或冻存备用。
1.5 前体脂肪细胞标记物PREF-1免疫荧光鉴定将皮下和肌内前体脂肪细胞分别接种在6孔培养板中,当细胞汇合达到70%时,弃去培养基,使用PBS轻柔洗涤细胞,每孔加入1.5 mL 4%的多聚甲醛,将细胞固定30 min,PBS洗涤;用浓度为0.5%的Triton X-100使细胞通透60 min,弃去液体,PBS洗涤,使用浓度为5%的山羊血清封闭60 min;弃去封闭溶液,并加入稀释的兔PREF-1抗体,4 ℃孵育过夜,弃去一抗,加入稀释的抗兔FITC荧光二抗,37 ℃孵育80 min,弃去二抗后用PBS洗3次,每次3 min。后滴加DAPI避光孵育5 min,用PBS洗4次去除多余的DAPI,每次5 min。最后加入适量PBS,在倒置荧光显微镜下观察结果。
1.6 前体脂肪细胞增殖能力检测将皮下与肌内前体脂肪细胞分别接种于96孔板,每孔细胞接种量为6×103个。使用CCK-8法检测牦牛皮下和肌内前体脂肪细胞增殖速度差异。每孔加入10%的CCK-8试剂,在37 ℃下孵育2 h,在450 nm波长下读取OD值。
1.7 不同部位前体脂肪细胞诱导分化皮下和肌内前体脂肪细胞生长融合至90%,继续培养2 d,随后将完全培养基换成分化培养基(添加2%双抗、1% 注射用卵磷脂、10 μg·mL-1牛胰岛素、0.5 mmol·L-1 DEX、0.5 mmol·L-1 IBMX、1 mmol·L-1 ROG)。分化3 d后更换维持培养基(添加2%双抗、10 μg·mL-1牛胰岛素)维持细胞6 d。换分化培养基第1天记为第0天。
1.8 油红O染色皮下和肌内前体脂肪细胞分化出明显脂滴后,弃去培养基,使用PBS轻柔清洗以完全去除培养基成分,每孔加入1.5 mL 10%中性多聚甲醛固定液,室温固定30 min。随后用60%异丙醇浸泡细胞,之后弃去异丙醇,每孔加入1.5 mL油红O工作液,室温孵育15 min,弃去染色液,用60%异丙醇分色,最后晾干镜检。
1.9 RNA提取及成脂分化相关基因qRT-PCR检测使用上述RNA提取试剂盒分别提取牦牛分化第0、3、6、9天的总肌内脂肪细胞和皮下脂肪细胞RNA。提取RNA后进行cDNA的合成和实时定量PCR检测。引物序列见表 1,本试验中,以UXT基因作为参考基因,使用2-△△CT法计算牦牛肌内和皮下脂肪细胞成脂分化基因的相对表达量变化。
|
|
表 1 实时定量PCR引物序列 Table 1 Primer sequences used for real-time quantitative PCR |
试验均设置3个重复组,所有数据使用SPASS软件进行单因素方差分析(One-way ANOVA),并通过LSD法进行多重比较,若P<0.05表示差异显著,说明具有统计学意义,作图则使用GraphPad Prism 6.0软件。
2 结果 2.1 牦牛肌内前体脂肪细胞和皮下前体脂肪细胞形态学观察对牦牛背最长肌和皮下脂肪组织进行酶消化处理,分离出的肌内前体脂肪细胞和皮下前体脂肪细胞如图 1所示,二者大部分均在原代培养第1天呈现椭圆状,随着培养时间的增加,椭圆状细胞逐渐变为长梭状,符合前体脂肪细胞形态。两个部位前体脂肪细胞均能在第4~5天完成融合。

|
IMF.肌内脂肪细胞;SC.皮下脂肪细胞 IMF.Intramuscular adipocytes; SC.Subcutaneous adipocytes 图 1 牦牛前体脂肪细胞原代生长情况(200×) Fig. 1 Primary growth of preadipocytes in yak (200×) |
将皮下前体脂肪细胞和肌内前体脂肪细胞接种于6孔板内,待两部位细胞生长至70%,对二者细胞PREF-1蛋白的表达进行免疫荧光检测,鉴定结果如图 2所示,可以看出皮下和肌内前体脂肪细胞TIFC检测呈阳性,且荧光形态与长梭形符合,这表明,PREF-1蛋白表达为阳性,PREF-1蛋白作为前体脂肪细胞特异性表达蛋白可以用来鉴定细胞样本是否为前体脂肪细胞,因此可以看出,本试验分离出来的细胞均为前体脂肪细胞,且根据MERGE组合图可以看出,两部位分离出的前体脂肪细胞形态良好,且细胞核显影与细胞显影重合度高。
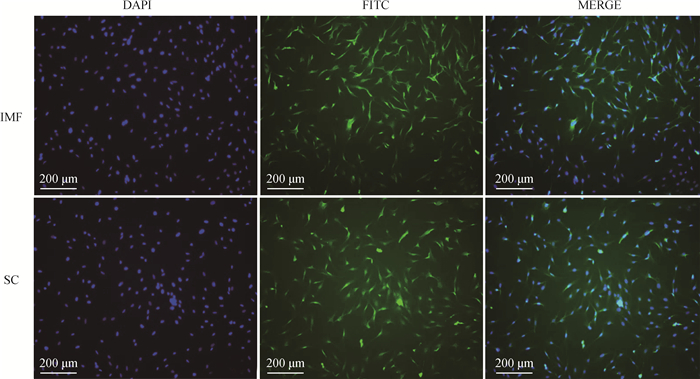
|
图 2 免疫荧光鉴定(200×) Fig. 2 Immunofluorescence identification (200×) |
使用CCK-8法测定牦牛皮下和肌内前体脂肪细胞的生长曲线,从图 3可以看出,牦牛肌内和皮下前体脂肪细胞生长曲线均呈现经典的“S”型,两部位细胞均在3 d内处于潜伏期,在生长第4天达到对数生长期,在第6天达到平台期,符合细胞的生长规律。并且从两部位OD值差异对比发现牦牛皮下前体脂肪细胞在第4天OD值显著高于肌内前体脂肪细胞(P < 0.05),这说明牦牛皮下前体脂肪细胞生长速度在第4天高于肌内前体脂肪细胞。
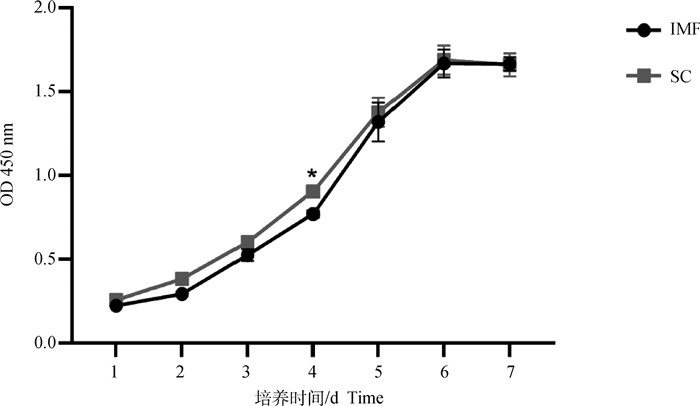
|
*表示差异显著(P < 0.05) * means significant difference(P < 0.05) 图 3 牦牛肌内与皮下前体脂肪细胞生长曲线 Fig. 3 Growth curve of intramuscular and subcutaneous preadipocytes of yak |
牦牛肌内前体脂肪细胞和皮下前体脂肪细胞完全融合2 d后,弃去原有培养基,换成分化培养基进行诱导分化3 d,如图 4所示,分化3 d后,肌内和皮下前体脂肪细胞均由梭形收缩变为圆球状,部分细胞开始出现脂滴,但大部分细胞没有明显脂滴出现;6 d后,两部位脂肪细胞内均出现明显密集的明亮小脂滴,此时能够看到脂肪细胞内脂滴并未聚集为大的圆形脂滴,脂肪细胞尚未成熟;分化9 d后,细胞内出现明亮的大圆形脂滴,标志两部位脂肪细胞均分化成熟。

|
图 4 前体脂肪细胞分化形态(400×) Fig. 4 Morphology of preadipocyte differentiation (400×) |
对处于分化第3、6、9天3个时间段的牦牛肌内和皮下脂肪细胞进行油红O染色,染色结果如图 5所示,可以看出,肌内和皮下脂肪细胞分化至第3天染色结果不明显,说明此阶段肌内和皮下脂肪细胞脂质合成量可能并不高,分化至第6天二者均出现明显的脂滴,说明分化第6~9天,两部位的脂肪细胞均出现了大量脂滴。
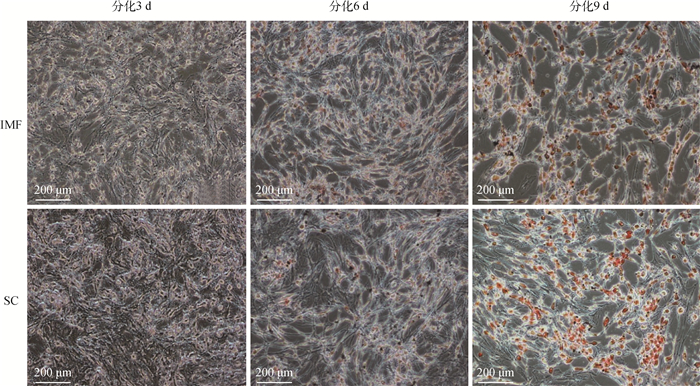
|
图 5 分化阶段油红O染色(200×) Fig. 5 Oil red O staining at differentiation stage (200×) |
成熟脂肪细胞是由前体脂肪细胞分化而来,前体脂肪细胞的分化过程受多种关键因子的调控。本试验检测了脂肪细胞分化关键基因PPARγ、C/EBPα,脂肪合成关键基因脂肪酸合成酶(FASN)、脂肪分解关键基因激素敏感性甘油三酯脂肪酶(HSL)。从图 6可以看出,以上基因表达水平都随着前体脂肪细胞分化的进行而发生变化。SC和IMF的PPARγ基因的相对表达量基本都出现随时间增加而增加的趋势,无论是SC还是IMF脂肪细胞在第9天PPARγ表达量显著高于分化第0、3、6天(P < 0.05)。SC和IMF的C/EBPα基因相对表达量均在分化第6天达到峰值,二者C/EBPα基因表达量在第6天显著高于第0、3、9天(P < 0.05)。HSL基因相对表达量也随分化时间的增加而增加,两部位HSL基因表达量在分化第9天显著高于第0、3、6天(P < 0.05),IMF脂肪细胞HSL基因表达量在第3天显著高于0天(P < 0.05),SC脂肪细胞HSL基因表达量在分化第6天显著高于0天(P < 0.05), 第0和3天的表达量差异并不显著(P>0.05)。FASN基因相对表达量也随分化时间的增加而增加,两部位FASN基因表达量在分化第9天显著高于第0、3、6天(P < 0.05),IMF脂肪细胞FASN基因表达量在第3天显著高于第0天,SC脂肪细胞FASN基因表达量在分化第6天显著高于第0天(P < 0.05), 第0和3天的表达量差异并不显著(P>0.05)。
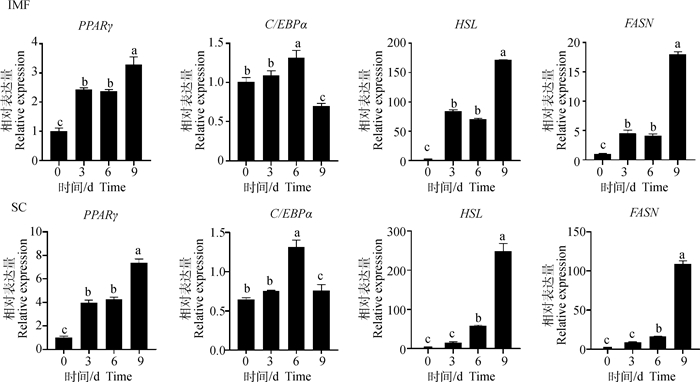
|
不同小写字母差表示差异显著(P < 0.05) The different lowercase letters indicate the significant difference (P < 0.05) 图 6 分化关键基因mRNA相对表达量 Fig. 6 Relative mRNA expression levels of key genes for differentiation |
脂肪含量是影响肉产品口感、风味和销量的关键因素[13],但不同部位脂肪沉积具有不同的效应。皮下脂肪的过度沉积不仅严重影响牛肉产品的口感。牛肌内脂肪单不饱和脂肪酸、共轭亚油酸以及必须氨基酸含量丰富十分有利于消费者健康[14-15],并且肌内脂肪含量对牛肉品质也有明显的提升[16]。因此建立体外皮下和肌内脂肪细胞模型,探究皮下和肌内脂肪细胞分化和增殖差异,对牦牛不同部位脂肪特异性沉积具有重要的意义。
本试验借鉴了张萌萌等[17]和朴政玉等[18]分离松辽黑猪和肉牛前体脂肪细胞的方法,熊静等[19]发现,离心力过低会造成细胞收获量减少,而离心力过高会造成细胞活力下降,蒋斌等[20]试验表明,离心力过高、时间长和次数多会造成细胞活力下降,因此本试验改进了离心步骤,减少了离心力对牦牛前体脂肪细胞的伤害以及通过差速贴壁法纯化了牦牛肌内前体脂肪细胞,最终成功分离了牦牛皮下和肌内前体脂肪细胞,通过CCK-8活性检测,两部位前体脂肪细胞生长曲线均呈现经典“S”型,与多数试验报道的前体脂肪细胞生长曲线相似[21-24]。通过对前体脂肪细胞特异性蛋白(PREF-1)进行检测,免疫荧光结果表明,本试验分离的皮下和肌内前体脂肪细胞形态符合长梭形,蛋白表达于细胞膜附近,此结果与Park和Kim[25]试验中PREF-1荧光定位相似,并且DAPI和FITC荧光组合图表明,本试验分离的皮下和肌内前体脂肪细胞纯度很高,说明本试验牦牛皮下和肌内前体脂肪细胞模型建立成功。
传统前体脂肪细胞分化方法有油酸诱导法以及经典的鸡尾酒法[26],但油酸诱导法多用于家禽的前体脂肪细胞分化[27-28],而经典鸡尾酒法又存在分化效率低、成脂量低的缺点[29],因此本试验通过改良经典鸡尾酒法,向分化培养基中添加卵磷脂注射剂,之后对上述两部位前体脂肪细胞进行诱导分化,分化结果表明,换成分化培养基后至出现大脂滴,分化成熟经过9 d,分化效率高,且脂滴数量可观,并且油红O染色结果表明,牦牛皮下和肌内成熟脂肪细胞分化成功。综上所述,牦牛皮下和肌内成熟脂肪细胞模型建立成功。
PPARγ和C/EBPα是动物脂肪组织生成的主要调节因子,并且都在脂肪组织中高表达[30],二者均可调节许多脂质合成基因的表达[31],其中C/EBPα可以诱导脂肪生成并上调PPARγ表达[32],而PPARγ是脂肪细胞分化的主要关键调节因子,能够通过调节乙酰辅酶A羧化酶活性促进甘油三酯的形成,最终影响脂肪的沉积[33],在本试验中,牦牛SC和IMF脂肪细胞中PPARγ出现相同的上升趋势,而C/EBPα在6 d后表达量发生下降。试验表明,脂肪细胞的PPARγ、C/EBPα的表达量会随着分化时间的增加出现先增加后下降的趋势,与本试验中SC和IMF脂肪细胞C/EBPα表达量趋势相似,但本试验中两部位脂肪细胞在9 d的分化期内PPARγ表达均未见下降,Wang等[34]对猪脂肪细胞分化检测发现其PPARγ、C/EBPα的表达在3~4 d内回落,而Tokach等[35]试验表明,肉牛脂肪细胞在分化7 d后其PPARγ表达量也未出现回落,与本试验结果相似,而与Wang等[34]在猪细胞上的试验结果不符,这可能是因为不同物种脂肪细胞PPARγ的表达规律存在差异。PPARγ的上调可以促进SREBP1的表达,Ikeda等[36]试验表明,SREBP1能够促进FASN的表达,FASN是生物体脂质生物合成的主要限速酶,张涛[37]试验发现,绵羊脂肪沉积与FASN的表达量成正比,Liang等[38]使用葡萄皮提取物和白藜芦醇抑制FASN可减少脂肪堆积,因此可见FASN在生物体内脂肪沉积过程中发挥着重要的作用。在本试验中,SC和IMF脂肪细胞PPARγ的表达量趋势与FASN表达量上升趋势相同,与Ikeda等[36]的结果相似,FASN表达量的上升与脂肪细胞分化成脂的过程相符。HSL是脂肪动员最初的限速酶和关键酶,其作用是将甘油三酯分解为甘油和游离脂肪酸,进而防止体内脂肪的沉积,在脂肪分解中具有重要的调节作用[39]。刘作华[40]研究发现,在不同脂肪细胞中HSL表达量会随着葡萄糖浓度的增加而增加,本试验中,IMF和SC脂肪细胞在9 d分化期内,HSL均呈现上升趋势,这可能与两部位前体脂肪细胞分化过程中使用高糖培养基且更换频繁有关。值得一提的是,在本试验中IMF脂肪细胞HSL和FASN的表达量在第3天升高,而SC脂肪细胞却在第6天升高, 这似乎说明牦牛IMF脂肪细胞在体外分化时,脂质代谢启动的速率可能高于SC脂肪细胞。
4 结论本试验通过改良传统胶原酶消化法和鸡尾酒诱导分化法,成功分离牦牛原代皮下和肌内前体脂肪细胞,并且成功诱导牦牛皮下和肌内前体脂肪细胞成脂成化。本试验中,成脂分化关键基因PPARγ、HSL、FASN表达量在9 d分化期内均呈现上升趋势,C/EBPα表达量在分化第6 d后显著下降。本试验成功分离了牦牛原代皮下和肌内脂肪细胞,改进了诱导分化方法,并初步检测了前体脂肪细胞分化关键基因的表达规律,为进一步探究牦牛皮下和肌内脂肪细胞的脂质代谢以及不同脂肪组织差异提供了良好的模型。
| [1] |
石斌刚. 天祝白牦牛肌肉生长和肌内脂肪沉积相关基因筛选与鉴定[D]. 兰州: 甘肃农业大学, 2020. SHI B G. Identification of genes associated with muscle growth and intramuscular fat deposition in Tianzhu White Yak[D]. Lanzhou: Gansu Agricultural University, 2020. (in Chinese) |
| [2] |
穆勇攀, 李愫, 李新民. 乳酸型复合酸化剂饲喂效果试验[J]. 畜牧兽医杂志, 2011, 30(6): 7-8. MU Y P, LI S, LI X M. Report on feeding effect of Jiajiawang lactic acid complex acidifier[J]. Journal of Animal Science and Veterinary Medicine, 2011, 30(6): 7-8. DOI:10.3969/j.issn.1004-6704.2011.06.003 (in Chinese) |
| [3] |
胡金丽, 庄蕾, 吴森. 牦牛肉质性状相关候选基因研究进展[J]. 中国畜牧杂志, 2021, 57(8): 10-15. HU J L, ZHUANG L, WU S. Research progress on candidate genes influencing meat quality traits in Yaks[J]. Chinese Journal of Animal Science, 2021, 57(8): 10-15. (in Chinese) |
| [4] |
陈浩, 王纯洁, 斯木吉德, 等. 牛肉品质及其影响因素研究进展[J]. 动物营养学报, 2021, 33(2): 669-678. CHEN H, WANG C J, SMUJID, et al. Research progress of beef quality and its influencing factors[J]. Chinese Journal of Animal Nutrition, 2021, 33(2): 669-678. DOI:10.3969/j.issn.1006-267x.2021.02.008 (in Chinese) |
| [5] |
LISTRAT A, GAGAOUA M, NORMAND J, et al. Are there consistent relationships between major connective tissue components, intramuscular fat content and muscle fibre types in cattle muscle?[J]. Animal, 2020, 14(6): 1204-1212. DOI:10.1017/S1751731119003422 |
| [6] |
万荣, 周振明, 孟庆翔. 丙酸对肉牛肌内前脂肪细胞分化的影响[J]. 农业生物技术学报, 2021, 29(7): 1295-1302. WAN R, ZHOU Z M, MENG Q X. Effects of propionate on differentiation of bovine (Bos taurus) intramuscular preadipocytes[J]. Journal of Agricultural Biotechnology, 2021, 29(7): 1295-1302. (in Chinese) |
| [7] |
李树国, 牛化欣, 于建华, 等. 肉牛肌内脂肪和脂肪酸的营养价值及其调控[J]. 黑龙江畜牧兽医, 2018(21): 59-62. LI S G, NIU H X, YU J H, et al. Nutritional value and regulation of intramuscular fat and fatty acids in beef cattle[J]. Heilongjiang Animal Science and Veterinary Medicine, 2018(21): 59-62. (in Chinese) |
| [8] |
CAWTHORN W P, SCHELLER E L, MACDOUGALD O A. Adipose tissue stem cells meet preadipocyte commitment: going back to the future[J]. J Lipid Res, 2012, 53(2): 227-246. DOI:10.1194/jlr.R021089 |
| [9] |
WANG Q A, TAO C, GUPTA R K, et al. Tracking adipogenesis during white adipose tissue development, expansion and regeneration[J]. Nat Med, 2013, 19(10): 1338-1344. DOI:10.1038/nm.3324 |
| [10] |
BONNET M, CASSAR-MALEK I, CHILLIARD Y, et al. Ontogenesis of muscle and adipose tissues and their interactions in ruminants and other species[J]. Animal, 2010, 4(7): 1093-1109. DOI:10.1017/S1751731110000601 |
| [11] |
FARMER S R. Transcriptional control of adipocyte formation[J]. Cell Metab, 2006, 4(4): 263-273. DOI:10.1016/j.cmet.2006.07.001 |
| [12] |
ALI A T, HOCHFELD W E, MYBURGH R, et al. Adipocyte and adipogenesis[J]. Eur J Cell Biol, 2013, 92(6-7): 229-236. DOI:10.1016/j.ejcb.2013.06.001 |
| [13] |
PARK S J, BEAK S H, JUNG D J S, et al. Genetic, management, and nutritional factors affecting intramuscular fat deposition in beef cattle—a review[J]. Asian-Australas J Anim Sci, 2018, 31(7): 1043-1061. DOI:10.5713/ajas.18.0310 |
| [14] |
杨蕾. 饲养方式对苏尼特羊脂肪组织中脂肪酸沉积的影响及机理研究[D]. 呼和浩特: 内蒙古农业大学, 2018. YANG L. Effect of different feeding methods on the deposition of fatty acid of Sunit Sheep and the mechanism[D]. Hohhot: Inner Mongolia Agricultural University, 2018. (in Chinese) |
| [15] |
李鹏涛, 范逸婷, 张宁宁, 等. 影响牛羊肌内脂肪沉积因素的研究进展[J]. 黑龙江畜牧兽医, 2021(5): 48-52. LI P T, FAN Y T, ZHANG N N, et al. Research progress of factors affecting intramuscular fat deposition in cattle and sheep[J]. Heilongjiang Animal Science and Veterinary Medicine, 2021(5): 48-52. (in Chinese) |
| [16] |
HOCQUETTE J F, GONDRET F, BAÉZA E, et al. Intramuscular fat content in meat-producing animals: development, genetic and nutritional control, and identification of putative markers[J]. Animal, 2010, 4(2): 303-319. DOI:10.1017/S1751731109991091 |
| [17] |
张萌萌, 魏胜娟, 王艺如, 等. 牛肌内前体脂肪细胞的分离培养及分化相关基因的表达规律研究[J]. 畜牧与兽医, 2018, 50(5): 1-6. ZHANG M M, WEI S J, WANG Y R, et al. Primary culture and expression of differentiation-related genes in bovine intramuscular preadipocytes[J]. Animal Husbandry & Veterinary Medicine, 2018, 50(5): 1-6. (in Chinese) |
| [18] |
朴政玉, 金一, 于永生, 等. 松辽黑猪前体脂肪细胞分离及诱导分化[J]. 吉林农业大学学报, 2020, 42(3): 337-342. PIAO Z Y, JIN Y, YU Y S, et al. Isolation and induced differentiation of preadipocytes from Songliao black pig[J]. Journal of Jilin Agricultural University, 2020, 42(3): 337-342. (in Chinese) |
| [19] |
熊静, 王思雨, 张云惠, 等. 不同离心力分离外周血单个核细胞的条件优化[J]. 检验医学与临床, 2019, 16(3): 289-291. XIONG J, WANG S Y, ZHANG Y H, et al. Condition optimization of different centrifugal force on separating peripheral blood mononuclear cells[J]. Laboratory Medicine and Clinic, 2019, 16(3): 289-291. DOI:10.3969/j.issn.1672-9455.2019.03.001 (in Chinese) |
| [20] |
蒋斌, 郑明辉, 张斌, 等. 三维载体培养下离心力对骨髓间充质干细胞增殖的影响[J]. 解剖学杂志, 2018, 41(1): 1-4. JIANG B, ZHENG M H, ZHANG B, et al. Effects of centrifugal force on proliferation of bone marrow mesenchymal stem cells in the three-dimensional carrier[J]. Chinese Journal of Anatomy, 2018, 41(1): 1-4. (in Chinese) |
| [21] |
胡艳霞, 曾勇庆, 崔志峰, 等. 莱芜猪前体脂肪细胞的原代培养及诱导分化研究[J]. 畜牧兽医学报, 2012, 43(9): 1346-1352. HU Y X, ZENG Y Q, CUI Z F, et al. Primary culture and induced differentiation of Laiwu black pig preadipocytes[J]. Acta Veterinaria et Zootechnica Sinica, 2012, 43(9): 1346-1352. (in Chinese) |
| [22] |
张清月, 王雪, 刘树林, 等. 绒山羊羔羊和成年羊前体脂肪细胞的原代培养及传代方法[J]. 动物营养学报, 2018, 30(9): 3551-3558. ZHANG Q Y, WANG X, LIU S L, et al. Primary culture and passage method of preadipocytes of cashmere lambs and adult goats[J]. Chinese Journal of Animal Nutrition, 2018, 30(9): 3551-3558. DOI:10.3969/j.issn.1006-267x.2018.09.025 (in Chinese) |
| [23] |
徐小春, 陈文娟, 赵瑞, 等. 滩羊肌内前体脂肪细胞的分离培养及分化相关基因的表达规律研究[J]. 家畜生态学报, 2020, 41(11): 35-41. XU X C, CHEN W J, ZHAO R, et al. Culture and induced differentiation of intramuscular preadipocytes and expression of related genes from tan sheep[J]. Acta Ecologiae Animalis Domastici, 2020, 41(11): 35-41. DOI:10.3969/j.issn.1673-1182.2020.11.007 (in Chinese) |
| [24] |
陈涛, 马立霞, 李志鑫, 等. 新西兰兔肌内和皮下前体脂肪细胞原代培养与诱导分化的研究[J]. 中国畜牧杂志, 2019, 55(6): 39-44. CHEN T, MA L X, LI Z X, et al. Comparative study on primary culture and induced differentiation of intramuscular and subcutaneous preadipocytes of new Zealand rabbits[J]. Chinese Journal of Animal Science, 2019, 55(6): 39-44. (in Chinese) |
| [25] |
PARK P J, KIM S T. Caveolae-associated protein 3 (Cavin-3) influences adipogenesis via TACE-mediated pref-1 shedding[J]. Int J Mol Sci, 2020, 21(14): 5000. DOI:10.3390/ijms21145000 |
| [26] |
张宁芳, 成志敏, 乐宝玉, 等. 猪肌源性前体脂肪细胞的分离培养和成脂诱导分化研究[J]. 畜牧兽医学报, 2018, 49(12): 2612-2621. ZHANG N F, CHENG Z M, LE B Y, et al. Isolation, culture and adipogenic differention of pig myogenic preadipocytes cell[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(12): 2612-2621. DOI:10.11843/j.issn.0366-6964.2018.12.010 (in Chinese) |
| [27] |
靳文姣, 翟彬, 苑鹏涛, 等. miR-215-5p通过靶向NCOA3基因抑制固始鸡腹部前脂肪细胞的增殖和分化[J]. 畜牧与兽医, 2021, 53(7): 69-77. JIN W J, ZHAI B, FAN P T, et al. miR-215-5p inhibits the proliferation and differentiation of Gushi chicken abdominal pre-adipocytes by targeting the NCOA3 gene[J]. Animal Husbandry & Veterinary Medicine, 2021, 53(7): 69-77. (in Chinese) |
| [28] |
王海霞, 张志威, 贺綦, 等. 鸡KLF3基因的表达规律及其对脂肪细胞分化的影响研究[J]. 畜牧兽医学报, 2015, 46(1): 26-31. WANG H X, ZHANG Z W, HE Q, et al. Expression pattern of chicken Krüppel-like Factor 3 gene and its effect on adipocyte differentiation[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(1): 26-31. (in Chinese) |
| [29] |
SHEN L Y, GAN M L, LI Q, et al. MicroRNA-200b regulates preadipocyte proliferation and differentiation by targeting KLF4[J]. Biomed Pharmacother, 2018, 103: 1538-1544. DOI:10.1016/j.biopha.2018.04.170 |
| [30] |
ROSEN E D, HSU C H, WANG X Z, et al. C/EBPα induces adipogenesis through PPARγ: a unified pathway[J]. Genes Dev, 2002, 16(1): 22-26. DOI:10.1101/gad.948702 |
| [31] |
ROSEN E D, MACDOUGALD O A. Adipocyte differentiation from the inside out[J]. Nat Rev Mol Cell Biol, 2006, 7(12): 885-896. DOI:10.1038/nrm2066 |
| [32] |
李娜, 陆敏, 樊欣钰, 等. C/EBPβ信号通路与肝细胞脂质代谢的关系研究进展[J]. 广西医学, 2019, 41(2): 241-243, 247. LI N, LU M, FAN X J, et al. Research progress of the relationship between C/EBP beta signaling pathway and lipid metabolism in hepatic cells[J]. Guangxi Medical Journal, 2019, 41(2): 241-243, 247. (in Chinese) |
| [33] |
李秀凉, 吕莹, 孙庆申. PPAR-γ及其调节剂与脂肪代谢的关系研究进展[J]. 食品安全质量检测学报, 2019, 10(17): 5722-5727. LI X L, LV Y, SUN Q S. Research progress on the relationship between PPAR-γ with its agonists/antagonists and fat metabolism[J]. Journal of Food Safety and Quality, 2019, 10(17): 5722-5727. (in Chinese) |
| [34] |
WANG S B, ZHOU G X, SHU G, et al. Glucose utilization, lipid metabolism and BMP-Smad Signaling pathway of porcine intramuscular preadipocytes compared with subcutaneous preadipocytes[J]. Cell Physiol Biochem, 2013, 31(6): 981-996. DOI:10.1159/000350116 |
| [35] |
TOKACH R J, RIBEIRO F R B, CHUNG K Y, et al. Chromium propionate enhances adipogenic differentiation of bovine intramuscular adipocytes[J]. Front Vet Sci, 2015, 2: 26. |
| [36] |
IKEDA J, ICHIKI T, TAKAHARA Y, et al. PPARγ agonists attenuate palmitate-induced ER stress through up-regulation of SCD-1 in macrophages[J]. PLoS One, 2015, 10(6): e0128546. DOI:10.1371/journal.pone.0128546 |
| [37] |
张涛. 不同能量水平日粮对绵羊脂肪酸合成酶基因和肥胖基因表达的影响[D]. 兰州: 甘肃农业大学, 2007. ZHANG T. Effects of different energy intake on the expression of fatty acid synthase gene and obese gene in sheep[D]. Lanzhou: Gansu Agricultural University, 2007. (in Chinese) |
| [38] |
LIANG Y, TIAN W X, MA X F. Inhibitory effects of grape skin extract and resveratrol on fatty acid synthase[J]. BMC Complement Altern Med, 2013, 13: 361. DOI:10.1186/1472-6882-13-361 |
| [39] |
STRÅLFORS P, BELFRAGE P. Phosphorylation of hormone-sensitive lipase by cyclic AMP-dependent protein kinase[J]. J Biol Chem, 1983, 258(24): 15146-15152. DOI:10.1016/S0021-9258(17)43785-9 |
| [40] |
刘作华. 日粮能量水平对猪肌内脂肪沉积的影响及作用机制研究[D]. 成都: 四川农业大学, 2008. LIU Z H. Effect of dietary energy density on intramuscular fat deposition for pigs and its underlying mechanism[D]. Chengdu: Sichuan Agricultural University, 2008. (in Chinese) |
(编辑 郭云雁)



