2. 浙江省畜禽绿色生态健康养殖应用 技术研究重点实验室, 杭州 311300;
3. 动物健康互联网检查技术浙江省工程实验室, 杭州 311300
2. Key Laboratory of Applied Technology on Green-Eco-Healthy Animal Husbandry of Zhejiang Province, Hangzhou 311300, China;
3. Zhejiang Provincial Engineering Laboratory for Animal Health Inspection and Internet Technology, Hangzhou 311300, China
壬基酚(nonylphenol,NP)是一种非离子表面活性剂,在工、农业产品中应用广泛[1]。但其带来的污染问题不容忽视,在多个来自世界各地区的环境样本中都检出较高水平的NP[2-3],同时,大量研究发现,NP具有雌激素样效应,除了会产生生殖毒性外,同样会对肝、肾、神经系统等多种器官造成损伤[4-7]。番茄红素(lycopene,LYC)是一种类胡萝卜素家族的异戊二烯类化合物,具有极强的抗氧化活性,是迄今为止自然界存在的抗氧化性最强的类胡萝卜素[8-10]。大量流行病学调查及试验研究证实,LYC具有抗氧化、抗炎症、活化免疫系统、解毒及预防和治疗癌症等功效,且至今尚未发现毒副作用[11-13]。然而,目前尚无研究评估LYC干预NP亚慢性毒性作用。因此,本试验通过建立LYC干预小鼠NP亚慢性中毒试验模型,探究LYC对NP造成的小鼠脾损伤的保护机制,为LYC的应用和NP中毒的防护提供理论依据。
1 材料与方法 1.1 实验动物与药品试剂清洁级ICR小鼠(40只,雌雄各半,体重18~23 g)购自杭州子源实验动物科技有限公司,实验动物合格证号为20200514Aabz0105999491。壬基酚(GR,纯度≥99%)购自上海阿拉丁生化科技股份有限公司;番茄红素(UV≥98%)和玉米油均购自北京索莱宝科技有限公司;抗氧化指标(T-AOC、SOD、CAT、GSH-Px和MDA)检测试剂盒购自南京建成生物工程研究所;免疫细胞因子(IL-2、IFN-γ和TNF-α)ELISA检测试剂盒购自武汉博士德生物工程有限公司;Akt、p-Akt、p53、Bcl-2、Bax,β-actin的一抗购自北京博奥森生物技术有限公司,羊抗兔和羊抗鼠的二抗购自美国Jackson ImmunoResearch公司。
1.2 药品配置根据课题组前期试验结果(未发表)和参考文献[14],将小鼠NP亚慢性中毒剂量和番茄红素干预剂量分别定为150和5 mg·kg-1。按照每10 g体重0.1 mL的灌胃量,称取适量NP溶解于相应体积玉米油中,配制成30 mg·mL-1 NP溶液,番茄红素使用玉米油配制成1 mg·mL-1溶液,现用现配。
1.3 试验设计与分组40只清洁级ICR小鼠随机分为4组,每组10只,雌雄各半:对照组(control group,CON)每天8:30经口灌服玉米油0.1 mL,2 h后经口灌服玉米油0.1 mL;中毒组(nonylphenol group,NPG)每天8:30经口灌服玉米油0.1 mL,2 h后经口灌服150 mg·kg-1壬基酚溶液;番茄红素对照组(lycopene group,LCG)每天8:30经口灌服5 mg·kg-1番茄红素,2 h后经口灌服0.1 mL玉米油;番茄红素干预组(lycopene+ nonylphenol group,LNG)每天8:30经口灌服5 mg·kg-1番茄红素,2 h后经口灌服150 mg·kg-1壬基酚溶液。所有实验动物雌雄分笼饲养,每晚21:00禁食,自由饮水,按试验计划连续灌胃30 d,每5 d称重1次,根据体重变化调整各药物灌服量。试验结束后各组小鼠确保不少于8只。
1.4 样品采集各组小鼠经口灌服药物30 d后,于第31天8:30准确称量小鼠体重。称重后小鼠进行颌下静脉采血0.5 mL,用于检测外周血免疫因子水平。安乐死后,小鼠开腹,采集脾准确称重后将脾分为3份,分别用于脾组织显微结构测定、抗氧化指标测定和凋亡通路蛋白水平测定。
1.5 平均日增重及脾体系数测定按如下方法计算日均增重和脾体系数:日均增重(g·d-1)=(试验后体重-试验前体重)/试验天数;脾体系数=脾重量/试验后体重×100%。
1.6 脾组织显微结构测定取适量脾组织至于10%甲醛溶液中固定,常规脱水,石腊包埋,制备切片,HE染色后光学显微镜下观察脾显微结构变化。
1.7 外周血免疫细胞因子测定取适量血清,按照试剂盒说明书采用ELISA法,测定血清中IL-2,IFN-γ和TNF-α的浓度。
1.8 抗氧化指标测定取适量脾组织与冰浴生理盐水混合后通过组织破碎仪制备成10%匀浆,3 000 r·min-1 4 ℃离心15 min,取上清-80 ℃备用。脾组织匀浆分别按照各抗氧化指标试剂盒的说明书进行操作,最后用酶标仪测定血清和脾中各抗氧化指标的含量。
1.9 脾中凋亡通路相关蛋白测定蛋白提取:取-80 ℃冻存的脾组织,冰上解冻后,剪取称重50 mg组织,放入预冷的玻璃匀浆器,加入200 μL裂解液和5 μL蛋白酶抑制剂PMSF,冰浴研磨至充分裂解,冰上静置5 min;移入1.5 mL离心管中,超声持续10 s 5次,间隔4次,每次10 s;4 ℃ 12 000 r·min-1离心5 min。离心后上清即为脾组织全蛋白提取物。
蛋白浓度测定及样品制备:利用BCA试剂盒测定脾组织蛋白提取物浓度。根据浓度上样体积定为20 μg每15 μL上样液,加入3 μL蛋白上样缓冲液(5X)和PBS。沸水浴10 min,冷却后分装,-80 ℃保存。
蛋白含量表达检测:取15 μL变性蛋白样本,通过SDS-聚丙烯酰胺凝胶电泳后,采用湿转法将目的蛋白从凝胶转移至PVDF膜上,随后用5%脱脂奶粉室温孵育2 h;封闭结束后,用TBST缓冲液洗膜3次,每次10 min。洗膜结束后,将膜置于已稀释好相应倍数的一抗中4 ℃孵育过夜;一抗孵育结束后,再次用TBST缓冲液洗膜3次,每次10 min。洗膜结束后,将膜置于相同种属的二抗中室温孵育1 h;孵育结束后,第3次用TBST缓冲液洗膜3次,每次10 min。洗膜结束后,在膜上滴加ECL显色液放入凝胶成像系统中曝光成像。以β-actin为内参蛋白,用Image J软件进行蛋白条带灰度值的分析,最终计算出目的蛋白相对表达量。
1.10 统计学方法试验所得数据表示为“平均值±标准误”,使用GraphPad Prism 8.0软件进行数据制图,试验数据采用单因素方差分析,运用T检验进行数据配对差异分析,P<0.05为差异显著,P<0.01为差异极显著。
2 结果 2.1 各组小鼠体重增长系数及脾体系数试验过程中,各组实验小鼠均未出现死亡,各组小鼠精神状态、食欲、采食量以及排便等状况未有明显异常,但与CON小鼠比较,NPG小鼠日均增重显著降低(P<0.05),而与CON小鼠比较,LCG小鼠和LNG小鼠日均增重无显著性差异(P>0.05);与NPG小鼠比较,LNG小鼠日均增重显著升高(P<0.05,图 1A)。各组实验小鼠脾体系数结果显示,与CON小鼠比较,NPG小鼠和LNG小鼠脾体系数显著升高(P<0.05),其余各组间无显著性差异(P>0.05,图 1B)。
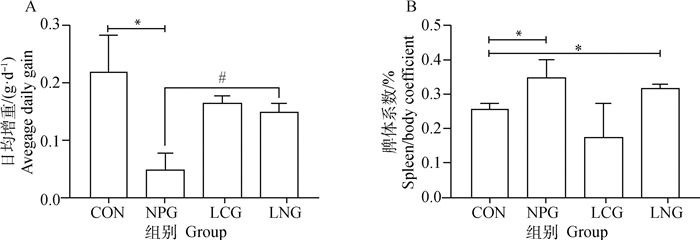
|
*表示与CON相比差异显著(P<0.05);#表示与NPG比较差异显著(P<0.05)。下同 * Means significant different versus CON; # Means significant different versus NPG. The same below 图 1 番茄红素干预对NP染毒小鼠体重增长(A)及脾体系数(B)的影响 Fig. 1 Effect of lycopene on body weight gain(A)and spleen/body coefficient(B)of mice exposed to NP |
如图 2所示,NPG小鼠脾小结中可见生发中心扩张(黑色箭头),伴有大量淋巴细胞凋亡,核碎裂(黄色箭头);红髓中可见较大量的髓外造血细胞(红色箭头)(图 2B),损伤严重;LNG小鼠脾小结边缘带增厚(黑色箭头);红髓中可见较多髓外造血细胞(黄色箭头),伴有多核巨细胞数量少量增多(红色箭头)(图 2C),损伤轻微;LCG小鼠脾红髓白髓分界清晰,脾小结形状规则、淋巴细胞数量丰富;红髓中可见少量髓外造血细胞(黑色箭头)(图 2D)与CON小鼠脾结构无明显差异。

|
A~D分别为CON、NPG、LNG和LCG小鼠脾组织切片图 Histological section of mouse spleen: A. CON; B. NPG; C. LNG; D. LCG 图 2 番茄红素干预对NP染毒小鼠脾组织结构的影响(100×) Fig. 2 Effect of lycopene on spleen tissue structure of NP exposed mice(100×) |
如图 3所示,与CON比较,NPG小鼠血清中细胞因子IL-2显著降低(P<0.05),细胞因子IFN-γ和TNF-α极显著降低(P<0.01);经过LYC干预后,与NPG小鼠比较,LNG小鼠血清中细胞因子IL-2极显著升高(P<0.01),细胞因子IFN-γ和TNF-α显著升高(P<0.05)。
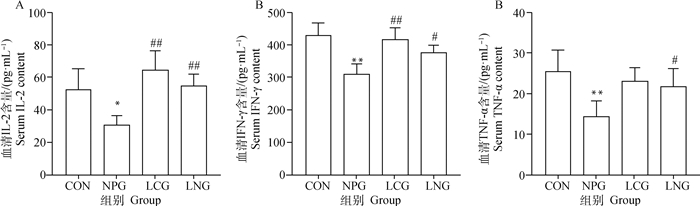
|
A.各组小鼠血清IL-2浓度;B.各组小鼠血清IFN-γ浓度;C.各组小鼠血清TNF-α浓度。**表示与CON比较差异极显著(P<0.01);##表示与NPG比较差异极显著(P<0.01)。下同 A. Serum IL-2 contents of mice in different group; B. Serum IFN-γ contents of mice in different group; C. Serum TNF-α contents of mice in different group. ** Means extremely significant different versus CON; ## Means extremely significant different versus NPG. The same below 图 3 番茄红素干预对NP染毒小鼠血清中细胞因子IL-2(A)、IFN-γ(B)和TNF-α(C)的影响 Fig. 3 Effect of lycopene on serum IL-2(A), IFN-γ(B) and TNF-α(C) of NP exposed mice |
由图 4可知,与CON比较,NPG小鼠脾GSH-Px、CAT、SOD活性及总抗氧化能力(T-AOC)均显著下降(P<0.05);与CON比较,LNG小鼠脾GSH-Px、SOD活性均显著下降(P<0.05),而CAT活性和总抗氧化能力(T-AOC)无显著性差异(P>0.05);与NPG比较,LNG小鼠脾CAT、SOD活性及总抗氧化能力(T-AOC)均显著升高(P<0.05),但NPG小鼠脾GSH-Px活性与LNG比较则无显著性差异(P>0.05);与CON比较,LCG小鼠脾SOD活性显著升高(P<0.05)。与CON比较,NPG小鼠脾MDA含量显著升高(P<0.05);与NPG相比,LNG小鼠脾MDA含量显著下降(P<0.05);LCG和LNG小鼠脾MDA含量与CON比较无显著性差异(P>0.05)。
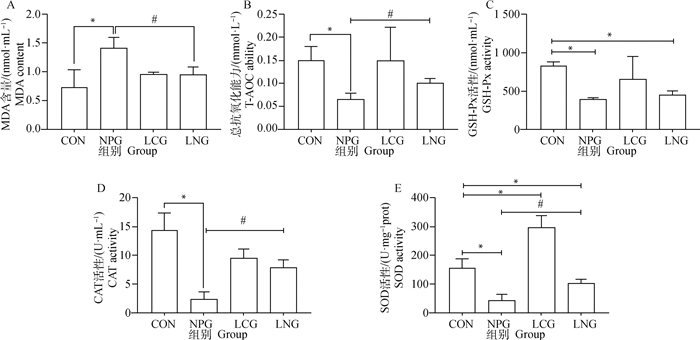
|
图 4 番茄红素干预对NP染毒小鼠脾氧化应激的影响 Fig. 4 Effects of lycopene on oxidative stress in spleen of NP exposed mice |
由图 5可知,与CON比较,NPG小鼠脾p53、Bax蛋白的表达水平显著升高(P<0.05),Bcl-2、Akt、p-Akt蛋白的表达水平显著降低(P<0.05),LCG小鼠脾p53、Bax蛋白的表达水平显著降低(P<0.05),Bcl-2、p-Akt、Akt蛋白的表达水平显著升高(P<0.05);与NPG比较,LNG和LCG组小鼠脾p53、Bax表达水平显著降低(P<0.05),LNG和LCG组小鼠Bcl-2、p-Akt、Akt蛋白表达水平显著升高(P<0.05)。
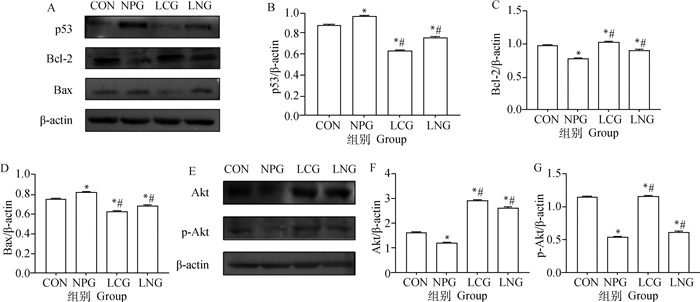
|
A.番茄红素干预对NP染毒小鼠脾凋亡相关蛋白p53/Bcl-2/Bax表达的影响;B、C、D、F、G.各蛋白表达情况灰度分析;E.番茄红素干预对NP染毒小鼠脾凋亡相关蛋白Akt/p-Akt表达的影响 A. Effects of LYC on apoptotic-related proteins p53/Bcl-2/Bax expression in NP-exposed mice; B-D, F, G. Quantitative analysis of protein expression; E. Effects of LYC on apoptotic-related proteins Akt/p-Akt expression in NP-exposed mice 图 5 番茄红素干预对NP染毒小鼠脾Akt/p53/Bcl-2通路相关蛋白表达的影响 Fig. 5 Effects of lycopene on expression of related protein in Akt/p53/Bcl-2 signaling pathway in spleen of NP exposed mice |
NP是一种典型的内分泌干扰物,具有抗雄激素和雌激素样作用[7]。关于NP毒性的研究主要集中在生殖毒性方面[10-11],但有研究表明,NP还可以引起氧化应激,并在多器官中产生具有高度活性的膜毒性中间产物[5-6]。番茄红素是一种天然类胡萝卜素抗氧化剂,是β-胡萝卜素的异构体,其在细胞培养和动物模型中清除自由基的能力已被证实[15]。因此,番茄红素能够降低氧化应激介导的多种疾病风险[16],而且有研究证实,番茄红素可以保护黄曲霉毒素诱导的小鼠脾损伤[14]。尽管NP在环境中分布广泛,对人和动物的健康危害极大,但LYC对NP毒性保护作用的具体机制尚未阐明。本研究旨在探讨NP对脾损伤和氧化应激的影响,以及应用LYC能否逆转NP诱导的小鼠脾组织氧化应激和组织病理学改变及其变化机制。
本研究通过HE染色方法检测了脾组织病理学变化,结果显示,NP亚慢性中毒后小鼠脾出现病理学损伤,而经过番茄红素干预的小鼠脾组织病理学变化轻微,这一结果与小鼠日增重和脾体系数变化结果相关联且保持一致,说明番茄红素干预对NP导致的小鼠脾损伤具有保护作用。虽然对NP亚慢性暴露后小鼠日增重和脾体系数变化的检测属于非功能性评估,但日增重和脾体系数变化可以直观体现出外源性毒物的毒性作用[17]。脾体系数变化结果显示,NP亚慢性染毒小鼠相对于对照小鼠和LYC干预小鼠均有显著性降低,说明亚慢性中毒剂量的NP对小鼠产生毒性效应,而LYC可以对亚慢性中毒剂量NP暴露的小鼠产生保护作用。脾是机体最大的免疫调节器官,有研究表明NP能够导致鲤鱼脾组织损伤[18]。本研究中,脾组织HE染色结果表明,NP亚慢性中毒导致小鼠脾小结中可见生发中心扩张,伴有大量淋巴细胞凋亡,核碎裂,红髓中可见较大量的髓外造血细胞,损伤严重。而经过LYC干预处理的小鼠在NP亚慢性暴露后,脾边缘带增厚伴有多核巨细胞数量少量增多,损伤轻微。这一结果与小鼠体重增长率和脾体系数变化保持一致,两组数据相互佐证说明LYC预处理可以保护小鼠抵抗NP亚慢性毒性效应。
细胞因子IL-2、IFN-γ和TNF-α与机体免疫状态密切相关。脾是机体内最重要的免疫器官,是淋巴细胞产生、成熟和存储的场所,具有清除衰老红细胞和参与免疫反应等功能。脾中T细胞数量多少和活性可反映出细胞的免疫状态,根据细胞表面蛋白表达情况,脾中T淋巴细胞可分为CD3+、CD4+和CD8+[19]。CD4+和CD8+T细胞可分泌细胞因子IFN-γ和TNF-α,促进淋巴细胞的增殖和分化,破坏胞内病原入侵,调节细胞免疫应答[20-21]。因此T淋巴细胞亚群和细胞因子水平被认为是细胞免疫的标志。本研究发现,小鼠经过NP灌胃后血清细胞因子IL-2、IFN-γ和TNF-α浓度显著降低,提示CD4+和CD8+T细胞的活化和增殖受到了抑制。CD4+和CD8+T细胞是介导机体细胞免疫的主要细胞,所以提示小鼠NP亚慢性中毒后机体的细胞免疫功能受到抑制。本研究中LYC预处理可在一定程度上减轻NP诱导的小鼠血清IFN-γ浓度降低,提示LYC能够有效减轻NP对小鼠脾免疫功能的抑制作用。此外单独应用LYC可不同程度提升小鼠血清中免疫细胞因子的水平,表明LYC具有较强的免疫增强活性。
MDA是氧化应激引起脂质过氧化的生化标志物[22],是指示机体氧化平衡状态的最常用指标。本研究显示,NP亚慢性中毒剂量暴露的小鼠脾组织MDA显著升高,说明小鼠在给予NP亚慢性中毒剂量后,体内的氧化与抗氧化平衡状态已经被破坏。NP是亲脂性化合物,因此细胞可能是脂质过氧化的靶点。研究发现,NP暴露可对机体产生毒性,增加氧自由基和脂质过氧化,抑制抗氧化酶活性,氧自由基的增加导致细胞发生膜脂过氧化,导致细胞损伤或死亡,并损害其周围组织的细胞结构和功能[23]。经LYC预处理小鼠给予NP亚慢性中毒剂量后,脾MDA水平比NPG小鼠显著降低,说明LYC可以纠正机体氧化与抗氧化的失衡。试验中,LNG小鼠MDA水平降低的同时,脾总抗氧化能力(T-AOC)和抗氧化酶(SOD、CAT和GSH-Px)活性增强,说明抗氧化作用是LYC抵抗NP毒性作用机制之一。此外,LYC分子结构中含有开链多烯或富电子芳香环结构,使得LYC能有效地清除超氧阴离子自由基,具备极强的抗氧化能力[24-25]。因此,LYC对NP毒性的保护作用可能与其直接清除自由基和增强抗氧化系统的抗氧化能力有关。
生理状态下的细胞凋亡是细胞程序性死亡,这一过程在控制细胞数量和维持细胞增殖活动中起着重要作用[26]。p53通路是经典的内源性细胞凋亡通路,p53蛋白是凋亡通路中关键蛋白,可以调节下游分子抗凋亡蛋白Bcl-2和促凋亡蛋白Bax的表达。Bcl-2可以阻止细胞色素C从线粒体中释放,从而阻止半胱氨酸蛋白酶活化和启动细胞凋亡[27],Bax是一种促凋亡蛋白,在正常情况下以单体形式存在于细胞质中,松散地附着在线粒体外膜上,受到刺激后,Bax进入线粒体中促进细胞色素C从线粒体中释放,加速细胞凋亡[28]。因此Bcl-2和Bax平衡状态的破坏可以促进凋亡。除了p53通路蛋白外,Akt信号蛋白在细胞凋亡过程中也发挥关键作用,磷酸化的Akt可以抑制p53的表达[29],此结果与本研究相吻合。本研究发现,NP暴露后磷酸化水平降低,而凋亡通路中关键分子p53蛋白的表达水平升高,说明NP可能抑制Akt的活化,上调p53蛋白表达水平,从促进脾细胞凋亡发挥毒性效应。在给予LYC处理后,检测凋亡通路蛋白表达水平发现,与NPG小鼠相比,LNG小鼠的p53和Bax蛋白表达下调,而Bcl-2蛋白表达水平和Akt磷酸化水平上调,说明LYC可能通过激活Akt磷酸化,抑制p53/Bcl-2信号通路调节脾细胞的过度凋亡发挥保护作用。
4 结论LYC对NP诱导的小鼠脾损伤具有保护作用,这与LYC增强脾抗氧化能力,抑制脾细胞凋亡有关。
| [1] |
EL-DAKDOKY M H, HELAL M A M. Reproductive toxicity of male mice after exposure to nonylphenol[J]. Bull Environ Contam Toxicol, 2007, 79(2): 188-191. DOI:10.1007/s00128-007-9158-y |
| [2] |
GRISOLIA C K, BILICH M R, FORMIGLI L M. A comparative toxicologic and genotoxic study of the herbicide arsenal, its active ingredient imazapyr, and the surfactant nonylphenol ethoxylate[J]. Ecotox Environ Safe, 2004, 59(1): 123-126. DOI:10.1016/j.ecoenv.2004.01.014 |
| [3] |
PARK H J, ZHANG M T, LEE W Y, et al. Toxic effects of nonylphenol on neonatal testicular development in mouse organ culture[J]. Int J Mol Sci, 2020, 21(10): 3491. DOI:10.3390/ijms21103491 |
| [4] |
KAZEMI S, MOUSAVI KANI S N, GHASEMI-KASMAN M, et al. Nonylphenol induces liver toxicity and oxidative stress in rat[J]. Biochem Biophys Res Commun, 2016, 479(1): 17-21. DOI:10.1016/j.bbrc.2016.08.164 |
| [5] |
KOTB A M, ABD-ELKAREEM M, ABOU KHALIL N S, et al. Protective effect of Nigella sativa on 4-nonylphenol-induced nephrotoxicity in Clarias gariepinus (Burchell, 1822)[J]. Sci Total Environ, 2018, 619-620: 692-699. DOI:10.1016/j.scitotenv.2017.11.131 |
| [6] |
MAO Z, ZHENG Y L, ZHANG Y Q. Behavioral impairment and oxidative damage induced by chronic application of nonylphenol[J]. Int J Mol Sci, 2011, 12(1): 114-127. |
| [7] |
CHOI J S, OH J H, PARK H J, et al. Mirna regulation of cytotoxic effects in mouse Sertoli cells exposed to nonylphenol[J]. Reprod Biol Endocrinol, 2011, 9: 126. DOI:10.1186/1477-7827-9-126 |
| [8] |
COSTA-RODRIGUES J, FERNANDES M H, PINHO O, et al. Modulation of human osteoclastogenesis and osteoblastogenesis by lycopene[J]. J Nutr Biochem, 2018, 57: 26-34. DOI:10.1016/j.jnutbio.2018.03.004 |
| [9] |
ALVI S S, ANSARI I A, AHMAD M K, et al. Lycopene amends LPS induced oxidative stress and hypertriglyceridemia via modulating PCSK-9 expression and Apo-CⅢ mediated lipoprotein lipase activity[J]. Biomed Pharmacother, 2017, 96: 1082-1093. DOI:10.1016/j.biopha.2017.11.116 |
| [10] |
GRAFF R E, PETTERSSON A, LIS R T, et al. Dietary lycopene intake and risk of prostate cancer defined by ERG protein expression[J]. Am J Clin Nutr, 2016, 103(3): 851-860. DOI:10.3945/ajcn.115.118703 |
| [11] |
LI W S, JIANG B H, CAO X L, et al. Protective effect of lycopene on fluoride-induced ameloblasts apoptosis and dental fluorosis through oxidative stress-mediated caspase pathways[J]. Chem Biol Interact, 2017, 261: 27-34. DOI:10.1016/j.cbi.2016.11.021 |
| [12] |
PALABIYIK S S, ERKEKOGLU P, ZEYBEK N D, et al. Protective effect of lycopene against ochratoxin A induced renal oxidative stress and apoptosis in rats[J]. Exp Toxicol Pathol, 2013, 65(6): 853-861. DOI:10.1016/j.etp.2012.12.004 |
| [13] |
PALOZZA P, SIMONE R, CATALANO A, et al. Lycopene prevents 7-ketocholesterol-induced oxidative stress, cell cycle arrest and apoptosis in human macrophages[J]. J Nutr Biochem, 2010, 21(1): 34-46. DOI:10.1016/j.jnutbio.2008.10.002 |
| [14] |
XU F B, WANG P Y, YAO Q C, et al. Lycopene alleviates AFB1-induced immunosuppression by inhibiting oxidative stress and apoptosis in the spleen of mice[J]. Food Funct, 2019, 10(7): 3868-3879. DOI:10.1039/C8FO02300J |
| [15] |
SRINIVASAN M, SUDHEER A R, PILLAI K R, et al. Lycopene as a natural protector against γ-radiation induced DNA damage, lipid peroxidation and antioxidant status in primary culture of isolated rat hepatocytes in vitro[J]. Biochim Biophys Acta, 2007, 1770(4): 659-665. DOI:10.1016/j.bbagen.2006.11.008 |
| [16] |
RAO A V, AGARWAL S. Role of lycopene as antioxidant carotenoid in the prevention of chronic diseases: a review[J]. Nutr Res, 1999, 19(2): 305-323. DOI:10.1016/S0271-5317(98)00193-6 |
| [17] |
ESTEBAN S, GORGA M, PETROVIC M, et al. Analysis and occurrence of endocrine-disrupting compounds and estrogenic activity in the surface waters of Central Spain[J]. Sci Total Environ, 2014, 466-467: 939-951. DOI:10.1016/j.scitotenv.2013.07.101 |
| [18] |
SCHWAIGER J, SPIESER O H, BAUER C, et al. Chronic toxicity of nonylphenol and ethinylestradiol: haematological and histopathological effects in juvenile Common carp (Cyprinus carpio)[J]. Aquat Toxicol, 2000, 51(1): 69-78. DOI:10.1016/S0166-445X(00)00098-9 |
| [19] |
HOWELL M, SHEPHERD M. The immune system[J]. Anaesth Intens Care Med, 2018, 19(10): 575-578. DOI:10.1016/j.mpaic.2018.08.014 |
| [20] |
ZHU J F, PAUL W E. CD4 T cells: fates, functions, and faults[J]. Blood, 2008, 112(5): 1557-1569. DOI:10.1182/blood-2008-05-078154 |
| [21] |
BERG R E, FORMAN J. The role of CD8 T cells in innate immunity and in antigen non-specific protection[J]. Curr Opin Immunol, 2006, 18(3): 338-343. DOI:10.1016/j.coi.2006.03.010 |
| [22] |
VALKO M, IZAKOVIC M, MAZUR M, et al. Role of oxygen radicals in DNA damage and cancer incidence[J]. Mol Cell Biochem, 2004, 266(1-2): 37-56. |
| [23] |
IMLAY J A. Pathways of oxidative damage[J]. Annu Rev Microbiol, 2003, 57: 395-418. DOI:10.1146/annurev.micro.57.030502.090938 |
| [24] |
MILANI A, BASIRNEJAD M, SHAHBAZI S, et al. Carotenoids: biochemistry, pharmacology and treatment[J]. Br J Pharmacol, 2017, 174(11): 1290-1324. DOI:10.1111/bph.13625 |
| [25] |
COSTA-RODRIGUES J, PINHO O, MONTEIRO P R R. Can lycopene be considered an effective protection against cardiovascular disease?[J]. Food Chem, 2018, 245: 1148-1153. DOI:10.1016/j.foodchem.2017.11.055 |
| [26] |
GHOBRIAL I M, WITZIG T E, ADJEI A A. Targeting apoptosis pathways in cancer therapy[J]. CA Cancer J Clin, 2005, 55(3): 178-194. DOI:10.3322/canjclin.55.3.178 |
| [27] |
KLUCK R M, BOSSY-WETZEL E, GREEN D R, et al. The release of cytochrome c from mitochondria: a primary site for Bcl-2 regulation of apoptosis[J]. Science, 1997, 275(5303): 1132-1136. DOI:10.1126/science.275.5303.1132 |
| [28] |
GROSS A, MCDONNELL J M, KORSMEYER S J. BCL-2 family members and the mitochondria in apoptosis[J]. Genes Dev, 1999, 13(15): 1899-1911. DOI:10.1101/gad.13.15.1899 |
| [29] |
HAUPT S, BERGER M, GOLDBERG Z, et al. Apoptosis-the p53 network[J]. J Cell Sci, 2003, 116(20): 4077-4085. DOI:10.1242/jcs.00739 |
(编辑 范子娟)



