2. 中国农业大学动物科技学院, 北京 100193
2. College of Animal Science and Technology, China Agricultural University, Beijing 100193, China
热应激是造成畜禽养殖业经济损失的主要原因之一,而奶牛对热尤为敏感,热应激是全球奶业面临的重要挑战[1-2]。热应激不仅会导致奶牛生产性能下降,而且还会引起奶牛机体免疫机能下降和繁殖功能障碍等[3-4]。当发生热应激时,机体会启动散热机制,流经肠道的血流量减少,导致肠道缺血、缺氧,营养物质供应不足,造成肠上皮细胞损伤且增殖受到影响,使肠道黏膜屏障通透性增加,机体产生炎症反应甚至死亡[5-7]。可见,肠道损伤是热应激奶牛的重要病理变化。肠道不仅是奶牛营养物质消化吸收的器官,也是在奶牛免疫防御的重要屏障,改善热应激状态下奶牛的肠道健康对奶牛的健康和生产性能具有重要的意义。利用营养调控来缓解或修复肠道损伤已成为研究者关注的热点,其中,氨基酸营养(如谷氨酸、色氨酸等)缓解动物肠道损伤的研究也多有报道[8-9]。
精氨酸是一种条件性必需氨基酸,也是动物机体细胞内功能最多的氨基酸,不仅是合成蛋白质的原料以及多种生物活性物质(如一氧化氮、多胺、肌酸等)的前体物质,而且还具有抗炎、抗氧化、促进肠道功能发育等生理功能[10-13]。在微生物改变、热应激、脓毒血症等应激或疾病状态下[14-16],动物机体对精氨酸的营养需求量还会增加。研究发现,精氨酸恢复细胞正常生长的作用是其他氨基酸不可替代的[17]。通过体外模型研究精氨酸对肠道上皮细胞热应激损伤的保护作用和机制,对生产实践中合理使用精氨酸以减少热应激造成的损失具有重要的意义。而体外培养小肠上皮细胞热应激模型在鼠、猪、鸡、山羊的热应激研究中得到了广泛应用[18-21]。因此,本研究在建立奶牛原代小肠上皮细胞热应激损伤模型的基础上,通过观察细胞形态、检测细胞增殖以及线粒体介导的细胞凋亡通路中关键基因Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、半胱氨酸天冬氨酸蛋白水解酶-9(cysteinyl aspartate specific proteinase-9,Caspase-9)、半胱氨酸天冬氨酸蛋白水解酶-3(cysteinyl aspartate specific proteinase-3,Caspase-3)mRNA和蛋白的表达,探究精氨酸对热应激奶牛肠道上皮细胞损伤修复效果,以期为精氨酸修复奶牛肠道屏障损伤提供试验依据。
1 材料与方法 1.1 主要试剂及仪器精氨酸(L-Arginine,纯度>99%)购自北京鼎国生物技术有限责任公司,DMEM培养基、4’, 6-二脒基-2-苯基吲哚盐酸核苷酸染料(DAPI)以及Ⅰ型胶原酶购自Gibco公司。胎牛血清(FBS)购自德国PAN-Biotech GmbH。磷酸盐缓冲液(PBS)、0.25%胰蛋白酶-EDTA消化液、青霉素与链霉素混合液(100×)以及Cell Counting Kit(CCK-8)活力检测试剂盒购自Solarbio公司。乳酸脱氢酶(LDH)检测试剂盒(型号A020-2-2)购自南京建成生物工程研究所。牛Bax、Bcl-2、Caspase-3以及Caspase-9检测试剂盒购自上海钰博生物科技有限公司。PrimeScriptTM RT reagent kit(反转录试剂盒)以及SYBR® Fast qPCR Mix(荧光定量试剂盒)购自TaKaRa公司。细胞培养箱(德国Thermo公司),Scientific Multiskan FC型酶标仪及超微量核酸蛋白浓度测定仪(美国Thermo公司),Axio Observer A1倒置荧光显微镜(德国蔡司公司),CFX96荧光定量PCR仪(Bio-RAD公司),流式细胞仪CytoFLEXS(美国贝克曼公司)。
1.2 奶牛原代小肠上皮细胞分离培养将1日龄荷斯坦犊牛安乐死后,剪取15 cm长的十二指肠放到预冷的含4%双抗的生理盐水中,尽快转移至实验室。采用胶原酶消化法获取奶牛小肠上皮细胞[22]。根据成纤维细胞和上皮细胞贴壁时间不同[20],将细胞悬液接种到培养瓶培养1 h后,将细胞上清液吸出,接种到新的培养瓶继续培养,以上步骤重复3次,此时小肠上皮细胞纯度可达90%左右。将分离得到的小肠上皮细胞于37 ℃、5%二氧化碳(CO2)培养箱中培养。每2 d换1次液,细胞铺满90%时进行传代培养。用0.25%胰蛋白酶-EDTA消化液消化第2代奶牛小肠上皮细胞,细胞出现皱缩变圆时加培养基终止消化,离心后加培养基重悬细胞并将细胞吹打均匀,取少量细胞悬液用细胞计数板计数,并计算细胞悬液的总细胞数,加培养基稀释细胞悬液,调整细胞密度,接种于96孔板(1×105个·mL-1)或6孔板(1×106个·mL-1),用于后续试验。试验用的是第3代奶牛小肠上皮细胞。
1.3 试验分组和处理1.3.1 精氨酸添加浓度的筛选 将奶牛小肠上皮细胞分为空白对照组(Con组)和试验组,试验组包括热应激组(HS组)和不同浓度精氨酸组(L-Arg组),每组6个重复。处理过程如下:1)对照组、试验组均用无血清培养基培养,Con组于37 ℃、试验组于42 ℃、5%CO2培养箱中培养6 h[9, 23]。2)弃去培养基用PBS洗两次,Con组、HS组继续用无血清培养基培养,L-Arg组更换成不同浓度(2、4、6、8、10 mmol·L-1)的精氨酸培养基培养,所有处理组均于37 ℃、5%CO2培养箱中培养,12 h后检测细胞活力,筛选出最佳的精氨酸添加浓度,用于后续试验。
1.3.2 精氨酸对热应激奶牛小肠上皮细胞增殖和凋亡的影响 将奶牛小肠上皮细胞分为对照组(Con组)、热应激组(HS组)和6 mmol·L-1精氨酸组(6 mmol·L-1 L-Arg组),每组6个重复。处理过程如下:1)3组细胞均用无血清培养基培养,Con组于37 ℃、HS组和6 mmol·L-1 L-Arg组于42 ℃、5%CO2培养箱中培养6 h。2)弃去培养基用PBS洗两次,Con组、HS组继续用无血清培养基培养,6 mmol·L-1L-Arg组更换成6 mmol·L-1精氨酸培养基培养,3个处理组均于37 ℃、5%CO2培养箱中培养,12 h后收集培养上清和细胞。
1.4 CCK-8检测细胞活力按照“1.3.1”试验步骤对奶牛小肠上皮细胞进行培养和处理后,弃去培养基,用PBS溶液清洗1遍,每孔加入100 μL不含血清的培养基和10 μL的CCK-8试剂在37 ℃中孵育2 h,用酶标仪450 nm测OD值以计算细胞活力。选择细胞活力最高的精氨酸浓度作为后续试验的浓度。
1.5 DAPI染色观察细胞的核形态变化按照“1.3.2”试验步骤对奶牛小肠上皮细胞进行培养和处理后,弃去培养基,每孔加100 μL 4%多聚甲醛固定20 min;弃甲醛,每孔加200 μL PBS液清洗两次;每孔加DAPI溶液(10 μg·mL-1),避光作用20 min;用PBS溶液清洗两次,置于倒置荧光显微镜下在相同荧光强度和曝光时间下采集图像信息,激发光波长为345 nm,发射光强度为455 nm。
1.6 微板法检测乳酸脱氢酶(LDH)含量按照“1.3.2”试验步骤对奶牛小肠上皮细胞进行培养和处理后,收集细胞培养上清液,按照试剂盒说明书步骤进行测定。
1.7 流式细胞仪检测细胞周期按照“1.3.2”试验步骤对奶牛小肠上皮细胞进行培养和处理后,用预冷PBS清洗细胞2次,用0.25%胰蛋白酶-EDTA消化液消化细胞,预冷的PBS洗涤细胞,加入-20 ℃预冷的75%乙醇固定细胞,4 ℃放置24 h。用冷PBS清洗细胞,2 500×g离心5 min,加入2 μL浓度为1 mg·mL-1的RNase去除RNA。加入100 μL PI染色液,避光染色20 min。用流式细胞仪进行上机检测,激发波长488 nm,发射波长585 nm。用Modfit软件分析细胞周期以确定细胞周期分布。
1.8 RT-PCR检测基因表达用PBS清洗细胞两遍,用TRIzol提取总RNA,超微量核酸蛋白浓度测定仪检测其浓度和纯度,OD260 nm/OD280 nm=1.9~2.0表示RNA纯度较高;用1%的琼脂糖凝胶电泳检测总RNA的完整度。按反转录试剂盒说明书步骤将RNA反转录成cDNA, 于-20 ℃冰箱保存。根据NCBI公布的牛的目的基因CyclinE1、CyclinB、CyclinG1、Bax、Bcl-2、Caspase-3、Caspase-9和内参基因GAPDH的mRNA序列,使用Premier 5.0设计特异性引物,委托生工生物工程股份有限公司合成,引物序列见表 1。实时荧光定量PCR反应体系20 μL: 2×SYBR Green Mix 10 μL,上、下游引物各2 μL,cDNA 2 μL,RNase Free ddH2O 4 μL。每个处理组6个重复。采用2-△△Ct法计算各组基因的mRNA相对表达量。
|
|
表 1 引物序列 Table 1 Primer sequences |
按照“1.3”试验步骤对奶牛小肠上皮细胞进行培养和处理后,用预冷PBS清洗细胞2次,用细胞刮板将细胞从6孔板底部刮下,置于1.5 mL的EP管中。用细胞破碎仪破碎,得到待测样本。按照试剂盒说明书分别检测细胞内Bax、Bcl-2、Caspase-3、Caspase-9的蛋白含量。
1.10 数据统计分析试验原始数据先用EXCEL进行整理,然后利用SPSS 20.0软件对数据进行组间单因素方差分析(one-way ANOVA)和Duncan氏法进行多重比较,P<0.05表示统计学检验差异显著。结果用“平均值±标准差”表示。
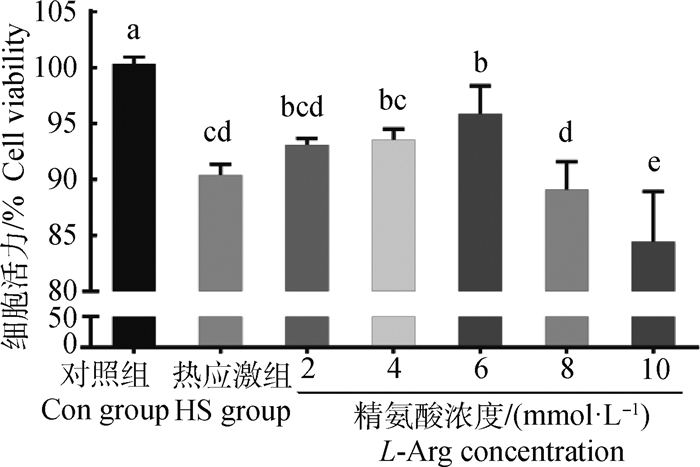
2 结果 2.1 精氨酸对热应激奶牛小肠上皮细胞活力的影响如图 1所示,与Con组相比,HS组细胞活力显著降低(P<0.05);与HS组相比,精氨酸浓度为2、4 mmol·L-1时,细胞活力差异不显著(P>0.05);精氨酸浓度为6 mmol·L-1时,细胞活力显著高于HS组(P<0.05),且低于Con组(P<0.05);精氨酸浓度为10 mmol·L-1时,细胞活力受到抑制(P<0.05)。
|
数据柱标含有相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P < 0.05)。下同 Value columns with the same small letter mean no significant difference (P>0.05), while with different small letters mean significant difference (P < 0.05). The same as below 图 1 精氨酸对热应激奶牛小肠上皮细胞活力的影响 Fig. 1 Effect of L-Arg on the activity of bovine intestinal epithelial cells challenged by heat stress |
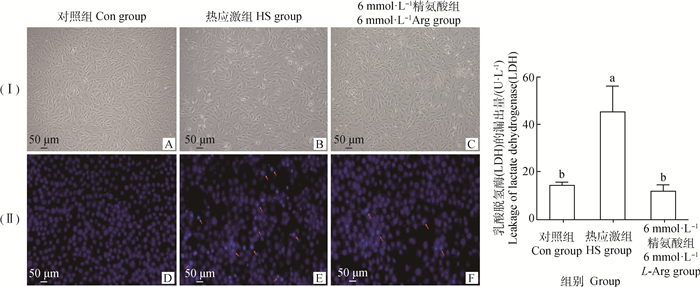
如图 2(Ⅰ)和(Ⅱ)所示,与Con组相比,HS组染色质浓缩、细胞的核形态不规则变化。与HS组相比,6 mmol·L-1 L-Arg组染色浓缩、细胞的核形态不规则变化减少。
|
(I).明场图,(Ⅱ).DAPI染色图;其中,A、D为对照组;B、E为热应激组;C、F为6 mmol·L-1精氨酸组;红色箭头指的是染色质浓缩、细胞核形态不规则;G.是细胞上清液中乳酸脱氢酶的含量 (I) Bright field figure, (Ⅱ) DAPI staining diagram. A, D. Control group; B, E. Heat stress group; C, F. 6 mmol·L-1 L-Arg group. The red arrows refer to chromatin condensation and irregular nuclear morphology. G. The content of lactate dehydrogenase in the supernatant of cells 图 2 精氨酸对热应激奶牛小肠上皮细胞形态及乳酸脱氢酶含量的影响 Fig. 2 Effects of L-Arg on morphology and lactate dehydrogenase content of intestinal epithelial cells challenged by heat stress |
由图 2G可知,与Con组相比,HS组上清液中LDH的含量显著升高(P<0.05)。与HS组相比,6 mmol·L-1 L-Arg组上清液LDH的含量显著降低(P<0.05),与Con组相比差异不显著(P>0.05)。
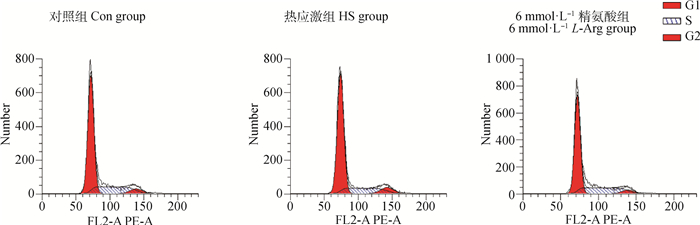
2.4 精氨酸对热应激奶牛小肠上皮细胞周期细胞比率的影响由图 3和表 2可知,与Con组相比,HS组G1期细胞比率升高(P<0.05),S期细胞比率显著降低(P<0.05),G2期细胞比率无显著差异(P>0.05);6 mmol·L-1 L-Arg组G1期和G2期细胞比率显著低于Con组和HS组(P<0.05),S期细胞比率显著高于Con组和HS组(P<0.05)。
|
图 3 各组细胞周期检测 Fig. 3 Detection of cell cycle in each group |
|
|
表 2 精氨酸对小肠上皮细胞各期细胞比率的影响 Table 2 Effect of L-Arg on the cell ratio of intestinal epithelial cells in different phases |
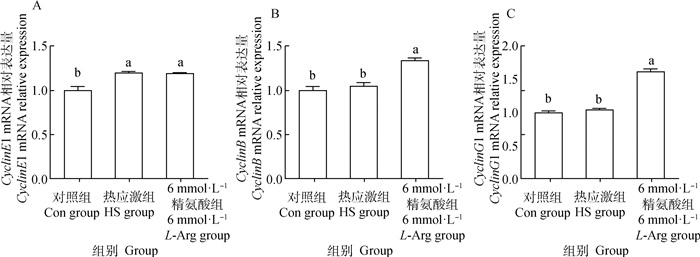
如图 4所示,HS组和6 mmol·L-1 L-Arg组CyclinE1的mRNA相对表达量差异不显著(P>0.05),均显著高于Con组(P<0.05)。与HS组相比,6 mmol·L-1 L-Arg组的CyclinB和CyclinG1的mRNA相对表达量均显著高于HS组(P<0.05)。与Con组相比,HS组CyclinB和CyclinG1的mRNA相对表达量均差异不显著(P>0.05)。
|
图 4 精氨酸对小肠上皮细胞调控细胞周期相关基因表达水平的影响 Fig. 4 The effect of L-Arg on the expression of cell cycle regulation-related genes in intestinal epithelial cells |
由图 5可得,HS组Bax、Caspase-3、Caspase-9、Bcl-2 mRNA相对表达量以及Bax/Bcl-2比值均显著高于Con组(P<0.05)。与HS组相比,6 mmol·L-1 L-Arg组Bax、Caspase-3、Caspase-9 mRNA相对表达量以及Bax/Bcl-2比值显著降低(P<0.05),而Bcl-2的mRNA相对表达量显著升高(P<0.05)。
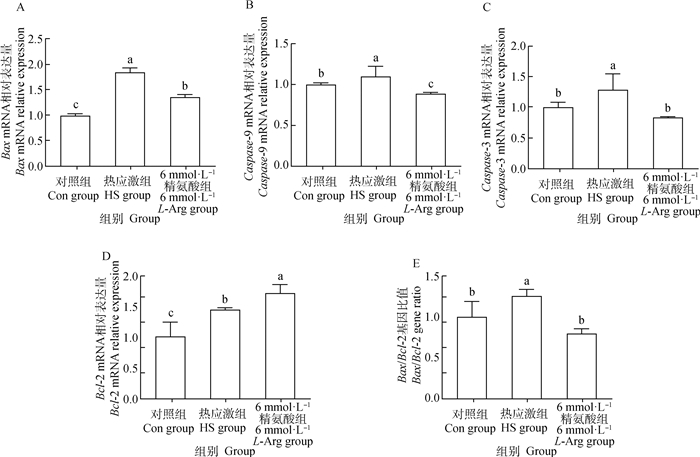
|
图 5 精氨酸对小肠上皮细胞凋亡相关基因表达水平的影响 Fig. 5 Effect of L-Arg on the expression of apoptotic-related genes in intestinal epithelial cells |
由图 6可知,与Con组相比,HS组的Bax、Caspase-3、Caspase-9的蛋白含量以及Bax/Bcl-2比值显著升高(P<0.05),HS组Bcl-2蛋白含量显著降低(P<0.05)。6 mmol·L-1 L-Arg组Bax、Caspase-3、Caspase-9的蛋白含量及Bax/Bcl-2比值显著低于HS组(P<0.05),而Bcl-2蛋白含量显著高于HS组(P<0.05);与Con组相比,6 mmol·L-1 L-Arg组Bax蛋白含量显著升高(P<0.05),而Caspase-3、Caspase-9蛋白含量及Bax/Bcl-2比值差异不显著(P>0.05),Bcl-2蛋白含量显著降低(P<0.05)。

|
图 6 精氨酸对小肠上皮细胞凋亡相关蛋白表达水平的影响 Fig. 6 Effect of L-Arg on the expression of apoptotic-related proteins in intestinal epithelial cells |
热应激会导致肠上皮细胞凋亡,造成肠道黏膜屏障损伤[24]。预防或缓解肠道上皮损伤是解决奶牛热应激的有效策略。研究表明,功能性氨基酸精氨酸在胃肠道的生长、发育、成熟、修复等方面具有重要的调节作用[25]。本试验结果显示,在2~10 mmol·L-1范围内,精氨酸浓度为6 mmol·L-1时,细胞活力达到最高值;精氨酸浓度低于6 mmol·L-1,细胞活力随着浓度的增加而增加;精氨酸浓度高于6 mmol·L-1时,细胞活力逐渐降低,这可能是过量的精氨酸会对细胞产生毒性[26]。细胞周期是细胞功能的基本过程,分为G1期、S期(DNA合成)、G2期以及M期(有丝分裂)[27],细胞周期对进一步研究细胞活力是非常重要的。热应激会使细胞阻滞在G0/G1期[28]。本研究发现,添加6 mmol·L-1精氨酸后,G1期的细胞比率显著低于热应激组,且6 mmol·L-1精氨酸组S期的细胞比率显著高于热应激组和对照组,表明精氨酸可以缓解热应激造成的细胞周期阻滞,促进细胞的增殖,这与前人的研究结果相符[27, 29]。整个细胞周期进程有多种细胞周期特异性蛋白(Cyclins)和蛋白依赖性蛋白激酶家族(CDKs)驱动,如G1期到S期主要由CyclinD与CDK4/6的复合物和CyclinE与CDK2的复合物驱动,G2期到M期主要由CyclinB与CDK1的复合物驱动[29]。本研究中,热应激组S期的细胞比率显著低于对照组和精氨酸组,但是CyclinE1基因的表达量要高于对照组,而与精氨酸组相比差异不显著。这可能是热应激组CyclinE1基因在表达翻译的过程受到了干扰。精氨酸组的CyclinE1和CyclinB基因的相对表达量均高于热应激组,表明精氨酸通过调节细胞周期促进了热应激奶牛小肠上皮细胞的增殖。CyclinG1是新发现的细胞周期蛋白G家族的重要成员,其对细胞的进程的调控具有正、负调节作用,这可能与CyclinG1作用的细胞和组织不同及其表达水平有关。有研究显示,CyclinG1对小鼠子宫细胞增殖产生负面影响[30-31]。柳朝华[32]在研究CyclinG1在小鼠卵巢的表达及其与卵泡发育和卵母细胞成熟的关系时,发现CyclinG1可能作为细胞周期的正调节因子参与了卵泡生长发育和卵母细胞成熟过程的调控。Yue等[30]发现,CyclinG1呈孕激素依赖性表达,参与孕激素对子宫内膜基质细胞的促增殖作用。本研究中,精氨酸组的CyclinG1基因的相对表达量显著升高,结合前面的研究结果,CyclinG1可能正向调控了热应激奶牛小肠上皮细胞的增殖。乳酸脱氢酶(LDH)是一种稳定的细胞质酶。当细胞膜受损时,LDH会迅速释放到细胞培养上清中,是细胞发生损伤的一种重要特征[33]。精氨酸可以促进细胞损伤修复。Zhang等[34]研究报道,培养基中添加100 μmol·L-1精氨酸能显著降低脂多糖诱导的绵羊肠上皮细胞LDH的释放量。梁鑫[35]研究发现,25 mmol·L-1精氨酸显著降低了100、300 μg·mL-1丙稀晴染毒大鼠心肌细胞培养上清液LDH的活性。本试验中,6 mmol·L-1精氨酸组的LDH含量显著低于热应激组,细胞损伤减少。无论是诱导损伤还是染毒损伤,添加精氨酸可以减少细胞损伤,其添加浓度和损伤程度、作用的靶器官以及物种等的不同均有关系。这表明不同的动物品种、生长阶段、损伤诱因等的精氨酸添加量是不同的,需要在明确其作用机制的前提下,探索精氨酸在生产实践中的合理应用。
凋亡指机体细胞在生长发育过程中或在一定条件下,通过细胞内外因素调控下而发生的一种程序性细胞死亡,其特征在于特定的形态学和生物化学变化,在早期属于可逆过程[19, 36]。研究发现,添加精氨酸可以减少鼠肝缺血再灌注损伤出现的染色质浓缩的凋亡细胞[37]。本试验也发现,精氨酸组染色质浓缩细胞数要低于热应激组(图 2),减少了凋亡的发生。细胞凋亡主要包括两种途径:外源性(死亡受体介导)和内源性(线粒体介导)凋亡传导通路[38]。霍爱华等[39]研究发现,热应激可导致线粒体凋亡通路的激活。Bcl-2家族的Bax以及半胱氨酸天冬氨酸蛋白酶家族的Caspase-9、Caspase-3在线粒体介导的凋亡通路中起着关键的起始调控和执行作用。黄琳[40]研究表明,精氨酸降低了饲喂氧化鱼油仔猪肠道Caspase-3的活性,缓解了仔猪肠道的氧化损伤。王万铁等[41]研究报道,精氨酸降低了兔肺缺血-再灌注损伤的肺细胞Bax基因表达,提高了Bcl-2基因的表达,有效地减轻了缺血再灌注损伤。而在晏利琼等[42]的研究发现,精氨酸对热应激肉鸡空肠Caspase-3及Bcl-2 mRNA的表达量均无影响。这可能与精氨酸添加量、动物个体差异以及试验设计不同有关。本试验结果显示,小肠上皮细胞经过热应激处理后,促凋亡因子Bax、Caspase-3、Caspase-9的相对表达水平和蛋白的含量显著升高。虽然热应激组Bcl-2基因表达量升高,但Bcl-2蛋白含量是降低,蛋白质是生理功能的执行者,且Bax/Bcl-2的基因比值是显著升高的,说明热应激导致细胞的凋亡增多[43-44]。通过添加精氨酸进行修复处理,促凋亡因子Bax、Caspase-3、Caspase-9 mRNA和蛋白表达量显著降低,抗凋亡因子Bcl-2 mRNA和蛋白表达量显著升高。这表明精氨酸可能通过影响细胞内Bax和Bcl-2的表达,抑制了线粒体信号转导途径促进Caspase-3酶解级联反应,减少了细胞的凋亡。可见,精氨酸缓解了热应激对奶牛小肠上皮细胞的凋亡损伤,这为精氨酸应用于预防或缓解奶牛热应激提供了体外试验理论依据。
4 结论本研究表明,精氨酸对体外培养的热应激奶牛小肠上皮细胞的活力具有低浓度促进、高浓度抑制的作用效果。其中,添加6 mmol·L-1精氨酸的细胞活力最高,显著改善细胞在G1期的阻滞;同时,6 mmol·L-1精氨酸可调控热应激奶牛小肠上皮细胞与细胞凋亡相关因子的mRNA和蛋白水平的表达,显著降低热应激导致的小肠上皮细胞凋亡损伤。
| [1] |
GONZALEZ-RIVAS P A, CHAUHAN S S, HA M, et al. Effects of heat stress on animal physiology, metabolism, and meat quality: a review[J]. Meat Sci, 2020, 162: 108025. DOI:10.1016/j.meatsci.2019.108025 |
| [2] |
POLSKY L, VON KEYSERLINGK M A G. Invited review: effects of heat stress on dairy cattle welfare[J]. J Dairy Sci, 2017, 100(11): 8645-8657. DOI:10.3168/jds.2017-12651 |
| [3] |
BAGATH M, KRISHNAN G, DEVARAJ C, et al. The impact of heat stress on the immune system in dairy cattle: a review[J]. Res Vet Sci, 2019, 126: 94-102. DOI:10.1016/j.rvsc.2019.08.011 |
| [4] |
LAPORTA J, FERREIRA F C, OUELLET V, et al. Late-gestation heat stress impairs daughter and granddaughter lifetime performance[J]. J Dairy Sci, 2020, 103(8): 7555-7568. DOI:10.3168/jds.2020-18154 |
| [5] |
SAMMAD A, WANG Y J, UMER S, et al. Nutritional physiology and biochemistry of dairy cattle under the influence of heat stress: consequences and opportunities[J]. Animals (Basel), 2020, 10(5): 793. |
| [6] |
YUN W, SONG M, LEE J, et al. Arginine addition in a diet for weaning pigs can improve the growth performance under heat stress[J]. J Anim Sci Technol, 2020, 62(4): 460-467. DOI:10.5187/jast.2020.62.4.460 |
| [7] |
SHANDILYA U K, SHARMA A, SODHI M, et al. Heat stress modulates differential response in skin fibroblast cells of native cattle (Bos indicus) and riverine buffaloes (Bubalus bubalis)[J]. Biosci Rep, 2020, 40(2): BSR20191544. DOI:10.1042/BSR20191544 |
| [8] |
李秋粉, 欧阳经鑫, 黎观红. 色氨酸调控畜禽热应激研究进展[J]. 动物营养学报, 2021, 33(2): 658-668. LI Q F, OUYANG J X, LI G H. Research progress on role of tryptophan in counteracting heat stress in livestock and poultry[J]. Chinese Journal of Animal Nutrition, 2021, 33(2): 658-668. DOI:10.3969/j.issn.1006-267x.2021.02.007 (in Chinese) |
| [9] |
陈欣. 谷氨酸对热应激致奶牛肠上皮细胞损伤的修复作用[D]. 洛阳: 河南科技大学, 2019. CHEN X. Repairment of glutamic acid on the damage by heat stress in dairy cattle intestinal epithelial cells[D]. Luoyang: Henan University of Science and Technology, 2019. (in Chinese) |
| [10] |
乔新月, 王梦竹, 贾军峰, 等. 功能性氨基酸对断奶仔猪肠道损伤修复机制的研究进展[J]. 畜牧兽医学报, 2020, 51(7): 1499-1505. QIAO X Y, WANG M Z, JIA J F, et al. Research progress on functional amino acids on intestinal injury repair mechanism of weaned piglets[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(7): 1499-1505. (in Chinese) |
| [11] |
王莹, 姜廷波, 孙泽威. L-精氨酸代谢产物对动物营养调控的研究进展[J]. 中国畜牧杂志, 2017, 53(3): 13-17. WANG Y, JIANG T B, SUN Z W. Advance in animal nutritional regulation of L-Arginine metabolites[J]. Chinese Journal of Animal Science, 2017, 53(3): 13-17. (in Chinese) |
| [12] |
MORRIS S M JR. Arginine metabolism revisited[J]. J Nutr, 2016, 146(12): 2579S-2586S. DOI:10.3945/jn.115.226621 |
| [13] |
DE ANDRADE BERNAL FAGIANI M, FLUMINHAN A, DE AZEVEDO MELLO F, et al. L-Arginine minimizes immunosuppression and prothrombin time and enhances the genotoxicity of 5-fluorouracil in rats[J]. Nutrition, 2019, 66: 94-100. DOI:10.1016/j.nut.2019.04.012 |
| [14] |
MOU Q, YANG H S, YIN Y L, et al. Amino acids influencing intestinal development and health of the piglets[J]. Animals (Basel), 2019, 9(6): 302. |
| [15] |
WU X, RUAN Z, GAO Y L, et al. Dietary supplementation with L-arginine or N-carbamylglutamate enhances intestinal growth and heat shock protein-70 expression in weanling pigs fed a corn- and soybean meal-based diet[J]. Amino Acids, 2010, 39(3): 831-839. DOI:10.1007/s00726-010-0538-y |
| [16] |
YOON S Y, SA S J, CHO E S, et al. Effects of zinc oxide and arginine on the intestinal microbiota and immune status of weaned pigs subjected to high ambient temperature[J]. Animals (Basel), 2020, 10(9): 1537. |
| [17] |
HALL G A, BYRNE T F. Effects of age and diet on small intestinal structure and function in gnotobiotic piglets[J]. Res Vet Sci, 1989, 47(3): 387-392. DOI:10.1016/S0034-5288(18)31267-0 |
| [18] |
HE S S, GUO Y H, ZHAO J X, et al. Ferulic acid protects against heat stress-induced intestinal epithelial barrier dysfunction in IEC-6 cells via the PI3K/Akt-mediated Nrf2/HO-1 signaling pathway[J]. Int J Hyperthermia, 2019, 35(1): 112-121. |
| [19] |
孙汇蕾, 仲庆振, 李明晔, 等. 热休克蛋白70上调表达对热应激猪小肠上皮细胞凋亡的影响[J]. 动物营养学报, 2020, 32(4): 1867-1874. SUN H L, ZHONG Q Z, LI M Y, et al. Effects of up-regulated expression of heat shock protein 70 on apoptosis in intestinal epithelial cells of heat-stressed piglets[J]. Chinese Journal of Animal Nutrition, 2020, 32(4): 1867-1874. DOI:10.3969/j.issn.1006-267x.2020.04.046 (in Chinese) |
| [20] |
王菊花, 张粟子, 刘丹丹, 等. 鸡胚小肠上皮细胞的分离培养及其热应激效应[J]. 西北农林科技大学学报: 自然科学版, 2020, 48(3): 9-15, 22. WANG J H, ZHANG S Z, LIU D D, et al. Isolation, culture and heat stress effect of chicken intestinal epithelial cells[J]. Journal of Northwest A&F University: Natural Science Edition, 2020, 48(3): 9-15, 22. (in Chinese) |
| [21] |
张宇, 徐子洁, 黄晓瑜, 等. 白藜芦醇对热应激诱导的山羊小肠上皮细胞炎性反应调节作用的研究[J]. 畜牧兽医学报, 2020, 51(8): 1886-1894. ZHANG Y, XU Z J, HUANG X Y, et al. Regulatory effect of resveratrol on inflammatory response induced by heat stress in goat small intestinal epithelial cells[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(8): 1886-1894. (in Chinese) |
| [22] |
徐文浩, 张才, 邵琦, 等. 纳米氧化锌对奶牛小肠上皮细胞增殖及凋亡的影响[J]. 中国兽医科学, 2020, 50(6): 797-804. XU W H, ZHANG C, SHAO Q, et al. Effect of nano-ZnO on intestinal epithelial cell proliferation and apoptotic in bovine[J]. Chinese Veterinary Science, 2020, 50(6): 797-804. (in Chinese) |
| [23] |
SALAMA A A K, DUQUE M, WANG L, et al. Enhanced supply of methionine or arginine alters mechanistic target of rapamycin signaling proteins, messenger RNA, and microRNA abundance in heat-stressed bovine mammary epithelial cells in vitro[J]. J Dairy Sci, 2019, 102(3): 2469-2480. DOI:10.3168/jds.2018-15219 |
| [24] |
HE X F, LU Z, MA B B, et al. Effects of chronic heat exposure on growth performance, intestinal epithelial histology, appetite-related hormones and genes expression in broilers[J]. J Sci Food Agric, 2018, 98(12): 4471-4478. DOI:10.1002/jsfa.8971 |
| [25] |
任永锋, 吴承堂. 左旋精氨酸在肠黏膜损伤修复中的作用机制[J]. 中华危重病急救医学, 2006, 18(12): 764-765. REN Y F, WU C T. The mechanism of L-arginine in the repair of intestinal mucosal injury[J]. Chinese Critical Care Medicine, 2006, 18(12): 764-765. DOI:10.3760/j.issn:1003-0603.2006.12.022 (in Chinese) |
| [26] |
XIA Z F, HUANG L Q, YIN P, et al. L-Arginine alleviates heat stress-induced intestinal epithelial barrier damage by promoting expression of tight junction proteins via the AMPK pathway[J]. Mol Biol Rep, 2019, 46(6): 6435-6451. DOI:10.1007/s11033-019-05090-1 |
| [27] |
MEI C, HE S S, YIN P, et al. Magnolol pretreatment attenuates heat stress-induced IEC-6 cell injury[J]. J Zhejiang Univ Sci B, 2016, 17(6): 413-424. DOI:10.1631/jzus.B1500261 |
| [28] |
QI D F, HU Y, LI J H, et al. Hyperthermia induces apoptosis of 786-O cells through suppressing Ku80 expression[J]. PLoS One, 2015, 10(4): e0122977. DOI:10.1371/journal.pone.0122977 |
| [29] |
曾黎明. 精氨酸对猪肠道上皮细胞IPEC-1精氨酸转运、细胞增殖及基因表达水平影响的研究[D]. 长沙: 湖南农业大学, 2012. ZENG L M. L-Arginine affects arginine transportation, cell proliferation and gene expression in intestinal porcine epithelial cells (IPEC-1)[D]. Changsha: Hunan Agricultural University, 2012. (in Chinese) |
| [30] |
YUE L M, DAIKOKU T, HOU X N, et al. Cyclin G1 and cyclin G2 are expressed in the periimplantation mouse uterus in a cell-specific and progesterone-dependent manner: evidence for aberrant regulation with Hoxa-10 deficiency[J]. Endocrinology, 2005, 146(5): 2424-2433. DOI:10.1210/en.2004-1605 |
| [31] |
HORNE M C, DONALDSON K L, GOOLSBY G L, et al. Cyclin G2 Is Up-regulated during growth inhibition and B Cell antigen receptor-mediated cell cycle arrest[J]. J Biol Chem, 1997, 272(19): 12650-12661. DOI:10.1074/jbc.272.19.12650 |
| [32] |
柳朝华. Cyclin G1在小鼠卵巢的表达及其与卵泡发育和卵母细胞成熟的关系[D]. 成都: 四川大学, 2006. LIU Z H. Expression of cyclin G1 in mouse ovary and its role in follicular development and oocytes maturation[D]. Chengdu: Sichuan University, 2006. (in Chinese) |
| [33] |
KUMAR P, NAGARAJAN A, UCHIL P D. Analysis of cell viability by the lactate dehydrogenase assay[J]. Cold Spring Harb Protoc, 2018, 2018(6): pdb.prot095497. DOI:10.1101/pdb.prot095497 |
| [34] |
ZHANG H, PENG A, YU Y, et al. L-Arginine protects ovine intestinal epithelial cells from lipopolysaccharide-induced apoptosis through alleviating oxidative stress[J]. J Agric Food Chem, 2019, 67(6): 1683-1690. DOI:10.1021/acs.jafc.8b06739 |
| [35] |
梁鑫. L-精氨酸对丙烯腈损伤心肌细胞的保护作用[D]. 上海: 复旦大学, 2013. LIANG X. Protective effects of L-Arginine on myocardial cells injured by acrylonitrile[D]. Shanghai: Fudan University, 2013. (in Chinese) |
| [36] |
彭锦芬, 揭红东, 周传社, 等. 细胞凋亡及其对羊细胞影响研究进展[J/OL]. 基因组学与应用生物学: 1-8[2021-01-18]. http://kns.cnki.net/kcms/detail/45.1369.Q.20190823.0926.002.html. PENG J F, JIE H D, ZHOU C S, et al. The research progress of apoptosis on sheep cell[J]. Genomics and Applied Biology, 1-8[2021-01-18]. http://kns.cnki.net/kcms/detail/45.1369.Q.20190823.0926.002.html. (in Chinese) |
| [37] |
CHATTOPADHYAY P, SHUKLA G, WAHI A K. Protective effect of L-arginine against necrosis and apoptosis induced by experimental ischemic and reperfusion in rat liver[J]. Saudi J Gastroenterol, 2009, 15(3): 156-162. DOI:10.4103/1319-3767.45356 |
| [38] |
刘大锐, 李报春, 李怀东. 细胞凋亡核心基因Caspase家族的研究进展[J]. 中国医药导刊, 2020, 22(11): 800-805. LIU D R, LI B C, LI H D. Research progress in Caspase family of apoptosis core gene[J]. Chinese Journal of Medical Guide, 2020, 22(11): 800-805. DOI:10.3969/j.issn.1009-0959.2020.11.014 (in Chinese) |
| [39] |
霍爱华, 孙雪荣, 于文慧, 等. 热应激诱导猪肾小管上皮(LLC-PK1)细胞线粒体凋亡相关因子的时效表达[J]. 华北农学报, 2016, 31(6): 94-99. HUO A H, SUN X R, YU W H, et al. Expression of factors related to mitochondrial apoptosis in pig kidney proximal tubular (LLC-PK1) cells induced by heat stress[J]. Acta Agriculturae Boreali-Sinica, 2016, 31(6): 94-99. (in Chinese) |
| [40] |
黄琳. 大豆异黄酮和精氨酸对缓解新生仔猪肠道氧化损伤的机制研究[D]. 广州: 华南农业大学, 2011. HUANG L. Mechanism of soybean isoflavone and arginine on alleviating intestinal oxidative damage in newborn piglets[D]. Guangzhou: South China Agricultural University, 2011. (in Chinese) |
| [41] |
王万铁, 戴雍月, 许益笑, 等. L-精氨酸对肺缺血/再灌注损伤时bcl-2、bax基因表达的影响[J]. 中国病理生理杂志, 2007, 23(2): 288-292. WANG W T, DAI Y Y, XU Y X, et al. Effect of L-Arginine on expression of bcl-2 and bax mRNA in pulmonary injury induced by ischemia-reperfusion in rabbits[J]. Chinese Journal of Pathophysiology, 2007, 23(2): 288-292. DOI:10.3321/j.issn:1000-4718.2007.02.019 (in Chinese) |
| [42] |
晏利琼, 廖满, 谢佳倩, 等. L-精氨酸和α-酮戊二酸对热应激肉鸡肠道吸收功能、抗氧化能力、能量代谢的影响[J]. 中国畜牧杂志, 2016, 52(15): 33-41. YAN L Q, LIAO M, XIE J Q, et al. Effects of L-arginine and α-ketoglutaric acid on intestinal absorption, antioxidant capacity, energy metabolism of heat-stressed broilers[J]. Chinese Journal of Animal Science, 2016, 52(15): 33-41. (in Chinese) |
| [43] |
孙春玲, 国晓瞳, 赵园, 等. 黄芩苷对热应激条件下猪近端肾小管(LLC-PK1)细胞凋亡率及B细胞淋巴瘤-2基因(Bcl-2)和Bcl-2相关X蛋白基因(Bax)表达的影响[J]. 农业生物技术学报, 2014, 22(12): 1553-1560. SUN C L, GUO X T, ZHAO Y, et al. Effects of baicalin on expression of B-cellymphoma-2 (Bcl-2) and Bcl-2 assaciated X protein gene (Bax) and apoptosis rates of pig kidney proximal tubular (LLC-PK1) cells subjected to heat stress[J]. Journal of Agricultural Biotechnology, 2014, 22(12): 1553-1560. DOI:10.3969/j.issn.1674-7968.2014.12.010 (in Chinese) |
| [44] |
XI H, FAN X, ZHANG Z, et al. Bax and Bcl-2 are involved in the apoptosis induced by local testicular heating in the boar testis[J]. Reprod Domest Anim, 2017, 52(3): 359-365. DOI:10.1111/rda.12904 |
(编辑 范子娟)



