早孕因子(early pregnancy factor,EPF)是热休克蛋白10(Hsp10)的细胞外同源物,位于妊娠期间细胞外,在妊娠第一阶段释放来参与妊娠的建立[1]。研究表明,EPF是成功怀孕的重要因素,一方面,它既可作为生长因子,促进胚胎和胎盘组织发育;另一方面,着床期胚胎滋养细胞产生的EPF也作为一种促进母体免疫系统对胎儿产生免疫耐受的抑制剂,通过自分泌和旁分泌途径,诱导免疫细胞如CD4+、CD25+ T细胞的分化并增强他们的免疫抑制活性。这可能是母体妊娠期间对胎儿产生免疫耐受的重要机制[2]。因此,EPF被认为是直接或间接参与妊娠过程中母胎之间复杂相互作用的重要分子[3]。在正常生理条件下,EPF只在怀孕期出现,可间接促进妊娠早期胚胎的发育[4]。哺乳动物妊娠期生殖器官的多个部位,如卵巢、输卵管、胎盘都有EPF的特异性表达[5-6]。本团队前期研究结果发现,在妊娠期牦牛生殖器官的多个部位也有丰富的EPF表达[7],且血液中EPF的含量在妊娠20 d左右开始就明显高于未孕个体[8]。因此,EPF具有作为妊娠诊断血液学参考指标的可能,能够更早、更准确地反映出牦牛的妊娠状态。然而,EPF作为重要的妊娠特异性变化指标,在国内尚未有应用于妊娠诊断的相关检测产品。
近年来,早期妊娠诊断在规模化养殖场中日益受到重视,诊断技术也在不断发展[9-10]。尤其在大规模养殖业中,如奶牛、绵羊等逐渐出现新的妊娠诊断技术[11-13]。受自然环境、技术水平和养殖习惯的影响[14-15],妊娠诊断技术在我国牦牛生产中少有应用。传统的直肠检查、B超扫查进行妊娠诊断对技术要求高[16],操作难度大,难于在实际生产中大范围应用。研制简便易行的血液学早期妊娠诊断方法,将为加强牦牛妊娠期精细化管理、减少孕期误宰误售、预防流产、提高牦牛整体繁殖效率奠定技术基础。
1 材料与方法 1.1 样品、菌株、质粒牦牛胎盘组织样品和卵巢组织样品于2019年11月份采集自中国青海省西宁市屠宰场;大肠杆菌载体质粒pET28-His10-Sumo由中国农业科学院兰州兽医研究所口蹄疫防控技术团队提供;大肠杆菌感受态细胞DH5α和BL21(DE3)均购自北京擎科新业生物技术有限公司。
1.2 试验试剂GoScriptTM Reverse Transcription System购自美国Promega公司;QIAprep Spin Miniprep Kit(50)购自于上海凯杰企业管理有限公司;DNA凝胶回收试剂盒、1-5TM2X High-Fidelity Master Mix均购自北京擎科新业生物技术有限公司;DL500 DNA marker、DL2000 DNA marker、DL5000 DNA marker购自日本TaKaRa公司;Ni Sepharose 6 Fast Flow His标签蛋白纯化填料购自爱必信(上海)生物科技有限公司;限制性核酸内切酶Xho Ⅰ、Sac Ⅰ、T4 DNA连接酶均购自美国NEB;异丙基-β-D-硫代半乳糖苷(IPTG,北京天根生化科技有限公司);THETM His Tag Antibody[HRP] 抗体购自金斯瑞生物科技有限公司。
1.3 引物设计与合成利用软件Prime premier5设计引物,两端选择Sac Ⅰ和Xho Ⅰ酶切位点,引物大小为309 bp。引物合成由上海生工生物股份有限公司完成。引物序列为:EPF-F:CGAGCTCATGGCAGGACAGGCA-TTTAGAA;EPF-R:CCCTCGAGTCAGTCGACATATTTCCCAAGAATGTCA。
1.4 重组质粒的构建1.4.1 目的基因扩增 用TRIzol裂解液从牦牛胎盘和卵巢组织提取RNA,反转录为EPF基因扩增模板。扩增体系:上、下游引物和扩增模板各1 μL,1-5TM2X High-Fidelity Master Mix 12.5 μL,用无菌去离子水补充体积至25 μL。PCR反应程序为:98 ℃预变性2 min,98 ℃变性10 s,55 ℃退火15 s,72 ℃延伸30 s,34个循环,72 ℃重延伸5 min,最后4 ℃保存。
1.4.2 重组质粒构建 使用DNA凝胶回收试剂盒对扩增出的EPF基因回收,并将该目的产物和载体pET28-His10-Sumo分别用Sac Ⅰ内切酶和Xho Ⅰ内切酶于37 ℃水浴酶切2 h, 用10 g·L-1琼脂糖凝胶电泳对酶切产物进行回收。酶切体系为:4 μL的10× CutSmart Buffer,Sac Ⅰ和Xho Ⅰ各1 μL,目的产物/载体8 μL,26 μL的free Water。将该产物、空载体和T4 DNA连接酶按一定的比例混合,置于16 ℃连接过夜。连接反应体系为:10× T4 DNA ligase Buffer、T4 DNA ligase、目的片段、载体分别为1、1、6和2 μL。连接反应后的产物转化至DH5α感受态细胞中:将4 μL产物加入50 μL感受态中冰浴30 min,42 ℃热激90 s,迅速放入碎冰冰浴2 min,加入0.4~1 mL的LB于37 ℃摇床培养1 h,取50~100 μL涂在含卡那的LB固体培养基上,37 ℃过夜倒置培养。使用QIAprep Spin Miniprep Kit(50)提质粒,并进行重组质粒菌液PCR鉴定和测序验证。
1.4.3 牦牛EPF基因同源性分析 用相关软件(ClustalX、GeneDoc、MEGA7)将经过测序后的牦牛EPF基因核苷酸序列与人(Homo sapiens,NM_002157.3)、小鼠(Mus musculus,NM_008303.4)、牛(Bostaurus,NM_174346.2)、黑猩猩(Chimpanzee,NM_001382477.1)、猕猴(Rhesus monkey,NM_001195788.1)、弯角大羚羊(Oryx dammah,XM_040228872.1)、欧亚水田鼠(Eurasian water vole,XM_038315376.1)、象海豹(Mirounga leonine,XM_035007463.1)、金丝猴(Rhinopithecusbieti,XM_017869311.1)、狒狒(Gelada,XM_025404234.1)、单峰驼(Camelus dromedaries,XM_031452070.1)、美洲野牛(Bisonbisonbison,XM_010860903.1)、山羊(Capra hircus,XM_018061298.1)、家兔(Oryctolaguscuniculus,XM_002712369.3)等14个GenBank中的参考序列进行同源性分析。
1.5 EPF重组蛋白的表达及表达形式鉴定将阳性质粒转化至BL21(DE3)感受态细胞中。涂板培养后挑取单克隆于37 ℃震荡培养13~16 h收集于4 ℃冰箱保存备用。将保存的EPF重组菌液按1∶200接种于37 ℃震荡培养,2~3 h后加入IPTG过夜诱导,次日收集菌液,用超声波细胞破碎仪进行破菌处理后取部分菌液进行SDS-PAGE电泳。剩余菌液离心,分别收集上清和包涵体进行Western blot试验。
1.6 EPF重组蛋白表达条件优化1.6.1 诱导剂浓度优化 将保存的EPF重组菌液按1∶200接种于50 mL离心管37 ℃震荡培养,2~3 h后分别依次加入0、100、300、500、700和900 nmol·L-1 IPTG在37 ℃下连续过夜进行诱导,诱导完成后各取1 mL菌液进行处理,进行SDS-PAGE电泳,考马斯亮蓝染色来确定最适合该蛋白表达的诱导剂浓度。
1.6.2 诱导温度优化 将保存的EPF重组菌液按1∶200接种于50 mL离心管37 ℃震荡培养,2~3 h后加入300 nmol·L-1IPTG并将其分别放在16、26、30和37 ℃下震荡过夜进行诱导,诱导完成后各取1 mL菌液处理,进行SDS-PAGE电泳,考马斯亮蓝染色来确定最适合该蛋白表达的温度。
1.6.3 诱导时间优化 将保存的EPF重组菌液按1∶200接种于50 mL离心管37 ℃震荡培养,2~3 h后加入300 nmol·L-1IPTG在37 ℃下进行诱导,从0 h开始诱导,隔2 h收集1次重组菌液,到诱导时间达到8 h时各取1 mL菌液处理蛋白样品进行SDS-PAGE电泳,考马斯亮蓝染色确定蛋白表达最佳时间。
1.7 EPF重组蛋白纯化将保存的EPF重组菌液按1∶200接种于锥形瓶扩大培养,2~3 h后加入浓度为300 nmol·L-1的IPTG 1 mL在37 ℃下诱导6 h。离心将沉淀的菌体用PBS重悬,用超声波细胞破碎仪250 W进行破菌处理60 min。离心收集上清用过滤器过滤后与Ni Sepharose 6 Fast Flow His标签蛋白纯化填料结合4 h。用不同浓度(顺序为20、40、60、80、150、500 mmol·L-1)洗脱液洗脱,分别收集处理后进行SDS-PAGE电泳。
1.8 多克隆抗体的制备及鉴定用纯化后的EPF重组蛋白免疫小鼠。四免后采集小鼠血液,置于4 ℃冰箱,次日离心收集血清。用包被液稀释牦牛EPF重组蛋白作为抗原包被96孔板(抗原包被浓度为10 μg·mL-1),每孔100 μL置于4 ℃冰箱中过夜包被,小鼠抗血清按1∶200稀释后2倍稀释作为一抗,采集未注射任何免疫原的小鼠血清作为阴性对照,HRP标记的羊抗鼠IgG作为二抗,一抗、二抗皆于37 ℃孵育1 h,孵育抗体前后用PBST洗涤3~5次。每孔加50 μL显色液,室温显色15~20 min后用50 μL终止液终止显色。以OD450 nm阳性血清/OD450 nm阴性血清>2.1的最大稀释倍数为抗体效价;将小鼠多抗血清以1∶2 000用10 g·L-1脱脂奶粉稀释,HRP标记的羊抗鼠二抗工作浓度按1∶10 000稀释,纯化后的EPF重组蛋白作为抗原进行Western blot检测鉴定。
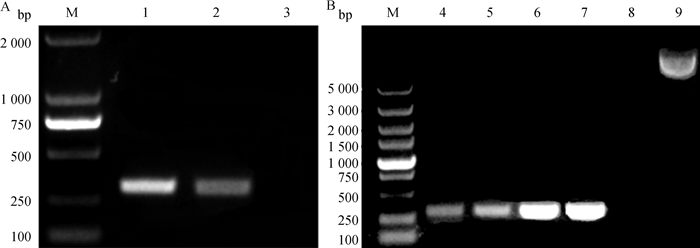
2 结果 2.1 目的基因扩增及重组质粒PCR鉴定PCR扩增目的基因,在300 bp左右得到比较单一的条带(图 1A),与预期结果一致。EPF重组质粒采用通用引物方法进行菌液PCR,扩增产物长度约在300 bp左右(图 1B),与预期结果一致。送北京擎科新业生物技术有限公司进行测序,结果进一步确认了重组EPF质粒构建成功。
|
A. 牦牛EPF基因扩增产物琼脂糖凝胶电泳;B. 重组质粒pET28-His10-Sumo-EPF扩增产物琼脂糖凝胶电泳。M. DNA Marker;泳道1~2为目的基因PCR扩增产物;泳道3为空白对照;泳道4~5为菌液PCR产物;泳道6~7为重组质粒PCR产物;泳道8为空白对照;泳道9为重组质粒 A. Agarose gel electrophoresis of EPF gene amplification product of yak; B. Agarose gel electrophoresis of amplified product of recombinant plasmid pET28-His10-Sumo-EPF. M. DNA Marker; Lane 1 and 2 represent PCR amplification products of the target gene; Lane 3 is blank control; Lane 4 and 5 are colony PCR product; Lane 6 and 7 represent recombinant plasmid PCR product; Lane 8 represents blank control; Lane 9 represents recombinant plasmid 图 1 EPF基因扩增和pET28-His10-Sumo-EPF质粒鉴定 Fig. 1 EPF gene amplification and identification of pET28-His10-Sumo-EPF plasmid |
将牦牛EPF核苷酸与人、小鼠、牛、黑猩猩、猕猴、弯角大羚羊、欧亚水田鼠、象海豹、金丝猴、狒狒、单峰驼、美洲野牛、山羊、家兔的序列相比较,结果显示,其核苷酸同源性分别为91%、88%、98%、91%、90%、66%、86%、63%、90%、89%、63%、97%、65%、90%(图 2)。进行EPF基因进化树分析,结果显示牦牛EPF与黄牛和美洲野牛的亲缘关系最近,与象海豹的亲缘关系相对较远(图 3)。

|
图 2 牦牛与其他物种EPF核苷酸多序列比对 Fig. 2 Multiple comparison of yak EPF nucleotide sequences with other species |

|
图 3 EPF系统进化树分析 Fig. 3 EPF phylogenetic tree analysis |
将EPF重组菌液于37 ℃震荡培养,2~3 h后加入IPTG过夜诱导,次日收集菌液,用超声波细胞破碎仪对菌液进行超声破菌处理,离心后收集上清和包涵体进行Western blot检测,结果显示,重组质粒转染大肠杆菌培养上清液和包涵体中,都有牦牛EPF蛋白的表达(图 4A)。以其中1个上清中蛋白表达量作为对照,灰度值分析其上清和包涵体中的相对表达量。分析结果显示,上清中的蛋白表达量要低于包涵体中的表达量(图 4B)。

|
A. 上清和包涵体中表达蛋白的Western blot检测;M. 蛋白分子质量标准;1~2.上清;3~4. 包涵体;5. 空载体。B. 上清和包涵体中蛋白相对表达量分析 A. Western blot analysis of expressed proteins in supernatant and inclusion bodies; M. Protein Marker; 1 and 2 represent supernatants; 3 and 4 represent inclusion bodies; 5 represents negative control. B. Relative expression analysis of expressed proteins in supernatant and inclusion bodies 图 4 上清和包涵体中表达蛋白的Western blot检测及相对表达量分析 Fig. 4 Western blot and relative expression analysis of expressed proteins in supernatant and inclusion bodies |
2.4.1 最佳诱导剂浓度 将菌液于37 ℃培养2.5 h后分别加入0、100、300、500、700和900 nmol·L-1 IPTG过夜诱导。对SDS-PAGE结果进行灰度值分析,结果显示EPF重组蛋白在IPTG浓度为300 nmol·L-1时蛋白表达量最大(图 5)。故选择重组蛋白诱导的最佳诱导剂浓度为300 nmol·L-1。

|
A. EPF重组蛋白诱导剂IPTG浓度优化;M蛋白分子质量标准;1~6分别代表IPTG浓度为0、100、300、500、700和900 nmol·L-1。B. 诱导剂IPTG浓度灰度值分析结果 A. Optimization of IPTG concentration of EPF recombinant protein; M. Protein Marker; 1-6 represent the level of IPTG are 0, 100, 300, 500, 700 and 900 nmol·L-1, respectively. B. Gray value analysis results of different inducer concerntrations 图 5 EPF重组蛋白诱导剂IPTG浓度优化 Fig. 5 Optimization of IPTG concentration of EPF recombinant protein |
2.4.2 最佳诱导温度 将菌液于37 ℃培养2.5 h后加入300 nmol·L-1 IPTG分别于16、26、30、37 ℃过夜诱导。SDS-PAGE结果显示EPF重组蛋白在37 ℃时蛋白表达量最高(图 6),故选择37 ℃为最佳诱导温度。

|
A. EPF重组蛋白诱导温度优化;M. 蛋白分子质量标准;1~4过夜诱导温度分别为16、26、30和37 ℃。B. 不同温度诱导SDS-PAGE灰度值分析结果 A. Optimum temperature selection for inducing EPF recombinant protein; M. Protein Marker; 1-4 represent the induced temperature are 16, 26, 30 and 37 ℃, respectively. B. Different temperatures induced SDS-PAGE gray value analysis results 图 6 EPF重组蛋白诱导温度优化 Fig. 6 Optimum temperature selection for inducing EPF recombinant protein |
2.4.3 最佳诱导时间 将菌液于37 ℃培养2.5 h后加入300 nmol·L-1 IPTG继续在37 ℃下诱导培养,每隔1或2 h取1次菌液,放置于4 ℃冰箱备用,最后诱导时间达到8 h后取出所有菌液,将所有菌液处理后跑胶验证。由SDS-PAGE结果可知,牦牛EPF重组蛋白在第6小时蛋白表达量最高。从灰度值分析结果也可以直观地看出不同诱导时间下的蛋白表达量不同(图 7)。最终选择最佳诱导时间为6 h。

|
A. 牦牛EPF重组蛋白最佳诱导时间;M. 蛋白分子质量标准;1~8分别代表诱导时间为0、8、6、5、4、3、2、1 h; B. 不同时间诱导SDS-PAGE灰度值分析结果 A. Optimization of induction time of yak EPF recombinant protein; M. Protein Marker; 1-8 represent the induction time are 0, 8, 6, 5, 4, 3, 2, 1 h, respectively; B. Induced SDS-PAGE gray value analysis results at different times 图 7 重组牦牛EPF蛋白诱导最佳时间选择 Fig. 7 Optimization of induction time of EPF recombinant protein of yak |
EPF重组蛋白经Ni柱纯化后用梯度浓度的洗脱液洗脱,当洗脱液浓度较小时洗脱掉大量的杂蛋白,当洗脱液浓度达到300 mmol·L-1时既有杂蛋白又有少量目的蛋白(故洗脱过程中取浓度为300 mmol·L-1的洗脱液),目的蛋白大部分存在于500 mmol·L-1的洗脱液中,蛋白纯化效果较好(图 8A)。透析后EPF重组蛋白经SDS-PAGE分析,获得的纯化蛋白无杂蛋白(图 8B)。

|
A. 纯化的EPF重组蛋白SDS-PAGE分析;B. EPF重组蛋白透析后SDS-PAGE分析结果。M. 蛋白分子质量标准;1. 纯化前破菌后上清;2. 20 mmol·L-1洗脱液;3. 40 mmol·L-1洗脱液;4. 60 mmol·L-1洗脱液;5. 80 mmol·L-1洗脱液;6. 100 mmol·L-1洗脱液;7. 150 mmol·L-1洗脱液;8. 500 mmol·L-1洗脱液;9. EPF重组蛋白未经IPTG诱导时菌液;10. EPF重组蛋白经IPTG诱导表达后菌液;11. 纯化前上清;12. 包涵体;13. 透析后的纯化EPF重组蛋白 A. SDS-PAGE analysis of purified EPF recombinant protein; B. Results of SDS-PAGE analysis of EPF recombinant protein after dialysis. M. Protein Marker; 1. Supernatant after bacteria destruction; 2. 20 mmol·L-1 eluent; 3. 40 mmol·L-1 eluent; 4. 60 mmol·L-1 eluent; 5. 80 mmol·L-1 eluent; 6. 100 mmol·L-1 eluent; 7. 150 mmol·L-1 eluent; 8. 500 mmol·L-1 eluent; 9. EPF recombinant protein was not induced by IPTG; 10. EPF recombinant protein was induced by IPTG and expressed in bacterial fluid; 11. Prepurification supernatant; 12. Inclusion body; 13. Purified recombinant EPF protein after dialysis 图 8 EPF重组蛋白的表达及纯化 Fig. 8 Expression and purification of EPF recombinant protein |
采集四免后小鼠血清,未免小鼠作为阴性对照用间接ELISA法检测多抗血清抗体效价。由图 9可知1∶25 600为OD450 nm阳性血清/OD450 nm阴性血清>2.1血清最大稀释度,因此,鼠抗EPF多克隆抗体效价为1∶25 600(图 9A)。以重组EPF蛋白作为抗原,小鼠抗血清以1∶2 000稀释作为一抗,二抗以1∶10 000稀释进行Western blot检测,结果显示在29 ku处出现特异性条带(图 9B)。结果表明,制备的鼠抗EPF多克隆抗体与重组后牦牛EPF蛋白能够发生特异性反应。

|
A. 不同血清稀释度的OD450 nm值;M. 蛋白分子质量标准;B. Western blot检测EPF抗血清与EPF反应性;1. EPF抗血清和EPF重组蛋白反应条带;2. 空载体 A. OD450 nm values of different serum dilutions; M. Protein Marker; B. The reactivity of EPF antiserum to EPF was detected by Western blot; 1. EPF antiserum and EPF recombinant protein reaction bands; 2. Negative control 图 9 EPF多克隆抗体效价及特异性检测 Fig. 9 EPF polyclonal antibody titer and specificity detection |
EPF是一种免疫抑制反应因子,存在于孕初女性和妊娠早期家畜血清细胞中[17-18]。Morton等[19]证明,EPF存在于所有研究的哺乳动物物种中,至少在妊娠的前三分之二时间内持续存在。Cruz等[20]研究发现,怀孕(第10天除外)动物血清中存在EPF,而未怀孕和排卵前动物血清中不存在该物质,这表明怀孕与EPF合成特别相关。Hu和Zheng等[21]利用RIA试验检测EPF活性,证明EPF是反映胎儿存活的敏感标志物, 可用于预测不明原因自然流产患者的预后。
本试验通过对牦牛EPF基因的同源性分析,得到其与牛的亲缘关系最近,这与马进彪等[8]的分析结果一致,另外,在此基础上,本研究还进一步比较了与小鼠、家兔、美洲野牛、黑猩猩、猕猴、弯角大羚羊、欧亚水田鼠、象海豹、金丝猴、狒狒等动物EPF序列,结果显示单峰驼、山羊、象海豹、弯角大羚羊形成一个分支,且牦牛与该分支的亲缘关系较远。
Ohnuma等[22]用RIT检测到马在交配后24~72 h出现EPF,并持续到妊娠中期。马进彪等[8]分别检测了妊娠期牦牛和未孕牦牛血液中EPF含量,发现妊娠组EPF含量显著高于未孕组,表明血液EPF可作为妊娠检测因子用于牦牛早期妊娠诊断。基于EPF以上的特性,Ohnuma等[23]试图从怀孕母马血清中采用离子交换和超滤的方法纯化EPF,但由于血清中EPF含量过少并没有纯化出马EPF,且血液纯化成本高、效率低。因此,本研究通过原核表达系统来大量表达纯化EPF蛋白,具有较高的经济价值。
Somodevilla-Torres等[24]将感染了杆状病毒的EPF在Sf9昆虫细胞中表达,通过生产一种完全未修饰的分子,并依靠其高pI (8.9)使用离子交换技术实现完全纯化,但纯化后蛋白有明显的杂蛋白存在。杨杰等[25]在Rosseta菌中表达了家兔EPF,但其蛋白主要以包涵体形式表达,通过包涵体洗涤等一系列过程后得到的蛋白回收率较低。刘静静等[26]通过原核表达系统得到重组绵羊EPF蛋白,并通过GST亲和层析进行了蛋白纯化,其蛋白只有少量可溶性表达。因此,基于以上这些表达系统的缺点,本研究通过原核表达系统来大量表达纯化EPF蛋白,并获得大量的可溶性表达。
由于EPF在大肠杆菌中表达主要以包涵体形式表达[27],为了减少蛋白纯化难度,本试验选用大肠杆菌表达系统,在pET28a载体上添加了SUMO标签。唐楚煜等[28-29]认为,SUMO标签具有抵抗蛋白酶水解的功能,它还能使靶蛋白正确折叠。本研究结果也证实了,在助溶标签SUMO的作用下,不但提高了重组蛋白的表达量,促进了EPF的可溶性表达,使大量蛋白出现在原核表达系统上清液中。同时也提高了镍柱纯化时的蛋白结合效率,避免了包涵体纯化的一系列复杂过程,为后期研究节约成本。
在蛋白表达过程中,对诱导时间进行了优化,结果显示EPF蛋白在诱导6 h时表达量达到最高,与刘云等[30]对奶牛EPF蛋白诱导时间优化结果一致,此外,本研究对诱导剂浓度和诱导温度也进行了优化,确定了37 ℃下诱导剂浓度为300 nmol·L-1为最佳条件。通过在载体上添加了SUMO及His标签,对诱导条件优化等方法,提高了EPF蛋白可溶性表达量,His标签镍柱纯化出的牦牛EPF重组蛋白浓度高达2 mg·mL-1,制备出的抗体效价高达1∶25 600,而刘云等[30]制备的奶牛EPF抗体效价仅达1∶12 800,宋立峰等[31]制备的绵羊EPF抗体效价为1∶16 000。EPF抗体的成功制备为牦牛妊娠早期高效快速诊断技术研究奠定了很好的基础,对于今后开展牦牛大规模妊娠检查具有重大意义。
4 结论本研究成功克隆了牦牛EPF基因,构建了牦牛EPF重组质粒,采用原核表达系统表达了可溶性EPF重组蛋白。最终得到纯度相对较高的牦牛EPF重组蛋白。用纯化透析后的重组牦牛EPF蛋白注射免疫小鼠,成功获得牦牛早孕因子的小鼠多克隆抗体,且该抗体具有良好的反应原性。
| [1] |
HATZEL J N, BOUMA G J, CLEYS E R, et al. Identification of heat shock protein 10 within the equine embryo, endometrium, and maternal peripheral blood mononuclear cells[J]. Theriogenology, 2015, 83(5): 832-839. DOI:10.1016/j.theriogenology.2014.11.020 |
| [2] |
CHEN Q G, ZHU X R, CHEN R J, et al. Early pregnancy factor enhances the generation and function of CD4+CD25+ regulatory T cells[J]. Tohoku J Exp Med, 2016, 240(3): 215-220. DOI:10.1620/tjem.240.215 |
| [3] |
MORTON H, ROLFE B, CLUNIE G J A, et al. An early pregnancy factor detected in human serum by the rosette inhibition test[J]. Lancet, 1977, 309(8008): 394-397. DOI:10.1016/S0140-6736(77)92605-8 |
| [4] |
CORRAO S, CAMPANELLA C, ANZALONE R, et al. Human Hsp10 and early pregnancy factor (EPF) and their relationship and involvement in cancer and immunity: current knowledge and perspectives[J]. Life Sci, 2010, 86(5-6): 145-152. DOI:10.1016/j.lfs.2009.11.004 |
| [5] |
GROSSO M C, BELLINGERI R V, SCHADE R, et al. Neutralization of early pregnancy factor by passive immunization alters normal embryonic development and cytokine balance[J]. Inmunología, 2012, 31(4): 106-114. DOI:10.1016/j.inmuno.2012.09.003 |
| [6] |
GROSSO M, BELLINGERI R, MOTTA C, et al. Immunohistochemical distribution of early pregnancy factor in ovary, oviduct and placenta of pregnant gilts[J]. Biotech Histochem, 2015, 90(1): 14-24. DOI:10.3109/10520295.2014.931599 |
| [7] |
赵生贤, 樊江峰, 余四九, 等. 早孕因子(EPF)在雌性牦牛主要生殖器官中的表达[J]. 农业生物技术学报, 2020, 28(5): 876-883. ZHAO S X, FAN J F, YU S J, et al. Expression of early pregnancy factors (EPF) in the main reproductive organs of female yak (Bos grunnien)[J]. Journal of Agricultural Biotechnology, 2020, 28(5): 876-883. (in Chinese) |
| [8] |
马进彪, 樊江峰, 余四九, 等. 牦牛EPF基因克隆及其在配种后血液中的含量分析[J]. 农业生物技术学报, 2020, 28(6): 994-1003. MA J B, FAN J F, YU S J, et al. The gene cloning and blood concentration analysis of EPF after artificial insemination in yak (Bos grunniens)[J]. Journal of Agricultural Biotechnology, 2020, 28(6): 994-1003. (in Chinese) |
| [9] |
MEZIANE R, BOUGHRIS F, BENHADID M, et al. Comparative evaluation of two methods of pregnancy diagnosis in dairy cattle in the East of Algeria: proteins associated with pregnancy and ultrasonography[J]. Biol Rhythm Res, 2021, 52(2): 237-245. DOI:10.1080/09291016.2019.1592348 |
| [10] |
郭腾龙, 汝振远, 任尚, 等. 牛早期妊娠诊断的研究进展[J]. 畜牧与兽医, 2021, 53(8): 142-146. GUO T L, RU Z Y, REN S, et al. Progress in research on early pregnancy diagnosis in cattle[J]. Animal Husbandry & Veterinary Medicine, 2021, 53(8): 142-146. (in Chinese) |
| [11] |
左海洋, 陈晓丽, 蔡勇, 等. 奶牛早期妊娠诊断技术研究进展[J]. 畜牧兽医学报, 2014, 45(10): 1584-1591. ZUO H Y, CHEN X L, CAI Y, et al. Advance of early pregnancy diagnosis technology in dairy cows[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(10): 1584-1591. DOI:10.11843/j.issn.0366-6964.2014.10.002 (in Chinese) |
| [12] |
郭延生, 陶金忠. 基于LC-Q/TOF-MS代谢组学方法筛选奶牛妊娠识别阶段乳样生物标志物的研究[J]. 畜牧兽医学报, 2018, 49(8): 1633-1641. GUO Y S, TAO J Z. Selection of milk biomarkers of pregnancy recognition in dairy cows based on LC-Q/TOF-MS metabolomics[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(8): 1633-1641. (in Chinese) |
| [13] |
卢春霞, 刘长彬, 周平, 等. 酶联适配体可视化检测牛妊娠相关糖蛋白9(bPAG9)及其在奶牛早孕检测中的应用[J]. 农业生物技术学报, 2021, 29(7): 1407-1416. LU C X, LIU C B, ZHOU P, et al. Enzyme-linked aptamer assay for visual detection of bPAG9 and its application for pregnancy diagnosis in dairy cows (Bos taurus)[J]. Journal of Agricultural Biotechnology, 2021, 29(7): 1407-1416. (in Chinese) |
| [14] |
傅芳, 王利, 罗晓林, 等. 牦牛IGFBP4和IGFBP5基因的克隆及其在各组织和不同生长阶段肝中的差异表达分析[J]. 畜牧兽医学报, 2021, 52(7): 1858-1868. FU F, WANG L, LUO X L, et al. Cloning of yak IGFBP4 and IGFBP5 and their expression patterns in different tissues and liver at different growth stages[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(7): 1858-1868. (in Chinese) |
| [15] |
张天留, 高雪, 徐凌洋, 等. 高原家养动物环境适应性的研究进展[J]. 畜牧兽医学报, 2020, 51(7): 1475-1487. ZHANG T L, GAO X, XU L Y, et al. Research progress on environment adaptation of plateau domestic animals[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(7): 1475-1487. (in Chinese) |
| [16] |
王秀娜, 王大力, 高安崇, 等. B型超声诊断仪在猪生产学实践教学中的应用[J]. 畜牧兽医杂志, 2021, 40(4): 77-80. WANG X N, WANG D L, GAO A C, et al. Application of B mode ultrasound diagnostic equipment in practical teaching of swine production[J]. Journal of Animal Science and Veterinary Medicine, 2021, 40(4): 77-80. (in Chinese) |
| [17] |
CAVANAGH A C. Identification of early pregnancy factor as chaperonin 10:implications for understanding its role[J]. Rev Reprod, 1996, 1(1): 28-32. DOI:10.1530/ror.0.0010028 |
| [18] |
李爱美, 练玉银, 王家骥. 重组早孕因子与天然早孕因子的免疫交叉反应[J]. 现代生物医学进展, 2018, 18(4): 616-620, 633. LI A M, LIAN Y Y, WANG J J. The cross reaction of the recombinant early pregnancy factor and the native early pregnancy factor[J]. Progress in Modern Biomedicine, 2018, 18(4): 616-620, 633. (in Chinese) |
| [19] |
MORTON H, MCKAY D A, MURPHY R M, et al. Production of a recombinant form of early pregnancy factor that can prolong allogeneic skin graft survival time in rats[J]. Immunol Cell Biol, 2000, 78(6): 603-607. DOI:10.1046/j.1440-1711.2000.00951.x |
| [20] |
CRUZ Y P, SELWOOD L, MORTON H, et al. Significance of serum early pregnancy factor concentrations during pregnancy and embryonic development in Sminthopsis macroura (Spencer) (Marsupialia: Dasyuridae)[J]. Reproduction, 2001, 121(6): 933-939. DOI:10.1530/rep.0.1210933 |
| [21] |
HU S X, ZHENG Z Q. A study of early pregnancy factor activity in the sera of patients with unexplained spontaneous abortion[J]. Am J Reprod Immunol, 1993, 29(2): 77-81. DOI:10.1111/j.1600-0897.1993.tb00569.x |
| [22] |
OHNUMA K, YOKOO M, ITO K, et al. Study of early pregnancy factor (EPF) in equine (Equus caballus)[J]. Am J Reprod Immunol, 2000, 43(3): 174-179. DOI:10.1111/j.8755-8920.2000.430307.x |
| [23] |
OHNUMA K, ITO K, TAKAHASHI J, et al. Partial purification of mare early pregnancy factor[J]. Am J Reprod Immunol, 2004, 51(2): 95-101. DOI:10.1046/j.8755-8920.2003.00124.x |
| [24] |
SOMODEVILLA-TORRES M J, MORTON H, ZHANG B, et al. Purification and characterisation of functional early pregnancy factor expressed in Sf9 insect cells and in Escherichia coli[J]. Protein Expr Purif, 2003, 32(2): 276-287. DOI:10.1016/j.pep.2003.08.011 |
| [25] |
杨杰, 张海涛, 翟频, 等. 家兔早孕因子原核表达及重组蛋白的纯化、复性与鉴定[J]. 江苏农业科学, 2011, 39(6): 70-72. YANG J, ZHANG H T, ZHAI P, et al. Prokaryotic expression of rabbit early pregnancy factor and purification, renaturation and identification of recombinant protein[J]. Jiangsu Agricultural Sciences, 2011, 39(6): 70-72. (in Chinese) |
| [26] |
刘静静, 王思伟, 董世伟, 等. 绵羊早孕因子重组蛋白在大肠杆菌中的高效表达[J]. 中国草食动物科学, 2014(S1): 199-200. LIU J J, WANG S W, DONG S W, et al. High expression of recombinant protein of sheep early pregnancy factor in Escherichia coli[J]. China Herbivore Science, 2014(S1): 199-200. (in Chinese) |
| [27] |
王晓姗, 陈树林, 张文华, 等. 孕牛血清中早孕因子的分离纯化与鉴定[J]. 中国牛业科学, 2018, 44(2): 22-24. WANG X S, CHEN S L, ZHANG W H, et al. Isolation and purification of early pregnancy factor from pregnant bovine serum by using chromatography techniques[J]. China Cattle Science, 2018, 44(2): 22-24. (in Chinese) |
| [28] |
唐楚煜, 张耀方, 王英超, 等. SUMO化修饰融合蛋白表达系统研究进展[J]. 生物化工, 2020, 6(4): 135-136. TANG C Y, ZHANG Y F, WANG Y C, et al. Research progress of SUMO modified fusion prote in expression system[J]. Biological Chemical Engineering, 2020, 6(4): 135-136. (in Chinese) |
| [29] |
陈徐, 赵洋, 叶映彤, 等. SUMO修饰在神经系统疾病中的作用机制[J]. 生命的化学, 2021, 41(5): 951-963. CHEN X, ZHAO Y, YE Y T, et al. The mechanism of SUMOylation in nervous system diseases[J]. Chemistry of Life, 2021, 41(5): 951-963. (in Chinese) |
| [30] |
刘云, 贾斌, 石峰, 等. 奶牛早孕因子重组蛋白的原核表达、纯化及多克隆抗体的制备[J]. 中国畜牧兽医, 2015, 42(4): 877-882. LIU Y, JIA B, SHI F, et al. Prokaryotic expression, purification of early pregnancy factor protein of the dairy cattle and preparation of polyclonal antibody against it[J]. China Animal Husbandry & Veterinary Medicine, 2015, 42(4): 877-882. (in Chinese) |
| [31] |
宋立峰, 刘静静, 刘月琴, 等. 用于检测绵羊妊娠早孕因子多克隆抗体的制备[J]. 中国草食动物科学, 2014(S1): 203-205. SONG L F, LIU J J, LIU Y Q, et al. Preparation of polyclonal antibody for detection of early pregnancy factor of sheep[J]. China Herbivore Science, 2014(S1): 203-205. (in Chinese) |
(编辑 范子娟)



