2. 西南民族大学 青藏高原动物遗传资源保护与利用国家教育部重点实验室, 成都 610041;
3. 西南民族大学 现代生物技术国家民委重点实验室, 成都 610041
2. Key Laboratory of Qinghai-Tibetan Plateau Animal Genetic Resource Reservation and Utilization of Ministry of Education, Southwest Minzu University, Chengdu 610041, China;
3. Key Laboratory of Modern Biotechnology of State Ethnic Affairs Commission, Southwest Minzu University, Chengdu 610041, China
牦牛(Bos grunniens)主要生活在青藏高原及其毗邻的高海拔地区,是当地牧民的主要经济收入来源之一。但因高原地区寒冷,营养不足等,导致牦牛性成熟晚、受孕率低且犊牛死亡率高[1],严重限制了高原畜牧经济的发展。黄体(corpus luteum, CL)是哺乳动物卵巢排卵后形成的一种临时性的内分泌腺,其主要功能是分泌孕酮(progesterone, P4),而孕酮是妊娠建立和维持的重要调节激素,因此,黄体功能的正常发挥与母畜受孕率及生产率息息相关。机体有氧代谢过程中产生的活性氧(reactive oxygen species, ROS)对动物繁殖具有重要影响。在大鼠卵巢中,生理水平的ROS能够促进卵母细胞减数分裂的恢复和成熟[2-4]。然而,ROS的大量积聚则会引起氧化应激,从而导致细胞衰老、凋亡,甚至发生炎症反应[5-6]。研究发现,ROS会导致卵母细胞质量下降及黄体期缺陷[7],黄体细胞发生氧化应激时,孕酮分泌水平受到严重影响[8]。
抗氧化剂是一类能帮助捕获并中和自由基的物质,在正常生理条件下,机体内存在的超氧化物歧化酶(superoxide disnutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GPX)、过氧化物酶(peroxidase, POD)、过氧化氢酶(catalase, CAT)等,可以保护机体不受活性氧和自由基损害,部分抗氧化剂还可以促进孕酮的分泌[9]。褪黑素(melatonin, MT)是由松果体分泌的具有多种生物活性的神经内分泌激素,具有抗炎、抗衰老、抗凋亡及强效抗氧化作用[10-13]。既往研究表明,褪黑素可降低多种细胞的凋亡和氧化应激水平[13-17],Zhang等[18]发现,褪黑素可以促进小鼠卵巢颗粒细胞的有丝分裂以及卵泡发育,提高卵母细胞质量,并对猪卵母细胞成熟过程中马拉硫磷引起的细胞缺陷有一定保护作用[19]。褪黑素具有分解多种氧化自由基的特性[20],其可以通过受体介导和自生活性这两种途径发挥抗氧化作用,降低体内氧化应激水平。有研究表明,褪黑素能通过与褪黑素Ⅰ型受体(MT1)和褪黑素Ⅱ型受体(MT2)结合,促进抗氧化基因的表达及抗氧化酶的合成,减轻顺铂诱导的小鼠卵巢氧化损伤[21]。此外,褪黑素能够通过减少人卵母细胞的氧化应激来提高受精率[22],受精后人体内高浓度的褪黑素能促进黄体细胞分泌孕酮[23],对胚胎健康发育具有重要意义。关于褪黑素对动物生殖方面影响的文献众多,但其对黄体细胞功能影响方面的研究较少,本研究成功分离培养了牦牛黄体细胞,在细胞层面探讨了褪黑素对牦牛黄体细胞命运、抗氧化性及孕酮分泌的影响,并初步讨论了其对黄体细胞影响的作用机制,为在细胞层面使用褪黑素提高牦牛繁殖性能提供了理论依据。
1 材料与方法 1.1 主要仪器与设备二氧化碳培养箱(Thermo,美国),低温高速离心机(Thermo,美国),超纯水系统(MILLI-Q,法国),荧光定量PCR仪(Bio-Rad,美国),涡旋振荡仪(Stuart,英国),紫外可见分光光度计(岛津,日本);DMEM/F-12培养基(Gibco公司),胎牛血清(Gibco公司),Ⅳ型胶原酶(BioFroxx),胰蛋白酶-EDTA消化液(索莱宝),青霉素-链霉素溶液(索莱宝),TRIzol(Invitrogen)、PrimeScriptTM RT Reagent Kit反转录试剂盒(TaKaRa),ChamQ Universal SYBR qPCR Master Mix(诺唯赞生物科技有限公司),褪黑素(上海麦克林生化有限公司),Cell Counting Kit-8(MCE)、Luzindole(MCE),牛活性氧(ROS)ELISA试剂盒(睿信生物科技有限公司),牛孕酮(PROG)ELISA试剂盒(睿信生物科技有限公司)。
1.2 牦牛黄体细胞的分离与培养牦牛卵巢采自四川成都周边屠宰场,健康成年雌性牦牛被屠宰后,立即用无菌的剪刀和镊子取下牦牛卵巢组织,经含双抗的磷酸缓冲盐溶液(PBS)清洗后,放入加有双抗的生理盐水保温盒中带回实验室处理。牦牛黄体细胞的分离培养参照张文华[24]的操作方法并进行优化。在超净工作台内,用PBS清洗后将黄体组织剪碎,加入约为黄体组织体积4~8倍的0.2% Ⅳ型胶原酶溶液在培养箱中消化。将消化液1 500 r·min-1离心5 min,吸弃上清后用DMEM/F-12悬起沉淀,先后通过200和400目过滤筛,收集滤液再次离心,弃上清后,用含血清和双抗的培养液制成单细胞悬液,接种于细胞培养皿,在38 ℃、5% CO2的培养箱中培养。待细胞生长融合度达到80% 以上时,消化细胞接种至新的培养皿中继续培养。
1.3 黄体细胞增殖、活力检测将原代黄体细胞密度调整为1×10 4个·mL-1,接种于96孔板,38 ℃、5% CO2培养14 h后,更换无血清培养基再培养10 h。更换新的无血清培养基并添加不同浓度的MT,使其终浓度为0(Control)、25、125、250、500 pg·mL-1,并设置空白调零组。分别培养1、2、3、4、5 d后取出96孔板,每孔添加10 μL CCK-8溶液后孵育2 h,用酶标仪测定在450 nm处的吸光度。根据说明书公式计算细胞活力,以吸光度为纵坐标,培养天数为横坐标,绘制细胞生长曲线。
1.4 细胞总RNA提取、cDNA制备及荧光定量PCR用胰蛋白酶消化细胞转移至无酶EP管中,离心,弃上清后向EP管中加入TRIzol溶液,在涡流仪上剧烈振荡以利于破壁。向EP管中加入氯仿,振荡混匀后于冰上静置15 min。4 ℃、12 000 r·min-1离心15 min,吸取200 μL上清液转移到新的无酶EP管中,加入等体积异丙醇,振荡混匀。冰上静置15 min,4 ℃、12 000 r·min-1离心10 min,弃上清留沉淀,用75% DEPC乙醇洗涤沉淀物,4 ℃、7 500 r·min-1离心5 min,再次洗涤获得RNA沉淀,风干后,用DEPC水将其溶解,紫外分光光度计测定RNA的浓度及纯度。按照PrimeScriptTM RT Reagent Kit反转录试剂盒操作说明书对合格RNA样品进行反转录,反应条件:37 ℃ 15 min,85 ℃ 5 s,并对cDNA进行浓度和纯度检测,以合格样品为模板进行qRT-PCR。根据NCBI公布家牛(Bos Taurus)的基因序列,用Primer Premier 5.0进行引物设计(表 1),采用ChamQ Universal SYBR qPCR Maste Mix试剂盒检测黄体细胞中各基因的表达情况,包括:与增殖相关的增殖细胞核抗原(prolifeiating cell nuclear antigen, PCNA)、与凋亡相关的B淋巴细胞瘤-2(B-cell lymphoma-2, BCL-2)、Bcl-2相关X蛋白(Bcl-2 Assaciated X, BAX)、FAS细胞表面死亡受体(Fas cell surface death receptor, FAS),抗氧化相关基因SOD1、SOD2、GPX1、CAT以及孕酮合成相关基因3β羟基类固醇脱氢酶(3β-hydroxysteroid dehydrogenase, HSD3β)、类固醇急性调节蛋白(steroid acute regulation protein, STAR)及胆固醇侧裂分解酶(P450 cholesterol side-chain cleavage enzyme, CYP11A1)。qRT-PCR反应体系为cDNA 1 μL,上、下游引物各0.5 μL,ddH2O 5.5 μL,SYBR Premix Ex TaqTM Ⅱ 7.5 μL。反应条件为:95 ℃预变性4 min;95 ℃变性10 s;60 ℃退火30 s,72 ℃延伸35 s,共40个循环。所有qRT-PCR反应至少做3次重复试验,所得目的基因Ct值用2-△△Ct法计算其相对表达量,并使用SPSS 21.0进行方差分析。
|
|
表 1 qRT-PCR引物序列 Table 1 Primer sequences of qRT-PCR |
二代黄体细胞先后经含血清的培养基和无血清培养基分别培养14及10 h,更换无血清培养基并添加不同浓度的MT,使其终浓度为0(Control)、125、250、500 pg·mL-1,38 ℃、5% CO2培养。采集培养8 h后的细胞培养液,通过牛活性氧(ROS)ELISA试剂盒(灵敏度:最低检测浓度小于1.0 IU·mL-1,检测范围12.5~400 IU·mL-1)检测黄体细胞ROS水平。并进一步比较了不添加褪黑素(Control)、添加250 pg·mL-1 MT处理(250 pg·mL-1 MT)以及250 pg·mL-1 MT和250 pg·mL-1 MT受体抑制剂Luzindole联合处理(250 pg·mL-1 MT+Luzindole)对培养了8 h黄体细胞ROS水平及“1.4”中抗氧化相关基因SOD1、SOD2、GPX1、CAT表达的影响。
1.6 MT及MT受体抑制剂Luzindole对黄体细胞孕酮分泌的影响二代黄体细胞先后经含血清的培养基和无血清培养基分别培养14及10 h,之后更换无血清培养基并添加不同浓度的MT,使其最终浓度为0(Control)、125、250、500 pg·mL-1,置于38 ℃、5% CO2培养箱培养,分别在24及36 h各采集200 μL细胞培养液,使用牛孕酮(PROG)ELISA试剂盒(灵敏度:最低检测浓度小于0.1 ng·mL-1)检测细胞孕酮分泌水平。并进一步比较不添加褪黑素(Control)、添加250 pg·mL-1 MT处理组(250 pg·mL-1 MT) 以及250 pg·mL-1 MT和250 pg·mL-1 MT受体抑制剂Luzindole联合处理组(250 pg·mL-1 MT+ Luzindole)黄体细胞培养24 h后的孕酮分泌水平,并检测3组细胞中的孕酮合成相关基因HSD3β、STAR和CYP11A1 mRNA的表达情况。
1.7 统计学分析所有组别的试验至少设3个重复,试验数据采用SPSS 21.0软件处理,用ANOVA进行显著性检验,SSR法进行多重比较,P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果 2.1 不同浓度MT对牦牛黄体细胞增殖及活力的影响由图 1A可知,Control组1~4 d OD值皆极显著上升(P < 0.01),4 d后OD值无明显变化;而4个MT处理组(25、125、250、500 pg·mL-1 MT)第1~2日OD值极显著上升(P < 0.01),2 d后OD值无明显变化。由此表明,MT对牦牛黄体细胞有促增殖作用,加速细胞进入平台期。由图 1B可知,25、125、250、500 pg·mL-1MT处理48 h后牦牛黄体细胞的活力与Control组相比分别显著升高了16.0%、43.7%、64.0%和34.7%。
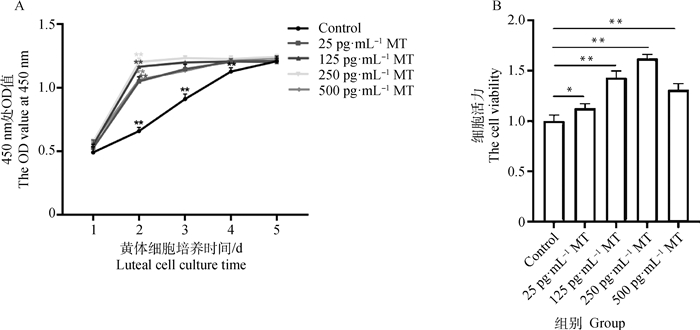
|
A. 不同浓度MT作用下牦牛黄体细胞生长曲线;B. 不同浓度MT作用48 h后牦牛黄体细胞的活力。*表示差异显著(P < 0.05),**表示差异极显著(P < 0.01),下同 A. Growth curves of yak luteal cells treated with different concentrations of MT; B. The viability of yak luteal cells treated with different concentrations of MT for 48 h. * indicates significant difference (P < 0.05), ** indicates extremely significant difference (P < 0.01), the same as below 图 1 不同浓度MT对牦牛黄体细胞增殖及活力的影响 Fig. 1 The effect of different concentrations of MT on proliferation and viability of yak luteal cells |
由图 2可知,由125、250、500 pg·mL-1 MT处理48 h后黄体细胞中增殖相关基因PCNA、抑凋亡基因BCL-2的表达水平皆显著上调,而促凋亡基因BAX、FAS的表达水平皆显著下调。
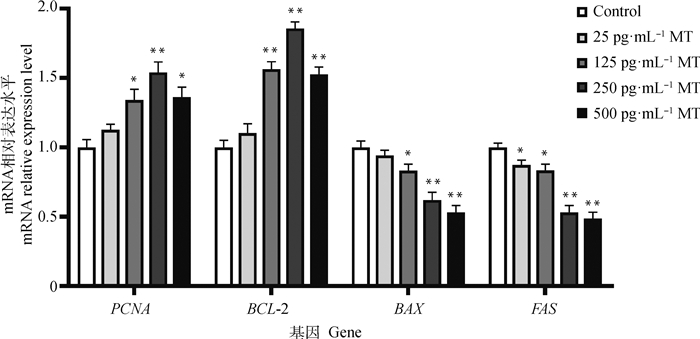
|
图 2 不同浓度MT作用牦牛黄体细胞48 h后增殖、凋亡相关基因表达水平 Fig. 2 The expression levels of proliferation-related gene and apoptosis-related gene in yak luteal cells treated with different concentrations of MT for 48 h |
结果表明,不同浓度的MT处理牦牛黄体细胞8 h后,黄体细胞ROS水平在250和500 pg·mL-1 MT作用下相较于Control组分别显著降低了15.7%和12.8%(图 3A)。然而同时添加250 pg·mL-1 MT和同浓度Luzindole的联合处理组,相较于250 pg·mL-1 MT单独处理组细胞ROS水平显著升高了13.7%(图 3B)。
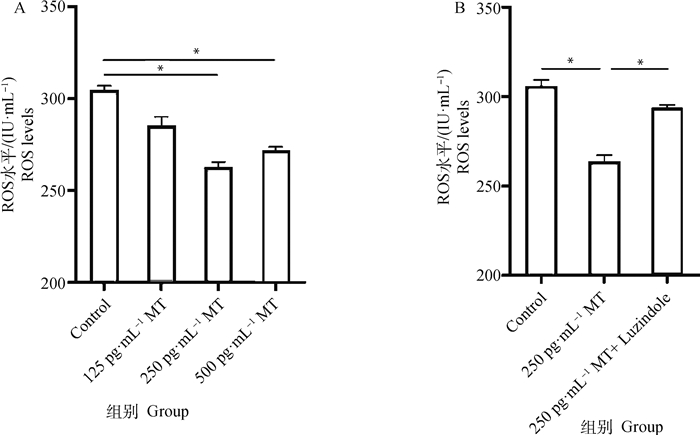
|
A. 不同浓度MT对黄体细胞ROS水平的影响;B. MT及Luzindole联合处理对黄体细胞ROS水平的影响 A. The effect of different concentrations of melatonin on the level of ROS in luteal cells; B. Effect of co-treatment with MT and Luzindole on ROS level in luteal cells 图 3 MT及MT受体抑制剂Luzindole对牦牛黄体细胞ROS水平的影响 Fig. 3 Effect of MT and MT receptor inhibitor Luzindole on ROS levels in yak luteal cells |
由图 4可知,250 pg·mL-1 MT组与Control组相比SOD1表达量无显著差异,SOD2、GPX1和CAT表达量分别极显著上调了41.0%、80.0% 和76.2%;250 pg·mL-1 MT+Luzindole组与250 pg·mL-1 MT组相比,SOD1表达量无显著差异,SOD2、GPX1和CAT的表达量分别显著下调了20.3%、31.7%和33.2%。

|
图 4 MT及Luzindole联合处理对牦牛黄体细胞中部分抗氧化相关基因表达的影响 Fig. 4 The effect of co-treatment with MT and Luzindole on the expression of some antioxidant-related genes in yak luteal cells |
由图 5A可见125、250和500 pg·mL-1 MT组在分别作用24、36 h后黄体细胞孕酮水平皆显著高于Control组,且250 pg·mL-1 MT处理组细胞分泌的孕酮水平显著高于其他3组。由图 5B可见添加MT处理后黄体细胞的孕酮分泌水平极显著升高了26.6%。而应用Luzindole联合处理时,细胞孕酮水平显著降低了19.6%。

|
A. 不同浓度MT作用不同时间后黄体细胞分泌孕酮的水平;B. MT和Luzindole联合作用对黄体细胞孕酮分泌的影响 A. The level of progesterone secreted by the luteal cells after the treatment of different concentrations of melatonin for different time; B. The effect of co-treatment with MT and Luzindole on progesterone secretion in yak luteal cells 图 5 MT及其受体抑制剂Luzindole对牦牛黄体细胞孕酮分泌水平的影响 Fig. 5 Effect of MT and its receptor inhibitor Luzindole on progesterone secretion in yak luteal cells |
由图 6可知,添加MT后对孕酮合成相关基因HSD3β表达量无显著影响,而STAR和CYP11A1表达量分别极显著上调了86.3%和99.7%;用同浓度MT及Luzindole处理后,与MT单独处理组比较,发现HSD3β表达量无显著差异,而STAR 和CYP11A1表达量分别极显著下调了28.0%和37.0%。
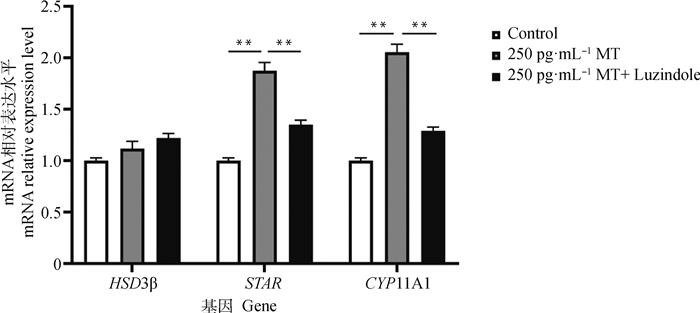
|
图 6 MT和Luzindole作用联合处理对黄体细胞孕酮合成相关基因表达的影响 Fig. 6 The effect of co-treatment with MT and Luzindole on the expression of progesterone synthesis-related genes in yak luteal cells |
黄体细胞是雌性动物卵巢中重要的细胞之一,对动物的繁殖生理具有重要调控作用。其主要功能是通过分泌孕酮作用于子宫平滑肌,使子宫肌纤维的兴奋性降低,减少收缩,减弱母体的免疫反应能力,使胚胎顺利着床[25],从而减少母畜发生流产,在维持妊娠方面起到核心作用[26]。因此,维持黄体细胞的正常功能是提高动物生产率的重要手段之一。
本试验通过添加不同浓度MT处理黄体细胞,发现25~500 pg·mL-1的MT均能加速细胞增殖进入平台期,对细胞活力检测发现,不同浓度MT处理48 h后黄体细胞活力皆有显著升高,推测MT对黄体细胞的增殖能力具有促进作用。已有多篇文献报道了类似的结果。有研究证实,MT会影响大鼠、仓鼠及山羊等动物支持细胞的生长、增殖、能量代谢和氧化状态[27],添加外源性MT通过抑制促凋亡基因BAX的表达而对山羊精原干细胞发挥抗凋亡作用,且显著降低了线粒体肿胀和空泡,并抑制了细胞色素C的释放和caspase-3的活化[28]。此外,MT还可直接作用于睾丸,改善氧化应激、细胞凋亡和炎症引起的睾丸损伤[29-31]。Romeu等[32]在MT对松果体切除雌性大鼠卵巢组织形态及PCNA表达的影响研究中发现,MT可能会下调卵巢间质细胞中PCNA的表达,上调黄体细胞中PCNA的表达,从而促进黄体生成,增加卵巢中黄体的数量。本研究检测了不同浓度MT处理牦牛黄体细胞后PCNA、BCL-2及BAX、FAS的表达情况,结果表明,MT浓度在125~500 pg·mL-1这一范围内能够显著促进PCNA、BCL-2并抑制BAX、FAS的表达,因此推测,MT对牦牛黄体细胞的促进作用是通过上调PCNA、BCL-2的表达以及下调BAX、FAS的表达实现的。
ROS是机体在有氧代谢过程中产生的一类富含氧的化学活性分子,能够引起氧化应激,导致DNA损伤和细胞凋亡[33-34]。已有多个研究表明,褪黑素能够有效清除机体内的ROS,例如给小鼠长期饲喂MT可降低小鼠卵巢中ROS水平,减缓卵巢的氧化损伤,并能有效提高抗氧化基因CAT、GPX1、GLRX1、SOD2和PRDX3的表达[35]。Mukherjee等[36]研究发现,MT可以提高金色仓鼠生殖细胞中抗氧化酶SOD、CAT和GPX1的水平,从而减弱地塞米松诱导的睾丸氧化应激,此外,MT可以通过降低8-OHdG水平缓解小鼠颗粒细胞的DNA损伤和氧化应激[37],本研究发现,MT可以增加SOD、GPX和CAT表达水平,并有效清除牦牛黄体细胞ROS,因此推测,MT能够通过促进细胞中抗氧化基因的表达进而清除细胞内的ROS。据报道,MT可以通过膜受体MT1和MT2形成同源二聚体和异源二聚体进而增强或抑制下游信号通路的活性[38],例如MT经受体介导后,可激活Nrf2信号传导途径,从而减轻氧化应激和炎症反应,对颅脑损伤提供一定的保护作用[39]。为研究褪黑素在黄体功能中的受体依赖性机制,本试验培养的黄体细胞中使用了针对MT1和MT2受体抑制剂Luzindole,Luzindole是一种竞争性的MT2受体拮抗剂,可同时抑制MT1和MT2的表达[40]。本研究中应用MT与Luzindole联合处理后发现,相较于MT单独处理组,联合处理组细胞ROS水平回升,同时SOD、GPX和CAT的表达水平显著下调,表明MT对牦牛黄体细胞的抗氧化作用可能依赖于受体介导,其具体的分子机制有待后续进一步研究。
黄体分泌的孕酮是维持妊娠的必要物质,而ROS是影响孕酮分泌的众多因素之一。在敲除小鼠抗氧化基因SOD1的研究中发现,SOD1缺失小鼠黄体体积显著减小,且黄体周围区域超氧化物生成显著增加,体内孕酮水平降低[41]。Carlson等[42]报道称,ROS可以在生殖周期中控制黄体细胞产生孕酮,并在周期结束时抑制孕酮合成。再者,孕酮合成过程受到STAR、HSD3β和CYP11A1等关键蛋白的调节作用[43],例如ROS可以诱导转录因子GATA4和GATA6的下调来抑制STAR表达,从而降低孕酮分泌水平[44]。由此可见,降低黄体细胞的ROS水平对黄体功能的维持十分重要。作为一种常见的抗氧化剂,已有多个研究报道MT与孕酮的分泌有关。有研究发现,MT有促进猪黄体细胞分泌孕酮的作用[45],Fang等[46]研究发现,人卵泡液中的MT水平与血清中的孕酮水平呈正相关,MT通过上调孕酮合成关键基因STAR的表达进而诱导人颗粒黄体细胞中孕酮的产生。在本研究中,通过添加MT处理牦牛黄体细胞,发现MT促进了SOD、GPX和CAT的表达,同时降低黄体细胞ROS水平,并且对细胞分泌孕酮有促进作用,说明细胞抗氧化性能的提高对清除ROS有重要意义,而降低细胞ROS水平,减少氧化应激发生有益于细胞分泌孕酮。然而在同一MT浓度下,随着培养时间的延长,孕酮含量增加,MT对黄体细胞分泌孕酮的促进作用并不呈现剂量依赖性。本研究中,MT还提高了细胞孕酮合成相关基因STAR和CYP11A1 mRNA的表达量,但对HSD3β mRNA无显著影响,推测可能是HSD3β的表达不受MT的影响。在同时添加MT及Luzindole处理黄体细胞后,孕酮水平显著降低,同时STAR和CYP11A1表达量显著下调,这与Zhang等[47]在猪妊娠黄体中的研究结果一致。由此说明,MT能促进牦牛黄体细胞分泌孕酮,且MT对孕酮、STAR和CYP11A1表达的影响可能是通过与MT1和MT2受体介导的,因为这种促进作用在添加Luzindole处理后被减弱。
4 结论本研究发现,MT可以通过促进细胞PCNA、BCL-2并抑制BAX、FAS的表达影响牦牛黄体细胞的增殖,MT通过提高细胞抗氧化相关基因SOD2、CAT及GPX1的表达,从而降低细胞ROS水平,同时提高孕酮分泌水平,且孕酮分泌量的增加与MT促进细胞STAR和CYP11A1的表达有关。此外,MT对细胞的作用依赖于与细胞膜上的MT1和MT2受体结合而发挥其生物学功能。
| [1] |
XIONG X R, LAN D L, LI J, et al. Supplementation of cilostazol during in vitro maturation enhances the meiosis and developmental competence of yak oocytes by influencing cAMP content and mRNA expression[J]. Anim Reprod Sci, 2017, 186: 21-30. DOI:10.1016/j.anireprosci.2017.08.013 |
| [2] |
CHAUBE S K, PRASAD P V, THAKUR S C, et al. Hydrogen peroxide modulates meiotic cell cycle and induces morphological features characteristic of apoptosis in rat oocytes cultured in vitro[J]. Apoptosis, 2005, 10(4): 863-874. DOI:10.1007/s10495-005-0367-8 |
| [3] |
TIWARI M, CHAUBE S K. Moderate increase of reactive oxygen species triggers meiotic resumption in rat follicular oocytes[J]. J Obstet Gynaecol Res, 2016, 42(5): 536-546. DOI:10.1111/jog.12938 |
| [4] |
FUJⅡ J, IUCHI Y, OKADA F. Fundamental roles of reactive oxygen species and protective mechanisms in the female reproductive system[J]. Reprod Biol Endocrinol, 2005, 3(1): 43. DOI:10.1186/1477-7827-3-43 |
| [5] |
MAO X B, GU C S, CHEN D W, et al. Oxidative stress-induced diseases and tea polyphenols[J]. Oncotarget, 2017, 8(46): 81649-81661. DOI:10.18632/oncotarget.20887 |
| [6] |
DEVINE P J, PERREAULT S D, LUDERER U. Roles of reactive oxygen species and antioxidants in ovarian toxicity[J]. Biol Reprod, 2012, 86(2): 27. |
| [7] |
TALUKDER S, INGENHOFF L, KERRISK K L, et al. Plasma oxidative stress biomarkers and progesterone profiles in a dairy cow diagnosed with an ovarian follicular cyst[J]. Vet Q, 2014, 34(2): 113-117. DOI:10.1080/01652176.2014.953264 |
| [8] |
AL-GUBORY K H, GARREL C, FAURE P, et al. Roles of antioxidant enzymes in corpus luteum rescue from reactive oxygen species-induced oxidative stress[J]. Reprod Biomed Online, 2012, 25(6): 551-560. DOI:10.1016/j.rbmo.2012.08.004 |
| [9] |
闫昭明, 郭秋平, 仲银召, 等. 茶多酚的生物学特性及其在畜牧生产中的应用[J]. 动物营养学报, 2019, 31(4): 1525-1532. YAN Z M, GUO Q P, ZHONG Y Z, et al. Tea polyphenols functions and their application in animal production[J]. Chinese Journal of Animal Nutrition, 2019, 31(4): 1525-1532. (in Chinese) |
| [10] |
TAMURA H, KAWAMOTO M, SATO S, et al. Long-term melatonin treatment delays ovarian aging[J]. J Pineal Res, 2017, 62(2): e12381. DOI:10.1111/jpi.12381 |
| [11] |
CARLONI S, FAVRAIS G, SALIBA E, et al. Melatonin modulates neonatal brain inflammation through endoplasmic reticulum stress, autophagy, and miR-34a/silent information regulator 1 pathway[J]. J Pineal Res, 2016, 61(3): 370-380. DOI:10.1111/jpi.12354 |
| [12] |
CHEN Z, LEI L J, WEN D, et al. Melatonin attenuates palmitic acid-induced mouse granulosa cells apoptosis via endoplasmic reticulum stress[J]. J Ovarian Res, 2019, 12(1): 43. DOI:10.1186/s13048-019-0519-z |
| [13] |
LI R Y, LUO X, LI L B, et al. The protective effects of melatonin against oxidative stress and inflammation induced by acute cadmium exposure in mice testis[J]. Biol Trace Elem Res, 2016, 170(1): 152-164. DOI:10.1007/s12011-015-0449-6 |
| [14] |
YANG F X, LI L, CHEN K L, et al. Melatonin alleviates β-zearalenol and HT-2 toxin-induced apoptosis and oxidative stress in bovine ovarian granulosa cells[J]. Environ Toxicol Pharmacol, 2019, 68: 52-60. DOI:10.1016/j.etap.2019.03.005 |
| [15] |
HIBAOUI Y, ROULET E, RUEGG U T. Melatonin prevents oxidative stress-mediated mitochondrial permeability transition and death in skeletal muscle cells[J]. J Pineal Res, 2009, 47(3): 238-252. DOI:10.1111/j.1600-079X.2009.00707.x |
| [16] |
HE R J, CUI M, LIN H, et al. Melatonin resists oxidative stress-induced apoptosis in nucleus pulposus cells[J]. Life Sci, 2018, 199: 122-130. DOI:10.1016/j.lfs.2018.03.020 |
| [17] |
LV Y H, ZHANG P F, GUO J Y, et al. Melatonin protects mouse spermatogonial stem cells against hexavalent chromium-induced apoptosis and epigenetic histone modification[J]. Toxicol Appl Pharmacol, 2018, 340: 30-38. DOI:10.1016/j.taap.2017.12.017 |
| [18] |
ZHANG L, ZHANG Z Z, WANG J, et al. Melatonin regulates the activities of ovary and delays the fertility decline in female animals via MT1/AMPK pathway[J]. J Pineal Res, 2019, 66(3): e12550. DOI:10.1111/jpi.12550 |
| [19] |
CHEN L, ZHANG J J, ZHANG X, et al. Melatonin protects against defects induced by malathion during porcine oocyte maturation[J]. J Cell Physiol, 2020, 235(3): 2836-2846. DOI:10.1002/jcp.29189 |
| [20] |
DAIR E L, SIMOES R S, SIMÕES M J, et al. Effects of melatonin on the endometrial morphology and embryo implantation in rats[J]. Fertil Steril, 2008, 89(5): 1299-1305. DOI:10.1016/j.fertnstert.2007.03.050 |
| [21] |
BARBERINO R S, MENEZES V G, RIBEIRO A E A S, et al. Melatonin protects against cisplatin-induced ovarian damage in mice via the MT1 receptor and antioxidant activity[J]. Biol Reprod, 2017, 96(6): 1244-1255. DOI:10.1093/biolre/iox053 |
| [22] |
TAMURA H, TAKASAKI A, MIWA I, et al. Oxidative stress impairs oocyte quality and melatonin protects oocytes from free radical damage and improves fertilization rate[J]. J Pineal Res, 2008, 44(3): 280-287. DOI:10.1111/j.1600-079X.2007.00524.x |
| [23] |
RAHMAN S A, BIBBO C, OLCESE J, et al. Relationship between endogenous melatonin concentrations and uterine contractions in late third trimester of human pregnancy[J]. J Pineal Res, 2019, 66(4): e12566. DOI:10.1111/jpi.12566 |
| [24] |
张文华. 催产素对牛黄体细胞中突触素表达的影响[D]. 杨凌: 西北农林科技大学, 2012. ZHANG W H. Effect of oxytocin on the expression of SYP in bovine luteal cells[D]. Yangling: Northwest A & F University, 2012. (in Chinese) |
| [25] |
MIYAMOTO A, SHIRASUNA K, SHIMIZU T, et al. Regulation of corpus luteum development and maintenance: specific roles of angiogenesis and action of prostaglandin F2α[J]. Soc Reprod Fertil Suppl, 2010, 67: 289-304. |
| [26] |
BHURKE A S, BAGCHI I C, BAGCHI M K. Progesterone-regulated endometrial factors controlling implantation[J]. Am J Reprod Immunol, 2016, 75(3): 237-245. DOI:10.1111/aji.12473 |
| [27] |
FRUNGIERI M B, CALANDRA R S, ROSSI S P. Local actions of melatonin in somatic cells of the testis[J]. Int J Mol Sci, 2017, 18(6): 1170. DOI:10.3390/ijms18061170 |
| [28] |
FENG T Y, LI Q, REN F, et al. Melatonin protects goat spermatogonial stem cells against oxidative damage during cryopreservation by improving antioxidant capacity and inhibiting mitochondrial apoptosis pathway[J]. Oxid Med Cell Longev, 2020, 2020: 5954635. |
| [29] |
GUO Y, SUN J Y, LI T, et al. Melatonin ameliorates restraint stress-induced oxidative stress and apoptosis in testicular cells via NF-κB/iNOS and Nrf2/HO-1 signaling pathway[J]. Sci Rep, 2017, 7(1): 9599. DOI:10.1038/s41598-017-09943-2 |
| [30] |
BAHRAMI N, GOUDARZI M, HOSSEINZADEH A, et al. Evaluating the protective effects of melatonin on di(2-ethylhexyl) phthalate-induced testicular injury in adult mice[J]. Biomed Pharmacother, 2018, 108: 515-523. DOI:10.1016/j.biopha.2018.09.044 |
| [31] |
MOHAMMADGHASEMI F, JAHROMI S K. Melatonin ameliorates testicular damages induced by nicotine in mice[J]. Iran J Basic Med Sci, 2018, 21(6): 639-644. |
| [32] |
ROMEU L R G, DA MOTTA E L A, MAGANHIN C C, et al. Effects of melatonin on histomorphology and on the expression of steroid receptors, VEGF, and PCNA in ovaries of pinealectomized female rats[J]. Fertil Steril, 2011, 95(4): 1379-1384. DOI:10.1016/j.fertnstert.2010.04.042 |
| [33] |
LUO X, JIA S J, MA Q L, et al. Suppressive effects of subchronic aluminum overload on the splenic immune function may be related to oxidative stress in mice[J]. Biol Trace Elem Res, 2014, 157(3): 249-255. DOI:10.1007/s12011-014-9888-8 |
| [34] |
WANG X, SHARMA R K, SIKKA S C, et al. Oxidative stress is associated with increased apoptosis leading to spermatozoa DNA damage in patients with male factor infertility[J]. Fertil Steril, 2003, 80(3): 531-535. DOI:10.1016/S0015-0282(03)00756-8 |
| [35] |
宋超. 褪黑素在延缓昆明小鼠卵巢衰老中的作用研究[D]. 杨凌: 西北农林科技大学, 2019. SONG C. Effect of melatonin on delaying the ovarian aging in Kunming mice[D]. Yangling: Northwest A & F University, 2019. (in Chinese) |
| [36] |
MUKHERJEE A, HALDAR C, VISHWAS D K. Melatonin prevents dexamethasone-induced testicular oxidative stress and germ cell apoptosis in golden hamster, Mesocricetus auratus[J]. Andrologia, 2015, 47(8): 920-931. |
| [37] |
TANABE M, TAMURA H, TAKETANI T, et al. Melatonin protects the integrity of granulosa cells by reducing oxidative stress in nuclei, mitochondria, and plasma membranes in mice[J]. J Reprod Dev, 2015, 61(1): 35-41. DOI:10.1262/jrd.2014-105 |
| [38] |
HARDELAND R. Melatonin: Signaling mechanisms of a pleiotropic agent[J]. Biofactors, 2009, 35(2): 183-192. DOI:10.1002/biof.23 |
| [39] |
WANG J M, JIANG C, ZHANG K, et al. Melatonin receptor activation provides cerebral protection after traumatic brain injury by mitigating oxidative stress and inflammation via the Nrf2 signaling pathway[J]. Free Radic Biol Med, 2019, 131: 345-355. DOI:10.1016/j.freeradbiomed.2018.12.014 |
| [40] |
JUSZCZAK M, ROSZCZYK M, KOWALCZYK E, et al. The influence of melatonin receptors antagonists, luzindole and 4-phenyl-2-propionamidotetralin (4-P-PDOT), on melatonin-dependent vasopressin and adrenocorticotropic hormone (ACTH) release from the rat hypothalamo-hypophysial system.In vitro and in vivo studies[J]. J Physiol Pharmacol, 2014, 65(6): 777-784. |
| [41] |
NODA Y, OTA K, SHIRASAWA T, et al. Copper/zinc superoxide dismutase insufficiency impairs progesterone secretion and fertility in female mice[J]. Biol Reprod, 2012, 86(1): 1-8. |
| [42] |
CARLSON J C, WU X M, SAWADA M. Oxygen radicals and the control of ovarian corpus luteum function[J]. Free Radic Biol Med, 1993, 14(1): 79-84. DOI:10.1016/0891-5849(93)90511-R |
| [43] |
李曼曼, 于昊, 薛洋, 等. 生殖激素对山羊颗粒细胞孕酮合成的影响[J]. 中国兽医学报, 2020, 40(8): 1652-1659. LI M M, YU H, XUE Y, et al. Effects of reproductive hormones on progesterone synthesis in granulosa cells of goats[J]. Chinese Journal of Veterinary Science, 2020, 40(8): 1652-1659. (in Chinese) |
| [44] |
QU X L, YAN L Y, GUO R H, et al. ROS-induced GATA4 and GATA6 downregulation inhibits StAR expression in LPS-treated porcine granulosa-lutein cells[J]. Oxid Med Cell Longev, 2019, 2019: 5432792. |
| [45] |
王振宇. 褪黑素对妊娠期猪黄体细胞孕酮分泌的调节作用及机制研究[D]. 杨凌: 西北农林科技大学, 2017. WANG Z Y. The regulation and mechanism of melatonin on progesterone secretion in porcine corpus luteum cells[D]. Yangling: Northwest A & F University, 2017. (in Chinese) |
| [46] |
FANG L L, LI Y R, WANG S J, et al. Melatonin induces progesterone production in human granulosa-lutein cells through upregulation of StAR expression[J]. Aging (Albany NY), 2019, 11(20): 9013-9024. |
| [47] |
ZHANG W L, WANG Z Y, ZHANG L, et al. Melatonin stimulates the secretion of progesterone along with the expression of cholesterol side-chain cleavage enzyme (P450 scc) and steroidogenic acute regulatory protein (StAR) in corpus luteum of pregnant sows[J]. Theriogenology, 2018, 108: 297-305. DOI:10.1016/j.theriogenology.2017.12.026 |
(编辑 范子娟)



