2. 中国农业科学院北京畜牧兽医研究所, 北京 100193
2. Institute of Animal Science, Chinese Academy of Agricultural Sciences, Beijing 100193, China
“民以食为天,食以味为先”,随着人民生活水平的提高,人们对于肉质与风味的要求也越来越高,尤其是对于禽肉的要求更为突出。通常认为,人们首次购买肉时主要关注的是肉色和质地,但之后的回购主要在于其口感和风味品质[1]。风味品质是肉类的主要食用品质之一,主要涉及到味道、气味等方面,它是消费者评价肉质最直观但又难以量化的指标[2]。目前,主流的肉鸭主要有快大型肉鸭和优质小体型肉鸭。大型肉鸭体型大,胸肌率高,但人们普遍认为肉质风味不好。优质小体型肉鸭的体型小,肉质风味鲜美[3]。但目前对于导致两种鸭肉风味产生差异的挥发性风味物质还属于未知状态,采用科学仪器准确评定禽肉风味品质,对于提高禽肉品质,培育生长速度与风味品质均衡的家禽品种具有重要的科学与产业价值。
熟化后肉品风味物质的形成主要来自加热反应,风味前体物质在加热条件下发生热降解反应、美拉德反应、脂质氧化等反应从而产生不同的风味物质[4-5]。研究证明,仅美拉德反应就可产生上千种的风味物质,脂质氧化也可以产生百余种挥发性物质,如醛类、硫化物等。这些物质通常又混杂在一起产生风味,使得风味研究更为复杂[6-7]。
固相微萃取-气相色谱-质谱(SPME-GC-MS)联用技术经常用于风味物质的检测,在对挥发性物质的定性定量检测方面尤为出色[8],本研究即采用该方法检测北京鸭、连城白鸭和野鸭胸肌,以期找到不同品种鸭胸肌的主要挥发性风味物质。同时,随着技术的快速发展,电子鼻等仿生设备也逐渐成熟,其原理是模仿人类鼻子感知、识别气味。基于内部的气味传感器阵列,对不同的挥发性物质进行检测[9]。二者都是对挥发性物质进行检测,不同的是,电子鼻是对风味宏观的一种检测,其内部的气味传感器可特异性的识别一类(如醛、醇类)物质,而SPME-GC-MS灵敏度高,可直接对挥发性风味物质进行定性检测。利用电子鼻进行仿生测定,结合SPME-GC-MS结果对3种鸭胸肉挥发性风味物质作出一个综合性的评价。
1 材料与方法 1.1 材料与设备北京鸭、野鸭、连城白鸭胸肌采集自中国农业科学院北京畜牧兽医研究所昌平实验基地;50/30 μm DVB/CAR/PDMS固相微萃取头(美国Supelco公司);气相色谱静电场轨道阱质谱仪Q Exactive GC Orbitrap(Thermofisher Scientific/赛默飞世尔);PEN 3电子鼻(德国AIRSENSE公司);2-甲基-2-庚酮、C 7-C 40正构烷烃(美国Sigma-Aldrich公司)。
1.2 方法1.2.1 样品准备 试验分为3组,以9周龄北京鸭、连城白鸭、野鸭为材料,每组各取5块相同位置胸肌,每个样品设计3个重复。样品储存在-20 ℃冰箱中,检测前放置在4 ℃冰箱中过夜解冻。剔除筋膜,用蒸煮袋包装后,在水浴锅中80 ℃条件下煮30 min,然后放在冰水中快速降温。最后在液氮中研磨成粉末状。
1.2.2 固相微萃取气质联用检测条件 取2 g研磨后的胸肌样品于20 mL顶空瓶中,加入10 μL内标,以0.5 μg·μL-12-甲基-3-庚酮为内标。
使用固相微萃取的方法提取鸭胸肌中的挥发性化合物。置于55 ℃孵育20 min,之后插入固相微萃取头,在55 ℃条件下萃取40 min,钻取速度为40 mm·s-1。最后仪器自动在气相色谱进样口完成进样,条件为55 ℃解吸附40 min。色谱柱:VF-WAXms色谱柱(60 m×0.25 mm×0.25 μm)。
升温程序:起始温度40 ℃(保持2 min),以4 ℃·min-1的速度升到230 ℃,保持5 min。载气为He,载气流量为1 mL·min-1,进样口温度为250 ℃,采用分流模式,分流比为5∶1。
质谱条件:EI离子源,电子能量为70 eV,传输线温度250 ℃,离子源温度280 ℃,采用全扫描模式,质量扫描范围30~400 m·z-1。
1.3 定性定量分析定性:通过Xcalibur软件系统完成试验数据处理,化合物的定性通过与NIST质谱数据库软件NSIT MS Search2.3中标准质谱图检索对比,同时计算各个化合物的Kovats保留指数RI值,结合正匹配SI值、反匹配RSI值3种方法进行确定。RI值相差20(含)以内,RI、RSI大于等于800(最大值为1 000)。
保留指数计算公式[10]:
| $ \begin{array}{l} \;\;\;{\rm{RI = 100}} \times \{ {\rm{n + }}\left[ {{\rm{t}}\left( {\rm{i}} \right){\rm{ - t}}\left( {\rm{n}} \right)} \right]{\rm{/}}[{\rm{t}}\left( {{\rm{n + 1}}} \right){\rm{ - t}}\\ \left( {\rm{n}} \right)]\} \end{array} $ |
式中,n为碳数,t(i)为待测组分的调整保留时间;t(n)为具有n个碳原子的正构烷烃的调整保留时间;t(n+1)为具有(n+1)个碳原子的正构烷烃的调整保留时间。
定量方法:采用内标法,以2-甲基-3-庚酮为内标。计算公式如下:
| $ {\rm{Ci = Cis \times }}\frac{{{\rm{Ai}}}}{{{\rm{Ais}}}} $ |
式中,Ci为待测风味化合物含量;Cis为内标物含量;Ai为待测风味化合物色谱峰面积;Ais为内标物色谱峰面积。
1.4 气味活度值(OAV)[11]计算公式如下:
| ${\rm{OAV = }}\frac{{\rm{P}}}{{\rm{T}}} $ |
式中,P为风味化合物的含量,μg·g-1;T为该化合物在空气中的气味阈值,mg·kg-1。
相对气味活度值(ROAV)计算公式如下:
| $ {\rm{ROAV = 100 \times }}\frac{{{\rm{Cri}}}}{{{\rm{Cmax}}}}{\rm{ \times }}\frac{{{\rm{Tmax}}}}{{{\rm{Ti}}}} $ |
式中,Cri为各组分的相对含量,%;Cmax为对样品整体风味贡献最大物质的相对含量,%;Ti为各组分的感觉阈值,μg·g-1;Tmax为对样品整体风味贡献最大的物质的感觉阈值,μg·g-1。
1.5 电子鼻检测取0.6 g样品于10 mL顶空瓶中,检测前置于水浴锅中60 ℃加热10 min,室温冷却平衡30 min后进行检测,检测时间为500 s。
2 结果 2.1 挥发性风味物质的种类分析在“1.2”测定方法和试验条件下,挥发性风味物质经过SPME-GC-MS检测,根据NIST谱图检索对比对其定性,并按照内标法得出各化合物的相对含量。通过试验数据分析处理,3种鸭肉所检测到的挥发性物质种类大致一致,但物质含量有较大差异(表 1)。3个品种鸭胸肌共检测出104种挥发性风味物质,醛类、醇类、酮类、呋喃占总风味物质含量比重最大,在70%以上(表 2)。
|
|
表 1 3种鸭胸肌挥发性物质成分种类及相对含量 Table 1 Categories and relative contents of volatile components in 3 breeds duck breast muscle |
|
|
表 2 3种鸭胸肌各挥发性物质占比 Table 2 Ratio of volatile substances in breast muscle of 3 breeds ducks |
如图 1所示,北京鸭的挥发性物质含量最高,连城白鸭次之,野鸭最少。同时,在挥发性物质种类方面,醛、醇、酮、呋喃类物质在3种鸭胸肌有较大差异。同时,3种鸭胸肌检测出的相对物质总量也有较大差异,这可能是3种鸭胸肌风味产生差异的原因之一。由表 1可知,北京鸭、连城白鸭、野鸭依次降低,主要差异为醛、醇、酮、呋喃类物质,而这几种物质主要来自于脂质氧化,因此3种鸭胸肌脂质含量应该是逐渐降低的,同时这也符合3种鸭本身的特性。北京鸭与连城白鸭相比,主要在于1-辛烯-3-醇的含量差异,这说明1-辛烯-3-醇是北京鸭风味组成之一。而野鸭检测出的醛、醇、酮、呋喃类等一些对风味有重要贡献的物质含量要明显低于北京鸭与连城白鸭,与传统认知的野鸭的风味更丰富不同,猜想可能有以下几点原因:1) 饲料对鸭肉风味的影响十分重要,带有“野味”的野鸭以采食鱼虾虫为主,并伴随有大量的运动,肉中矿物质元素丰富;而人工养殖的野鸭以喂养饲料为主,活动范围也受限制,可能导致“野味”丧失[12]。2) 有研究表明,食品的风味是多种物质混合在一起的复杂反应,且不同气味的物质具有相乘或阻碍作用[13],仅以某种成分单独气味评价是不可靠的,还需从整体上去评价,每类物质在肉中的比例不同风味也会不同。3) 肉品风味包括气味、滋味等,气味为本试验检测出的挥发性物质,而滋味为非挥发性物质,包括酸、甜、苦、咸、鲜等味道,大多数芳香化合物具有亲脂性的特点,挥发性较低[14]。因此,以单一的气味评价“野味”是不够全面的,因此,此试验结果说明,3个品种鸭胸肌的风味差异还需结合非挥发性物质进一步研究。
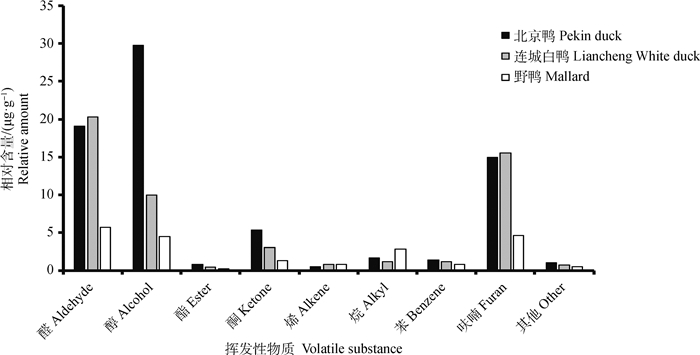
|
图 1 3种鸭胸肌挥发性成分含量比较 Fig. 1 Comparison of volatile substances contents of three kinds of duck breast muscle |
如图 2所示,在挥发性风味物质组成上,3种鸭胸肌物质组成种类主要是醛类、醇类、呋喃3类。北京鸭胸肌中挥发性物质醇类最多,其次是醛类和呋喃,醇类占比40.01%。而连城白鸭和野鸭胸肌中挥发性物质占比以醛类最高,其次是呋喃和醇类物质。醛类物质阈值低,在肉中的比例越高,对鸭胸肌风味的贡献越大,这一点与上述猜想相符合。对比3种鸭胸肌挥发性物质组成,可以发现北京鸭比其他两种鸭的醇类含量占比要大,这可能是因为北京鸭作为快大型肉鸭,脂肪沉积较多,而醇类主要来源于脂肪的氧化。连城白鸭是公认的肉质好的品种,可以看出其醛类、呋喃类物质占比大,而醛类和呋喃类物质阈值较低,对于风味贡献较大。

|
图 2 3种鸭胸肌挥发性物质组成比较 Fig. 2 Comparison of volatile substance composition of three kinds of duck breast muscle |
研究发现,不仅挥发性风味物质的种类会影响鸭肉的风味,其含量也是影响鸭肉风味的重要因素,且含量相比种类对鸭肉风味的影响更加重要,这和鸡肉中检测到的己醛和1-辛烯-3-醇的相对含量结果相似[15]。通过对比3种肉鸭胸肌挥发性风味物质的种类及相对含量发现,3种肉鸭挥发性物质主要成分都是由醛、醇、呋喃、酮4类物质构成。同时,此4类物质的嗅觉阈值较低,对于风味的贡献较大,但由于各类物质相对含量的差异导致风味的不同。
2.2 鸭胸肌中主要风味物质的鉴定挥发性风味物质对肉质的影响不仅与化合物的含量有关,还与其嗅觉阈值有关。根据“1.4”公式计算OAV、ROAV值,结果如表 3所示。
|
|
表 3 3种鸭胸肌挥发性物质OAV值、ROAV值、阈值及气味特征 Table 3 OAV values, ROAV values, thresholds and odor characteristics of volatile substances of three kinds of duck breast muscle |
在OAV值计算时,OAV>1,说明该物质对于整体风味有贡献。通过OAV结果来看,OAV>1的物质,北京鸭有39种,连城白鸭有41种,野鸭有35种。
如图 3所示,共有物质有32种,每种肉鸭都有一种独有物质,北京鸭为异戊醇(OAV=2.20),连城白鸭为月桂醇(OAV=1.84),野鸭为甲硫醇(OAV=10.15)。这几种特有物质的OAV相对较小,对于物质的风味贡献相对较小。由表 3可知,32种共有物质OVA较大,对于鸭肉挥发性风味整体贡献较大。因此,鸭胸肌肉的风味基本上由这共有的32种物质提供。
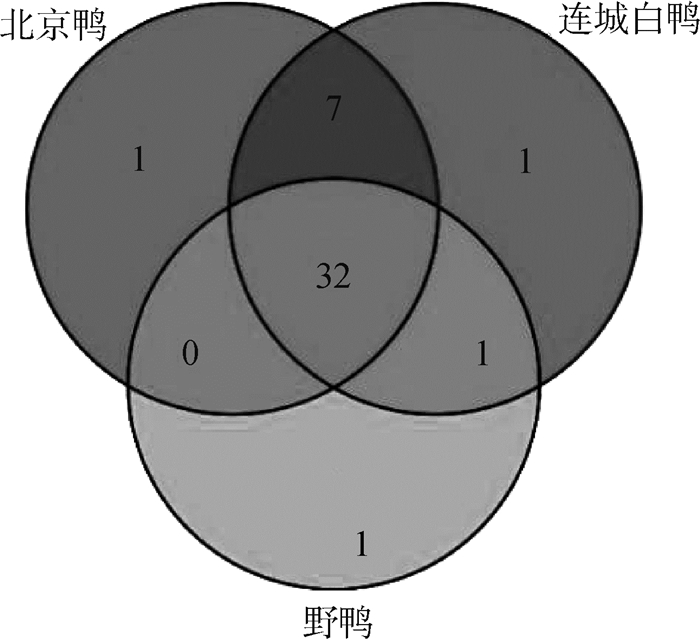
|
图 3 3种鸭胸肌挥发性物质韦恩图 Fig. 3 Venn diagram of volatile substances in three kinds of breast muscle of ducks |
在计算挥发性风味物质的相对气味活度值(ROAV)时,将样品中检测到的对风味贡献最大的组分的ROAV赋值为100,其余按照“1.4”的公式计算。通过ROAV的结果可以清晰的看到对各个品种鸭胸肌风味贡献程度的物质。从表 3可以看出,3种鸭胸肉的主要风味物质种类基本一致,但同种物质对风味贡献程度有差别。
依据上述内容,可以构建出3种鸭胸肌的风味轮廓:北京鸭的主要风味物质为(E)-2, 4-癸二烯醛、壬醛、2-辛烯醛、2-戊基呋喃、1-辛烯-3-酮;连城白鸭的主要风味物质为(E)-2, 4-癸二烯醛、壬醛、2-戊基呋喃、2-辛烯醛、己醛;野鸭主要风味物质为壬醛、2-戊基呋喃、正辛醛、己醛。
2.3 基于OPLS-DA对不同鸭胸肌的区分采用正交偏最小二乘法判别分析(OPLS-DA)进行3个品种的鉴别区分。以样品代谢物的相对含量为X变量,以3个品种的鸭胸肌样品为Y变量,进行有监督的OPLS-DA分析。样品代谢物相对含量经SIMCA14.1软件Par-scaling标准化预处理后进行分析,结果见图 4所示。
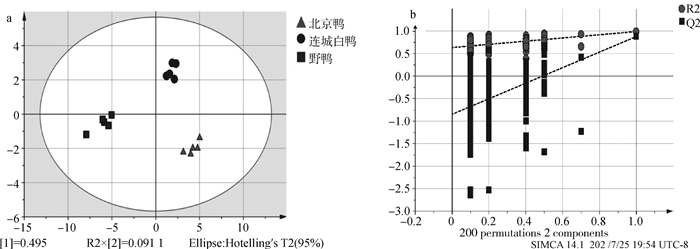
|
a. OPLS-DA分析;b. OPLS-DA验证模型 a. OPLS-DA analysis; b. OPLS-DA validation model 图 4 3种鸭胸肌OPLS-DA分析 Fig. 4 OPLS-DA analysis of three kinds of duck breast muscle |
在人们的主观认识中,3种肉鸭胸肌的挥发性风味是不同的。对32种共有的挥发性物质进行OPLS-DA分析(R2Y=0.761,Q2=0.624,且模型没有过拟合,可以使用),从图 4a中可以看出,模型可以对3种鸭胸肉进行有效区分。同时选取VIP>1、|log2(Fold Change)| ≥1的物质作为差异代谢物,进行3种鸭胸肉差异代谢物的比较。
从表 4中可以看出,北京鸭和连城白鸭主要的差异挥发性物质为1-己醇和3-羟基-2-丁酮,主要呈水果味、脂肪味;北京鸭和野鸭的主要的差异挥发性物质为1-己醇、己醛、苯甲醛、壬醛、戊醛、1-辛烯-3-醇、2-戊基呋喃、1-戊醇;连城白鸭和野鸭的主要差异挥发性物质为己醛、苯甲醛、壬醛、戊醛、1-辛烯-3-醇、2-戊基呋喃。
|
|
表 4 3种鸭胸肉间差异代谢物比较 Table 4 Comparison of different metabolites among three kinds of duck breast meat |
对3个品种鸭胸肌电子鼻的检测结果进行PCA分析,结果如图 5所示,电子鼻可以有效地对3个品种鸭胸肌进行区分。图 5中,PC1和PC2的总贡献率达到87.5%,可以看到,3个品种鸭胸肌在沿PC2的方向进行了区分,结果基本上与SPME-GC-MS结果一致。

|
图 5 3个品种鸭胸肌电子鼻检测结果 Fig. 5 Test results of electronic nose of breast muscle of 3 breeds ducks |
通过SPME-GC-MS技术在3个品种鸭胸肌中检测到超过100种挥发性物质,其中只有30种左右对胸肌肉风味贡献较大。醛、醇、呋喃、酮类物质在3个品种鸭胸肌中含量最多,这是鸭胸肌中的共性物质。本研究找到了3种鸭胸肉的挥发性风味图谱,并阐述了其中的差异风味物质,在很大程度上缩小了目标风味化合物的范围,为之后进行肉鸭风味物质的全基因组关联分析、寻找影响风味的主效基因和助力培育优质肉鸭打下了坚实的基础。
在鸭胸肉检测到的物质中,主要风味物质有醛、醇、呋喃类物质。醛类化合物主要来源于脂质的氧化、烷氧基自由基的分解[16-17]。3个品种鸭胸肌检测出的醛类物质相对含量都较高,同时,野鸭醛类物质含量与北京鸭和连城白鸭相比有着较大的差异(表 1)。在鸭胸肌肉中,醛类化合物是被鉴定出来的主要挥发性物质,并且由于其阈值较低,通常被认为是肉制品的主要风味物质,鉴定出的主要物质有己醛、苯甲醛、壬醛、戊醛、庚醛等[18-19]。其中己醛含量是醛类挥发性物质中最高的,其具有鸭腥味、青草气味,被认为是脂肪氧化水平的指标[20]。苯甲醛具有苦杏仁气味,是在美拉德反应中由异亮氨酸或苯丙氨酸通过Strecker降解产生的[21];壬醛具有鸭腥味和浓厚的油脂气味[22];戊醛具有青草味;庚醛具有油脂氧化气味[23]。同时,醛类物质的风味阈值较低,对于肉类风味的贡献较大[24-25]。3个品种中野鸭与北京鸭、连城白鸭检测出的醛类物质含量差异较大,这可能是野鸭胸肌风味明显区别于其他两种的原因之一。
从表 2中可以看出,北京鸭醇类物质相对含量最多,其主要物质为1-辛烯-3-醇和1-己醇。醇类化合物主要来源于脂肪的氧化[26]。1-己醇具有青草味、甜味[27],1-辛烯-3-醇具有蘑菇味[28]。一般来说,饱和醇的阈值较高,不饱和醇的阈值较低,对风味贡献大,1-辛烯-3-醇就是一种不饱和醇[10, 29],这可能也是引起鸭胸肌风味产生差异的原因之一。呋喃类化合物在鸭肉中相对含量较多,检测出了2-甲基呋喃、2-乙基呋喃、2-丁基呋喃、2-戊基呋喃4种物质。呋喃类化合物的主要来源途径是脂质氧化,使物质出现烘烤香气[30-31],比如检测到的2-戊基呋喃就具有这种烘烤香气。在3种鸭胸肌中检测出较多含量呋喃类物质,这可能与熟鸭肉的香气有关。酮类化合物主要来源于不饱和脂肪酸的氧化和美拉德反应[32]。通常来说,酮类化合物具有高阈值,主要具有青草香气。试验中所检测到的酮类物质中仅有1-辛烯-3-酮对鸭肉贡献了土壤味、清香味。
关于挥发性风味化合物的检测,大多数研究都是针对熟肉制品,很少有检测生肉的。主要是因为生肉气味少,其风味被定义为咸味、金属味和甜味[33]。有研究对生牛肉、生鸭肉进行了挥发性物质的检测,通过GC-MS技术对生鸭肉进行检测,发现其挥发性物质主要是以1-己醇、2-戊基呋喃为主的物质[34]。与鸡肉相比,鸭肉中含有更多的脂质物质[35],有研究发现,鸭肉的风味与脂肪含量呈正相关[36],通过脂肪氧化,产生各种风味物质。不同品种的肉鸭在脂肪含量和脂肪酸组成上存在显著差异,也表明不同肉鸭品种在加工熟制后产生的挥发性物质也会存在差异[37]。
对3种鸭胸肉的检测结果也说明,食品的整体风味感知不仅取决于挥发性风味物质的浓度和风味阈值,还取决于他们与食品中的非挥发性化合物的相互作用[38]。因此还需检测熟肉中的滋味化合物,结合非挥发性物质进行关联分析,主要是肌内脂肪和游离氨基酸的降解产物[39]。另一方面,风味的产生离不开风味前体物质,它对于食品独特风味的形成具有决定性作用[4]。如有报道称,野鸭的“野味”就来自于前体物质中的游离氨基酸[40]。前体物质是直接存在于动物体内的,相比于熟肉制品,前体物质未经过复杂的加工工艺,更方便研究其产生机制,有利于风味的追溯和定性分析。
4 结论不同品种的鸭肉胸肌挥发性风味物质不同,基于SPME-GC-MS技术能够有效对其主要组成成分进行鉴定。北京鸭的主要风味物质为(E)-2, 4-癸二烯醛、壬醛、2-辛烯醛、2-戊基呋喃、1-辛烯-3-酮;连城白鸭的主要风味物质为(E)-2, 4-癸二烯醛、壬醛、2-戊基呋喃、2-辛烯醛、己醛;野鸭主要风味物质为壬醛、2-戊基呋喃、正辛醛、己醛。3个品种鸭胸肌的差异风味物质主要为1-己醇、3-羟基-2-丁酮、己醛、苯甲醛、壬醛、戊醛、1-辛烯-3-醇、2-戊基呋喃、1-戊醇。
| [1] |
AASLYNG M D, MEINERT L. Meat flavour in pork and beef - From animal to meal[J]. Meat Sci, 2017, 132: 112-117. DOI:10.1016/j.meatsci.2017.04.012 |
| [2] |
ZHU G T, GOU J B, KLEE H, et al. Next-gen approaches to flavor-related metabolism[J]. Annu Rev Plant Biol, 2019, 70: 187-212. DOI:10.1146/annurev-arplant-050718-100353 |
| [3] |
WU C M, LIOU S E. Volatile components of water-boiled duck meat and Cantonese style roasted duck[J]. J Agric Food Chem, 1992, 40(5): 838-841. DOI:10.1021/jf00017a026 |
| [4] |
RAMALINGAM V, SONG Z, HWANG I. The potential role of secondary metabolites in modulating the flavor and taste of the meat[J]. Food Res Int, 2019, 122: 174-182. DOI:10.1016/j.foodres.2019.04.007 |
| [5] |
XIA B, NI Z J, HU L T, et al. Development of meat flavors in peony seed-derived Maillard reaction products with the addition of chicken fat prepared under different conditions[J]. Food Chem, 2021, 363: 130276. DOI:10.1016/j.foodchem.2021.130276 |
| [6] |
WANG W T, SUN B, HU P, et al. Comparison of differential flavor metabolites in meat of Lubei white goat, Jining gray goat and Boer goat[J]. Metabolites, 2019, 9(9): 176. DOI:10.3390/metabo9090176 |
| [7] |
FLORES M, PIORNOS J A. Fermented meat sausages and the challenge of their plant-based alternatives: A comparative review on aroma-related aspects[J]. Meat Sci, 2021, 182: 108636. DOI:10.1016/j.meatsci.2021.108636 |
| [8] |
SEO S H, KIM E J, PARK S E, et al. GC/MS-based metabolomics study to investigate differential metabolites between ale and lager beers[J]. Food Biosci, 2020, 36: 100671. DOI:10.1016/j.fbio.2020.100671 |
| [9] |
ZHU D S, REN X J, WEI L W, et al. Collaborative analysis on difference of apple fruits flavour using electronic nose and electronic tongue[J]. Sci Horticult, 2020, 260: 108879. DOI:10.1016/j.scienta.2019.108879 |
| [10] |
KONDJOYAN N, BERDAGUÉ J L. A compilation of relative retention indices for the analysis of aromatic compounds[M]. France: Laboratoire Flaveur, 1996.
|
| [11] |
ZHU J C, NIU Y W, XIAO Z B. Characterization of the key aroma compounds in Laoshan green teas by application of odour activity value (OAV), gas chromatography-mass spectrometry-olfactometry (GC-MS-O) and comprehensive two-dimensional gas chromatography mass spectrometry (GC×GC-qMS)[J]. Food Chem, 2021, 339: 128136. DOI:10.1016/j.foodchem.2020.128136 |
| [12] |
COBOS Á, VEIGA A, DIAZ O. Chemical and fatty acid composition of meat and liver of wild ducks (Anas platyrhynchos)[J]. Food Chem, 2000, 68(1): 77-79. DOI:10.1016/S0308-8146(99)00164-8 |
| [13] |
MOTTRAM D S. Flavour formation in meat and meat products: a review[J]. Food Chem, 1998, 62(4): 415-424. DOI:10.1016/S0308-8146(98)00076-4 |
| [14] |
KHAN M I, JO C, TARIQ M R. Meat flavor precursors and factors influencing flavor precursors-A systematic review[J]. Meat Sci, 2015, 110: 278-284. DOI:10.1016/j.meatsci.2015.08.002 |
| [15] |
JIN Y X, CUI S H, YUAN X Y, et al. Identification of the main aroma compounds in Chinese local chicken high-quality meat[J]. Food Chem, 2021, 359: 129930. DOI:10.1016/j.foodchem.2021.129930 |
| [16] |
ZHAO J, WANG M, XIE J C, et al. Volatile flavor constituents in the pork broth of black-pig[J]. Food Chem, 2017, 226: 51-60. DOI:10.1016/j.foodchem.2017.01.011 |
| [17] |
VUORELA S, SALMINEN H, MÄKELÄ M, et al. Effect of plant phenolics on protein and lipid oxidation in cooked pork meat patties[J]. J Agric Food Chem, 2005, 53(22): 8492-8497. DOI:10.1021/jf050995a |
| [18] |
REN L Y, MA J, LV Y, et al. Characterization of key off-odor compounds in thermal duck egg gels by GC-olfactometry-MS, odor activity values, and aroma recombination[J]. LWT, 2021, 143: 111182. DOI:10.1016/j.lwt.2021.111182 |
| [19] |
ZANG M W, WANG L, ZHANG Z Q, et al. Changes in flavour compound profiles of precooked pork after reheating (warmed-over flavour) using gas chromatography-olfactometry-mass spectrometry with chromatographic feature extraction[J]. Int J Food Sci Technol, 2020, 55(3): 978-987. DOI:10.1111/ijfs.14306 |
| [20] |
AZARBAD M H, JELE N ' H. Determination of hexanal—an indicator of lipid oxidation by static headspace gas chromatography (SHS-GC) in fat-rich food matrices[J]. Food Anal Methods, 2015, 8(7): 1727-1733. DOI:10.1007/s12161-014-0043-0 |
| [21] |
KAMIREDDY K, SONBARSE P P, MISHRA S K, et al. Proteomic approach to identify the differentially abundant proteins during flavour development in tuberous roots of Decalepis hamiltonii Wight & Arn[J]. 3 Biotech, 2021, 11(4): 173. DOI:10.1007/s13205-021-02714-x |
| [22] |
INSAUSTI K, MURILLO-ARBIZU M T, URRUTIA O, et al. Volatile compounds, odour and flavour attributes of lamb meat from the Navarra breed as affected by ageing[J]. Foods, 2021, 10(3): 493. DOI:10.3390/foods10030493 |
| [23] |
BANASZAK M, KUŹNIACKA J, BIESEK J, et al. Meat quality traits and fatty acid composition of breast muscles from ducks fed with yellow lupin[J]. Animal, 2020, 14(9): 1969-1975. DOI:10.1017/S1751731120000610 |
| [24] |
YIN X Y, LV Y C, WEN R X, et al. Characterization of selected Harbin red sausages on the basis of their flavour profiles using HS-SPME-GC/MS combined with electronic nose and electronic tongue[J]. Meat Sci, 2021, 172: 108345. DOI:10.1016/j.meatsci.2020.108345 |
| [25] |
TAN F L, WANG P, ZHAN P, et al. Characterization of key aroma compounds in flat peach juice based on gas chromatography-mass spectrometry-olfactometry (GC-MS-O), odor activity value (OAV), aroma recombination, and omission experiments[J]. Food Chem, 2021, 130604. |
| [26] |
GASPARDO B, PROCIDA G, TOSO B, et al. Determination of volatile compounds in San Daniele ham using headspace GC-MS[J]. Meat Sci, 2008, 80(2): 204-209. DOI:10.1016/j.meatsci.2007.11.021 |
| [27] |
HAN G, ZHANG L, LI Q X, et al. Impacts of different altitudes and natural drying times on lipolysis, lipid oxidation and flavour profile of traditional Tibetan yak jerky[J]. Meat Sci, 2020, 162: 108030. DOI:10.1016/j.meatsci.2019.108030 |
| [28] |
蒋平香, 戴欣玮, 王勤志, 等. 广式烧鸭不同加工阶段挥发性风味成分研究[J]. 食品工业科技, 2020, 41(11): 37-45, 50. JIANG P X, DAI X W, WANG Q Z, et al. Study on volatile flavor components of cantonese roast duck in different processing stages[J]. Sci Technol Food Ind, 2020, 41(11): 37-45, 50. (in Chinese) |
| [29] |
LAWRIE R A, LEDWARD D. Lawrie's meat science[M]. Woodhead Publishing, 2014.
|
| [30] |
MIN D B, CALLISON A L, LEE H O. Singlet oxygen oxidation for 2-pentylfuran and 2-pentenyfuran formation in soybean oil[J]. J Food Sci, 2003, 68(4): 1175-1178. DOI:10.1111/j.1365-2621.2003.tb09620.x |
| [31] |
KANTONO K, HAMID N, CHADHA D, et al. Pulsed Electric Field (PEF) processing of chilled and frozen-thawed lamb meat cuts: relationships between sensory characteristics and chemical composition of meat[J]. Foods, 2021, 10(5): 1148. DOI:10.3390/foods10051148 |
| [32] |
KOHNO Y, MAKINO T, KANAKUBO M. Effect of phase behavior for ionic liquid catalysts with reactants/products on reactivity of esterification from long-chain fatty alcohols and fatty acids[J]. Fluid Phase Equilib, 2019, 490: 107-113. DOI:10.1016/j.fluid.2019.03.001 |
| [33] |
BERIAIN M J, MURILLO-ARBIZU M T, INSAUSTI K, et al. Raw-cured Spanish traditional meat product "Chistorra de Navarra": sensory and composition quality standards[J]. Foods, 2020, 9(8): 1006. DOI:10.3390/foods9081006 |
| [34] |
SONCIN S, CHIESA L M, CANTONI C, et al. Preliminary study of the volatile fraction in the raw meat of pork, duck and goose[J]. J Food Composit Anal, 2007, 20(5): 436-439. DOI:10.1016/j.jfca.2006.09.001 |
| [35] |
BAÉZA E. Effects of genotype, age and nutrition on intramuscular lipids and meat quality[C]//Symposium 2006 Scientific Cooperation in Agriculture. Taiwan, China, 2006: 7-10.
|
| [36] |
CHARTRIN P, MÉTEAU K, JUIN H, et al. Effects of intramuscular fat levels on sensory characteristics of duck breast meat[J]. Poult Sci, 2006, 85(5): 914-922. DOI:10.1093/ps/85.5.914 |
| [37] |
XIA C L, HE Y X, CHENG S, et al. Free fatty acids responsible for characteristic aroma in various sauced-ducks[J]. Food Chem, 2021, 343: 128493. DOI:10.1016/j.foodchem.2020.128493 |
| [38] |
GUICHARD E. Interactions between flavor compounds and food ingredients and their influence on flavor perception[J]. Food Rev Int, 2002, 18(1): 49-70. DOI:10.1081/FRI-120003417 |
| [39] |
WANG X R, JIANG G T, KEBREAB E, et al. 1H NMR-based metabolomics study of breast meat from Pekin and Linwu duck of different ages and relation to meat quality[J]. Food Res Int, 2020, 133: 109126. DOI:10.1016/j.foodres.2020.109126 |
| [40] |
YU Q F, FANG C K, MA Y J, et al. Dietary resveratrol supplement improves carcass traits and meat quality of Pekin ducks[J]. Poult Sci, 2021, 100(3): 100802. DOI:10.1016/j.psj.2020.10.056 |
(编辑 郭云雁)



