精密组织切片(precision-cut tissue slices,PCTS)是许多研究人员广泛使用的器官体外模型,实质上是可以进行体外培养的组织的活性外植体。通过使用专门的设备(组织切片机),它们可以制备出可重现的、定义良好的厚度,可以在保持组织活力的条件下从绝大多数类型的固体组织中制备组织切片,并保证切片中包含自然环境中组织的所有细胞类型,细胞间和细胞-基质之间的相互作用保持完好[1],为疾病模型的建立提供了一个新的选择。
各种方法制备的器官组织切片作为体外系统已经使用了几十年,但由于切片缺乏重复性和组织制剂的相对有限的生存能力阻碍了切片作为广泛的试验模型被使用。1923年,由奥托·沃伯格(Otto Warburg)首次利用精密组织切片作为一种离体模型用于测量肿瘤组织中细胞代谢和耗氧量,汉斯·克雷布斯(Hans Krebs)进一步探索,研究包括人类在内的各种动物器官的氨基酸代谢。但由于未优化的孵育条件和使用刀片手工切割,使它们的活性迅速丧失,厚度不一。直至1980年,一种新的半自动仪器-克鲁姆迪克组织切片机(Krumdieck tissue slicer)被发明,通过半自动切片实现了定义明确的尺寸,并优化了孵育条件,以重复制备薄而精密切割的肝切片,这种方式优化了组织的活力,保存了分化细胞的代谢功能,并提高了重复性[2]。后来,随着能够重复生产相对较薄的组织切片的自动切片机的生产和优化,以及动态器官培养系统的开发,使得这项技术被广泛使用。此后,精密组织切片不仅在健康细胞和癌细胞的代谢领域,而且在药物的转运、代谢和毒性、纤维化和病毒感染中的应用得到了广泛的探索,为疾病模型的建立提供了一个新的方案[3]。本文简要综述了精密组织切片的制备方法、培养体系和活性检测指标,以及精密组织切片应用于各个器官进行药理、毒理、病理、致病机制等不同方面的研究,以期为后续研究人员使用精密组织切片作为新型生物学体外离体模型进行研究提供借鉴和参考。
1 精密组织切片的制备与培养 1.1 精密组织切片的制备目前, 已成功制备精密组织切片的器官包括肝、肾、心、肺、肠、脾等。不同器官的切片制备方法大致相似,主要区别在于组织的固定方式和不同器官切片厚度的选择。精密组织切片的大致制备过程如图 1所示。
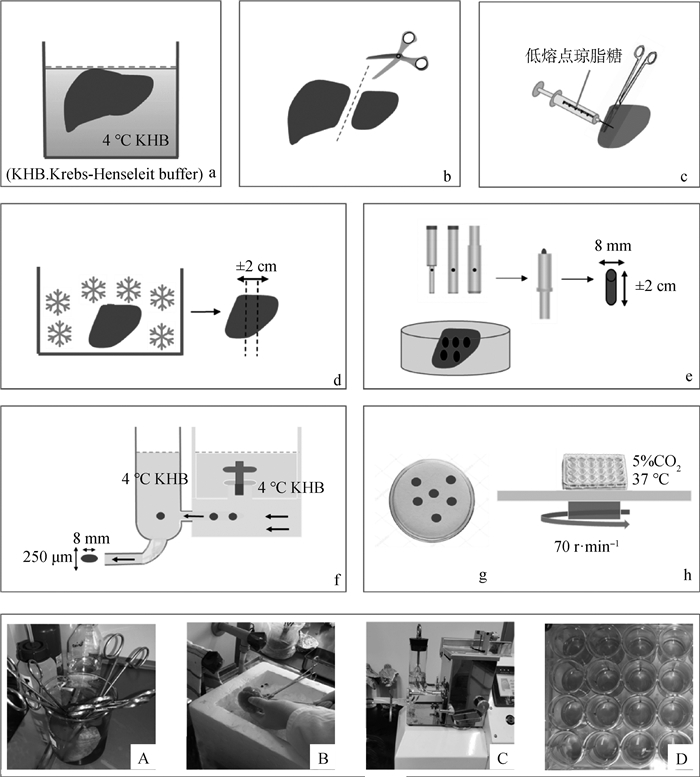
|
a、A.取出器官,冲洗干净;b.切割组织块;c、B.灌注低熔点琼脂糖;d.置于冰盒中凝固;e.取芯;f、C.切片;g.筛选切片;h、D.培养 a.A. Take out the organs and rinse it; b. Cut tissues; c, B.Infuse low-melting agarose; d.Place in ice box to freeze; e. Cut with tissue core knife; f, C. Cut with tissue slicer; g. Select precision-cut tissue slices; h, D. Incubation slices 图 1 精密组织切片制作流程图 Fig. 1 Piglet precision-cut lung slices making process |
首先,为了准备切片,必须从活体内切除组织,用冰冷的PBS或者简单的生理缓冲液冲洗动物器官中的血液。切除后尽快将器官浸入冰冷的器官保存液中降温,以减少缺血损伤。冲洗过程容易对组织细胞造成损伤,所以动作要轻柔缓慢,尽量少次便清洗干净。对于肠道,须多次冲洗肠腔,以去除肠道内容物,并且使用的抗生素要多于实质性器官的使用量以降低污染[4]。
切片时,实质器官,如肝、肾等,清洗后直接用组织取芯工具,轻轻旋转切割圆柱形的核心,制作成适合切片机大小的形状便可。非实质器官,如肠和肺,需要包埋在低熔点的琼脂或明胶中形成固体器官样结构,修饰成合适大小后使用取芯工具轻轻旋出组织块再进行切片。后续在37 ℃的培养基中孵育,琼脂糖可脱落或溶解,使组织的细胞结构与培养基直接接触[5]。
影响切片存活的一个关键因素便是切片厚度,切片过厚容易缺乏氧气和营养,过薄又会在切片过程中造成组织细胞的机械性损伤,致使切片活力丧失。切片厚度一般在100~500 μm变化,根据试验需求调整。肝和肾的制片厚度在200~250 μm变化,心的制片厚度为200~300 μm,肺的制片厚度在250~500 μm变化,肠切片在200~350 μm厚度处切割最佳。对于其他组织,厚度的描述并不一致,但250 μm通常被认为是最有利的,该厚度允许足够的营养物质和氧气进入切片,防止切片内细胞层的坏死。切片厚度可以通过多种手段确定,包括机械测定和光学测微计以及计算切片湿重[5]。
最后,根据外观选择切片,好的切片具有相同的厚度,均匀的颜色和光滑的边缘。使用弯曲的和切片大小等同的勺子小心转移切片,以避免损坏切片。选好后转移至培养皿中培养[5-6]。
1.2 精密组织切片的培养精密组织切片的成功制备的另一个关键因素是切片的培养体系,要求孵育切片时允许氧气和营养物质能扩散到切片内部细胞层,并且避免切片中心内坏死或活力不足。培养系统可分为3种系统:1)浸没系统,使切片一直浸入培养基中,在锥形瓶或培养板中培养;2)动态器官培养系统,通过滚动培养容器让切片间歇地暴露在培养基和气相中;3)新改进的灌注培养系统,其中切片被培养在梯度培养容器中,并使切片的顶面和底面暴露于流动的培养基中[5, 7-8]。
当将切片短时间(小于48 h)孵育时,浸没培养系统是合适的。器官切片通常置于6、12、24孔板,或50、125 mL锥形瓶中,2 mL培养基·片-1,然后将孔板或烧瓶置于摇床上,缓慢摇动切片(70 r·min-1)。这种类型的孵育允许切片恒定地暴露于化合物,并允许人们在非常短的时间点移除培养基或切片而不结束孵育[5];缺点是无法避免组织在切片-介质界面处发生崩解,而且切片另一侧容易坏死。对于长期培养,动态器官培养系统优于其他孵育系统。将切片放在孵化摇篮的网状面过滤器上,然后将这个摇篮放入一个装有1.7 mL培养基的小瓶中,瓶子在培养箱中旋转,在整个培养过程中不断地将切片的两个表面暴露在气体和液体中[7, 9]。该系统已被证明可以防止单侧切片的坏死。然而,动态器官培养系统的缺点是由于与网状物接触可能导致切片的机械损伤,而这在浸没系统中是完全避免的。在保持蛋白质表达和组织结构方面,能够持续交换培养基的灌注培养系统似乎优于浸没或动态培养。该容器的顶部和底部各有一个入口和一个出口,切片的顶面和底面连续暴露在流动培养基中,使用流动泵以100 mL·min-1的流速输送培养基,可以允许培养基持续交换[8]。这也表明了培养基不仅要流动,并且需要定期更新。然而该系统由于制备相对复杂,且成本高昂,所以使用率相对较低。
为了使组织切片具有良好的生存能力,培养基应该是营养丰富的培养基,如WME培养基、DMEM培养基、Waymouth培养基等,并且含有葡萄糖和抗生素[10]。这种培养基可以用于所有组织的切片,但使用不同种类抗生素时需考虑是否会引起器官特异性毒性,有时还会在培养基中加入地塞米松、胰岛素或表皮生长因子等加强切片活性。此外,还需要高氧浓度(>70%),一般会选择将培养系统置于5% CO2、37 ℃的细胞培养箱中培养[9],并且在37 ℃的培养基中孵育后,灌注了低熔点琼脂糖的组织切片中的琼脂糖会脱落或溶解,利于组织的细胞结构与培养基直接接触。对于超过48 h的孵化,需要考虑添加胎牛血清以维持切片活性[10]。最后,需要定期监测培养基的pH,及时更换新的培养基,一般每24 h更换一次新的培养基[8-9]。
2 精密组织切片的活性检测指标精密组织切片的成功制备以及后续的活力和功能正常维持是试验数据可用且准确的依据,因此监测组织切片的活性对试验结果的准确性是很有必要的。
切片的组织形态、ATP水平的含量、活/死细胞染色(Calcein-AM/PI)是最常用于检测精密组织切片活性变化的指标[6, 11]。切片的组织形态是否完整是将PCTS用于试验模型的基础,通常直接使用电子显微镜观察或随机选取切片进行HE染色来评估切片的完整性。ATP作为活体细胞最基本的能量来源,当细胞凋亡、坏死或处于毒性状态下时ATP水平会下降,因此测定切片的ATP含量可反映切片的活性,ATP含量代表了PCTS的活性[6]。活/死细胞染色试剂盒通过分析细胞质膜完整性与细胞内酯酶活性反映细胞活力[11],其中Calcein-AM能穿透活细胞膜,将细胞染成绿色;PI则不能穿透活细胞膜,能将死细胞染成红色,可用荧光显微镜在同一波长下同时观察活细胞和死细胞,也可在不同波长下分别观察活/死细胞,其中,红、绿荧光的比例便代表了切片的活力。此外,还有通过检测组织特异性酶(如丙氨酸氨基转移酶或乳酸脱氢酶等),功能酶(如不同类型的细胞色素),Ⅰ期和Ⅱ期底物的恒定代谢率,MTT还原,K+保留等参数作为精密组织切片活性变化的指标[11-12]。
3 精密组织切片在各个器官的应用 3.1 肺切片(precision-cut lung slices,PCLS)精密切割的肺切片在动态器官培养下保持与体内肺器官相似的高度分化功能是一种非常有效的工具。它被成功地用于肺基因转移效率的评估、肺病毒感染效率的评估、组织保存介质的研究和移植前优化肺组织活力的组织后处理的研究。肺切片已经成为研究炎症刺激、感染和新型药物化合物的呼吸反应的有用体外工具。
由于保存了完整的显微解剖结构,细胞因子在炎症反应中的重要作用已在肺精密组织切片中成功研究,从而可以在显微镜下监测支气管收缩。该模型允许在精密控制的暴露条件下和没有血源性白细胞的情况下研究细胞因子对气道张力和反应性的直接影响[13]。而且肺切片可以同时测量收缩和细胞内游离钙,对于发展连接生化途径和力产生的定量模型非常有用[14]。将单个精密切割的肺片安装在聚二甲基硅氧烷的薄而灵活的支撑膜上,在生物反应器中通过在静态条件下施加不同的压力,可以模拟与完整肺中描述的肺泡扩张类似的情况[15]。
精密肺切片在应用于评估药物化合物在肺内的代谢与反应方面也表现优异,Vickers等[16]证明了人和大鼠肺切片对环孢素衍生物具有代谢活性,表现出氧化和酯酶途径。暴露于苯并[a]-芘(benzo[a]-pyrene)的精密切割肺切片证实了化合物的摄取和代谢先于诱导代谢物与DNA结合和加合物的形成[17]。肺组织可能在这种新陈代谢和化合物清除中发挥重要作用,特别是在吸入给药之后,该模型可能有助于肺组织致癌物代谢和与DNA结合的种间研究。
精密切割的肺切片也可作为评估细菌或病毒等病原体感染肺部的平台,可以评估宿主与病原体之间相互作用以及感染机制等。Banerjee等[18]建立了人类精密切割肺切片作为模拟肺炎鼠疫期间早期宿主/病原体相互作用的平台,发现纤溶酶原激活物蛋白酶Pla是肺鼠疫的早期宿主/病原体相互作用中的关键角色。Delgado-Ortega等[19]利用精密切割肺片作为离体模型研究了新生猪气管细胞,肺泡巨噬细胞和精密切割肺片对H3N2亚型猪流感病毒的先天免疫反应。Punyadarsaniya等[20]在精密猪肺切片上进行了流感病毒感染效率的试验研究,证明肺切片对病毒感染的敏感性是常规肺组织培养的100倍。病毒感染诱导纤毛滞留的动态变化与感染过程中产生的病毒量有一定的相关性,这种方法使研究肺细胞类型对病毒感染的相对易感性成为可能,这也为新型冠状病毒肺炎感染机制的研究提供了一种新的思路。
同时,精密肺切片可能是一个评估基因输送到肺组织上皮细胞非常有用的模型。McBride等[21]在将表达LacZ的腺病毒注入肺切片培养4 d后,可在细支气管和肺泡细胞中观察到LacZ的表达。
精密肺切片最近被用来建立肺组织缺血/再灌注损伤评估模型。心脏骤停诱导缺血,在心脏骤停后不同时间进行琼脂糖肺组织充气,将精密肺切片培养24 h,检测肺组织活力、氧化应激反应和炎症反应,初步结果显示,热缺血4 h后肺组织活力仍能保持24 h[22]。最终,这种模式可能会在延长使用非心脏跳动捐赠者的肺进行肺移植的时间延迟方面开辟新的领域。
3.2 肠切片(precision-cut intestinal slices,PCIS)最初,精密组织切片技术并不适用于肠道。由于肠道是一个柔软非实质的器官,难以切片和孵育。后来由De Kanter等[23]改善,使用低熔点琼脂糖填充肠腔,并垂直切开肠段,形成组织环。改进的精密组织肠切片的制备和使用变得相对简单和方便,并且拥有更好的重复性和组织活性。目前,精密切割肠切片已成功地应用于药物和其他外源物质的运输、代谢、诱导、抑制和生理、毒理等方面的研究。
肠道广泛参与药物口服后的转运、代谢和毒性,因此药物的肠道转运需要临床前的研究。通过分析不同浓度底物孵育后和不同时间点后切片含量的增加,可以直接测量摄取转运蛋白的活性。Li等[24]以大鼠和人的精密肠切片作为活体动物模型,研究了根尖依赖性胆汁酸转运体介导的转运活性以及功能的区域差异和种间差异。也有学者用胆酸、脱氧胆酸和牛磺胆酸研究了胆汁酸在PCIS中的摄取[25]。表明PCIS是可用于研究摄取转运蛋白活性和外源性物质与转运体相互作用的有效模型,并可作为一种潜在的转运蛋白抑制剂的筛选工具。
随着越来越多的药物代谢酶和药物转运蛋白在肠道不同区域的识别,肠道作为决定药物首过代谢的重要因素的作用得到了越来越多的认识。CaCO-2单层培养被认为是体外研究药物肠道代谢的“金标准”。然而,由于不能反映组织的多细胞性和细胞去极化,限制了体内预测的准确性。而精密组织肠切片很好地解决了这一问题,有学者发现肠切片的代谢活性比微粒体或从肠道制备的S9组分高得多,范围从3倍~50倍不等[26]。表明PCIS是研究肠道代谢的一个有价值的模型。在使用诱导剂后,药物代谢酶、药物转运蛋白及其核受体的mRNA表达梯度已被广泛研究,但其对代谢活性的影响此前未见广泛研究。在体内口服给药后,可以在切片上测量不同节段之间在大鼠肠道诱导方面的差异,体外试验允许所有片段平等地暴露于诱导剂[27]。因此,PCIS是研究肠道不同区域新陈代谢能力和诱导性的极好工具。
药物所致的器官损伤是药物开发和临床治疗中的一个重要的安全性问题,药物毒性的关键靶器官通常是那些高度暴露于毒素的器官,包括肝、肾和肠道。肠道作为药物首过代谢的器官,药物对肠道的毒性的研究是非常有必要的。很多学者都以精密肠道组织为模型,研究过非甾体抗炎药诱导的大鼠肠道毒性。在PCIS中观察到典型的非甾体抗炎药诱导的形态学改变,体内外毒性排序与体外和体内公布的数据有很好的相关性[28]。表明PCIS正确地反映了非甾体抗炎药所致肠毒性的各种机制,可作为预测药物所致肠道毒性的体内外模型。
由于分化的肠上皮细胞的培养系统不易获得,分析肠道病原感染并不容易。Punyadarsaniya等[29]以精密肠组织切片为培养系统,分析禽流感病毒对分化肠上皮细胞的感染情况,从而解决了这一难题。证明了α2,3连接唾液酸是禽流感病毒的首选受体决定因子,存在于上皮细胞的顶端,并且绒毛上皮细胞(尖端)易受H9N2亚型禽流感病毒感染。表明了该培养系统可用于分析肠道上皮细胞的病毒感染,并且同样适用于其他物种肠道病原感染的分析,为肠道病原感染研究提供了一种新的方法。
3.3 肝切片(precision-cut liver slices,PCLS)精密切割的肝组织切片代表了一个健壮的、多功能的体外模型,它保留了肝环境的复杂和多细胞组织结构,包括肝脏浸润的免疫细胞,是研究肝损伤、纤维化机制、病毒感染、细胞相互作用和识别新的治疗靶点的理想模型。
目前,用于肝研究的体外细胞模型和体内动物模型不能完全模拟肝损伤和疾病进展的复杂发病机制,特别是在纤维化的发展过程中,精密切割的肝切片很好地弥补了其他模型的缺点。使用小鼠和人精密切割肝组织切片的体外模型评估奥帕利西布对纤维化形成的影响,发现奥米帕利西布对体外小鼠和人肝PCLS均有抗纤维化作用[30]。表明PCLS可作为探究治疗肝纤维化的的靶点的有效模型。Coombes等[31]通过小鼠PCLS模型用瘦素诱导纤维化形成,并评估骨桥蛋白中和消除这一反应的能力,证实了它作为抗纤维化治疗的临床前模型的实用性和优势。
酒精性肝病与多种病理表现有关,包括酒精性脂肪性肝炎、炎症、纤维化和肝硬化。然而反映酒精性肝病发病机制的模型很少,因为常用的实验动物小鼠等对酒精并不敏感,即使持续灌服也并不能导致严重的纤维化。PCLS暴露于酒精中会导致肝损伤、脂肪变性和氧化应激,而且乙醇代谢可保存数天[32]。同时,在非酒精性脂肪性肝病中,保留肝浸润淋巴细胞的精密切割肝组织切片也是在不同阶段观察肝变化和检验新药疗效的良好模型[33]。
精密切割肝组织切片在病毒性肝炎的研究中也被证明有相当大的实用价值。肝切片是研究病毒感染和复制机制、病毒生命周期和病毒在天然组织中传播动力学以及评价新型抗病毒药物疗效的理想体外模型。PCLS可感染乙型和丙型肝炎病毒(HCV),以及腺病毒和腺相关病毒,作为研究病毒感染和复制的模型。在Lagaye等[34]的研究中,对切片培养进行了长达10 d的跟踪,显示了HCV RNA在细胞内的复制,病毒蛋白的表达,细胞外感染性颗粒的产生。此外,感染后培养的切片上清液也能进一步感染其他肝切片。
肝切片也可以从病变的肝中制备,例如严重的纤维化和肝硬化患者。切除的恶性/转移性肝组织也可用于获得肿瘤切片。来自肝细胞癌的组织切片(HCC-hPCLS)保留了肿瘤的微环境,并已被证明是抗肝细胞癌药物临床前测试的一个有价值的系统[35]。来自肝癌的PCLS可以作为肝癌的模型,通过与相匹配的外周血白细胞共培养来评估肿瘤-免疫细胞的相互作用[36],这也是PCLS系统目前研究的一个新领域。
3.4 肾切片(precision-cut kidney slices,PCKS)肾切片为研究各种对象提供了有用的工具,包括肾对毒物的反应以及内源性和外源性的肾新陈代谢,有机离子转运和肾素释放,肾最重要的功能都已经使用切片系统进行了研究,建立了合适的研究模型。
肾皮质切片保留了完整器官的许多特征,包括集合管、Henle上行粗支、肾小球和直而曲折的近端小管,允许对肾毒物进行细胞特异性评估[37]。PCKS已被证明可用于药物毒理学研究,特别是用于揭示肾毒性的机制。Branchflower等[38]对P-450诱导剂苯巴比妥在体外可增强氯仿所致的毒性反应的研究证明,肾组织切片模型在获取肾中氯仿的有毒代谢产物的数据方面起了重要作用。Vickers等[39]研究了顺铂对肾切片的影响,清楚地证明了该药物具有部位特异性毒性,表现为广泛的肾小管坏死,而肾小球似乎未受影响。因此,PCKS可以用来探究药物诱导的肾毒性的复杂机制。肾素分泌在肾切片模型中也得到了广泛的研究,有研究者在大鼠肾皮质切片上观察到钙对肾素释放的双相改变。向缺钙切片重新注入钙,最初导致肾素释放增加,随后持续下降,证明了细胞内钙活性和肾素释放之间的反向关系[40]。
慢性肾病与肾纤维化相关,肾纤维化是一种病理过程,其特征在于细胞外基质蛋白的过度积累导致器官结构和功能的丧失。在过去的几十年中,已经建立了多种模型来研究肾纤维化,由于缺乏多细胞特征,这些模型可能会出现一些与机体情况不匹配的现象。有研究者以小鼠肾为材料制备了精密肾组织切片,成功研究了精密肾切片中的纤维化以及干扰素γ和干扰素γ结合物PPB-PEG-IFNγ的抗纤维化作用[41]。表明PKCS模型是一种在多细胞和亲纤维化环境下检测纤维化病理生理和体外筛选抗纤维化药物的新工具。从肿瘤肾切除的人皮质组织中制备PCKS可引起炎症组织反应,而长期孵育(96 h)可诱导纤维增生,并且PCKS的功能维持超过48 h[42]。这些研究表明PCKS在培养过程中可保持其肾表型,是体外研究肾纤维化的一个很有前途的模型。
通过精密切割的仓鼠肾切片探究酚酸对肾切片中汞诱导的DNA损伤的保护作用中[43],第1次将彗星检测技术结合精密组织切片技术,以清晰和简单的方式从肾组织切片中可视化彗星,表明精密组织切片是生物医学研究中一种有机的三维体外研究模型。
3.5 心切片(precision-cut heart slices,PCHS)虽然心切片不能保持培养心肌细胞的收缩反应,但心切片对于某些研究来说是一个较好的选择。它可以维持正常的细胞-细胞相互作用,并且分离过程不选择特定的细胞群体,对不可移植的人体组织的适用性也是一个潜在的优势。心切片已成功地用于心肌损伤、体外毒理学、物质转运和探寻新的药物靶点的研究。
精密切割的心切片适用于毒理学研究,肝/心切片共培养系统可用于研究肝代谢介导的心毒性[44]。在这些研究中,肝和心切片的共培养增强了心切片中烯丙醇的毒性,但不能增强烯丙胺的毒性。由于这些化合物对丙烯醛的代谢分别是由肝和血管特异性酶介导的,这些结果表明了共培养系统的潜力。虽然心切片不能保持在培养心肌细胞中看到的收缩反应,但切片为许多体外毒理学研究提供了一种替代系统。
抗肿瘤药物很受关注,而剂量依赖性的心毒性可能是癌症化疗的严重副作用。在精密切割的心切片系统中,通过测定切片的摄氧量和ATP生成量来评估表阿霉素、阿霉素和米托蒽醌等物质的毒性。已证实蒽环素衍生物表阿霉素和米托蒽醌对大鼠心切片摄氧量和ATP含量的影响。心切片的摄氧量也是评估一系列阿霉素类似物相对心毒性的活性参数。卡米丁衍生物和辅酶Q对阿霉素相关的心毒性的细胞保护作用也在心切片上得到证实[45]。表明精密心组织切片为评估毒物对心肌组织的损伤提供了一种替代系统钠泵在心脏中特别重要,因为离子梯度对于维持心作为生理泵的收缩特性是极其重要的。Fischer等[46]用心切片研究了饮食和年龄对钠-钾泵活性的影响,发现镁缺乏似乎对钠-钾泵的数量没有影响,但确实降低了泵的活性。Wanless等[47]使用通过泵介导的活性离子传输的直接测量,确定去甲肾上腺素对泵的刺激可以稳定细胞内离子浓度和静息膜电位。这些数据都表明了心组织切片在研究生理泵方面的可行性和有效性。
由于心切片部分保留了电紧张性和旁分泌细胞间的相互作用,它们构成了研究心细胞生物学的一个新颖的模型。Stuckmann等[48]很好地证明了这一点,用培养的心组织切片来说明鸡胚心的心外膜分泌促红细胞生成素和维甲酸,这是心肌细胞增殖所必需的。
心切片还被广泛用于其他研究,包括肉碱转运、β-肾上腺素能刺激环磷酸腺苷代谢和再灌注损伤。该模型适用于药物安全评价,通过对不应期的重复评估,可以对多式HERG抑制剂戊脒引起的复极损伤进行敏感性分析[49]。仿生组织培养为研究成人心肌的药物靶点、基因功能和细胞可塑性提供了新的机会,在此背景下,一些研究使用了人、小鼠或大鼠心切片,研究了心肌与人胚胎干细胞或骨髓细胞之间的相互作用[50]。
4 小结与展望近年来,人们对器官组织模型重新产生了兴趣,越来越多的试验者使用器官组织作为试验模型。精密组织切片作为一种介于器官与细胞水平间的组织器官体外离体模型,在天然环境中包含了组织的所有细胞类型,不仅能够比较完整地保存正常组织结构、细胞间的联系及细胞极性,而且也能保证切片的生存能力,使其能够最大限度地模拟在体状态,并能充分维持组织活性、功能活性以进行毒性、诱导和感染研究[51-52]。由于培养和切片技术有了重大改进,可有效利用稀缺的组织制备大量非常薄的精密组织切片,可以提供足够的试验材料,以便每个样本都是自己的内部对照,模型显示出很好的结果重复性,提高了试验的可信度与准确性。并且与体内简化的模型相比,具有很高的生物学相关性。而且根据3R (replacement,reduction,refinement)概念,精密组织切片大大地减少了实验动物的用量,改善动物福利,降低使用动物数量时由于个体差异无法避免的试验质量问题[1]。精密组织切片的材料除了来自健康的动物,也可从患病动物手术中切除的废弃组织中获取[33],在人以及某些稀有动物的研究中,精密组织切片有助于提供真实的数据,克服研究一些人类疾病时由于物种差异而导致的问题。以上这些优点都支持精密组织切片作为体外离体模型的应用与发展。
虽然精密组织切片制备比较简单方便,但依然存在一些问题和缺点,例如,在保持切片无菌时,冲洗器官时如何用最佳的方式减少对组织细胞的损伤以及制备不同组织切片培养基中抗生素的选择。在切片培养期间,需要考虑如何最大限度地保证切片的生存力和活力。虽然前人已经对上述一些问题进行了不同程度的优化和改进,但该技术在切片培养方面仍有改进空间。
目前,国内鲜有对精密组织切片的研究,主要用于精密肝切片上的损伤、代谢、药理等方面[53-54],和一例应用于动物感染模型的研究[6]。而国外则早已运用此技术,研究热点多集中于代谢、药理、毒理、转运、药物评估、免疫反应和病毒感染等方面,而一例对肝、肺、肾、小肠、结肠切片的联合应用来预测药物全身代谢清除率[55],更是拓展了精密组织切片的应用范围,推进它向多器官联合培养体外模型的发展。这些精密组织切片模型的建立,表明它可作为哺乳动物研究中广泛使用的生物学离体模型,适用于各种致病机制、生理病理的研究。希望在不久的将来,越来越多的应用以及精密组织切片的不断优化和改进能使这项很有前途的技术成为实验动物模型的创新替代品。
| [1] |
SEWALD K, BRAUN A. Assessment of immunotoxicity using precision-cut tissue slices[J]. Xenobiotica, 2013, 43(1): 84-97. DOI:10.3109/00498254.2012.731543 |
| [2] |
STRIBOS E G D, HILLEBRANDS J L, OLINGA P, et al. Renal fibrosis in precision-cut kidney slices[J]. Eur J Pharmacol, 2016, 790: 57-61. DOI:10.1016/j.ejphar.2016.06.057 |
| [3] |
PARRISH A R, GANDOLFI A J, BRENDEL K. Precision-cut tissue slices: applications in pharmacology and toxicology[J]. Life Sci, 1995, 57(21): 1887-1901. DOI:10.1016/0024-3205(95)02176-J |
| [4] |
LI M, DE GRAAF I A M, GROOTHUIS G M M. Precision-cut intestinal slices: alternative model for drug transport, metabolism, and toxicology research[J]. Exp Opin Drug Metab Toxicol, 2016, 12(2): 175-190. DOI:10.1517/17425255.2016.1125882 |
| [5] |
DE GRAAF I A, GROOTHUIS G M, OLINGA P. Precision-cut tissue slices as a tool to predict metabolism of novel drugs[J]. Exp Opin Drug Metab Toxicol, 2007, 3(6): 879-898. DOI:10.1517/17425255.3.6.879 |
| [6] |
黄石磊, 谢录异, 余秋寒, 等. 仔猪肺、肠组织离体感染模型的建立及应用[J]. 中国兽医学报, 2020, 40(7): 1325-1333. HUANG S L, XIE L Y, YU Q H, et al. Establishment and application of piglet lung and intestinal tissue isolated infection model[J]. Chinese Journal of Veterinary Science, 2020, 40(7): 1325-1333. (in Chinese) |
| [7] |
MORIN J P, BASTE J M, GAY A, et al. Precision cut lung slices as an efficient tool for in vitro lung physio-pharmacotoxicology studies[J]. Xenobiotica, 2013, 43(1): 63-72. DOI:10.3109/00498254.2012.727043 |
| [8] |
SCHUMACHER K, KHONG Y M, CHANG S, et al. Perfusion culture improves the maintenance of cultured liver tissue slices[J]. Tissue Eng, 2007, 13(1): 197-205. DOI:10.1089/ten.2006.0046 |
| [9] |
TOUTAIN H J, MORONVALLE-HALLEY V, SARSAT J P, et al. Morphological and functional integrity of precision-cut rat liver slices in rotating organ culture and multiwell plate culture: effects of oxygen tension[J]. Cell Biol Toxicol, 1998, 14(3): 175-190. DOI:10.1023/A:1007458408863 |
| [10] |
VICKERS A E M, SAULNIER M, CRUZ E, et al. Organ slice viability extended for pathway characterization: an in vitro model to investigate fibrosis[J]. Toxicol Sci, 2004, 82(2): 534-544. DOI:10.1093/toxsci/kfh285 |
| [11] |
FISHER R L, VICKERS A E M. Preparation and culture of precision-cut organ slices from human and animal[J]. Xenobiotica, 2013, 43(1): 8-14. DOI:10.3109/00498254.2012.728013 |
| [12] |
DE KANTER R, MONSHOUWER M, MEIJER D K F, et al. Precision-cut organ slices as a tool to study toxicity and metabolism of xenobiotics with special reference to non-hepatic tissues[J]. Curr Drug Metab, 2002, 3(1): 39-59. DOI:10.2174/1389200023338071 |
| [13] |
MARTIN C, UHLIG S, ULLRICH V. Cytokine-induced bronchoconstriction in precision-cut lung slices is dependent upon cyclooxygenase-2 and thromboxane receptor activation[J]. Am J Respirat Cell Mol Biol, 2001, 24(2): 139-145. DOI:10.1165/ajrcmb.24.2.3545 |
| [14] |
WANG I, POLITI A Z, TANIA N, et al. A mathematical model of airway and pulmonary arteriole smooth muscle[J]. Biophys J, 2008, 94(6): 2053-2064. DOI:10.1529/biophysj.107.113977 |
| [15] |
DASSOW C, WIECHERT L, MARTIN C, et al. Biaxial distension of precision-cut lung slices[J]. J Appl Physiol, 2010, 108(3): 713-721. DOI:10.1152/japplphysiol.00229.2009 |
| [16] |
VICKERS A E, JIMENEZ R M, SPAANS M C, et al. Human and rat lung biotransformation of cyclosporin A and its derivatives using slices and bronchial epithelial cells[J]. Drug Metab Dispos, 1997, 25(7): 873-880. |
| [17] |
HARRIGAN J A, VEZINA C M, MCGARRIGLE B P, et al. DNA adduct formation in precision-cut rat liver and lung slices exposed to benzo[J]. Toxicol Sci, 2004, 77(2): 307-314. DOI:10.1093/toxsci/kfh030 |
| [18] |
BANERJEE S K, HUCKUNTOD S D, MILLS S D, et al. Modeling pneumonic plague in human precision-cut lung slices highlights a role for the plasminogen activator protease in facilitating type 3 secretion[J]. Infect Immun, 2019, 87(8): e00175. |
| [19] |
DELGADO-ORTEGA M, MELO S, PUNYADARSANIYA D, et al. Innate immune response to a H3 N2 subtype swine influenza virus in newborn porcine trachea cells, alveolar macrophages, and precision-cut lung slices[J]. Vet Res, 2014, 45: 42. DOI:10.1186/1297-9716-45-42 |
| [20] |
PUNYADARSANIYA D, LIANG C H, WINTER C, et al. Infection of differentiated porcine airway epithelial cells by influenza virus: differential susceptibility to infection by porcine and avian viruses[J]. PLoS One, 2011, 6(12): e28429. DOI:10.1371/journal.pone.0028429 |
| [21] |
MCBRIDE S, RANNIE D, HARRISON D J. Gene transfer to adult human lung tissue ex vivo[J]. Gene Ther, 2000, 7(8): 675-678. DOI:10.1038/sj.gt.3301146 |
| [22] |
ALSAFADI H N, UHL F E, PINEDA R H, et al. Applications and approaches for three-dimensional precision-cut lung slices. disease modeling and drug discovery[J]. Am J Respirat Cell Mol Biol, 2020, 62(6): 681-691. DOI:10.1165/rcmb.2019-0276TR |
| [23] |
DE KANTER R, TUIN A, VAN DE KERKHOF E, et al. A new technique for preparing precision-cut slices from small intestine and colon for drug biotransformation studies[J]. J Pharmacol Toxicol Methods, 2005, 51(1): 65-72. DOI:10.1016/j.vascn.2004.07.007 |
| [24] |
LI M, VOKRAL I, EVERS B, et al. Human and rat precision-cut intestinal slices as ex vivo models to study bile acid uptake by the apical sodium-dependent bile acid transporter[J]. Eur J Pharmaceut Sci, 2018, 121: 65-73. DOI:10.1016/j.ejps.2018.05.005 |
| [25] |
POSSIDENTE M, DRAGONI S, FRANCO G, et al. Rat intestinal precision-cut slices as an in vitro model to study xenobiotic interaction with transporters[J]. Eur J Pharm Biopharm, 2011, 79(2): 343-348. DOI:10.1016/j.ejpb.2011.04.004 |
| [26] |
MARTIGNONI M, GROOTHUIS G, DE KANTER R. Comparison of mouse and rat cytochrome P450-mediated metabolism in liver and intestine[J]. Drug Metab Disposit, 2006, 34(6): 1047-1054. DOI:10.1124/dmd.105.009035 |
| [27] |
VAN DE KERKHOF E G, DE GRAAF I A M, GROOTHUIS G M M. In vitro methods to study intestinal drug metabolism[J]. Curr Drug Metab, 2007, 8(7): 658-675. DOI:10.2174/138920007782109742 |
| [28] |
NIU X Y, DE GRAAF I A M, VAN DER BIJ H A, et al. Precision cut intestinal slices are an appropriate ex vivo model to study NSAID-induced intestinal toxicity in rats[J]. Toxicol in Vitro, 2014, 28(7): 1296-1305. DOI:10.1016/j.tiv.2014.06.010 |
| [29] |
PUNYADARSANIYA D, WINTER C, MORK A K, et al. Precision-cut intestinal slices as a culture system to analyze the infection of differentiated intestinal epithelial cells by avian influenza viruses[J]. J Virol Methods, 2015, 212: 71-75. DOI:10.1016/j.jviromet.2014.10.015 |
| [30] |
GORE E, BIGAEVA E, OLDENBURGER A, et al. PI3K inhibition reduces murine and human liver fibrogenesis in precision-cut liver slices[J]. Biochem Pharmacol, 2019, 169: 113633. DOI:10.1016/j.bcp.2019.113633 |
| [31] |
COOMBES J D, CHOI S S, SWIDERSKA-SYN M, et al. Osteopontin is a proximal effector of leptin-mediated non-alcoholic steatohepatitis (NASH) fibrosis[J]. Biochim Biophys Acta Mol Basis Dis, 2016, 1862(1): 135-144. DOI:10.1016/j.bbadis.2015.10.028 |
| [32] |
KLASSEN L W, THIELE G M, DURYEE M J, et al. An in vitro method of alcoholic liver injury using precision-cut liver slices from rats[J]. Biochem Pharmacol, 2008, 76(3): 426-436. DOI:10.1016/j.bcp.2008.05.012 |
| [33] |
PALMA E, DOORNEBAL E J, CHOKSHI S. Precision-cut liver slices: a versatile tool to advance liver research[J]. Hepatol Internat, 2019, 13(1): 51-57. DOI:10.1007/s12072-018-9913-7 |
| [34] |
LAGAYE S, SHEN H, SAUNIER B, et al. Efficient replication of primary or culture hepatitis C virus isolates in human liver slices: a relevant ex vivo model of liver infection[J]. Hepatology, 2012, 56(3): 861-872. DOI:10.1002/hep.25738 |
| [35] |
ZIMMERMANN M, ARMEANU S, SMIRNOW I, et al. Human precision-cut liver tumor slices as a tumor patient-individual predictive test system for oncolytic measles vaccine viruses[J]. Int J Oncol, 2009, 34(5): 1247-1256. |
| [36] |
RINGELHAN M, PFISTER D, O'CONNOR T, et al. The immunology of hepatocellular carcinoma[J]. Nat Immunol, 2018, 19(3): 222-232. DOI:10.1038/s41590-018-0044-z |
| [37] |
RUEGG C E. Preparation of precision-cut renal slices and renal proximal tubular fragments for evaluating segment-specific nephrotoxicity[J]. J Pharmacol Toxicol Methods, 1994, 31(3): 125-133. DOI:10.1016/1056-8719(94)90074-4 |
| [38] |
BRANCHFLOWER R V, NUNN D S, HIGHET R J, et al. Nephrotoxicity of chloroform: metabolism to phosgene by the mouse kidney[J]. Toxicol Appl Pharmacol, 1984, 72(1): 159-168. DOI:10.1016/0041-008X(84)90260-6 |
| [39] |
VICKERS A E M, ROSE K, FISHER R, et al. Kidney slices of human and rat to characterize cisplatin-induced injury on cellular pathways and morphology[J]. Toxicol Pathol, 2004, 32(5): 577-590. DOI:10.1080/01926230490508821 |
| [40] |
MATSUMURA Y, KOYAMA Y, SHINYAMA H, et al. Calmodulin-independent stimulation of renin release by exposure of rat kidney cortical slices to calcium[J]. Clin Exp Pharmacol Physiol, 1988, 15(8): 585-590. DOI:10.1111/j.1440-1681.1988.tb01117.x |
| [41] |
POOSTI F, BANSAL R, YAZDANI S, et al. Selective delivery of IFN-γ to renal interstitial myofibroblasts: a novel strategy for the treatment of renal fibrosis[J]. FASEB J, 2015, 29(3): 1029-1042. DOI:10.1096/fj.14-258459 |
| [42] |
STRIBOS E G D, LUANGMONKONG T, LELIVELD A M, et al. Precision-cut human kidney slices as a model to elucidate the process of renal fibrosis[J]. Trans Res, 2016, 170: 8-16. DOI:10.1016/j.trsl.2015.11.007 |
| [43] |
CARRANZA-TORRES I E, VIVEROS-VALDEZ E, GUZMÁN-DELGADO N E, et al. Protective effects of phenolic acids on mercury-induced DNA damage in precision-cut kidney slices[J]. Iran J Basic Med Sci, 2019, 22(4): 367-375. |
| [44] |
PARRISH A R, DORR R T, GANDOLFI A J, et al. Adult rat myocardial slices: A tool for studies of comparative cardiotoxicity[J]. Toxicol in vitro, 1994, 8(6): 1233-1237. DOI:10.1016/0887-2333(94)90114-7 |
| [45] |
NERI B, CINI-NERI G, D'ALTERIO M. Effect of anthracyclines and mitoxantrone on oxygen uptake and ATP intracellular concentration in rat heart slices[J]. Biochem Biophys Res Commun, 1984, 125(3): 954-960. DOI:10.1016/0006-291X(84)91376-7 |
| [46] |
FISCHER P W F, GIROUX A. Effects of dietary magnesium on sodium-potassium pump action in the heart of rats[J]. J Nutr, 1987, 117(12): 2091-2095. DOI:10.1093/jn/117.12.2091 |
| [47] |
WANLESS R B, NOBLE M I M, DRAKE-HOLLAND A J D. The mechanisms of action of noradrenaline on ouabain-sensitive rubidium uptake in guinea-pig myocardium[J]. Clin Sci (Lond), 1985, 69(6): 737-743. DOI:10.1042/cs0690737 |
| [48] |
STUCKMANN I, EVANS S, LASSAR A B. Erythropoietin and retinoic acid, secreted from the epicardium, are required for cardiac myocyte proliferation[J]. Dev Biol, 2003, 255(2): 334-349. DOI:10.1016/S0012-1606(02)00078-7 |
| [49] |
FISCHER C, MILTING H, FEIN E, et al. Long-term functional and structural preservation of precision-cut human myocardium under continuous electromechanical stimulation in vitro[J]. Nat Commun, 2019, 10(1): 117. DOI:10.1038/s41467-018-08003-1 |
| [50] |
HANNES T, HALBACH M, NAZZAL R, et al. Biological pacemakers: characterization in an in vitro coculture model[J]. J Electrocardiol, 2008, 41(6): 562-566. DOI:10.1016/j.jelectrocard.2008.06.017 |
| [51] |
BAVEREL G, KNOUZY B, GAUTHIER C, et al. Use of precision-cut renal cortical slices in nephrotoxicity studies[J]. Xenobiotica, 2013, 43(1): 54-62. DOI:10.3109/00498254.2012.725142 |
| [52] |
VICKERS A E M, FISHER R L. Evaluation of drug-induced injury and human response in precision-cut tissue slices[J]. Xenobiotica, 2013, 43(1): 29-40. DOI:10.3109/00498254.2012.732714 |
| [53] |
李婧婷, 汪晖, 潘晓靓, 等. 醋氨酚所致精密肝切片损伤模型的建立及CYP2E1的调节作用[J]. 中国临床药理学与治疗学, 2008, 13(1): 46-50. LI J T, WANG H, PAN X L, et al. Establishment of an acetaminophen-induced hepatotoxicity model of precision-cut liver slices and the regulation of cytochrome P450 2E1[J]. Chinese Journal of Clinical Pharmacology and Therapeutics, 2008, 13(1): 46-50. DOI:10.3969/j.issn.1009-2501.2008.01.011 (in Chinese) |
| [54] |
郭喻. 肝纤维化精密切片技术的建立及其在药物代谢研究中的应用[D]. 武汉: 武汉大学, 2005. GUO Y. Establishment of fibrotic rat precision-cut liver slice technique and its application in drug metabolism[D]. Wuhan: Wuhan University, 2005. (in Chinese) |
| [55] |
DE KANTER R, MONSHOUWER M, DRAAISMA A L, et al. Prediction of whole-body metabolic clearance of drugs through the combined use of slices from rat liver, lung, kidney, small intestine and colon[J]. Xenobiotica, 2004, 34(3): 229-241. DOI:10.1080/004982502000196758 |
(编辑 白永平)



