2. 德州市畜牧兽医事业发展中心,德州 253000
2. Dezhou Animal Husbandry and Veterinary Development Center, Dezhou 253000, China
鹿茸是一种能够完全再生的骨质器官,为雄性鹿科动物第二性征。鹿茸生长周期在100 d左右,呈“S”型生长,最快生长速度可达2.75 cm·d-1或300 g·d-1[1]。鹿茸细胞的增殖速率比癌细胞快30倍,但有序、可控,是研究骨骼快速生长、骨质疏松的良好模型。茸尖被认为是鹿茸的生长中心,以软骨内成骨方式驱动鹿茸的快速生长过程。近些年,利用RNA-seq、iTRAQ、label-free等组学技术对鹿茸的基因、蛋白质表达动态进行了详细研究,并筛选到了与鹿茸快速生长相关的基因、信号通路[2-5]。
继基因组、转录组、蛋白质组学,又衍生出了代谢组学(metabonomics),主要研究生物体相对分子质量小于1 000的内源性小分子代谢物的种类、数量及其在内外因素作用下的变化规律,如氨基酸、脂质、核苷等化合物[6]。与基因组、蛋白质组相比,代谢组更能直观地反映生物体对环境变化的响应,且可以放大基因组、蛋白质组的微小改变,是对基因组学、蛋白质组学的有力补充与相互印证。目前,代谢组学技术已广泛应用于中医药研究、临床疾病诊断、化学生态学、环境科学、毒理研究等多个科学领域[7-8]。
随着质谱技术的不断发展,代谢组学技术也逐渐应用在鹿茸组分的研究。孙伟丽等[9]、刘文媛等[10]、唐丽昕等[11]利用UPLC-QTOF/MS代谢组学技术,对不同区段鹿茸的内源性小分子代谢进行了鉴定与差异分析;张楠茜等[12]对比分析了鹿茸热炮制前后的化学组成差异;Su等[13]利用代谢组学技术分析了梅花鹿和马鹿鹿茸之间的代谢物差异;本课题组前期利用UPLC-QTOF/MS技术对梅花鹿静脉血与鹿茸血小分子代谢物成分进行了对比分析,发现了天然抗氧化剂-麦角硫因在鹿茸血中含量显著高于静脉血[14]。
代谢组学技术不仅可以分析鹿茸组分,也是探究鹿茸复杂生长机制的一种重要技术手段。本研究利用UPLC-QTOF/MS技术对生长25、45、65、100与130 d的梅花鹿鹿茸进行代谢组学研究,分析小分子代谢物在鹿茸生长发育过程中的表达变化,为鹿茸快速生长、骨化分子调控机制的解析奠定基础。
1 材料与方法 1.1 试验材料本试验所需的梅花鹿鹿茸取自中国农业科学院特产研究所试验动物基地。选取体况良好的4岁龄雄性东北梅花鹿,收取生长25、45、65、100与130 d的鹿茸,每时期样品分别取自不同的3头梅花鹿做为生物学重复。用PBS缓冲液将新鲜鹿茸组织表面的血液与污渍冲洗干净,然后选取鹿茸的尖部,去除茸皮,并将其切成1 mm3小块,用液氮研磨仪研磨成粉末,-80 ℃保存备用。
1.2 主要试剂与仪器乙腈购自Merck公司,甲醇、乙酸铵购自Honeywell公司(均为LC-MS级别);质谱仪5600/6600购自AB SCIEX公司,超高压液相色谱仪1290购自Agilent公司,低温高速离心机5430R购自Eppendorf公司;液相色谱柱均购自Waters公司,ACQUITY UPLC BEH Amide column (1.7 μm,2.1 mm× 100 mm),ACQUITY UPLC HSS B3 column(1.8 μm,2.1 mm×100 mm)。
1.3 样本预处理每份样品分别称取80 mg至1.5 mL离心管中,加入800 μL甲醇乙腈水溶液(体积比2∶2∶1),涡旋混匀30 s,冰上超声30 min,-20 ℃静置1 h;之后4 ℃,13 000 r·min-1离心15 min;小心地取出上清溶液,冷冻干燥,甲醇乙腈水溶液复溶。每个样本各取10 μL混合成QC质控样本。
1.4 HPLC-MS分析试验所用液质联用系统由Aglient 1290 Infinity LC串联AB Sciex Triple TOF 5600高分辨质谱仪组成。所使用的色谱柱为Waters的UPLC BEH Amide色谱柱。柱温设置25 ℃,正离子扫描模式进样量3 μL,负离子扫描模式进样量4 μL。每进6个样品后加入一个QC样品。流动相为25 mmol·L-1醋酸铵及25 mmol·L-1氨水的水溶液(A液),纯乙腈(B液),梯度洗脱程序见表 1;整个分析过程中样品置于4 ℃自动进样器中。
|
|
表 1 液相洗脱梯度 Table 1 Gradient of HPLC |
利用AB 5600 Triple TOF质谱仪进行一级、二级质谱数据采集。ESI离子源参数设置如下:雾化气压:40 Psi,辅助气压:80 Psi,气帘气压:30 Psi,温度:650 ℃,喷雾电压:5 000 V(正、负两种离子扫描模式)。二级质谱碰撞能量(35±15)eV。数据采集按照分段模式进行:50~300,290~600,590~900,890~1 200 m·z-1。所采集获得的数据分别使用自建MetDDA和LipDDA方法,进行代谢物的结构鉴定。
1.5 数据处理原始数据经ProteoWizard转换成.mzXML格式,然后采用XCMS程序进行峰对齐、保留时间校正和提取峰面积。数据经Pareto-scaling预处理后,进行多维统计分析,包括无监督主成分分析(principal component analysis,PCA)和正交偏最小二乘法判别分析(OPLS-DA)[15]。单维统计分析包括Student’s t-test和变异倍数分析。利用MetaboAnalyst 5.0在线软件进行代谢物的通路富集分析[16]。代谢物结构鉴定采用精确质量数匹配(< 25 ppm) 和二级谱图匹配的方式,检索自建数据库。
2 结果 2.1 试验质量控制对比6份相同QC样本的正、负离子检测模式下的总离子流图,结果显示,各QC样本的色谱峰响应强度和保留时间基本重叠且基线稳定,说明在整个试验过程中仪器误差引起的变异较小(图 1)。采用XCMS软件对梅花鹿鹿茸样品的代谢物离子峰进行提取,正离子模式下共提取到保留峰12 063个,负离子模式下提取到8 974个。

|
A、B. 分别为QC样品在正、负离子模式下TIC重叠图谱 A, B. The TIC overlap spectra of QC samples in the positive and negative ion modes, respectively 图 1 试验样品质量控制 Fig. 1 Sample quality control |
分别对各样品的数据进行Pareto-scaling处理,然后进行样品间主成分分析(PCA)与层次聚类分析。结果显示,各时期鹿茸在PC1(34.3%)维度上显著分离(图 2A)。样品层次聚类结果显示,5个时期样品可以分为两类(图 2B),第一类包括25、45、65 d三个时期鹿茸,第二类包括100与130 d两个时期鹿茸。
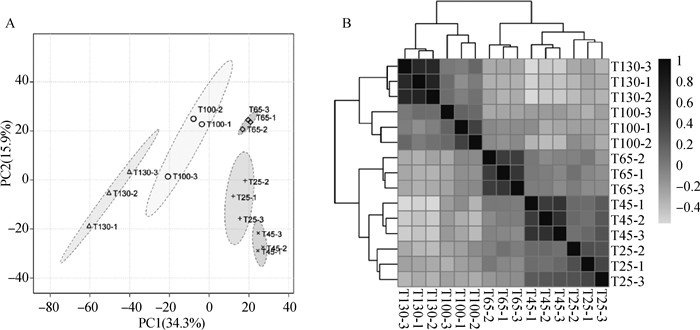
|
A. 鹿茸样品PCA分析;B. 鹿茸样品层次聚类分析 A. PCA analysis of antler; B. Hierarchical cluster analysis of antler 图 2 不同生长时期鹿茸样品统计分析 Fig. 2 Statistical analysis of antler samples in different growth periods |
为筛选鹿茸不同生长时期的显著差异表达代谢物,首先进行正交偏最小二乘判别分析(OPLS-DA)。OPLS-DA是一种有监督的判别分析统计方法,通过运用偏最小二乘回归建立代谢物表达量与样品间的关系模型,来实现对样品类别的预测;同时通过计算变量投影重要度(VIP)来衡量各代谢物的表达模式对各样本分类的影响强度和解释能力。最终设定显著差异代谢物筛选标准:VIP>1,P < 0.05,|fold change|>2。结果共鉴定到171种显著差异表达代谢物,其中T25 vs. T45有39种差异代谢物,T45 vs. T65组有7种差异代谢物,T65 vs. T100组有70种差异代谢物;T100 vs. T130组有84种差异代谢物(图 3)。
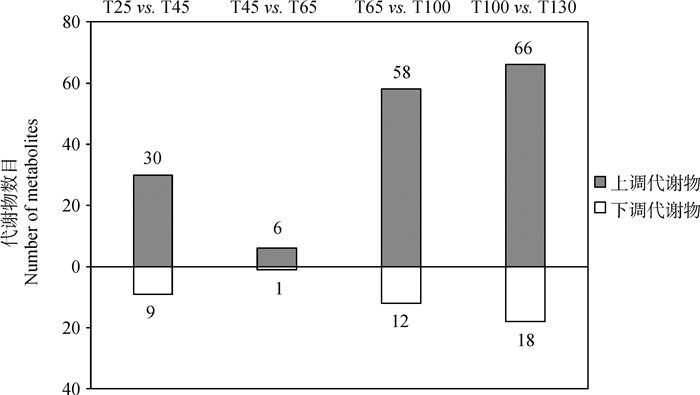
|
图 3 显著差异表达代谢物 Fig. 3 Significant differentially expressed metabolites |
差异代谢物匹配到HMDB数据库的112种化合物,可分为7大类,分别为有机酸及其衍生物类,脂质和类脂质分子,核苷、核苷酸和类似物,有机氮化合物,有机氧化合物,有机杂环化合物以及苯类化合物(图 4)。
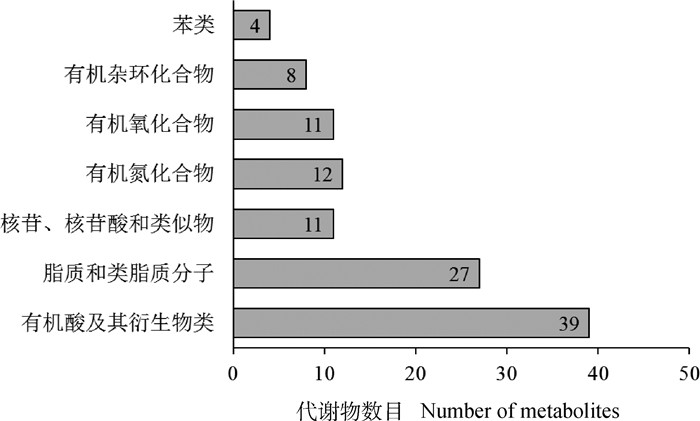
|
图 4 基于HMDB数据库的差异代谢物分类 Fig. 4 Classification of differential metabolites based on HMDB database |
有机酸及其衍生物类有39种显著差异代谢物,其中29种为氨基酸,包括L-亮氨酸、L-苯丙氨酸、D-脯氨酸、L-谷氨酰胺、L-精氨酸、L-丙氨酸、L-焦谷氨酸、N-乙酰-L-天冬氨酸、L-天冬氨酸、L-缬氨酸、甘氨酸、L-瓜氨酸、L-丝氨酸、L-蛋氨酸、L-谷氨酸、D-天冬氨酸、L-组氨酸等。除L-焦谷氨酸、L-组氨酸外,其他氨基酸类化合物均在鹿茸生长期表达上调;而L-焦谷氨酸、L-组氨酸、L-肌肽(β-丙氨酰-L-组氨酸)与阿坎酸等有机酸类化合物在100 d含量最高,随后在130 d时显著下降。所有有机酸及其衍生物类化合物均在130 d时表达显著下调。
脂质和类脂质分子是差异代谢物的第二大类,包含了27种差异代谢物。其中13种为脂肪酸化合物,包括羟基异己酸、3-羟基-3-甲基戊二酸、乙酰肉碱、肉豆蔻酸、十五烷酸、cis-9-棕榈油酸、十七烷酸、油酸、16-羟基棕榈酸、花生酸、山嵛酸、L-棕榈酰肉碱、硬脂酰肉碱等,其中L-棕榈酰肉碱在骨化期上调,其他均在生长期上调;6种为类固醇类代谢物,其中鹅去氧胆酸盐、胆酸在25 d含量上调,甘胆酸在100 d时显著上调,而胆钙化醇、甾醇在130 d时显著上调;此外,还包含有3种类花生酸化合物,15-脱氧-Δ12, 14-前列腺素J2、前列腺素H2、前列腺素I2均在130 d显著上调。
核苷、核苷酸和类似物包含了11种显著差异代谢物。8种为嘌呤核苷酸,包括脱氧肌苷、肌苷、腺苷、N6-甲基腺苷、鸟苷、黄嘌呤核苷、2-甲基鸟苷、1-甲基鸟苷等,其中肌苷与鸟苷在100 d时含量最高,所有嘌呤核苷酸类代谢物均在130 d时表达显著下调。有机氮化合物包含了12种差异代谢物,其中组胺、鞘氨醇、鞘氨醇、植物鞘氨醇、亚油酰乙醇酰胺、N-油酰乙醇胺等胺类化合物均在130 d含量显著上调。
有机氧化合物有11种,主要为碳水化合物或碳水化合物结合物,这些化合物均在130 d时含量显著下调,包括甘油酸、L-山梨糖、D-甘露糖、α-D-葡萄糖、N-乙酰基-D-氨基葡萄糖、L-苏糖酸盐、D-葡萄糖酸盐、D-核糖、N-乙酰甘露糖胺、N-乙酰神经氨酸等。有机杂环化合物有8种,其中5-甲基胞嘧啶、二氢胸腺嘧啶、次黄嘌呤、2-羟基腺嘌呤在100 d显著上调;尿囊素、L-色氨酸在130 d时下调。苯类差异代谢物有4种,其中酪胺、多巴胺、马尿酸等在130 d下调。
2.5 差异代谢物通路富集分析差异代谢物共显著富集到13种KEGG代谢通路(P < 0.05),分别为氨酰-tRNA生物合成,组氨酸代谢,精氨酸生物合成,丙氨酸、天冬氨酸和谷氨酸代谢,甘氨酸、丝氨酸和苏氨酸代谢,缬氨酸、亮氨酸和异亮氨酸生物合成,乙醛酸和二羧酸代谢,苯丙氨酸、酪氨酸和色氨酸生物合成,苯丙氨酸代谢,嘌呤代谢,甘油磷脂代谢,泛酸和CoA生物合成,谷胱甘肽代谢等代谢通路(图 5)。组氨酸代谢通路见图 6。
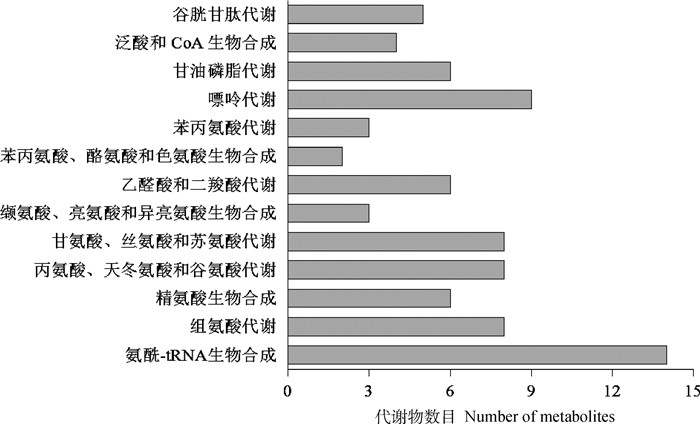
|
图 5 差异代谢物代谢通路分析 Fig. 5 Differential metabolite metabolic pathway analysis |

|
代谢物上方的热图代表 25、45、65、100、130 d的相对含量。红色代表上调,蓝色代表下调 Heatmaps above metabolites represent relative amounts at 25, 45, 65, 100, 130 d. Red represents up-regulation, blue represents down-regulation 图 6 组氨酸代谢通路 Fig. 6 Histidine metabolism pathway |
鹿茸生长过程可分为生长期与骨化期[17],其生长速度、相对骨质密度以及基因、蛋白质的表达模式均有显著差异。本研究发现,生长期与骨化期在代谢组水平也存在显著差异,且筛选到了171种显著差异表达代谢物,主要为氨基酸类、脂质、核苷酸类等化合物。
鹿茸中含有丰富的氨基酸,其总量占鹿茸干重的30%~50%,其中天冬氨酸、谷氨酸、脯氨酸、甘氨酸、精氨酸等氨基酸占氨基酸总量的32.5%~37.2%,这主要是由于胶原蛋白的存在[18]。KEGG富集结果显示,氨基酸代谢在鹿茸生长发育过程中发生了显著变化,如组氨酸、精氨酸、丙氨酸、天冬氨酸、谷氨酸、甘氨酸、丝氨酸、苏氨酸、缬氨酸、亮氨酸和异亮氨酸代谢。除L-组氨酸外,其他氨基酸均在鹿茸生长期表达上调。这与前期蛋白质组学研究结果是一致的,参与翻译起始、蛋白折叠、蛋白转运等生物学过程的蛋白质在生长期表达上调[2]。另一类在生长期表达上调的化合物为有机酸类,其中柠檬酸、磷酸烯醇式丙酮酸、L-苹果酸、琥珀酸等都是三羧酸循环的中间产物。三羧酸循环是机体将糖或其他物质氧化而获得能量的最有效方式,能够为机体的生命活动提供大量能力。因而,三羧酸循环相关化合物可提供鹿茸快速生长所需的能量供应。
组氨酸代谢是差异代谢物显著富集通路之一,涉及到了L-组氨酸、组胺、肌肽、鹅肌肽等。组氨酸是合成蛋白质所必需的,在酶的活性位点起着重要作用,如丝氨酸蛋白酶[19]。肌肽与鹅肌肽是由β-丙氨酸和L-组氨酸两种氨基酸组成的内源性二肽[20],鹅肌肽可由肌肽-N-甲基转移酶1(CARNMT1)催化肌肽形成[21]。肌肽富含在脊椎动物的肌肉和大脑组织中,在体内发挥多种生物效应,包括抗炎[22]、抗氧化[23]、抗衰老[24]、抗糖基化[25]等,也有研究发现肌肽可能通过抑制β-catenin信号通路调控的成骨因子转录生成和细胞凋亡,而抑制血管平滑肌细胞钙化[26]。组氨酸可以在组氨酸脱羧酶的酶解下形成组胺。组胺是一种重要的化学介质,主要由肥大细胞合成,参与胚胎发育[27]、组织再生[28-29]、伤口愈合[30]、免疫[31]、骨代谢[32]。有研究证实,组氨酸脱羧酶敲除OVX(卵巢切除术)小鼠的骨小梁丢失减少。同时,组胺也可以增加破骨细胞和破骨细胞前体的数量,而组胺受体1和组胺受体2的拮抗剂则降低了破骨细胞的招募和骨吸收[33-34]。进一步有研究证明,组胺是通过RANKL-RANK信号通路诱导破骨细胞分化的[35],而且组胺能通过刺激牙龈成纤维细胞IL-2、IL-4表达升高,间接促使前列腺素E2的分泌表达。因此,组氨酸代谢通路可能参与了鹿茸快速骨化过程的调控。
脂类化合物在鹿茸生长过程中也发生了显著差异变化,其中前列腺素H2、前列腺素I2、前列腺素J2等参与了前列腺素生物合成过程。前列腺素H2是所有前列腺素生物合成的第一个中间体,其中前列腺素E2是骨代谢的重要调节剂,体外注射可增加骨小梁表面的成骨细胞数量[36],诱导新生松质骨形成,促进骨折愈合[37]。Weinreb等[38]发现,前列腺素E2可通过结合EP4受体,激活鞘氨醇激酶,抑制caspase活性,从而增加大鼠骨髓成骨基质细胞的数量。此外,前列腺素E2还可直接刺激成骨细胞分化,或通过刺激成骨细胞中RANKL表达,抑制骨保护素的表达,而间接刺激破骨细胞分化,进而调控骨重塑[39]。因此可以推测,前列腺素合成通路在鹿茸生长发育过程中也同样发挥重要的作用。
4 结论本试验利用UHPLC-TOF-MS技术对不同生长时期的梅花鹿鹿茸进行代谢组学分析,结果共检测到了171种显著差异代谢物,其中L-组氨酸、L-肌肽、组胺、前列腺素等化合物在骨化期表达上调,推测这些化合物可能参与了鹿茸的快速骨化过程。本研究从代谢组水平为鹿茸快速生长与骨化分子机制的探究提供数据支撑。
| [1] |
LANDETE-CASTILLEJOS T, KIERDORF H, GOMEZ S, et al. Antlers-evolution, development, structure, composition, and biomechanics of an outstanding type of bone[J]. Bone, 2019, 128: 115046. DOI:10.1016/j.bone.2019.115046 |
| [2] |
ZHANG R R, LI Y, XING X M. Comparative antler proteome of sika deer from different developmental stages[J]. Sci Rep, 2021, 11(1): 10484. DOI:10.1038/s41598-021-89829-6 |
| [3] |
ZHAO Y, YAO B J, ZHANG M, et al. Comparative analysis of differentially expressed genes in Sika deer antler at different stages[J]. Mol Biol Rep, 2013, 40(2): 1665-1676. DOI:10.1007/s11033-012-2216-5 |
| [4] |
DONG Z, BA H X, ZHANG W, et al. iTRAQ-based quantitative proteomic analysis of the potentiated and dormant antler stem cells[J]. Int J Mol Sci, 2016, 17(11): 1778. DOI:10.3390/ijms17111778 |
| [5] |
张然然, 刘华淼, 王磊, 等. 不同生长时期梅花鹿鹿茸转录组分析[J]. 畜牧兽医学报, 2017, 48(2): 235-242. ZHANG R R, LIU H M, WANG L, et al. Transcriptome analysis of sika deer antlers at different stages[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(2): 235-242. (in Chinese) |
| [6] |
NICHOLSON J K, LINDON J C. Systems biology: Metabonomics[J]. Nature, 2008, 455(7216): 1054-1056. DOI:10.1038/4551054a |
| [7] |
NICHOLSON J K, LINDON J C, HOLMES E. 'Metabonomics': understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data[J]. Xenobiotica, 1999, 29(11): 1181-1189. DOI:10.1080/004982599238047 |
| [8] |
NICHOLSON J K, CONNELLY J, LINDON J C, et al. Metabonomics: a platform for studying drug toxicity and gene function[J]. Nat Rev Drug Discov, 2002, 1(2): 153-161. DOI:10.1038/nrd728 |
| [9] |
孙伟丽, 赵海平, 王雪华, 等. 基于代谢组学技术分析不同区段鹿茸差异代谢分子物质[J]. 中草药, 2019, 50(20): 5047-5053. SUN W L, ZHAO H P, WANG X H, et al. Analysis on differential metabolites of Cervi Cornu Pantotrichum based on metabolomics[J]. Chinese Traditional and Herbal Drugs, 2019, 50(20): 5047-5053. DOI:10.7501/j.issn.0253-2670.2019.20.029 (in Chinese) |
| [10] |
刘文媛, 李春义, 巴恒星, 等. 鹿茸4个区段非靶向代谢组学研究[J]. 吉林农业大学学报, 2020, 42(4): 454-466. LIU W Y, LI C Y, BA H X, et al. Untargeted metabolomics of four portions of velvet antlers in sika deer (Cervus nippon)[J]. Journal of Jilin Agricultural University, 2020, 42(4): 454-466. (in Chinese) |
| [11] |
唐丽昕, 张然然, 刘华淼, 等. 梅花鹿蜡片茸与血片茸脂质组分比较研究[J]. 特产研究, 2020, 42(3): 1-5, 11. TANG L X, ZHANG R R, LIU H M, et al. Comparative study on lipids of antler wax and blood slices for sika deer[J]. Special Wild Economic Animal and Plant Research, 2020, 42(3): 1-5, 11. (in Chinese) |
| [12] |
张楠茜, 孙慧, 吕经纬, 等. 基于液质联用技术结合多元统计分析的鹿茸热炮制机理研究[J]. 时珍国医国药, 2020, 31(2): 327-330. ZHANG N X, SUN H, LÜ J W, et al. Study on the mechanism of heat processing of pilose antler by the combination of liquid and mass technology and multivariate statistical analysis[J]. Lishizhen Medicine and Materia Medica Research, 2020, 31(2): 327-330. (in Chinese) |
| [13] |
SU H, YANG C H, JIN C R, et al. Comparative metabolomics study revealed difference in central carbon metabolism between sika deer and red deer antler[J]. Int J Genomics, 2020, 2020: 7192896. |
| [14] |
张然然, 王磊, 李洋, 等. 基于代谢组学技术的鹿血与鹿茸血鉴别研究[J]. 畜牧兽医学报, 2018, 49(7): 1533-1539. ZHANG R R, WANG L, LI Y, et al. Distinguishing for the deer blood and antler blood by metabolomics approach[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(7): 1533-1539. (in Chinese) |
| [15] |
WORLEY B, POWERS R. Multivariate analysis in metabolomics[J]. Curr Metabolomics, 2013, 1(1): 92-107. |
| [16] |
PANG Z Q, CHONG J, ZHOU G Y, et al. MetaboAnalyst 5.0:narrowing the gap between raw spectra and functional insights[J]. Nucleic Acids Res, 2021, 49(W1): W388-W396. DOI:10.1093/nar/gkab382 |
| [17] |
高志光. 梅花鹿鹿茸生长与骨化关系的研究[J]. 特产研究, 1999(3): 51-53. GAO Z G. Study on the relationship between antler growth and ossification in sika deer[J]. Special Wild Economic Animal and Plant Research, 1999(3): 51-53. (in Chinese) |
| [18] |
JEON B, KIM S, LEE S, et al. Effect of antler growth period on the chemical composition of velvet antler in sika deer (Cervus nippon)[J]. Mamm Biol, 2009, 74(5): 374-380. DOI:10.1016/j.mambio.2008.07.005 |
| [19] |
BROSNAN M E, BROSNAN J T. Histidine metabolism and function[J]. J Nutr, 2020, 150(S1): 2570S-2575S. |
| [20] |
王西汐, 李雯晖, 张健, 等. 组氨酸二肽及其功能性研究进展[J]. 食品研究与开发, 2022, 43(7): 213-218. WANG X X, LI W H, ZHANG J, et al. Progress in investigations of histidine dipeptide and its functions[J]. Food Research and Development, 2022, 43(7): 213-218. (in Chinese) |
| [21] |
王雨晴, 陈亮, 贾福怀, 等. UHPLC-ESI-MS/MS法测定动物源食物提取物中肌肽与鹅肌肽的含量[J]. 分析测试学报, 2018, 37(11): 1328-1333. WANG Y Q, CHEN L, JIA F H, et al. Determination of carnosine and anserine in animal-derived food extracts by UHPLC-ESI-MS/MS[J]. Journal of Instrumental Analysis, 2018, 37(11): 1328-1333. DOI:10.3969/j.issn.1004-4957.2018.11.008 (in Chinese) |
| [22] |
IMPELLIZZERI D, SIRACUSA R, CORDARO M, et al. Protective effect of a new hyaluronic acid -carnosine conjugate on the modulation of the inflammatory response in mice subjected to collagen-induced arthritis[J]. Biomed Pharmacother, 2020, 125: 110023. |
| [23] |
BOLDYREV A, BULYGINA E, LEINSOO T, et al. Protection of neuronal cells against reactive oxygen species by carnosine and related compounds[J]. Comp Biochem Physiol B Biochem Mol Biol, 2004, 137(1): 81-88. |
| [24] |
HIPKISS A R, BAYE E, DE COURTEN B. Carnosine and the processes of ageing[J]. Maturitas, 2016, 93: 28-33. |
| [25] |
夏莉, 章诗琪, 胡红琳, 等. 肌肽对糖尿病肾病的保护作用[J]. 安徽医学, 2017, 38(1): 111-114. XIA L, ZHANG S Q, HU H L, et al. Protective effect of carnosine on diabetic nephropathy[J]. Anhui Medical Journal, 2017, 38(1): 111-114. (in Chinese) |
| [26] |
金朝霞, 徐成胜. 肌肽对血管平滑肌细胞钙化的影响及机制研究[J]. 河北医学, 2022, 28(3): 358-362. JIN Z X, XU C S. Study of the effect of carnosine on vascular smooth muscle cell calcification and its mechanism[J]. Hebei Medicine, 2022, 28(3): 358-362. (in Chinese) |
| [27] |
刘诺亚. 组胺H3受体拮抗剂在小鼠胚胎干细胞神经分化早期作用研究[D]. 杭州: 浙江大学, 2021. LIU N Y. Role of histamine H3 receptor antagonist in early neural differentiation of mouse embryonic stem cells[D]. Hangzhou: Zhejiang University, 2021. (in Chinese) |
| [28] |
ZHU X W, DING S L, LI H, et al. Disruption of histamine/H1R signaling pathway represses cardiac differentiation and maturation of human induced pluripotent stem cells[J]. Stem Cell Res Ther, 2020, 11(1): 27. |
| [29] |
陈有超. 拮抗组胺H3受体促进脑缺血后血管再生的作用研究[D]. 杭州: 浙江大学, 2019. CHEN Y C. Antagonism of histamine H3 receptor promotes angiogenesis following focal cerebral ischemia[D]. Hangzhou: Zhejiang University, 2019. (in Chinese) |
| [30] |
KOMI D E A, KHOMTCHOUK K, SANTA MARIA P L. A review of the contribution of mast cells in wound healing: involved molecular and cellular mechanisms[J]. Clin Rev Allergy Immunol, 2020, 58(3): 298-312. |
| [31] |
DE LA PAZ SARASOLA M, TÁQUEZ DELGADO M A, NICOUD M B, et al. Histamine in cancer immunology and immunotherapy.Current status and new perspectives[J]. Pharmacol Res Perspect, 2021, 9(5): e00778. |
| [32] |
RAGIPOGLU D, DUDECK A, HAFFNER-LUNTZER M, et al. The role of mast cells in bone metabolism and bone disorders[J]. Front Immunol, 2020, 11: 163. |
| [33] |
KRONER J, KOVTUN A, KEMMLER J, et al. Mast cells are critical regulators of bone fracture-induced inflammation and osteoclast formation and activity[J]. J Bone Miner Res, 2017, 32(12): 2431-2444. |
| [34] |
FITZPATRICK L A, BUZAS E, GAGNE T J, et al. Targeted deletion of histidine decarboxylase gene in mice increases bone formation and protects against ovariectomy-induced bone loss[J]. Proc Natl Acad Sci USA, 2003, 100(10): 6027-6032. |
| [35] |
IKAWA Y, YONEKAWA T, OHKUNI Y, et al. A comparative study of histamine activities on differentiation of osteoblasts and osteoclasts[J]. J Toxicol Sci, 2007, 32(5): 555-564. |
| [36] |
MORI S, JEE W S S, LI X J, et al. Effects of prostaglandin E2 on production of new cancellous bone in the axial skeleton of ovariectomized rats[J]. Bone, 1990, 11(2): 103-113. |
| [37] |
FEIGENSON M, JONASON J H, SHEN J, et al. Inhibition of the prostaglandin EP-1 receptor in periosteum progenitor cells enhances osteoblast differentiation and fracture repair[J]. Ann Biomed Eng, 2020, 48(3): 927-939. |
| [38] |
WEINREB M, SHAMIR D, MACHWATE M, et al. Prostaglandin E2 (PGE2) increases the number of rat bone marrow osteogenic stromal cells (BMSC) via binding the EP4 receptor, activating sphingosine kinase and inhibiting caspase activity[J]. Prostaglandins Leukot Essent Fatty Acids, 2006, 75(2): 81-90. |
| [39] |
PILBEAM C. Prostaglandins and bone[M]//STERN P H. Bone Regulators and Osteoporosis Therapy. Cham: Springer, 2020: 157-175.
|
(编辑 郭云雁)



