2. 华南农业大学实验动物中心,广州 510642
2. Laboratory Animal Center, South China Agricultural University, Guangzhou 510642, China
铜是机体必需的微量元素之一,在增强机体免疫力、调节新陈代谢、参与解毒和造血等方面发挥重要作用[1]。自1945年铜被发现添加在饲料中对动物具有促生长作用后,含铜添加剂在养殖业中得到广泛应用,但是铜的过量或不合理使用不仅会对动物产生毒性作用,还会通过环境污染或食物链危害人类健康[2]。研究表明,过量的铜主要蓄积在肝组织,高水平铜暴露会造成肝细胞的出血、变性和坏死[3-4],然而目前高铜对肝的损伤机制尚不清楚。
线粒体自噬是选择性自噬的一种,可以将受损的线粒体及时清除,是维持线粒体稳态的重要途径。正常生理条件下,线粒体质量控制系统积极地发挥作用,保护线粒体免受应激和损伤,当线粒体发生损伤,线粒体通透性转换孔(mitochondrial permeability transition pore,MPTP)开放,线粒体外膜膜电位丢失,线粒体自噬开始启动调节线粒体质量。细胞焦亡是近几年发现的一种新的程序性细胞死亡方式,是Caspase活化介导的程序性细胞死亡的结果,表现为细胞膜穿孔,细胞肿胀并破裂,内容物的释放并引起强烈的炎性反应。线粒体自噬和细胞焦亡是程序性细胞死亡的不同形式,既是维持机体正常生命活动的保护形式,也可能是机体发生损伤时的表现,它们可以被多种刺激共同激活,参与多种疾病的发生或发展,二者之间存在着复杂的相互调控,线粒体自噬和细胞焦亡通路在重金属中毒性疾病中的研究也得到了广泛关注。大量研究表明,线粒体自噬途径和细胞焦亡参与了多种肝疾病的发生,并且在不同途径诱导的肝损伤中发挥不同作用[5-6]。同时,本课题组前期研究发现,高铜可以诱导线粒体自噬,促进线粒体自噬相关基因的表达[7-8]。为进一步探究高铜对大鼠肝毒性的作用机制,本研究通过对大鼠连续灌胃不同水平的铜建立铜的肝毒性模型,检测线粒体自噬和细胞焦亡途径相关基因和蛋白的表达,旨在为临床铜中毒提供分子病理学研究基础。
1 材料与方法 1.1 实验动物分组与设计120只4周龄SPF级SD大鼠购自广东省医学实验动物中心,随机分为5组(每组24只),以碱式氯化铜(tribasic copper chloride,TBCC)为铜源,灌胃铜含量分别为:0(对照组,灌胃不含铜的同体积分散剂溶液0.5%羧甲基纤维素钠)、20(高铜Ⅰ组)、40(高铜Ⅱ组)、80(高铜Ⅲ组)、160 mg·kg-1(高铜Ⅳ组),各组大鼠自由饮水、采食,连续灌胃63 d。大鼠饲料符合国家实验动物饲料营养标准(GB14924.3—2010),基础日粮中的铜含量为10 mg·kg-1。试验结束后,用1.5%戊巴比妥钠按150 mg·kg-1腹腔注射安乐死,分离肝组织,用提前预冷的生理盐水冲洗,吸干水后一部分组织用4%多聚甲醛溶液固定,剩余的组织立即储存在-80 ℃下待用。本试验经华南农业大学实验动物福利伦理委员会批准(编号:2019e007)。
1.2 试验试剂与仪器TBCC来自北京金润木丰生物营养科技有限公司。TRIzol、Prime Script RT Master Mix购自TaKaRa公司;2×ChamQ SYBR qPCR Master Mix购自南京诺唯赞生物科技有限公司;蛋白一抗购于北京博奥森生物技术有限公司;蛋白二抗、预染Marker、ECL化学发光试剂盒购于广州凯阁生物科技有限公司;蛋白定量测试盒购于南京建成生物工程研究所;多聚甲醛购于Sigma公司;切片石蜡、中性树胶购于国药集团公司;其它试剂均为国产分析纯。
电感耦合等离子体质谱仪ICP-MS,购自美国热电公司;TDZ5-WS型冷冻离心机,购自湖南湘仪实验室仪器开发有限公司;LightCycler480型荧光定量PCR仪,购自美国Bio-Rad公司;5200型凝胶成像系统,购自上海医科大学仪器厂;Unique-R10型超纯水仪,购自厦门锐思捷科学仪器有限公司;DM1000型光学显微镜,购自广州德真科学仪器有限公司。
1.3 肝组织铜含量的测定采集新鲜肝组织,将收集的组织用微波消解系统进行消化,按照食品安全国家标准GB5009.268—2016 《食品中多元素的测定》中ICP-MS法,使用电感耦合等离子体质谱ICP-MS分析样品中的铜含量[9-10]。
1.4 肝组织病理学观察将组织浸泡于4%多聚甲醛溶液中24 h,组织块流水冲洗过夜,酒精梯度脱水,二甲苯透明,石蜡包埋,切片并烘干。二甲苯脱蜡,梯度酒精脱水,苏木精核染,盐酸酒精分色,自来水返蓝,伊红复染,酒精脱色脱水,二甲苯透明,最后用中性树胶进行封片,显微镜观察组织病理变化。
1.5 透射电镜观察各试验组肝组织切碎成小于1 mm3,用2.5%戊二醛固定,用0.1 mol·L-1PBS缓冲液漂洗4次,每次漂洗15 min;再用1%锇酸固定过夜后,再用0.1 mol·L-1 PBS缓冲液漂洗4次,每次漂洗15 min;乙醇进行梯度脱水(30%乙醇、70%乙醇、80%乙醇、90%乙醇、100%乙醇)后,用100%丙酮进行脱水2次,将丙酮与树脂混合液(V/V=3/1)比例渗透4.5 h;丙酮与树脂混合液(V/V=1/1)渗透过夜,再将丙酮与树脂按1∶3的比例渗透7 h;用纯树脂进行包埋过夜,用70 ℃聚合24 h。最后用超薄切片机修块,切片,用醋酸双氧铀和与柠檬酸铅双染色,晾干后,美国FEI公司的Talos L120C型透射电镜中观察。
1.6 实时荧光定量PCR所测基因序列从GenBank中获得,选用管家基因GAPDH作为内参基因,由上海生物工程有限公司(广州合成部)合成,Primer Express 6.0软件设计。引物序列如表 1所示。TRIzol法提取肝总RNA,并用Nanodrop-2000超微量分光光度计检测RNA的总浓度和纯度,RNA反转录严格按照试剂盒说明书进行,生成的cDNA用DEPC水稀释10倍,采用染料法进行RT-qPCR反应,反应体系为10 μL:2×ChamQ SYBR premix Ex TaqTM 5 μL,cDNA 1 μL,上、下游引物各0.4 μL。反应条件:预变性95 ℃ 5 min;95 ℃ 30 s,60 ℃ 30 s,共进行40个循环;检测相关基因的mRNA转录水平。
|
|
表 1 基因名称和引物序列 Table 1 Genes and primer sequences |
取30 mg肝组织,RIPA裂解液(RIPA∶PSMF= 100∶1)提取总蛋白,BCA试剂盒测定蛋白含量,使用RIPA裂解液稀释,稀释后的样品与4×Loading Buffer以3∶1比例混匀。SDS-PAGE凝胶电泳分离目标蛋白并转移转至PVDF膜上,5%脱脂奶粉室温封闭2 h,一抗4 ℃孵育过夜,二抗室温孵育60 min,用发光液显影,凝胶成像系统成像。
1.8 统计分析所有数据用GraphPad Prism 6.0进行分析。所有组均进行两两比较。采用单因素方差分析评价差异。数据以“平均值±SEM”表示(n=12),P < 0.05认为具有统计学意义。
2 结果 2.1 肝组织铜含量结果随着灌胃铜浓度的升高,大鼠肝组织中的铜含量呈剂量依赖性增加,高铜Ⅳ组肝组织铜含量较对照组显著上升(P < 0.01,图 1)。

|
**. P<0.01;*. P<0.05。下同 **. P < 0.01; *. P < 0.05. The same as below 图 1 肝组织铜含量 Fig. 1 Cu content in liver |
肝组织病理切片HE染色见图 2。如图 2A所示,对照组的肝细胞排列整齐,以中央静脉(central veins,CV)为中心,向四周呈放射状排列,胞核明显,门管区(portal area,PT)结构完整。随着铜含量的增加,门管区和肝细胞结构均出现明显的病理学改变,门管区小叶间静脉上皮细胞出现脱落、管壁增厚、炎性细胞浸润,肝细胞空泡变性等变化。高铜Ⅱ组开始呈现不同程度的肝细胞排列紊乱,并出现肝细胞胞核溶解或消失、空泡变性(红色箭头)和出血(蓝色箭头),PT小叶间静脉上皮细胞逐渐脱落,特别是高铜Ⅳ组中的小叶间静脉和小叶间胆管管壁明显增厚,表现炎性细胞浸润(如图 2B~E)。结果表明,高水平的铜暴露会诱导肝组织出现明显的结构变化和病理学改变。

|
A~E. 分别为对照组(0 mg·kg-1)、高铜Ⅰ组(20 mg·kg-1)、高铜Ⅱ组(40 mg·kg-1)、高铜Ⅲ组(80 mg·kg-1)和高铜Ⅳ组(160 mg·kg-1)。a. 不同组门管区病理变化(100×),CV. 中央静脉;PT. 门管区。b. 不同组的肝细胞病理学改变(400×);黑色箭头指向细胞核;红色箭头指向空泡变性;蓝色箭头指向肝出血 A-E. Represent control group (0 mg·kg-1), high level copper group I (20 mg·kg-1), high level copper group Ⅱ (40 mg·kg-1), high level copper group Ⅲ (80 mg·kg-1) and high level copper group Ⅳ (160 mg·kg-1), respectively. a. Pathological changes of portal area in different groups (100×); CV. Central vein; PT. Portal area. b. Pathological changes of hepatocytes in different groups (400×); Black arrows point to nucleus; Red arrows point to vacuolar degeneration; Blue arrows point to liver hemorrhage 图 2 肝组织病理切片HE染色图 Fig. 2 Pathological section of liver tissues |
由肝组织超微结构(图 3)可知,铜处理组均出现不同程度的线粒体自噬,高铜Ⅱ组、高铜Ⅲ组出现明显的线粒体自噬小体,对照组、高铜Ⅰ组、高铜Ⅱ组的线粒体形态和结构都比较正常,而高铜Ⅲ组和高铜Ⅳ组的线粒体出现线粒体空泡、变长、肿胀,脊变少或消失,且高铜Ⅳ组线粒体数量减少,极少观察到线粒体自噬小体。

|
A~E. 分别为对照组(0 mg·kg-1)、高铜Ⅰ组(20 mg·kg-1)、高铜Ⅱ组(40 mg·kg-1)、高铜Ⅲ组(80 mg·kg-1)和高铜Ⅳ组(160 mg·kg-1)。N. 细胞核;M. 线粒体;黑色箭头指向线粒体自噬小体 A-E. Represent control group (0 mg·kg-1), high level copper group I (20 mg·kg-1), high level copper group Ⅱ (40 mg·kg-1), high level copper group Ⅲ (80 mg·kg-1) and high level copper group Ⅳ (160 mg·kg-1), respectively. N. Nucleus; M. Mitochondria; Black arrows point to mitophagosomes 图 3 肝组织超微结构图(13 500×) Fig. 3 Changes in ultrastructure of liver tissue of rats in each group (13 500×) |
如图 4所示,随着铜暴露剂量增加,线粒体自噬相关基因Parkin、Pink1和LC3的mRNA和蛋白表达水平表现为先上升后下降的趋势,底物蛋白p62的表达趋势相反。高铜Ⅱ组和高铜Ⅲ组自噬相关基因PINK1、Parkin和LC3的mRNA和蛋白表达水平高于对照组,且PINK1和LC3的表达量与对照组差异显著(P<0.05),而当铜含量超过80 mg·kg-1时,高铜Ⅳ组自噬相关基因的相对表达量显著低于高铜Ⅱ组(P<0.05),p62的表达量表现为先下降后上升。结果表明,适量的铜可以激活自噬,但长期高水平的铜暴露会抑制自噬通路。

|
A~D. Parkin、Pink1、LC3B、p62的mRNA相对表达水平;E. Parkin、PINK1、LC3B、p62和内参β-actin的蛋白条带;F~I. Parkin、PINK1、LC3B和p62的蛋白相对表达分析。P<0.001,下同 A-D. Relative mRNA expression of Parkin, PINK1, LC3B and p62; E. Protein bands of Parkin, PINK1, LC3B, p62 and internal reference β-actin; F-I. The analysis of protein expression of Parkin, PINK1, LC3B and p62. P < 0.001, the same as below 图 4 不同水平铜暴露对大鼠肝线粒体自噬的影响 Fig. 4 Effect of different levels of copper exposure on mitochondrial autophagy in rat liver |
如图 5所示,与对照组相比,随着肝组织中铜含量的增加,细胞焦亡相关基因NLRP3、Caspase-1、GSDMD、IL-1β和IL-18的mRNA和蛋白表达量呈剂量依赖性增加,与对照组相比,高铜Ⅲ组焦亡相关基因NLRP3、Caspase-1、GSDMD、IL-1β和IL-18的mRNA相对表达显著升高(P < 0.05),高铜Ⅲ组NLRP3、Caspase-1、GSDMD和IL-1β的蛋白表达极显著高于对照组(P < 0.01);与高铜Ⅲ组相比,高铜Ⅳ的Caspase-1、GSDMD和IL-18的mRNA相对表达显著降低(P < 0.05)。
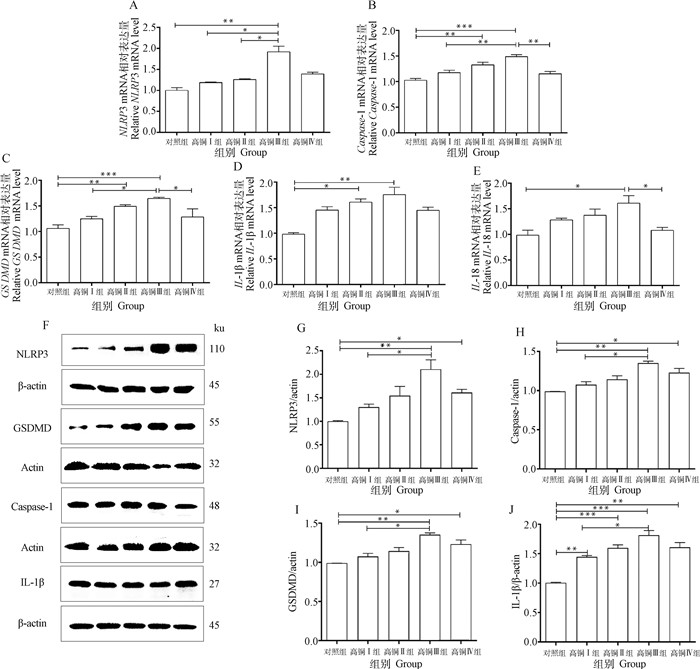
|
A~E. NLRP3、Caspase-1、GSDMD、IL-1β和IL-18的mRNA相对表达水平;F. NLRP3、Caspase-1、GSDMD、IL-1β及内参actin和β-actin的蛋白条带;G-J. NLRP3、Caspase-1、GSDMD、IL-1β的蛋白相对表达分析 A-E. Relative mRNA expression of NLRP3, Caspase-1, GSDMD, IL-1β and IL-18; F. Protein bands of NLRP3, Caspase-1, GSDMD, IL-1β, actin and β-actin; G-J. The analysis of protein expression of NLRP3, Caspase-1, GSDMD and IL-1β 图 5 不同水平铜暴露对大鼠肝细胞焦亡的影响 Fig. 5 Effect of different levels of copper exposure on pyroptosis in rat liver |
铜是一种常见的有毒重金属,广泛分布于各种流域、土壤、空气等环境中,通过食物链的累积和放大,最终对人和动物的健康造成威胁[11-12]。铜可通过血液循环,长期铜暴露可对机体肝、肾、脑组织等器官和系统造成不可逆的毒性作用。雷鸣等[13]和赵春雨等[14]研究发现,铜会在肝组织蓄积并造成实质损伤。研究发现,鸡摄入过量纳米氧化铜会造成肝局部出血[15];大鼠连续食用高铜饲料(700 mg·kg-1) 28 d,肝出现变性、纤维增生和炎性细胞浸润[16]。本试验结果表明,随着铜暴露剂量的增加,各组大鼠肝组织铜含量也随之增加,且摄入过量的铜会对肝造成损伤。在正常生理耐受范围内,饲养63 d,高铜Ⅱ组和高铜Ⅲ组铜含量升高不明显,机体通过正常的代谢可把多余的铜排出体外,但当添加含量达到160 mg·kg-1时,过量的铜会大量蓄积在肝中,并造成肝细胞病变,发生大面积空泡变性,胞核浓缩甚至消失,门管区结缔组织增生。
线粒体自噬是控制线粒体质量的重要机制,可以清除细胞内受损或多余的线粒体,与多种蛋白有关,其中Pink1/Parkin信号通路是线粒体自噬的经典途径[17-18]。线粒体正常时,Pink1通过线粒体外膜和内膜复合物转移至内膜,继而被泛素-蛋白酶体系统降解;线粒体在受到损伤时,内膜复合物功能障碍,通透性发生改变并去极化,Pink1由线粒体内膜转到线粒体外膜,Pink1在线粒体外膜集聚并招募胞质的Parkin转移至线粒体,Parkin通过磷酸化作用与其结合,进而泛素化线粒体外膜蛋白,使线粒体被“标记”,启动线粒体自噬[19-20]。本试验结果显示,随着铜剂量的增加,肝组织中Pink1和Parkin的mRNA和蛋白表达水平随之增加,表明铜可诱导肝组织发生自噬,但随着铜含量的进一步升高,Pink1和Parkin的mRNA和蛋白表达量呈现下降趋势,表明线粒体自噬过程受到抑制或阻滞。微管相关蛋白1轻链3 (protein light chain3,LC3)通过接头蛋白p62与被标记的线粒体结合,分隔膜继续弯曲延伸形成线粒体自噬体,最后与溶酶体融合并被降解[21]。自噬发生时,胞浆型(LC3B-Ⅰ)会转变为膜型(LC3B-Ⅱ),而p62作为自噬底物,表达量会下降。因此,p62和LC3B-Ⅱ/Ⅰ比值的可作为评估自噬流的标志蛋白[22]。本试验结果也发现,随着铜暴露水平的增加,LC3B-Ⅱ/Ⅰ的表达量增加,而p62蛋白表达下降,而随着铜的进一步浓度加大,LC3B-Ⅱ/Ⅰ和p62蛋白表达结果表现相反的趋势,表明适量的铜可以促进整个自噬过程的发生,但高水平的铜会抑制自噬的发生。推测铜的浓度已超过生理耐受范围,铜对肝细胞的损伤作用过强,导致线粒体功能障碍,线粒体自噬过程已无法完全抵抗铜诱导的损伤,这与Yang等[23-24]的研究结果一致。
细胞焦亡是另一种细胞程序性死亡的方式,细胞受到内源性和外源性信号的刺激,与相关蛋白组装成炎性小体,进而激活Caspase-1,活化的Caspase-1一方面切割pro-IL-1β和pro-IL-18,产生成熟的IL-1β和IL-18,后者作为炎症介质,能诱导其他免疫细胞的聚集,进而放大炎症反应;另一方面,Caspase-1切割GSDMD使其产生具有活性的N端结构域,活化后的GSDMD-N与细胞膜上的磷脂酰肌醇特异性结合,形成孔道,导致细胞内外渗透压改变,大量水分子进入细胞,细胞肿胀破裂而死[25-26]。其中NLRP3炎性小体是目前研究比较广泛的一种炎性小体,由NLRP3受体、凋亡相关斑点样蛋白和pro-Caspase-1构成,LRP3炎性小体激活产生活化的Caspase-1,从而诱导GSDMD蛋白的裂解,介导细胞焦亡的发生。研究发现,铜可以调节细胞焦亡,用不同浓度的硫酸铜处理鸡原代肝细胞,发现焦亡相关基因NLRP3、Caspase-1、IL-1β和IL-18表达显著上调;NAC与铜联合作用于肝细胞,发现焦亡相关基因表达显著下降,表明铜可通过活性氧诱导鸡肝细胞发生焦亡[27]。由此可见,铜可以通过激活NLRP3炎症小体,导致肝炎性反应,发挥铜的肝毒性效应。本试验结果显示,随着铜暴露浓度的升高,肝组织中NLRP3、Caspase-1、GSDMD、IL-1β和IL-18的基因表达水平升高,NLRP3、Caspase-1、GSDMD和IL-1β的蛋白表达升高。试验结果提示铜通过诱导NLRP3炎性小体产生,激活Caspase-1,促进IL-1β和IL-18释放,从而GSDMD蛋白表达增加,引起肝细胞焦亡,对肝造成损伤。
近年来的研究表明,自噬与焦亡之间存在复杂的联系。研究表明,自噬相关蛋白LC3B和Beclin-1的缺失可以激活炎症小体,同时增强了Caspase-1的激活和IL-1β和IL-18的分泌;诱导线粒体功能障碍可通过活化NLRP3炎症小体诱导细胞损伤,而阻断线粒体功能障碍可以抑制NLRP3炎症小体活化,减轻细胞损伤[28-30]。
4 结论本研究结果显示,当灌胃铜浓度为80 mg·kg-1时,肝组织线粒体自噬水平开始下降,而细胞焦亡水平继续升高,表明线粒体自噬的抑制可能可以激活细胞焦亡。然而当铜浓度到达160 mg·kg-1时,线粒体自噬被进一步抑制,但细胞焦亡水平并没有继续升高,也呈现下调的趋势,推测高水平的铜可能通过抑制自噬和焦亡进一步造成机体的损伤,但是具体的机制有待进一步研究。
| [1] |
BAKER Z N, COBINE P A, LEARY S C. The mitochondrion: A central architect of copper homeostasis[J]. Metallomics, 2017, 9(11): 1501-1512. DOI:10.1039/C7MT00221A |
| [2] |
张清华. 饲料中高铜对生态环境的影响及对策[J]. 饲料研究, 2008(10): 33-34. ZHANG Q H. Effects of high copper content in feed on ecological environment and countermeasures[J]. Feed Research, 2008(10): 33-34. DOI:10.13557/j.cnki.issn1002-2813.2008.10.015 (in Chinese) |
| [3] |
刘文博, 郭梦尧, 张乃生, 等. 绵羊铜中毒的病例报告[J]. 中国畜牧兽医, 2010, 37(12): 212-213. LIU W B, GUO M Y, ZHANG N S, et al. Case report of copper poisoning in sheep[J]. China Animal Husbandry & Veterinary Medicine, 2010, 37(12): 212-213. (in Chinese) |
| [4] |
蒙洪娇, 姜海龙, 朱世馨, 等. 日粮铜水平对育肥猪组织器官铜沉积及铜代谢的影响研究[J]. 猪业科学, 2017, 34(3): 90-92. MENG H J, JIANG H L, ZHU S X, et al. Effects of dietary copper level on Cu deposition and Cu metabolism in tissues and organs of finishing pigs[J]. Swine Industry Science, 2017, 34(3): 90-92. DOI:10.3969/j.issn.1673-5358.2017.03.039 (in Chinese) |
| [5] |
黄道斌, 钟佳, 邹书兵. 细胞自噬与急性肝损伤[J]. 生命的化学, 2015, 35(2): 219-224. HUANG D B, ZHONG J, ZOU S B. Autophgy and acute liver injury[J]. Chemistry of Life, 2015, 35(2): 219-224. DOI:10.13488/j.smhx.20150212 (in Chinese) |
| [6] |
孙伟, 刘杉杉, 陆安法, 等. 细胞焦亡在肝脏损伤中的作用研究进展[J/OL]. 中国免疫学杂志, 2021[2022-03-31]. https://kns.cnki.net/kcms/detail/22.1126.R.20210923.1809.002.html. SUN W, LIU S S, LU A F, et al. Research Progress on the role of pyroptosis in liver injury[J]. Chinese Journal of Immunology, 2021[2022-03-31]. https://kns.cnki.net/kcms/detail/22.1126.R.20210923.1809.002.html. (in Chinese) |
| [7] |
杨艳阳, 余文兰, 廖建昭, 等. 高铜诱导大鼠心肌细胞线粒体自噬[J]. 畜牧兽医学报, 2020, 51(2): 374-381. YANG Y Y, YU W L, LIAO J Z, et al. High level of copper induced mitophagy in cardiomyocytes of rats[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(2): 374-381. (in Chinese) |
| [8] |
YU W L, LIAO J Z, YANG F, et al. Chronic tribasic copper chloride exposure induces rat liver damage by disrupting the mitophagy and apoptosis pathways[J]. Ecotoxicol Environ Saf, 2021, 212: 111968. DOI:10.1016/j.ecoenv.2021.111968 |
| [9] |
ORCT T, JURASOVIĆ J, MICEK V, et al. Macro-and microelements in the rat liver, kidneys, and brain tissues; Sex differences and effect of blood removal by perfusion in vivo[J]. J Trace Elem Med Biol, 2017, 40: 104-111. DOI:10.1016/j.jtemb.2016.12.015 |
| [10] |
徐志华. ICP-MS法测定食品中多元素的方法验证研究[J]. 现代食品, 2020(15): 163-167, 171. XU Z H. Validation of ICP-MS method for determination of multiple elements in food[J]. Modern Food, 2020(15): 163-167, 171. (in Chinese) |
| [11] |
杨亚芳, 何杰. 宁夏中部干旱带土壤重金属污染及生态风险评价[J]. 石河子大学学报: 自然科学版, 2021, 39(5): 608-613. YANG Y F, HE J. Pollution characteristics and ecological risk assessment of soil heavy metals in arid area of central Ningxia[J]. Journal of Shihezi University: Natural Science, 2021, 39(5): 608-613. (in Chinese) |
| [12] |
谢文平, 陈昆慈, 朱新平, 等. 珠江三角洲河网区水体及鱼体内重金属含量分析与评价[J]. 农业环境科学学报, 2010, 29(10): 1917-1923. XIE W P, CHEN K C, ZHU X P, et al. Evaluation on heavy metal contents in water and fishes collected from the waterway in the Pearl River Delta, South China[J]. Journal of Agro-Environment Science, 2010, 29(10): 1917-1923. (in Chinese) |
| [13] |
雷鸣, 隋啸一, 刘磊, 等. 饲粮铜对生长獭兔血清免疫、血液生化、铜消化率及组织铜沉积的影响[J]. 山东畜牧兽医, 2017, 38(7): 3-5. LEI M, SUI X Y, LIU L, et al. Effects of dietary copper on serum immunity, blood biochemistry, copper digestibility and tissue copper deposition of growing Rex rabbits[J]. Shandong Journal of Animal Science and Veterinary Medicine, 2017, 38(7): 3-5. (in Chinese) |
| [14] |
赵春雨, 张天芮, 刘博, 等. 日粮铜来源及水平对猪血液生化指标及含铜酶活性的影响[J]. 中国畜牧杂志, 2015, 51(21): 39-44. ZHAO C Y, ZHANG T R, LIU B, et al. Effects of dietary copper sources and levels on blood biochemical indexes indexes and enzyme activities in piglets[J]. Chinese Journal of Animal Science, 2015, 51(21): 39-44. (in Chinese) |
| [15] |
高晨, 耿建芬, 张海容, 等. 纳米氧化铜对肉鸡急性毒性及蓄积毒性试验[J]. 黑龙江畜牧兽医, 2021(3): 119-122, 163-164. GAO C, GENG J F, ZHANG H R, et al. The research on acute toxicity and accumulation toxicity of Nano copper oxide on broilers[J]. Heilongjiang Animal Science and Veterinary Medicine, 2021(3): 119-122, 163-164. (in Chinese) |
| [16] |
程颜, 刘亚云, 张方洁, 等. 五苓散对实验性铜中毒大鼠的治疗作用[J]. 浙江农业学报, 2017, 29(2): 206-212. CHENG Y, LIU Y Y, ZHANG F J, et al. Effect of Wuling San on copper poisoning in experimental rats[J]. Acta Agriculturae Zhejiangensis, 2017, 29(2): 206-212. (in Chinese) |
| [17] |
LEMASTERS J J, ZHONG Z. Mitophagy in hepatocytes: Types, initiators and role in adaptive ethanol metabolism[J]. Liver Res, 2018, 2(3): 125-132. |
| [18] |
胡磊, 戴海明. 线粒体自噬的研究进展[J]. 中国细胞生物学学报, 2018, 40(4): 594-601. HU L, DAI H M. Advances in the study of Mitophagy[J]. Chinese Journal of Cell Biology, 2018, 40(4): 594-601. (in Chinese) |
| [19] |
张浩, 张悦, 赵文武, 等. PINK1/Parkin介导的线粒体自噬及其在肝脏疾病发生发展中的作用机制[J]. 临床肝胆病杂志, 2020, 36(7): 1663-1665. ZHANG H, ZHANG Y, ZHAO W W, et al. PINK1/Parkin-mediated mitophagy and its mechanism of action in the development and progression of liver diseases[J]. Journal of Clinical Hepatology, 2020, 36(7): 1663-1665. (in Chinese) |
| [20] |
王鹤璇, 马静萍. 线粒体自噬机制及其在脑缺血再灌注损伤中的研究进展[J]. 中西医结合心脑血管病杂志, 2021, 19(14): 2361-2363. WANG H X, MA J P. Advances in the mechanism of mitophagy and its role in cerebral ischemia-reperfusion injury[J]. Chinese Journal of Integrative Medicine on Cardio-Cerebrovascular Disease, 2021, 19(14): 2361-2363. (in Chinese) |
| [21] |
张杨, 孙弯弯, 陆丽丹, 等. 细胞自噬与凋亡相互作用分子机制的研究进展[J]. 基础医学与临床, 2021, 41(9): 1342-1346. ZHANG Y, SUN W W, LU L D, et al. Research progress on molecular mechanism of the interaction between autophagy and apoptosis[J]. Basic and Clinical Medicine, 2021, 41(9): 1342-1346. (in Chinese) |
| [22] |
KABEYA Y, MIZUSHIMA N, UENO T, et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing[J]. EMBO J, 2000, 19(21): 5720-5728. |
| [23] |
YANG F, LIAO J Z, YU W L, et al. Exposure to copper induces mitochondria-mediated apoptosis by inhibiting mitophagy and the PINK1/parkin pathway in chicken (Gallus gallus) livers[J]. J Hazard Mater, 2021, 408: 124888. |
| [24] |
WAN F, ZHONG G L, NING Z J, et al. Long-term exposure to copper induces autophagy and apoptosis through oxidative stress in rat kidneys[J]. Ecotoxicol Environ Saf, 2020, 190: 110158. |
| [25] |
LIU X, ZHANG Z B, RUAN J B, et al. Inflammasome-activated gasdermin D causes pyroptosis by forming membrane pores[J]. Nature, 2016, 535(7610): 153-158. |
| [26] |
徐飞, 吴俏兰, 陈修保, 等. 细胞焦亡的分子调控机制及其在肺癌中的研究进展[J]. 肿瘤学杂志, 2021, 27(1): 69-73. XU F, WU Q L, CHEN X B, et al. Molecular mechanism of pyroptosis and its role in lung cancer[J]. Journal of Chinese Oncology, 2021, 27(1): 69-73. (in Chinese) |
| [27] |
KANNEGANTI T D, LAMKANFI M, NÚÑEZ G. Intracellular NOD-like receptors in host defense and disease[J]. Immunity, 2007, 27(4): 549-559. |
| [28] |
SAITOH T, FUJITA N, JANG M H, et al. Loss of the autophagy protein Atg16L1 enhances endotoxin-induced IL-1β production[J]. Nature, 2008, 456(7219): 264-268. |
| [29] |
NAKAHIRA K, HASPEL J A, RATHINAM V A K, et al. Autophagy proteins regulate innate immune responses by inhibiting the release of mitochondrial DNA mediated by the NALP3 inflammasome[J]. Nat Immunol, 2011, 12(3): 222-230. |
| [30] |
白咪. SIRT1通过线粒体自噬阻断NLRP3炎症小体活化和足细胞损伤[D]. 南京: 南京医科大学, 2016: 82-95. BAI M. SIRT1 blocks NLRP3 inflammasome activation and podocyte injury through mitophagy[D]. Nanjing: Nanjing Medical University, 2016: 82-95. (in Chinese) |
(编辑 范子娟)



