2. 佛山科学技术学院附属教学动物医院,佛山 528225
2. Foshan University Veterinary Teaching Hospital, Foshan 528225, China
创伤性脑损伤(traumatic brain injury, TBI)对动物的健康问题危害严重。TBI主要是由机械外力引起的,造成的主要原因:打架、撞击、坠落等。TBI所造成的原发性损伤往往不可逆转,会直接导致神经元的死亡,只能通过干预TBI造成的继发性损伤来治疗,但TBI的病理机制较为复杂,损伤过程包括线粒体损伤导致的细胞凋亡和氧化应激,细胞能量产生降低和弥漫性轴索损伤等[1-2]。TBI具有高致残率、高死亡率、高治疗费的特点,它的发生会降低患畜的生活质量,甚至会导致严重的残疾或死亡,且预后不良[3]。虽然人们已经意识到TBI的危害,但目前对治疗TBI的特效药物研究仍处于起步阶段,缺乏有效的治疗药物去治疗由TBI引起的各种损伤,如不及时治疗,会造成不可逆的损伤,是一项迫切需要解决的公共卫生和医疗问题。所以需要继续探索对TBI有修复作用的药物,以进一步改善TBI的预后。3, 6-二溴-beta-氟-N-(3-甲氧基苯基)-9H-咔唑-9-丙胺(P7C3-A20)是一种稳定细胞能量水平的化合物,可以通过血脑屏障,具有治疗TBI的潜力[4-5]。研究发现,P7C3-A20能对中风大鼠的脑细胞提供保护作用,在抑制成熟神经细胞死亡的同时,也可以增加烟酰胺腺嘌呤二核苷酸(NAD)的通量,并且接受P7C3-A20治疗的大鼠肢体性能和认知功能得到了改善[6-7]。即使大鼠在中风后延迟6 h腹腔注射P7C3-A20,依然具有减轻神经变性和促进慢性功能恢复的治疗效果[8]。研究也证实P7C3-A20的治疗可以恢复正常的血脑屏障内皮细胞长度,增加脑毛细血管周细胞密度,增加血脑屏障紧密连接蛋白的表达,减少脑内免疫球蛋白的浸润,阻止慢性神经变性和恢复认知[4]。虽然P7C3-A20已被证实在缺血性中风和神经退行性疾病等各种疾病中发挥神经保护作用,但是在大鼠肾上腺髓质嗜铬瘤分化细胞株(PC12细胞)TBI模型中,P7C3-A20与神经元凋亡和氧化应激的关系尚不清楚。本研究旨在通过CCK8试剂盒测定细胞活力,荧光显微镜观察细胞凋亡、活性氧含量,荧光定量PCR检测mRNA等方法探明P7C3-A20在PC12细胞TBI模型中所起的作用,为临床合理用药提供试验依据。
1 材料与方法 1.1 试验材料3, 6-二溴-beta-氟-N-(3-甲氧基苯基)-9H-咔唑-9-丙胺(P7C3-A20),分子式为C22H19Br2FN2O,购自上海源叶生物科技有限公司;CCK-8试剂盒购自武汉赛维尔生物科技有限公司;Annexin V-FITC/PI双染细胞凋亡检测试剂盒、细胞活性氧(ROS)检测试剂盒购自上海贝博生物科技有限公司;TransZol Up Plus RNA Kit、TransScript Uni One-Step gDNA Removal and cDNA Synthesis SuperMix购自北京全式金生物技术股份有限公司;LightCycler 480 SYBR Green I Master购自Roche公司。
1.2 主要仪器Biotek 800TS吸收光酶标仪(美国伯腾仪器有限公司);ECHO revolve FL正置倒置一体荧光显微镜(北京深蓝云生物科技有限公司);Roche LightCycler480 Ⅱ实时荧光定量PCR仪(罗氏诊断产品(上海)有限公司)。
1.3 试验细胞大鼠肾上腺髓质嗜铬瘤分化细胞株(PC12细胞),由东北农业大学临床教研室高利教授课题组馈赠。
1.4 试验方法1.4.1 试验设计 将PC12细胞分为6组,分别为对照组(A组)、模型组(B组)和造模加药物治疗组,其中药物浓度分为0.03、0.3、和3 μmol·L-1 3组(C~E组)和药物空白组(F组)。A组不造模,在添加含100 mL·L-1血清、10 mL·L-1双抗的高糖DMEM培养液中培养细胞,并把细胞放置于37 ℃,50 mL·L-1 CO2的培养箱中。B~E组模型通过使用10 μL枪头划出横竖相间4 mm的直线来制备[9]。B组造模后,后续处理与对照组相同。C~E组造模后使用不同浓度的P7C3-A20药物溶液对细胞进行治疗。F组不造模,只在对照组的基础上添加3 μmol·L-1的P7C3-A20药物溶液。
1.4.2 酶标仪检测细胞活力 在96孔板中,每孔接种100 μL细胞悬液,细胞密度为1×105·mL-1,待细胞贴壁完全后处理细胞,各组培养24 h后加入CCK8液,在培养箱避光孵育1 h,然后使用酶标仪测定450 nm处的吸光度。采用说明书中“细胞活力(%)=[A(加药)-A(空白)]/[A(0加药)-A(空白)] ×100”公式对细胞活力进行计算。
1.4.3 荧光显微镜观察细胞凋亡、活性氧情况 在24孔板中,每孔接种500 μL细胞悬液,细胞密度为2×105·mL-1,待细胞贴壁完全后处理细胞,然后按说明使用Annexin V-FITC/PI双染细胞凋亡检测试剂盒与细胞活性氧(ROS)检测试剂盒对细胞进行染色,最后使用荧光显微镜观察细胞凋亡与活性氧的情况。
1.4.4 荧光定量PCR检测Caspase-3、Bcl-2、HO-1、NQO1和GCLC mRNA相对表达量 应用SYBR Green荧光定量PCR检测半胱氨酸蛋白酶-3(Caspase-3)、B细胞淋巴瘤/白血病-2基因(Bcl-2)、血红素氧合酶1(HO-1)、NAD(P)H: 醌氧化还原酶1(NQO1)和谷氨酸半胱氨酸连接酶催化亚基(GCLC)在PC12细胞中的mRNA相对表达量。引物由生工生物工程(上海)股份有限公司设计与合成,引物序列见表 1。反应体系为LightCycler 480 SYBR Green I Master 10 μL、Double Distilled Water 8 μL、cDNA 1 μL、上下游引物各0.5 μL。反应程序为95 ℃ 5 min;95 ℃ 10 s,53 ℃ 20 s,72 ℃ 20 s,45个循环;95 ℃ 5 s;65 ℃ 1 min;每间隔5 s上升0.5 ℃至97 ℃。以β-actin为内参,采用2-ΔΔCt法计算Caspase-3、Bcl-2、HO-1、NQO1、GCLC的mRNA相对表达量。
1.5 统计分析试验数据以“x±s”方式表示。采用SPSS 21.0软件对数据进行统计分析,使用单因素ANOVA法进行差异显著性检验。P < 0.05表示差异显著,P < 0.01表示差异极显著。
|
|
表 1 荧光定量PCR引物 Table 1 Real-time PCR Primer |
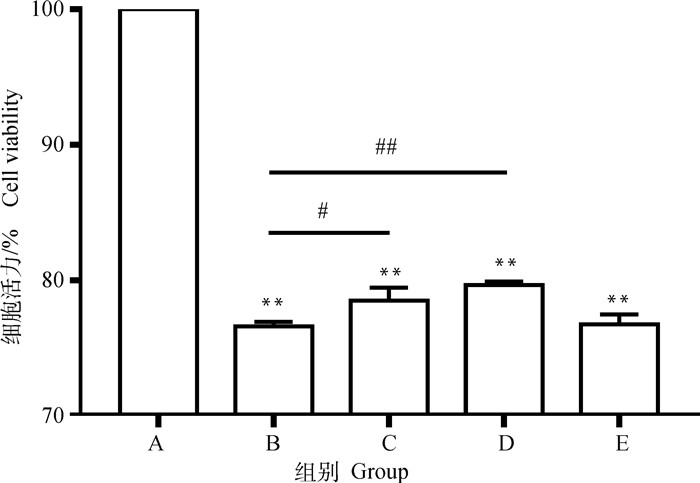
PC12细胞活力结果如图 1所示。数据显示模型组对比对照组,细胞活力极显著下降(P < 0.01)。0.03 μmol·L-1药物治疗组对比模型组,细胞活力显著上升(P < 0.05)。0.3 μmol·L-1药物治疗组对比模型组,细胞活力极显著上升(P < 0.01)。
|
A. 对照组;B. 模型组;C. 0.03 μmol·L-1P7C3-A20药物治疗组;D. 0.3 μmol·L-1P7C3-A20药物治疗组;E. 3 μmol·L-1 P7C3-A20药物治疗组。与A组比较,**.P < 0.01;与B组比较,#.P < 0.05,##.P < 0.01 A. Control group; B. Model group; C. 0.03 μmol·L-1P7C3-A20 drug treatment group; D. 0.3 μmol·L-1P7C3-A20 drug treatment group; E. 3 μmol·L-1P7C3-A20 drug treatment group. Compared with group A, **. P < 0.01. Compared with group B, #. P < 0.05, ##.P < 0.01 图 1 细胞活力 Fig. 1 Cell viability |
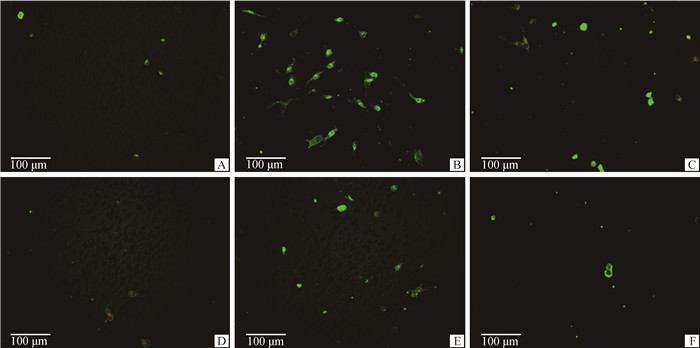
PC12细胞凋亡情况如图 2和图 3所示,图 3的结果为各试验组凋亡细胞比例与对照组凋亡细胞比例的比值。数据显示,相对于对照组,模型组早晚期凋亡细胞比例均极显著增加(P < 0.01)。0.03 μmol·L-1药物治疗组对比模型组早期凋亡细胞比例显著减少(P < 0.05),晚期凋亡细胞比例极显著减少(P < 0.01)。0.3 μmol·L-1和3 μmol·L-1药物治疗组对比模型组早晚期凋亡细胞比例均极显著减少(P < 0.01)。
|
A.对照组;B.模型组;C.0.03 μmol·L-1P7C3-A20药物治疗组;D.0.3 μmol·L-1P7C3-A20药物治疗组;E. 3 μmol·L-1P7C3-A20药物治疗组;F. 药物空白组 A. Control group; B. Model group; C. 0.03 μmol·L-1P7C3-A20 drug treatment group; D. 0.3 μmol·L-1P7C3-A20 drug treatment group; E. 3 μmol·L-1P7C3-A20 drug treatment group; F. Drug blank group 图 2 PC12细胞凋亡检测(Annexin V-FITC/PI染色,标尺=100 μm) Fig. 2 PC12 cell apoptosis detection (Annexin V-FITC/PI stain, Bar=100 μm) |

|
A. 对照组;B. 模型组;C. 0.03 μmol·L-1P7C3-A20药物治疗组;D. 0.3 μmol·L-1P7C3-A20药物治疗组;E. 3 μmol·L-1 P7C3-A20药物治疗组;F. 药物空白组。与A组比较,**.P < 0.01;与B组比较,#.P < 0.05,##.P < 0.01 A. Control group; B. Model group; C. 0.03 μmol·L-1P7C3-A20 drug treatment group; D. 0.3 μmol·L-1P7C3-A20 drug treatment group; E. 3 μmol·L-1P7C3-A20 drug treatment group; F. Drug blank group. Compared with group A, **. P < 0.01. Compared with group B, #. P < 0.05, ##.P < 0.01 图 3 凋亡细胞比例 Fig. 3 Proportion of apoptotic cells |
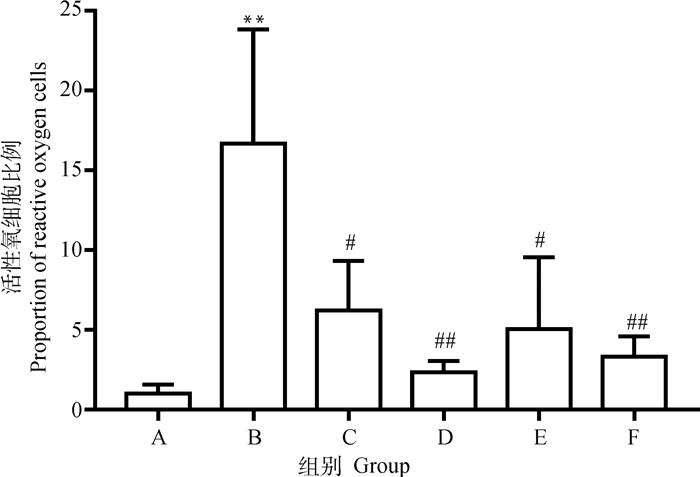
PC12细胞活性氧情况如图 4和图 5所示,图 5的结果为各试验组活性氧细胞比例与对照组活性氧细胞比例的比值。数据显示,相对于对照组,模型组活性氧细胞比例极显著增加(P < 0.01)。0.03 μmol·L-1和3 μmol·L-1药物治疗组对比模型组活性氧细胞比例均显著减少(P < 0.05)。0.3 μmol·L-1药物治疗组对比模型组活性氧细胞比例极显著减少(P < 0.01)。

|
A.对照组;B.模型组;C.0.03 μmol·L-1P7C3-A20药物治疗组;D.0.3 μmol·L-1P7C3-A20药物治疗组;E. 3 μmol·L-1P7C3-A20药物治疗组;F. 药物空白组 A. Control group; B. Model group; C. 0.03 μmol·L-1P7C3-A20 drug treatment group; D. 0.3 μmol·L-1P7C3-A20 drug treatment group; E. 3 μmol·L-1P7C3-A20 drug treatment group; F. Drug blank group 图 4 PC12细胞活性氧检测(DCFHDA染色,标尺=100 μm) Fig. 4 PC12 cell ROS detection (DCFHDA stain, Bar=100 μm) |
|
A. 对照组;B. 模型组;C. 0.03 μmol·L-1P7C3-A20药物治疗组;D. 0.3 μmol·L-1P7C3-A20药物治疗组;E. 3 μmol·L-1 P7C3-A20药物治疗组;F. 药物空白组。与A组比较,**.P < 0.01;与B组比较,#.P < 0.05,##.P < 0.01 A. Control group; B. Model group; C. 0.03 μmol·L-1P7C3-A20 drug treatment group; D. 0.3 μmol·L-1P7C3-A20 drug treatment group; E. 3 μmol·L-1P7C3-A20 drug treatment group; F. Drug blank group. Compared with group A, **. P < 0.01. Compared with group B, #. P < 0.05, ##.P < 0.01 图 5 活性氧细胞比例 Fig. 5 Proportion of reactive oxygen cells |
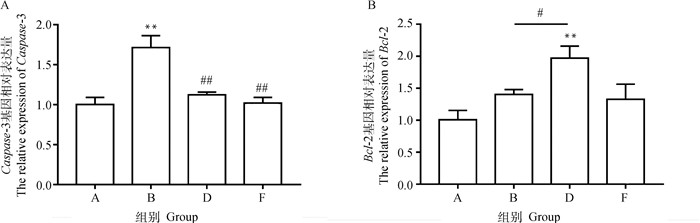
Caspase-3和Bcl-2 mRNA荧光定量PCR检测结果如图 6所示,0.3 μmol·L-1药物治疗组对比模型组Caspase-3 mRNA表达量极显著下降(P < 0.01),Bcl-2 mRNA表达量显著上升(P < 0.05)。HO-1、NQO1和GCLC mRNA荧光定量PCR检测结果如图 7所示,0.3 μmol·L-1药物治疗组对比模型组NQO1、HO-1和GCLC mRNA表达量显著上升(P < 0.05)。
|
A. 对照组;B. 模型组;D. 0.3 μmol·L-1P7C3-A20药物治疗组;F. 药物空白组。与A组比较,**.P < 0.01;与B组比较,#.P < 0.05,##.P < 0.01 A. Control group; B. Model group; D. 0.3 μmol·L-1P7C3-A20 drug treatment group; F. Drug blank group. Compared with group A, **. P < 0.01. Compared with group B, #. P < 0.05, ##.P < 0.01 图 6 PC12细胞中Caspase-3、Bcl-2 mRNA的表达量 Fig. 6 The relative expression of Caspase-3, Bcl-2 mRNA in PC12 cells |

|
A. 对照组;B. 模型组;D. 0.3 μmol·L-1P7C3-A20药物治疗组;F. 药物空白组。与A组比较,*.P < 0.05,**.P < 0.01;与B组比较,#.P < 0.05 A. Control group; B. Model group; D. 0.3 μmol·L-1P7C3-A20 drug treatment group; F. Drug blank group. Compared with group A, *.P < 0.05, **. P < 0.01. Compared with group B, #. P < 0.05 图 7 PC12细胞中HO-1、NQO1、GCLC mRNA的表达量 Fig. 7 The relative expression of HO-1, NQO1, GCLC mRNA in PC12 cells |
TBI对动物危害严重,任何对头部的强烈撞击都可能导致TBI的发生,随后会导致运动、感觉和认知等功能障碍,另外还促进氧自由基增多和细胞凋亡等病理过程,且这种损害常常持续很久,甚至持续终生[10-11]。动物在体试验昂贵且费力,细胞体外模型具有易于构建,费时短,花费低,干扰因素少,试验条件可控性强等优点[12]。PC12细胞系是神经科学研究中最常用的细胞之一,源于大鼠嗜铬细胞瘤[13]。细胞体外TBI模型通过机械横断体外细胞,已被许多研究者认可并使用[9, 12, 14-15]。本试验通过使用10 μL移液枪头划断神经元神经突来制备细胞体外TBI模型,能够模拟神经元的轴索损伤,是一种操作简单,效果显著的体外模型,用于模拟体外TBI后的各种脑组织病变[9]。P7C3-A20能增强正常哺乳动物细胞中NAD补救途径的通量,阻止细胞死亡[6]。NAD在调节线粒体代谢的基本底物方面起重要作用,也是ATP产生的主要底物,对细胞生长、分化,能量代谢和细胞保护方面发挥重要作用。TBI模型中,对PC12细胞使用P7C3-A20能提高细胞活力。
3.2 P7C3-A20对创伤性脑损伤后的PC12细胞具有抗凋亡的作用细胞凋亡指的是特定蛋白相互作用,程序化传递死亡诱导信号,从而进行细胞分解的过程[16]。凋亡细胞以核小体结构、脱落受体、抗炎代谢物或者包装在凋亡细胞外囊泡(ApoEVs)中的分子形式释放信使[17]。在此试验中,Annexin V-FITC能在Ca2+环境下与磷脂酰丝氨酸(PS)结合,早期凋亡细胞PS会从细胞膜内侧外翻,会被Annexin V-FITC染料染成绿色。PI不能透过完整细胞膜,但当细胞膜破损后,PI则能渗透进去,故晚期凋亡细胞会被Annexin V-FITC与PI同时染成绿色与红色。半胱氨酸蛋白酶(caspase)可以启动细胞凋亡,其家族成员Caspase-3是细胞凋亡级联反应关键的因子,细胞凋亡信号出现时,会导致Caspase-3裂解并被激活,而活化后的Caspase-3又会进一步放大蛋白酶级联切割效应,导致细胞最终走向死亡,Caspase-3一旦被激活,细胞凋亡则不可避免[10, 18]。Caspase-3是重要的凋亡蛋白酶,其表达量可直接反映细胞凋亡的程度[18]。Bcl-2是典型的抗凋亡蛋白,可以通过形成异源二聚体来抑制凋亡,还可以通过抗氧化作用来提高细胞存活率[16]。TBI后使用P7C3-A20治疗,凋亡面积减少,Caspase-3 mRNA表达量下降,Bcl-2 mRNA表达量上升,表明P7C3-A20可以减少TBI后的神经元凋亡,具有抗凋亡的功能。
3.3 P7C3-A20对创伤性脑损伤后的PC12细胞具有抗氧化应激的作用ROS诱导的脂质过氧化在细胞死亡中起重要作用,由于多不饱和脂肪酸含量较高,细胞膜和细胞器膜很容易受到ROS损伤,甚至会导致细胞凋亡[19]。ROS包括过氧化氢(H2O2)、一氧化氮(NO)、超氧阴离子(·O2-)、羟基自由基(·OH)、过氧化自由基(ROO·)、过氧羟自由基(HOO·)和单线态氧(1O2)等,它们会被DCFHDA荧光探针标记成绿色。ROS的过度产生会攻击生物膜,对细胞成分产生不利的影响,增强各种致病机制,引起氧化应激,而氧化应激会引起大脑神经损伤,诱导不同类型的细胞死亡。HO-1、NQO1和GCLC是Nrf2下游的抗氧化基因,上调HO-1、NQO1和GCLC基因的表达可以发挥抗氧化应激的作用[20-22]。HO-1在其启动子区域有一个抗氧化反应元件,HO-1直接影响机体的抗氧化平衡,并具有抗凋亡的作用[23]。NQO1能以NAD (P) H为受体,将醌类物质通过双电子还原反应转化为低毒性的氢醌类物质,从而避免细胞氧化损伤[24-25]。GCLC是抗氧化蛋白酶,能提高抗氧化应激的能力[20]。TBI后使用P7C3-A20治疗,活性氧面积减少,HO-1、NQO1和GCLC mRNA的表达量上升,说明PC12细胞在TBI后使用P7C3-A20会使氧化应激减少。
4 结论P7C3-A20对创伤性脑损伤后的PC12细胞有抗凋亡、减轻氧化应激的修复作用。
| [1] |
李坪, 李晓文, 王艳雪, 等. 右美托咪定通过SIRT1信号通路抑制脑损伤大鼠神经元凋亡[J]. 神经解剖学杂志, 2020, 36(6): 612-618. LI P, LI X W, WANG Y X, et al. Dexmedetomidine inhibits neuronal apoptosis in TBI rats through SIRT1 signaling pathway[J]. Chinese Journal of Neuroanatomy, 2020, 36(6): 612-618. DOI:10.16557/j.cnki.1000-7547.2020.06.004 (in Chinese) |
| [2] |
古丽加克拉·艾山, 余克威, 朱玉连. 创伤性脑损伤后康复治疗联合药物治疗对线粒体功能恢复的研究进展[J]. 中国康复医学杂志, 2020, 35(1): 106-111. AI SHAN·G L J K L, YU K W, ZHU Y L. Research progress of rehabilitation therapy combined with drug therapy on mitochondrial function recovery after traumatic brain injury[J]. Chinese Journal of Rehabilitation Medicine, 2020, 35(1): 106-111. DOI:10.3969/j.issn.1001-1242.2020.01.022 (in Chinese) |
| [3] |
唐佳琦, 卢韵碧. 小胶质细胞与创伤性脑损伤关系的研究进展[J]. 中国细胞生物学学报, 2021, 43(8): 1714-1721. TANG J Q, LU Y B. Research progress of the relationship between microglia and traumatic brain injury[J]. Chinese Journal of Cell Biology, 2021, 43(8): 1714-1721. (in Chinese) |
| [4] |
VÁZQUEZ-ROSA E, SHIN M K, DHAR M, et al. P7C3-A20 treatment one year after TBI in mice repairs the blood-brain barrier, arrests chronic neurodegeneration, and restores cognition[J]. Proc Natl Acad Sci U S A, 2020, 117(44): 27667-27675. DOI:10.1073/pnas.2010430117 |
| [5] |
BAI J J, ZENG S S, ZHU J J, et al. The small molecule P7C3-A20 exerts neuroprotective effects in a hypoxic-ischemic encephalopathy model via activation of PI3K/AKT/GSK3β signaling[J]. Neuroscience, 2020, 441: 197-208. DOI:10.1016/j.neuroscience.2020.05.051 |
| [6] |
LORIS Z B, PIEPER A A, DIETRICH W D. The neuroprotective compound P7C3-A20 promotes neurogenesis and improves cognitive function after ischemic stroke[J]. Exp Neurol, 2017, 290: 63-73. DOI:10.1016/j.expneurol.2017.01.006 |
| [7] |
WANG S N, XU T Y, WANG X, et al. Neuroprotective efficacy of an aminopropyl carbazole derivative P7C3-A20 in ischemic stroke[J]. CNS Neurosci Ther, 2016, 22(9): 782-788. DOI:10.1111/cns.12576 |
| [8] |
LORIS Z B, HYNTON J R, PIEPER A A, et al. Beneficial effects of delayed P7C3-A20 treatment after transient MCAO in rats[J]. Transl Stroke Res, 2018, 9(2): 146-156. DOI:10.1007/s12975-017-0565-z |
| [9] |
李岱. 颅脑创伤后高表达miR-124-3p的小胶质细胞外泌体调控神经元自噬在神经功能损伤中的作用和机制研究[D]. 天津: 天津医科大学, 2019. LI D. Increases in miR-124-3p in microglial exosomes confer neuroprotective effects by regulating neuronal autophagy following traumatic brain injury[D]. Tianjin: Tianjin Medical University, 2019. (in Chinese) |
| [10] |
李芳, 邓玲. 塞来昔布对颅脑创伤后大鼠神经元凋亡的影响[J]. 中国临床药理学杂志, 2018, 34(10): 1164-1167. LI F, DENG L. Effect of celecoxib on neuronal apoptosis after traumatic brain injury in rats[J]. The Chinese Journal of Clinical Pharmacology, 2018, 34(10): 1164-1167. (in Chinese) |
| [11] |
MAITI P, PERUZZARO S, KOLLI N, et al. Transplantation of mesenchymal stem cells overexpressing interleukin-10 induces autophagy response and promotes neuroprotection in a rat model of TBI[J]. J Cell Mol Med, 2019, 23(8): 5211-5224. DOI:10.1111/jcmm.14396 |
| [12] |
赵程程. 低温促进脑创伤后神经突再生及调节SOCS3表达的研究[D]. 上海: 上海交通大学, 2018. ZHAO C C. The effects of hypothermia on promoting neurite sprouting and regulating suppressor of cytokine signaling 3 expression after traumatic brain injury[D]. Shanghai: Shanghai Jiao Tong University, 2018. (in Chinese) |
| [13] |
WIATRAK B, KUBIS-KUBIAK A, PIWOWAR A, et al. PC12 cell line: cell types, coating of culture vessels, differentiation and other culture conditions[J]. Cells, 2020, 9(4): 958. DOI:10.3390/cells9040958 |
| [14] |
王露. miR-21在氢气保护创伤性脑损伤中作用机制研究[D]. 天津: 天津医科大学, 2019. WANG L. The mechanism of miR-21 in hydrogen protection of traumatic brain injury[D]. Tianjin: Tianjin Medical University, 2019. (in Chinese) |
| [15] |
LIU W, CHEN Y H, MENG J, et al. Ablation of caspase-1 protects against TBI-induced pyroptosis in vitro and in vivo[J]. J Neuroinflamm, 2018, 15(1): 48. DOI:10.1186/s12974-018-1083-y |
| [16] |
胡善明, 王亚楠, 许正茂, 等. Bcl-2家族分子在细胞凋亡中的作用研究进展[J]. 动物医学进展, 2021, 42(10): 85-89. HU S M, WANG Y N, XU Z M, et al. Progress on Bcl-2 family molecular function in apoptosis[J]. Progress in Veterinary Medicine, 2021, 42(10): 85-89. DOI:10.3969/j.issn.1007-5038.2021.10.016 (in Chinese) |
| [17] |
BERTHELOOT D, LATZ E, FRANKLIN B S. Necroptosis, pyroptosis and apoptosis: an intricate game of cell death[J]. Cell Mol Immunol, 2021, 18(5): 1106-1121. DOI:10.1038/s41423-020-00630-3 |
| [18] |
于丰铭, 徐扬. Caspase-3的研究进展[J]. 中国细胞生物学学报, 2020, 42(11): 2072-2078. YU F M, XU Y. Research progress of Caspase-3[J]. Chinese Journal of Cell Biology, 2020, 42(11): 2072-2078. (in Chinese) |
| [19] |
SU L J, ZHANG J H, GOMEZ H, et al. Reactive oxygen species-induced lipid peroxidation in apoptosis, autophagy, and ferroptosis[J]. Oxid Med Cell Longev, 2019, 2019: 5080843. |
| [20] |
胡跃强, 唐农, 王启芝, 等. 实验性脑缺血损伤大鼠Nrf2/ARE信号通路相关基因NQO1、GCLC和GCLM表达的变化[J]. 中风与神经疾病杂志, 2019, 36(10): 873-876. HU Y Q, TANG N, WANG Q Z, et al. The expression Chang of Nrf2/ARE signaling pathway related genes NQO1, GCLC and GCLM in rats with experimental cerebral ischemia reperfusion injury[J]. Journal of Apoplexy and Nervous Diseases, 2019, 36(10): 873-876. (in Chinese) |
| [21] |
ZHANG Q, LIU J, DUAN H X Y, et al. Activation of Nrf2/HO-1 signaling: an important molecular mechanism of herbal medicine in the treatment of atherosclerosis via the protection of vascular endothelial cells from oxidative stress[J]. J Adv Res, 2021, 34: 43-63. DOI:10.1016/j.jare.2021.06.023 |
| [22] |
HE J, ZHOU D, YAN B. Eriocitrin alleviates oxidative stress and inflammatory response in cerebral ischemia reperfusion rats by regulating phosphorylation levels of Nrf2/NQO-1/HO-1/NF-κB p65 proteins[J]. Ann Transl Med, 2020, 8(12): 757. |
| [23] |
WEN Z M, HOU W C, WU W, et al. 6'-O-galloylpaeoniflorin attenuates cerebral ischemia reperfusion-induced neuroinflammation and oxidative stress via PI3K/Akt/Nrf2 activation[J]. Oxid Med Cell Longev, 2018, 2018: 8678267. |
| [24] |
郑兰, 王馨悦, 韩安娜, 等. 神经胶质瘤中NQO1高表达在预后评估中的意义[J]. 临床与实验病理学杂志, 2020, 36(1): 20-23. ZHENG L, WANG X Y, HAN A N, et al. Prognostic evaluation significance of NQO1 overexpression in glioma[J]. Journal of Clinical and Experimental Pathology, 2020, 36(1): 20-23. (in Chinese) |
| [25] |
于春磊, 李强, 牛英才, 等. 天麻素和异钩藤碱联合应用对MPP+诱导的PC12细胞ROS产生的协同抑制作用[J]. 时珍国医国药, 2021, 32(5): 1046-1050. YU C L, LI Q, NIU Y C, et al. The combination of gastrodin and isorhynchophylline exhibits a synergistic ROS-scav-enging action in MPP+ -challenged PC12 cells[J]. Lishizhen Medicine and Materia Medica Research, 2021, 32(5): 1046-1050. (in Chinese) |
(编辑 白永平)



