2. 中国农业科学院兰州兽医研究所 兰州大学动物医学与生物安全学院 家畜疫病病原生物学国家重点实验室,兰州 730000;
3. 河北科技师范学院动物科技学院 河北省预防兽医学重点实验室,秦皇岛 066004;
4. 深圳真瑞生物科技有限公司,深圳 518000
2. State Key Laboratory of Veterinary Etiological Biology, College of Veterinary Medicine, Lanzhou University, Lanzhou Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Lanzhou 730000, China;
3. Hebei Key Laboratory of Preventive Veterinary Medicine, College of Animal Science and Technology, Hebei Normal University of Science & Technology, Qinhuangdao 066004, China;
4. Shenzhen Zhenrui Biological Science and Techonology Co. Ltd., Shenzhen 518000, China
非洲猪瘟(African swine fever, ASF)是由非洲猪瘟病毒(ASF virus, ASFV)感染引起家猪和野猪的一种急性、出血性的烈性传染病[1]。动物感染不同的ASFV毒株产生不同临床症状,从亚临床型到高度致死型[2]。2018年,我国首次爆发ASF疫情之后,该病在我国迅速蔓延,对我国养猪业的发展和国内动物食品安全造成了严重威胁[3]。ASFV的基因组庞大,且对其病毒基因的功能注释仍不完全清楚,是导致目前没有获得有效疫苗的重要原因之一。目前,该病仍在非洲、欧洲和亚洲持续传播,防控形势至今仍异常严峻[4]。因此,对于ASFV的基因进行功能注释显得尤为重要。
ASFV是一种大型、高度结构化的包膜DNA病毒,具有双链DNA基因组(180~190 kb),编码至少160个开放阅读框(ORFs),包括结构蛋白、免疫逃避蛋白、病毒复制相关蛋白、多基因家族蛋白和许多功能未知蛋白[5]。ASFV基因组中大约30%的基因具有多个拷贝,称为多基因家族(multigene families,MGF),包括MGF100、MGF110、MGF300、MGF360和MGF505/530,由于MGF基因插入和删除,ASFV基因组长度在不同毒株间存在差异[6]。不同ASFV毒株的基因组含有数目不同的MGF,这些基因与ASFV的嗜性、天然免疫逃逸及病毒毒力相关[7]。有研究报道,在强毒力ASFV Georgia 2007/1(ASFV-G)中特异性地删除包括MGF360-13L在内的6个MGF基因后免疫家猪,能够有效提高免疫猪受强毒株ASFV-G感染的存活率[8],这提示了MGF360-13L在ASFV致病过程中可能具有重要功能。目前,已有研究证明MGF360-13L能够通过cGAS-STING信号通路抑制宿主Ⅰ型干扰素的产生[9],但该研究仅通过外源表达的方法研究了蛋白功能。在实际情况中,ASFV编码多种蛋白,其中许多蛋白间存在相互作用,因此,利用单基因缺失株研究MGF360-13L基因功能具有重要意义。
炎症反应是天然免疫的重要组成部分,与病毒感染后的发病进程和致病力有关[10]。在猪体内,ASFV主要在血液中的单核细胞和组织中的巨噬细胞中复制,不同ASFV感染巨噬细胞后,促炎性细胞因子的分泌活化能力也存在差异[11]。而目前关于ASFV调控机体炎症反应相关研究仍然不完全清楚,因此对于ASFV调控炎症反应的研究势在必行。
1 材料与方法 1.1 试验材料与主要试剂非洲猪瘟基因II型野生毒株ASFV CN/GS/2018由兰州兽医研究所P3实验室分离并保存;猪肺泡巨噬细胞(porcine alveolar macrophages, PAMs)和猪骨髓巨噬细胞(porcine bone marrow macrophages,BMDM)取自40日龄仔猪;pAVX1真核表达载体、大肠杆菌DH5α感受态细胞、293T人源上皮细胞和IL-1β、IL-6、TNF-α和GAPDH qPCR检测引物[12]由兰州兽医研究所口蹄疫与新发流行病学团队保存;DMEM培养基、1640培养基、胎牛血清购自Gibco公司;ELISA检测试剂盒购自欣博盛公司;质粒大提取试剂盒、PCR产物纯化试剂盒购自Promega生物科技有限公司;脂质体转染试剂lipofectamine2000购自Invitrogen公司;辣根过氧化物酶标记的山羊抗小鼠IgG购于中杉金桥公司;一步法TB GreenⓇ RT-PCR定量检测试剂盒、PrimeSTARⓇ HS高保真PCR酶购自TaKaRa公司;ClonExpress II One Step Cloning Kit重组酶购自南京诺唯赞生物公司。
1.2 ASFV MGF360-13L生物信息学分析以ASFV CN/GS/2018全基因组序列中MGF360-13L基因为分析对象,使用ProtScale(https://web.expasy.org/protscale/)分析MGF360-13L蛋白的亲疏水性;使用TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测MGF360-13L蛋白的跨膜结构;用SignalP-5.0 Server(http://www.cbs.dtu.dk/services/SignalP/)在线预测蛋白质的信号肽;利用PredictProtein在线工具(http://www.predictprotein.org/)对蛋白质二级结构进行预测;用SWISS-MODEL(https://swissmodel.expasy.org/)的同源建模方法构建蛋白质三级结构模型。通过EBI(https://www.ebi.ac.uk/Tools/msa/clustalo/)对基因II型ASFV的MGF360-13L基因进行氨基酸序列比对,利用MEGA7.0.26构建系统进化树。
1.3 ASFV MGF360-13L基因真核表达质粒的构建及验证根据ASFV CN/GS/2018毒株序列设计含有真核表达载体pVAX1同源臂的MGF360-13L全基因扩增引物F1/R1(表 1),并在目的基因N端添加Flag标签序列;以提取的ASFV CN/GS/2018基因组为模板,使用PrimeSTARⓇHS高保真PCR酶扩增MGF360-13L基因片段,扩增PCR反应程序:95 ℃预变性3 min;95 ℃变性30 s,60 ℃退火15 s,72 ℃延伸70 s,34次循环;72 ℃总延伸5 min。PCR产物经1%琼脂糖凝胶电泳鉴定并回收。使用ClonExpress II One Step Cloning Kit连接酶将载体与目的片段进行连接,37 ℃连接30 min,构建完成的重组质粒pVAX1-MGF360-13L送至兰州天启基因生物科技有限公司测序,测序正确的重组质粒转染至293T细胞中进行蛋白表达验证。
|
|
表 1 本研究用引物 Table 1 Primers used in this study |
单基因缺失毒株ASFV-ΔMGF360-13L由亲本毒株ASFV CN/GS/2018与重组转移载体p72mCherry MGF360-13L同源重组生成。p72mCherry MGF360-13L重组转移载体包含MGF360-13L基因上、下游各约1 000 bp的同源臂序列(对应病毒基因组位置分别为29 584~20 594 bp和31 657~32 657 bp),上、下游同源臂序列间为p72启动子和mCherry基因。分别设计上游同源臂扩增引物360-13L-L-F2/R2、下游同源臂扩增引物360-13L-R-F3/R3和p72mCherry荧光报告盒扩增引物360-13L-mCherry-F4/R4(表 1),扩增同源臂和p72mCherry荧光基因,使用ClonExpress II One Step Cloning Kit重组酶将上述3个片段与线性化载体pUC19进行连接,将构建完成的p72mCherry-MGF360-13L进行单酶切鉴定后测序验证。
1.5 ASFV-ΔMGF360-13L缺失毒制备将测序正确的p72mCherry MGF360-13L转染BMDM细胞,1 h后感染ASFV CN/GS/2018毒株,使ASFV CN/GS/2018与p72mCherry MGF360-13L在细胞内进行同源重组,生成重组病毒ASFV-ΔMGF360-13L,感染48 h后通过观察mCherry荧光,挑取具有mCherry荧光的BMDM,通过连续14轮极限稀释纯化得到重组ASFV-ΔMGF360-13L。为检测制备缺失毒株的纯度,根据MGF360-13L基因设计引物360-13L-F5/R5(表 1);分别以提取的ASFV CN/GS/2018和ASFV-ΔMGF360-13L基因组为模板,进行PCR扩增,反应程序: 95 ℃预变性3 min; 95 ℃变性30 s,62 ℃退火15 s,72 ℃延伸70 s,34次循环;72 ℃总延伸5 min。将提取的ASFV-ΔMGF360-13L基因组送基因公司进行测序。
1.6 ASFV-ΔMGF360-13L体外生长曲线测定比较ASFV-ΔMGF360-13L与ASFV CN/GS/2018的体外生长趋势。将PAMs细胞铺于96孔板中过夜培养形成单层细胞,并以MOI=0.01的ASFV-ΔMGF360-13L与ASFV CN/GS/2018感染细胞,置于37 ℃、5% CO2细胞培养箱,吸附1 h后去除接种物,用PBS冲洗3次,加入1.5 mL培养基,在37 ℃、5% CO2细胞培养箱中孵育2、24、48、72和96 h,在感染后不同时间点收取样品,冻融后,在PAMs细胞上进行病毒滴定,通过血细胞吸附试验(HAD)计算病毒滴度。
1.7 ASFV-ΔMGF360-13L感染BMDM细胞后炎性因子的检测为了探究ASFV-ΔMGF360-13L与ASFV CN/GS/2018在感染巨噬细胞后细胞炎性因子表达水平是否相同;将BMDM细胞铺于6孔板中过夜培养形成单层细胞,并以MOI=1分别感染ASFV-ΔMGF360-13L与ASFV CN/GS/2018,在37 ℃、5% CO2细胞培养箱中各分别孵育4、8、12、24、48 h后收取细胞样品;用TRIzol总RNA提取试剂提取总RNA,使用一步法TB GreenⓇRT-PCR定量检测试剂盒检测细胞IL-1β、IL-6和TNF-α炎症因子的mRNA水平。荧光定量PCR反应条件:42 ℃反转录5 min、95 ℃预变性10 s;95 ℃ 5 s、60 ℃ 40 s,40次循环;使用ELISA检测试剂盒检测上清样品中分泌的IL-1β、IL-6和TNF-α含量;并用qPCR检测病毒基因组拷贝数[13]。
1.8 生物安全涉及ASFV病原的操作及样品的制备在中国农业科学院兰州兽医研究所P3实验室开展,试验中所产生的废弃物均经过灭菌杀毒后无害化处理。
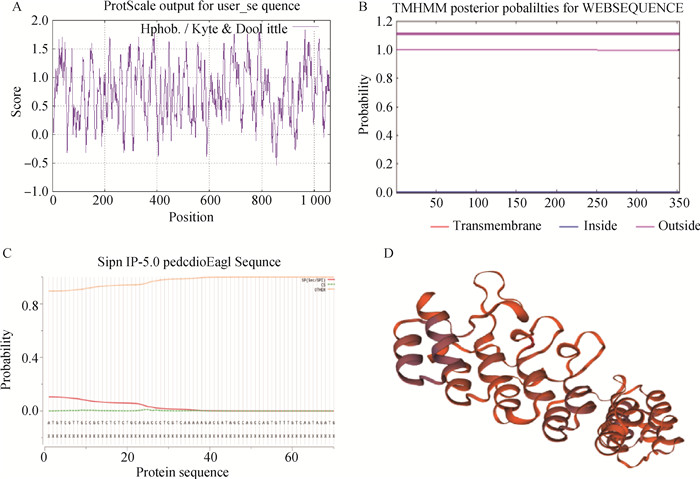
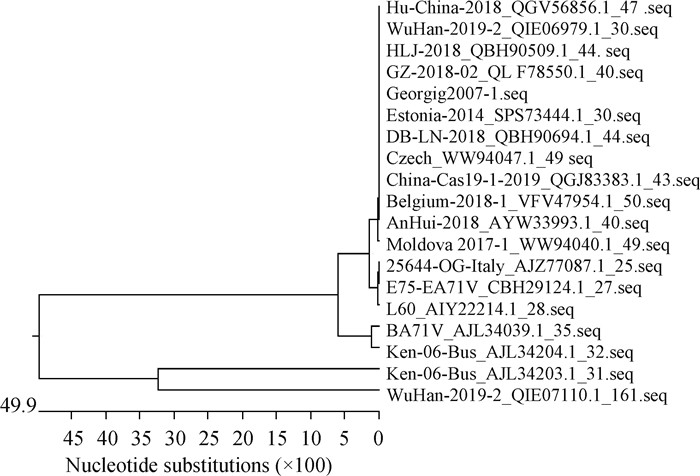
2 结果 2.1 MGF360-13L基因生物信息学分析利用ProtScale软件对MGF360-13L基因做亲水性分析,纵坐标负值表示亲水区,可见组成MGF360-13L蛋白的氨基酸多集中在正值,整体表现为疏水性(图 1A);TMHMM Server v.2.0软件预测表明,MGF360-13L蛋白不存在跨膜区(图 1B);使用SignalP-5.0 Server软件预测发现,MGF360-13L蛋白S值为0.110 1(S>0.5,则判断为分泌蛋白并且有信号肽),说明该蛋白不是分泌蛋白且不存在信号肽(图 1C);预测MGF360-13L蛋白二级结构中α-螺旋、β-折叠、β-转角和无规则卷曲分别占52.12%、0.00%、5.38%和27.20%,α-螺旋和无规则卷曲比例高则有助于蛋白质的稳定性;其三级结构如图 1D,有α-螺旋结构富集域, 以β-转角和无规卷曲连接形成其特定结构,与二级结构预测结果一致。通过EBI对比不同ASFV的MGF360-13L蛋白氨基酸序列,发现在不同基因II型病毒分离株中MGF360-13L蛋白序列相对保守,从系统进化树可知我国流行的ASFV基因II型毒株与ASFV-G关系密切(图 2)。
|
A.蛋白亲疏水性分析;B.跨膜区预测;C.信号肽预测;D.三级结构预测 A. Hydrophilic analysis; B. Prediction of transmembrane region; C. Signal peptide prediction; D. Tertiary structure prediction 图 1 MGF360-13L生物信息学分析 Fig. 1 Bioinformatics analysis of MGF360-13L |
|
图 2 ASFV MGF360-13L基因系统进化树 Fig. 2 Phylogenetic tree of ASFV MGF360-13L gene |
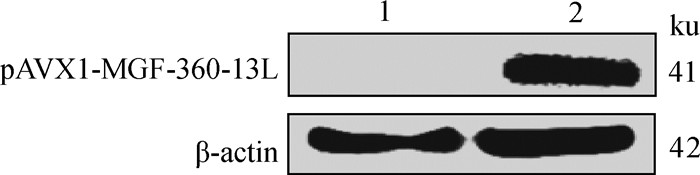
使用ASFV CN/GS/2018基因组DNA为模板,通过PCR方法扩增目的片段MGF360-13L,经1%的琼脂糖凝胶电泳检测可见与预期目的片段大小相同(图 3A)。将连接后的载体进行单酶切(HindⅢ)验证,条带大小与预期条带大小相一致,同时送测序验证(图 3B);测序正确后提取表达质粒,转染至293T细胞,培养24 h后利用Western blot检测蛋白表达,结果显示,在41 ku处出现特异性条带,ASFV MGF360-13L基因外源表达成功(图 4)。

|
A. MGF360-13L基因条带扩增: M.DNA相对分子质量标准;1.阴性对照2.扩增目的基因条带(1 063 bp)。B.重组质粒PCR扩增:M.DNA相对分子质量标准;1.载体对照(2 999 bp);2.重组质粒扩增条带(4 062 bp) A. Amplification of MGF360-13L; M. DNA relative molecular weight standard: 1. Negative control; 2. Amplification of the target gene(1 063 bp). B. PCR amplification of recombinant plasmid: M. DNA relative molecular weight standard; 1. Vector control(2 999 bp); 2. Amplification band of recombinant plasmid(4 062 bp) 图 3 MGF360-13L基因PCR扩增及载体酶切验证 Fig. 3 PCR amplification and vector enzyme digest verification of MGF360-13L gene |
|
1.空白对照;2.转染pAVX1-MGF360-13L在细胞中表达 1. Blank control; 2. Transfected pVAX1-MGF360-13L was expressed in cells 图 4 质粒pAVX1-MGF360-13L表达鉴定 Fig. 4 Expression and identification of plasmid pAVX1-MGF360-13L |
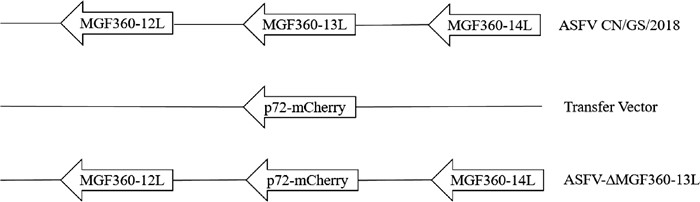
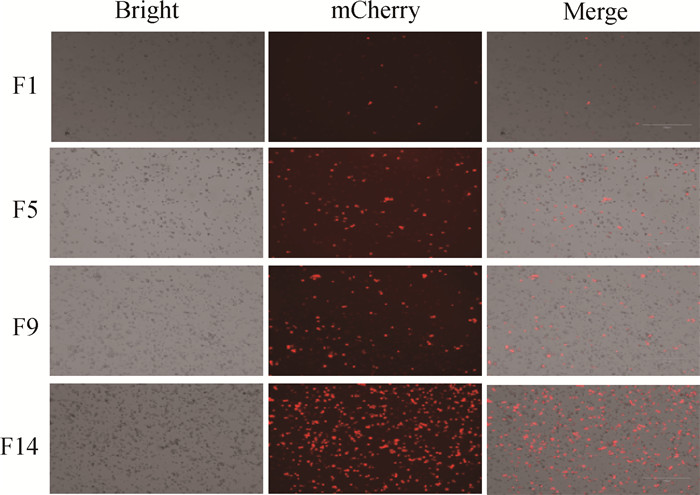
为进一步研究MGF360-13L基因在病毒复制过程中的功能,使用同源重组方法构建基因缺失毒株ASFV-ΔMGF360-13L(图 5)。首先扩增同源臂及荧光基因片段(图 6A),构建重组转移载体p72mCherry-MGF360-13L,酶切验证(HindⅢ)符合预期大小后质粒测序(图 6B)。将测序正确的重组转移载体转染BMDM细胞,1 h后感染ASFV CN/GS/2018。通过观察荧光判断病毒重组效率及纯化效率(图 7),连续纯化多代,其间收集细胞病毒提取基因组DNA,利用PCR鉴定病毒纯度,最终经过14轮纯化获得单纯的MGF360-13L单基因缺失毒株(图 6C)。对经过PCR验证后的基因缺失毒株进行测序验证,结果显示ASFV-Δ MGF360-13L与ASFV CN/GS/2018比较,于MGF360-13L基因位置缺失1 063个核苷酸(MGF360-13L),插入1 294个核苷酸(p72mCherry),表明ASFV-ΔMGF360-13L毒株构建成功。
|
图 5 ASFV-ΔMGF360-13L构建策略示意图 Fig. 5 The schematic diagram of ASFV-ΔMGF360-13L construction strategy |

|
A.同源臂片段PCR扩增: M.DNA相对分子质量标准;1、3、5. 阴性对照;2. MGF360-13L上游同源臂扩增(1 000 bp);4. MGF360-13L下游同源臂扩增(1 000 bp);6.p72mCherry基因扩增(1 200 bp)。B.重组质粒PCR扩增: M. DNA相对分子质量标准;1. 载体对照(2 300 bp);2. 重组质粒扩增条带(5 499 bp)。C. ASFV-ΔMGF-360-13L纯度PCR鉴定: M. DNA相对分子质量标准;1. 阴性对照;2.ASFV-ΔMGF360-13L基因组DNA为扩增模板,无条带;3. ASFV CN/GS/2018基因组DNA为扩增模板,扩增出目的基因MGF360-13L条带(1 063 bp) A. PCR amplification of homologous arm fragment: M. DNA relative molecular weight standard; 1, 3, 5. Negative control; 2. Upstream homologous arm amplification of MGF360-13L(1 000 bp) 4. Downstream homologous arm amplification of MGF360-13L(1 000 bp); 6. p72mCherry gene amplification(1 200 bp). B.PCR amplification of recombinant plasmid: M. DNA relative molecular weight standard; 1. Carrier control(2 300 bp); 2. Amplification band of recombinant plasmid (5 499 bp). C.ASFV-ΔMGF-360-13L purity PCR identification: M. DNA relative molecular weight standard; 1. Negative control; 2. ASFV-ΔMGF360-13L genomic DNA as amplification template, without bands; 3.ASFV CN/GS/2018 genomic DNA was used as the amplification template, and the target gene MGF360-13L band was amplified(1 063 bp) 图 6 重组转移载体p72mCherry-MGF360-13L构建及缺失毒纯度鉴定 Fig. 6 Construction of recombinant transfer vector p72mCherry-MGF360-13L and purity identification of the gene deleted strain |
|
Bright.自然光观察结果;mCherry.荧光观察结果;Merge.合并观察结果;F1. 第一轮纯化结果;F5. 第五轮纯化结果;F9. 第九轮纯化结果;F14. 第十四轮纯化结果 Bright. Natural light observation results; mCherry. Fluorescence observation results; Merge. Combined observation results; F1. The first round of purification rersults; F5. The fifth round of purification results; F9. The ninth round of purification results; F14. The fourteenth round of purification results 图 7 ASFV-ΔMGF360-13L纯化结果 Fig. 7 Purification result of ASFV-ΔMGF360-13L |
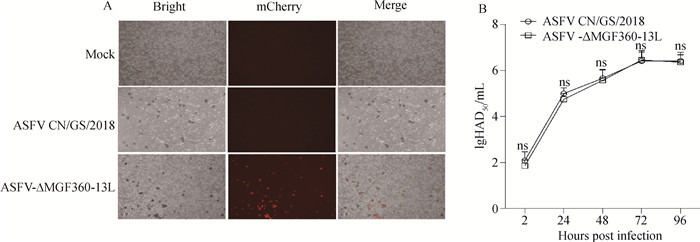
用MOI=0.01的ASFV-ΔMGF360-13L与ASFV CN/GS/2018分别感染PAMs细胞,分别在感染2、24、48、72和96 h收取样品,冻存于-70 ℃冰箱,并用解冻后的裂解液测定病毒滴度。结果显示,ASFV-ΔMGF360-13L与ASFV CN/GS/2018在不同时间点的病毒量无显著差异(图 8)。
|
A. HAD50试验显微镜观察结果: Bright. 自然光观察结果;mCherry. 荧光观察结果;Merge. 合并观察结果;Mock. 阴性对照;ASFV CN/GS/2018. 亲本毒株;ASFV-ΔMGF360-13L. 缺失毒株;B. ASFV-ΔMGF360-13L和ASFV CN/GS/2018体外生长特性比较。ns. 差异不显著(P>0.05) A.HAD50 experimental microscope observation: Bright. Natural light observation results; mCherry. Fluorescence observation results; Merge. Combined observation results; Mock. Negative control; ASFV CN/GS/2018. Parent strain; ASFV-ΔMGF360-13L. The gene deleted strain. B.Comparison of in vitro growth characteristics between ASFV-ΔMGF360-13L and ASFV CN/GS/2018. ns. No significant difference (P > 0.05) 图 8 血吸附试验观察结果与病毒体外生长比较 Fig. 8 The results of blood adsorption experiment were compared with the growth of virus in vitro |
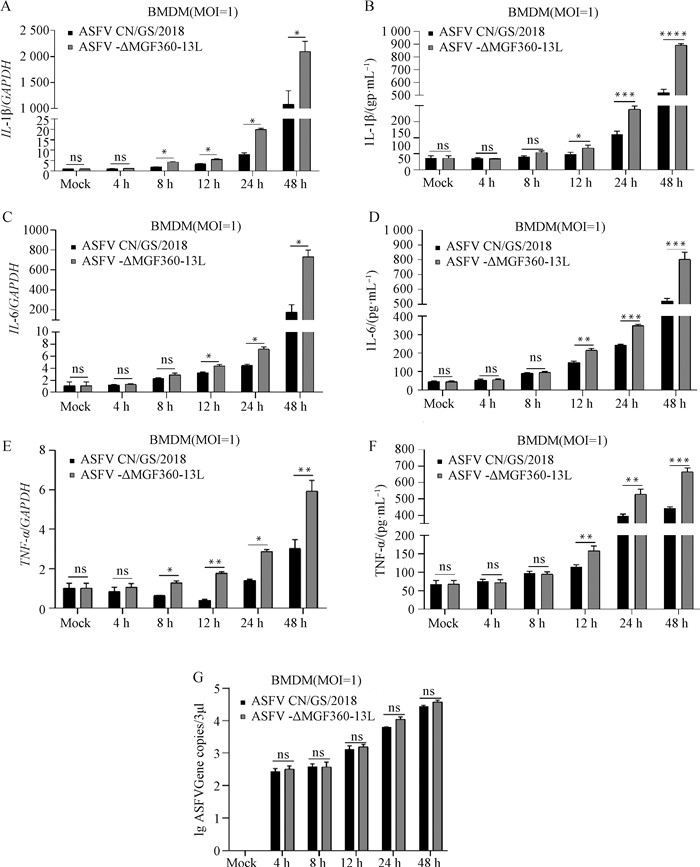
用MOI=1的ASFV-ΔMGF360-13L与ASFV CN/GS/2018分别感染BMDM细胞,在感染后4、8、12、24、48 h分别收集样品,提取细胞总RNA,测定总RNA浓度,使用qPCR方法检测细胞IL-1β、IL-6和TNF-α炎性因子相对表达量,采用ELISA检测上清液中炎性因子的含量。结果显示,在ASFV-ΔMGF360-13L与ASFV CN/GS/2018感染后4 h时,检测细胞产生的IL-1β、IL-6和TNF-α炎性因子mRNA水平和蛋白水平无显著性差异;在感染12 h后炎症因子表达mRNA水平和蛋白水平存在显著性差异(图 9A~F,P<0.05)。qPCR方法测定病毒拷贝数在不同时间点的增长(图 9G)。
|
A、C、E. 感染后4、8、12、24、48 h时IL-1β、IL-6和TNF-α相对mRNA表达量;B、D、F. 感染后4、8、12、24、48 h时IL-1β、IL-6和TNF-α的ELISA结果;G. 不同时间点ASFV拷贝数;ns. 差异不显著(P>0.05);*、**、***. 差异显著(P < 0.05) A, C, E. The relative mRNA expression levels of IL-1β, IL-6 and TNF-α at 4, 8, 12, 24 and 48 h after infection; B, D, F. The ELISA results of IL-1β, IL-6 and TNF-α at 4, 8, 12, 24 and 48 h after infection; G. ASFV copy number at different time points. ns. No significant difference (P > 0.05);*, **, ***. Significant difference(P < 0.05) 图 9 细胞炎性因子相对表达量及病毒拷贝数检测 Fig. 9 Detection of relative expression level of cytokines and virus copy number |
目前,ASFV仍然威胁着我国的养猪业,严重影响农业经济的发展。由于免疫环境复杂且涉及多种免疫机制和免疫决定因素,ASFV疫苗的研发具有重重阻碍,目前尚没有有效的疫苗,只能通过动物检疫和屠宰来控制疫情。
ASFV基因组编码多达150到200个蛋白,其中大多数还没有经过功能鉴定,ASFV编码的毒力基因、宿主-病毒相互作用方式和发病机制仍远未被了解[14]。因此,识别病毒蛋白功能,解析病毒在体内和体外复制的规律,以及对病毒毒力基因的研究具有重要意义,是研发ASFV疫苗的一个至关重要的环节。
减毒活疫苗是有效开发ASF疫苗的方法之一[15]。研究发现,在高毒力ASFV-G中分别删除9GL、UK和I177L等基因能够致弱ASFV-G的致病性,其缺失毒株在免疫猪只后受到同源亲本ASFV-G攻击时获得了一定的保护[16-17]。也有研究发现,在高毒力ASFV-G中删除MGF360-1L、X69R、J64R基因时并不减弱病毒毒力,与亲本ASFV-G感染时引起的症状无明显区别[18-19]。因此,在庞大的ASFV基因组筛选有效的毒力基因,是成功制备ASFV减毒活疫苗的关键。
现已知MGF家族蛋白在病毒的转录、翻译和免疫逃逸等多个阶段发挥重要作用。研究发现,在高毒力ASFV-G中删除MGF360和MGF505部分基因以及在高毒力ASFV CN/GS/2018中删除MGF110-9L、MGF505-7R基因可以减弱亲本ASFV毒力[8, 12-13]。因此,本研究以MGF360-13L为对象进行研究。通过生物信息学分析,发现MGF360-13L蛋白为亲水性蛋白,且不具有跨膜区,也不是分泌蛋白;成功构建了外源表达质粒pVAX1-MGF360-13L,在293T细胞中成功表达MGF360-13L蛋白;通过同源重组方法构建了单基因缺失毒株ASFV-ΔMGF360-13L,并通过生长曲线的绘制证明其在病毒复制中的非必需性。
ASFV有严格的细胞噬性,其主要靶细胞是巨噬细胞和单核细胞,也有报道其在树突状细胞中复制[20]。这些细胞类型在先天免疫反应中发挥着关键作用[21]。其中,巨噬细胞是专门识别和破坏病原体并启动炎症反应的关键,ASFV感染巨噬细胞会诱导炎症因子表达和促进细胞凋亡[22]。有研究发现,ASFV病毒蛋白L83L能够特异性结合宿主基因IL-1β, L83L基因缺失的ASFV毒株毒力并没有减弱[23],这也提示了ASFV致病过程的复杂性。本研究通过构建基因缺失毒株,证实了MGF360-13L能够抑制宿主炎性因子的表达。
4 结论在本研究中,使用生物信息学软件分析了ASFV MGF360-13L基因的初步信息,成功构建了外源表达质粒pVAX1-MGF360-13L,构建了单基因缺失毒株ASFV-ΔMGF360-13L,证明该基因为ASFV非必需基因,在感染BMDM细胞时,缺失毒株刺激细胞产生的IL-1β、IL-6和TNF-α等炎性因子水平高于亲本毒株,证明MGF360-13L基因在AFSV感染BMDM细胞产生炎症因子应答反应具有一定的抑制作用。本文研究为进一步揭示ASFV MGF360-13L基因功能做了铺垫。
| [1] |
DIXON L K, CHAPMAN D A G, NETHERTON C L, et al. African swine fever virus replication and genomics[J]. Virus Res, 2013, 173(1): 3-14. DOI:10.1016/j.virusres.2012.10.020 |
| [2] |
MALOGOLOVKIN A, KOLBASOV D. Genetic and antigenic diversity of African swine fever virus[J]. Virus Res, 2019, 271: 197673. DOI:10.1016/j.virusres.2019.197673 |
| [3] |
GE S Q, LI J M, FAN X X, et al. Molecular characterization of African swine fever virus, China, 2018[J]. Emerg Infect Dis, 2018, 24(11): 2131-2133. DOI:10.3201/eid2411.181274 |
| [4] |
CACKETT G, MATELSKA D, SÝKORA M, et al. The African swine fever virus transcriptome[J]. J Virol, 2020, 94(9): e00119-20. |
| [5] |
ZHU Z Z, CHEN H T, LIU L, et al. Classification and characterization of multigene family proteins of African swine fever viruses[J]. Brief Bioinform, 2021, 22(4): bbaa380. DOI:10.1093/bib/bbaa380 |
| [6] |
FARLOW J, DONDUASHVILI M, KOKHREIDZE M, et al. Intra-epidemic genome variation in highly pathogenic African swine fever virus (ASFV) from the country of Georgia[J]. Virol J, 2018, 15(1): 190. DOI:10.1186/s12985-018-1099-z |
| [7] |
DIXON L K, ISLAM M, NASH R, et al. African swine fever virus evasion of host defences[J]. Virus Res, 2019, 266: 25-33. DOI:10.1016/j.virusres.2019.04.002 |
| [8] |
O'DONNELL V, HOLINKA L G, GLADUE D P, et al. African swine fever virus Georgia isolate harboring deletions of MGF360 and MGF505 genes is attenuated in swine and confers protection against challenge with virulent parental virus[J]. J Virol, 2015, 89(11): 6048-6056. DOI:10.1128/JVI.00554-15 |
| [9] |
郭泽恒. 非洲猪瘟病毒MGF360-13L蛋白通过cGAS-STING信号通路抑制Ⅰ型干扰素的产生[D]. 武汉: 华中农业大学, 2021. GUO Z H. African swine fever virus MGF360-13L inhibited type I interferon production through cGAS-STING pathway[D]. Wuhan: Huazhong Agricultural University, 2021. (in Chinese) |
| [10] |
KUPRASH D V, NEDOSPASOV S A. Molecular and cellular mechanisms of inflammation[J]. Biochemistry (Mosc), 2016, 81(11): 1237-1239. DOI:10.1134/S0006297916110018 |
| [11] |
CORREIA S, VENTURA S, PARKHOUSE R M. Identification and utility of innate immune system evasion mechanisms of ASFV[J]. Virus Res, 2013, 173(1): 87-100. DOI:10.1016/j.virusres.2012.10.013 |
| [12] |
LI D, YANG W P, LI L L, et al. African swine fever virus MGF-505-7R negatively regulates cGAS-STING-mediated signaling pathway[J]. J Immunol, 2021, 206(8): 1844-1857. DOI:10.4049/jimmunol.2001110 |
| [13] |
LI D, LIU Y G, QI X L, et al. African swine fever virus MGF-110-9L-deficient mutant has attenuated virulence in pigs[J]. Virol Sin, 2021, 36(2): 187-195. DOI:10.1007/s12250-021-00350-6 |
| [14] |
潘力, 罗瑞, 王涛, 等. 非洲猪瘟病毒研究进展: 组学视角[J]. 病毒学报, 2022, 38(2): 246-256. PAN L, LUO R, WANG T, et al. Advances in African swine fever virus research: An omics view[J]. Chinese Journal of Virology, 2022, 38(2): 246-256. (in Chinese) |
| [15] |
URBANO A C, FERREIRA F. Role of the DNA-binding protein pA104R in ASFV genome packaging and as a novel target for vaccine and drug development[J]. Vaccines (Basel), 2020, 8(4): 585. DOI:10.3390/vaccines8040585 |
| [16] |
O'DONNELL V, RISATTI G R, HOLINKA L G, et al. Simultaneous deletion of the 9GL and UK genes from the African swine fever virus Georgia 2007 isolate offers increased safety and protection against homologous challenge[J]. J Virol, 2016, 91(1): e01760-16. |
| [17] |
BORCA M V, RAMIREZ-MEDINA E, SILVA E, et al. Development of a highly effective African swine fever virus vaccine by deletion of the I177L gene results in sterile immunity against the current epidemic Eurasia strain[J]. J Virol, 2020, 94(7): e02017-19. |
| [18] |
RAMIREZ-MEDINA E, VUONO E A, RAI A, et al. Evaluation in swine of a recombinant African swine fever virus lacking the MGF-360-1L gene[J]. Viruses, 2020, 12(10): 1193. DOI:10.3390/v12101193 |
| [19] |
RAMIREZ-MEDINA E, VUONO E, PRUITT S, et al. X69R is a non-essential gene that, when deleted from African swine fever, does not affect virulence in swine[J]. Viruses, 2020, 12(9): 918. DOI:10.3390/v12090918 |
| [20] |
GALINDO I, ALONSO C. African swine fever virus: A review[J]. Viruses, 2017, 9(5): 103. DOI:10.3390/v9050103 |
| [21] |
黄瑶, 赵军, 曾喻兵, 等. 非洲猪瘟病毒调控宿主细胞因子表达水平的研究进展[J]. 病毒学报, 2021, 37(6): 1484-1490. HUANG Y, ZHAO J, ZENG Y B, et al. Research advances in regulation of expression of cytokines in hosts by the African swine fever virus[J]. Chinese Journal of Virology, 2021, 37(6): 1484-1490. (in Chinese) |
| [22] |
HAMIDZADEH K, CHRISTENSEN S M, DALBY E, et al. Macrophages and the recovery from acute and chronic inflammation[J]. Annu Rev Physiol, 2017, 79: 567-592. DOI:10.1146/annurev-physiol-022516-034348 |
| [23] |
BORCA M V, O'DONNELL V, HOLINKA L G, et al. The L83L ORF of African swine fever virus strain Georgia encodes for a non-essential gene that interacts with the host protein IL-1β[J]. Virus Res, 2018, 249: 116-123. DOI:10.1016/j.virusres.2018.03.017 |
(编辑 范子娟)



