2. 中国农业科学院兰州兽医研究所/家畜疫病病原生物学国家重点实验室/甘肃省动物寄生虫病重点实验室,兰州 730046
2. State Key Laboratory of Veterinary Etiological Biology/Key Laboratory of Veterinary Parasitology of Gansu Province/Lanzhou Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Lanzhou 730046, China
环形泰勒虫属于原生动物,是顶复门家族的一种胞内致病寄生虫,感染牛后可导致其淋巴结肿大、发热、黄疸和厌食,常被当作一种普通的发热症状治疗。因治疗措施不当病情加剧,从而导致感染牛死亡,在一些地区死亡率接近80%[1],给世界各地的养殖业每年造成的经济损失高达12.95亿美元[2]。环形泰勒虫病主要分布在热带和亚热带地区,但随着全球气温上升导致其媒介蜱分布范围扩大,以及国际畜牧贸易的往来,均加剧了环形泰勒虫的传播[3]。在我国,环形泰勒虫在北方牧区很常见,但近年来,在我国南方也相继有环形泰勒虫病例的报道[4-5]。
环形泰勒虫可感染宿主的单核细胞、淋巴细胞、树突状细胞,在没有抗原刺激或外源生长因子的情况下,被感染的细胞在体外培养时表现出无限增殖的特征,也称为转化[6-7],同时被感染的细胞还具备逃脱免疫机制以及抗凋亡的能力,虽然这些与癌细胞表现出的特征极为相似[8]。但环形泰勒诱导的转化细胞也有一些独特之处,例如:这种转化是完全可逆的。感染细胞的持续增殖取决于宿主细胞质中环形泰勒虫的存在,并且通过用特定的泰勒虫药物布帕伐醌处理消除寄生虫后,感染细胞会在3~4 d内恢复到正常,并最终经历细胞凋亡[9]。因此也有很多学者把这两者相联系,以期找到这些表型背后的分子机制。现阶段环形泰勒虫转化细胞的机制研究主要在抑制细胞的凋亡信号通路方面开展。已有多种虫体蛋白被验证可对宿主细胞的NF-κB、MAPK、c-Myc、JAK/ STAT3、JNK和C-Jun等信号通路发挥作用,从而增强细胞的转化活性。感染环形泰勒虫的淋巴细胞会在宿主体内增殖,导致感染动物全身出现多个肿瘤样病变[10]。环形泰勒虫在感染细胞中表现为无限繁殖,说明环形泰勒虫需要建立一种或者多种机制来保护被感染的细胞免受促死亡信号的激活。现已证明多种抗凋亡蛋白在环形泰勒虫转化的淋巴细胞中被激活,比如p53蛋白[11]。同样在泰勒虫转化的细胞中,发现NF-κB被结构性激活,这赋予感染细胞对抗凋亡的能力[12]。在这样的背景下,本实验室通过药物处理前后环形泰勒虫感染的牛单核细胞(TaNM Ⅰ)转录组数据的比较分析。筛选出与细胞增殖、凋亡相关的信号通路中发挥重要作用的分子,预测其在细胞转化过程中发挥的作用,为后续研究的开展奠定基础。
1 材料与方法 1.1 试验材料与试剂1.1.1 细胞来源 环形泰勒虫裂殖体感染的牛单核细胞(TaNM Ⅰ)由中国农业科学院兰州兽医研究所国家重点实验室提供。
1.1.2 主要试剂 M5 Total RNA Extraction Reagent购自聚合美公司;PrimeScripTMRT reagent Kit with gDNA Eraser、RPMI 1640培养基均购自TaKaRa公司;布帕伐醌(BW720)购自源叶生物公司;二甲基亚砜(DMSO)、10×PBS缓冲液购自索莱宝公司;甲醇(CH3OH)、乙醇(C2H5OH)、氯仿(CHCl3)等均为国产分析纯。
1.1.3 主要仪器 细胞培养箱(3423)、超微量分光光度计(Nano Drop2000)、-80 ℃冰箱(900)购自赛默飞(中国)公司;Bioanalyzer 2100生物分析仪购自上海亚晶公司;低速冷冻离心机(DL-5M)购自湘仪集团;可调式移液器购自艾本德中国有限公司;荧光定量PCR仪(Mx3005P)购自安捷伦科技公司;自动细胞计数仪购自上海睿钰公司。
1.2 试验方法1.2.1 环形泰勒虫转化细胞系的培养 将第20代环形泰勒虫感染细胞培养于含10%胎牛血清、16 ng·μL-1庆大霉素的RPMI1640培养瓶,置于37 ℃含5% CO2的培养箱中培养。
1.2.2 环形泰勒虫感染细胞的药物处理 将细胞浓度培养至1×105cells·mL-1,处理组加入DMSO配制的200 ng·mL-1的BW720,在DMSO对照组中加入相同体积的DMSO; 每组均设3个生物学重复,然后放回培养箱中继续培养,在72 h收集BW720处理组和DMSO对照组细胞样品,并调整细胞数在1×107细胞左右(数量相差控制在±2倍内)。同时利用吉姆萨染色法以及细胞计数的方式观察药物的作用效果。
1.2.3 总RNA的提取 按试剂盒说明利用Trizol Reagent分别提取BW720组和DMSO组的细胞总RNA,使用Nano Drop-2000分光光度计和Bioanalyzer2100生物分析仪对RNA浓度及RNA完整性进行鉴定。
1.2.4 mRAN文库构建 从样品中提取总RNA后,把BW720和DMSO处理的样品送至公司进行测序分析,构建好的文库使用Agilent 2100以及qPCR进行质控,最后利用测序平台Illumina HiSeq 4000进行测序。
1.2.5 测序数据质控 利用Fastqc和Trimglore软对原始数据(Raw reads)进行质量控制:1)去除含有接头的Reads;2)去除低质量的Reads(包括去除N的比例>10%的Reads,去除质量值Q≤10的碱基数占整条Read的50%以上的Reads);3)过滤包含poly A的Reads,过滤后得到的Clean reads,即有效序列,进行总数、种类分布统计,并用于后续分析。
1.2.6 BW720和DMSO处理后基因的比对与Venn分析 将严格质控后得到的序列,分别与GenBank、Rfam、RDP数据库进行比对,同时运用Blast软件,尽可能去除样本中的rRNA、scRNA、snoRNA、snRNA和tRNA,从而获得高质量数据。通过Hisat2软件将质控后的Clean reads数据映射到牛的参考基因组中,把与牛参考基因组相一致(外显子区域、内含子区域、重复序列区域)的Clean reads,以及未比对上的Clean reads与数据库中的mRNA前体序列进行比对,从而鉴定已知基因的序列。同时基于所选参考基因组序列,使用String Tie软件对Mapped reads进行拼接,并与原有的基因组注释信息进行比较,寻找原来未被注释的转录区,发掘该物种的新转录本和新基因,从而补充和完善原有的基因组注释信息。利用基迪奥在线工具集合(www.omicshare.com)对BW720和DMSO的mRNA进行Venn分析,采用默认参数,分别筛选出BW720和DMSO处理组的共有和差异的mRNA。
1.2.7 差异表达基因的GO和KEGG富集分析 高质量的转录组学数据可作为本研究中mRNA的数据来源。以差异倍数(Fold change)≥2且P≤0.01作为筛选标准,利用DESeq2和edgeR软件筛选BW720与DMSO处理组中差异表达的mRNA(DE mRNA)筛选结果的交集作为可信度高的mRNA。利用Blast工具将DE mRNA比对到GO和KEGG数据库,获得相应的功能和通路注释信息。
1.2.8 差异表达基因实时荧光定量PCR验证 分别以BW720和DMSO组的细胞为试验材料,利用M5 Total RNA Extraction Reagent提取总RNA,然后用逆转录试剂盒(TaKaRa PrimeScripTM RT reagent kit with gDNA Eraser)进行cDNA合成,-20 ℃保存备用。随机选择10个差异表达的基因,以牛的B2M为内参基因进行荧光定量验证,利用在线软件(Eurofinsgenomics.eu)设计引物,由生工生物工程(上海)股份有限公司合成(表 1)。按照TB GreenTM Premix Ex TaqTM Ⅱ(TaKaRa)说明书对目的基因进行RT-qPCR验证。每个样品设置3个重复,使用2-ΔΔCT方法计算基因的相对表达量,结果以“平均值±标准误差(x±s)”表示。使用t检验对相对表达量进行分析,若P value<0.05,则为差异显著。
|
|
表 1 RT-qPCR引物序列信息 Table 1 Primers for RT-qPCR |
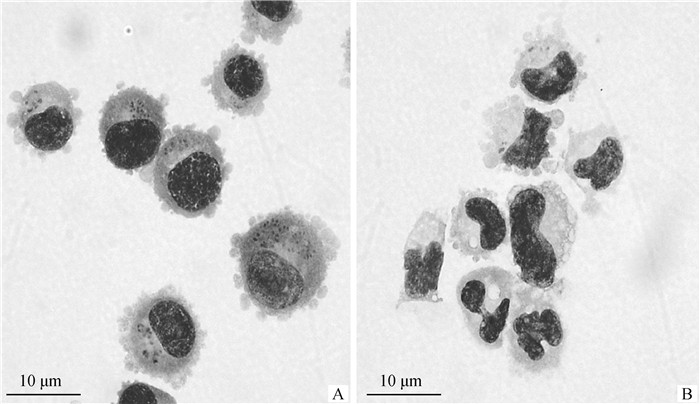
用BW720处理TaNMⅠ细胞后,细胞中的虫体数量以及感染细胞数量都有明显下降(图 1、2),说明BW720对环形泰勒虫作用明显,可用于后续试验。

|
图 1 DMSO和BW720处理TaNMⅠ细胞后的数量变化 Fig. 1 The number changes of TaNM I cells treated with DMSO and BW720 |
|
A. 用DMSO处理的感染细胞;B.用BW720处理的感染细胞 A.Infected cells treated with DMSO; B. Infected cells treated with BW720 图 2 DMSO和BW720处理TaNMⅠ感染细胞的吉姆萨染色观察 Fig. 2 Observation of T. annulata infected TaNM Ⅰcells treated with DMSO and BW720 by Giemsa staining |
将数据上传于服务器中进行质控、比对、计数。每个样品产生超过5.96Gb的Clean数据,测序结果如表 2所示,其中,比对率均在85%以上,Q30数据均在90%以上,表明测序数据满足后续分析的条件。本试验中BW720组和DMSO组分别得到6 854 019 704和6 627 265 854条Raw reads,经过一系列的筛选后,BW720组和DMSO组中分别获得22 925 606和22 171 427条Clean reads。
|
|
表 2 转录组测序数据质量检测分析 Table 2 Quality analysis of transcriptome sequencing data |
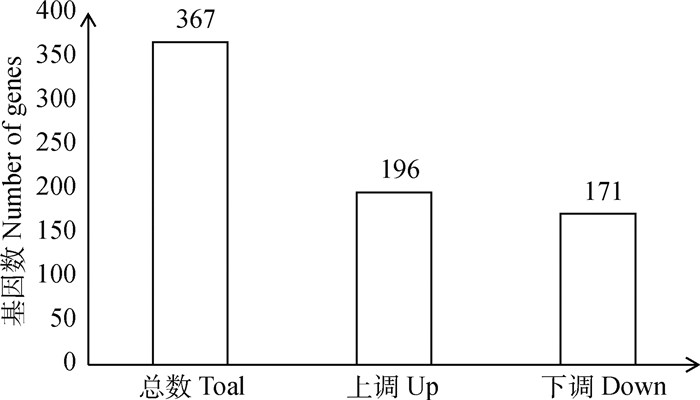
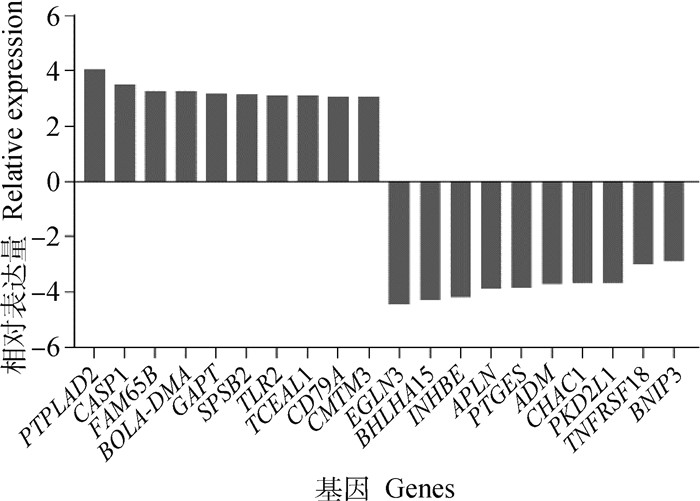
本研究以DMSO处理的TaNM Ⅰ为对照组,以FDR<0.05,Fold change>2为筛选差异表达基因的条件。筛选出表达基因共4 054个,其中,2 146个基因显著上调,1 908个基因显著下调;共同差异表达的基因367个,有196个基因显著上调,171个基因显著下调(图 3),通过对367个差异表达基因进行聚类分析观察本试验的分组是否合理(图 5)。然后从上调和下调的基因中分别筛选出表达量高且差异显著的前10个基因(图 4),其中,TLR2与PIK3-AKT信号通路有关,而EGLN3则与癌症信号通路有关,提示这两个基因可以作为后续研究细胞增殖的方向。
|
图 3 在DMSO和BW720处理组中差异表达基因数 Fig. 3 Numbers of differentially expressed genes in DMSO and BW720 treated cells |
|
图 4 异表达基因统计图 Fig. 4 Statistics of differentially expressed genes |

|
图 5 367个差异表达基因的聚类结果 Fig. 5 The clustering results of 367 differentially expressed genes |
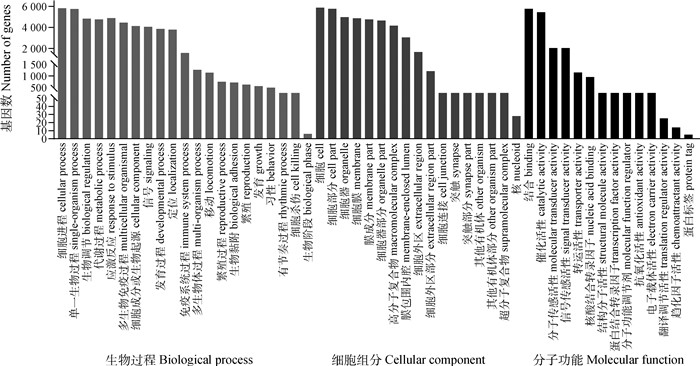
使用g: Profiler在线软件对367个差异共表达基因进行GO功能富集分析,以P value < 0.05为筛选显著富集的条件。GO功能注释到显著富集的差异mRNA共52条生物学功能条目,其中生物过程21条,富集水平最高且显著富集前3的是细胞进程、生物调节、单一组织进程;细胞组分17条,显著富集前3的是细胞、细胞部分、细胞器;分子功能14条,显著富集前3的是结合、催化活性、信号传感活性。如图 6所示。通过筛选到的这些显著富集的GO条目可以发现,DMSO和BW720处理后差异表达的基因在生物代谢、蛋白质合成以及糖代谢方面发挥了重要作用。富集条目大部分都与转录和翻译过程紧密相关,表明细胞在此时期的活动如:细胞增殖、分化以及凋亡等方面的活动非常活跃,此时期可能为细胞周期的重要阶段。
|
图 6 差异表达基因的GO图 Fig. 6 GO diagram of differentially expressed genes |
使用g: Profiler在线软件对367个差异表达基因进行KEGG功能富集分析,以P value < 0.05为筛选显著富集的条件,共筛选到270条信号通路,其中,Top 20的信号通路主要有癌症信号通路、PI3K-Akt信号通路、MAPK信号通路、Ras等信号通路等(图 7)。
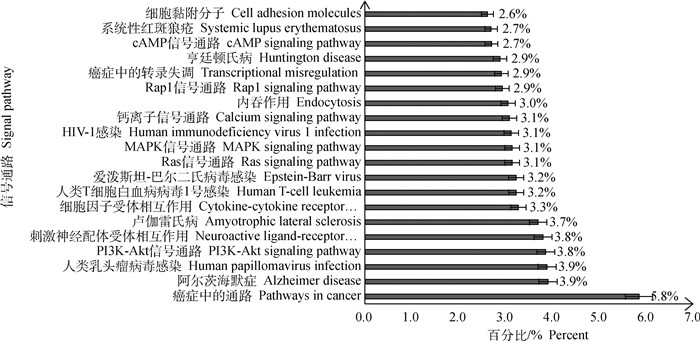
|
图 7 KEGG差异基因显著富集的前20个信号通路 Fig. 7 The top 20 pathways enriched by differentially expressed genes analyzed by KEGG |
利用g: Profiler在线软件对Top20富集最明显的“癌症信号通路”中的差异表达基因及相关信号通路进行深入分析。分析结果表明,在几个主要的信号通路中PI3K-Akt通路富集较多,表明在感染细胞凋亡的过程中这条通路可能是起主要作用的信号通路之一。同时转录组数据和q-PCR验证结果均表明,PI3KR3、NFKBIA等基因在药物处理组中显著下调,说明在细胞凋亡的过程中这两个基因起调节的作用,而且PI3KR3参与了多条信号通路,这提示在后续研究中可以把这两个基因当作重点的研究对象(表 3)。
|
|
表 3 参与癌症的主要信号通路以及主要基因 Table 3 Main signal pathways and main genes involved in cancer |
对随机选取10个差异表达基因进行RT-qPCR验证,结果如图 8所示,10个差异表达基因中6个下调,4个上调,试验结果与转录组测序结果一致,进一步证明了转录组测序数据的可靠性。
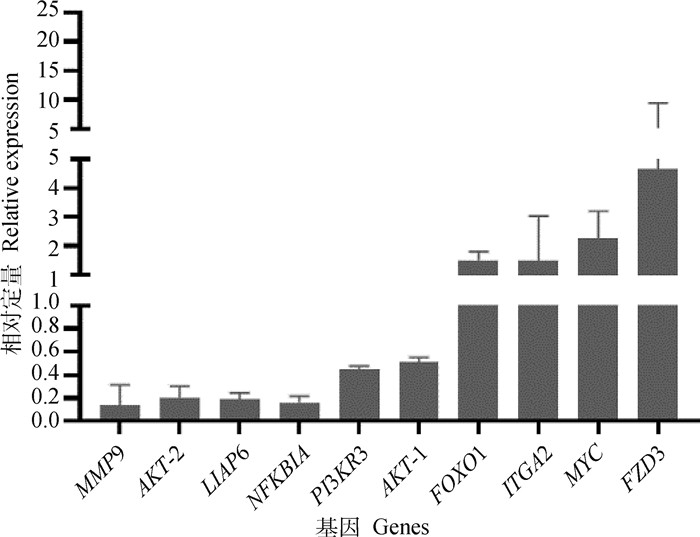
|
图 8 RT-qPCR验证差异表达的基因 Fig. 8 RT-qPCR analysis of differentially expressed genes |
在环形泰勒虫转化细胞无限增殖的过程中,很多信号通路处于激活状态,而且这些信号通路大部分均与细胞的增殖与凋亡有关。虽然针对环形泰勒虫转化的机制进行过大量研究[13-15],但利用转录组手段对TaNM Ⅰ细胞药物处理前后基因及信号通路的研究尚未发现。基于此,本研究通过转录水平对药物处理前后环形泰勒虫转化细胞进行了研究,以期从中发现引起环形泰勒感染细胞无限增殖的基因,为下一步探究感染细胞的凋亡与增殖机制奠定基础。在本研究中,为验证药物BW720对环形泰勒虫的作用效果,使用吉姆萨染料对药物处理前后的感染细胞进行染色。结果表明,当用BW720处理环形泰勒虫感染细胞后,感染细胞以及感染细胞内的虫体数量显著减少,说明BW720对环形泰勒虫是有作用效果的。
通过对药物处理前后环形泰勒虫感染细胞差异基因进行GO和KEGG富集分析,差异表达基因显著富集于生物代谢、蛋白质合成、糖代谢、细胞增殖以及凋亡等生物过程中。说明为了使感染细胞具备无限增殖的能力,环形泰勒虫可能需要借助宿主细胞的多种代谢机制,来维持自身不断增长的物质需求。对KEGG富集结果分析发现,在Top20通路中关于环形泰勒虫研究较多的信号通路:癌症信号通路、PI3K-Akt信号通路、MAPK信号通路、Ras等信号通路被显著富集。对这些信号通路进步分析发现:PI3KR3、FOXO1、IL23A、FZD3、AKT、MMP9等基因在转录组水平表达显著,同时在环形泰勒虫转化细胞的研究中上述基因也有相关文献的报道[16-18]。这为深入研究环形泰勒虫转化宿主细胞过程中的哪条信号通路起作用或者是否是多条信号通路联合的效果提供了一个可思考的方向。因此本研究通过把环形泰勒虫转化细胞后相关信号通路以及信号通路上的有关基因与转录组数据结合起来,从而进行深入的分析,以期为环形泰勒虫转化细胞无限增殖的机制研究奠定理论基础。
PI3K-AKT-mTOR信号通路主要参与细胞的生长、增殖和存活。PI3K通过诱导粒细胞—单核细胞集落刺激因子(GM-CSF)依赖性自分泌环从而促进淋巴细胞增殖,这也是泰勒虫感染白细胞的特征之一[16, 19]。目前的研究表明,PI3K可能成为治疗癌症、慢性炎症、过敏和心血管衰竭的药物靶点[20]。在控制细胞增殖和存活的多条途径中PI3K占据中心地位,研究表明在泰勒虫转化的淋巴细胞中PI3K被持续激活[21-22],从而诱导丝氨酸/苏氨酸激酶AKT(PKB)激活。阻断PI3K-PKB通路可导致细胞增殖停滞,但不会立即诱导细胞凋亡,这表明PI3K-PKB通路在细胞增殖方面起到了主要的作用。PI3K被招募到质膜上,以响应由多种刺激传递的触发信号,包括生长因子、免疫受体和细胞外基质成分。PI3K刺激导致PKB的激活,它除了调节葡萄糖代谢外,还有助于调节细胞周期和防止细胞凋亡[23]。在PI3K家族的众多分子中,大多数证据显示IA类PI3K在人类癌症中有着重要作用,特别是p110α亚型,在前列腺癌、乳腺癌、结直肠癌中均发现了PIK3CA基因突变或上调的存在[24-25]。进一步的临床前数据表明,显著存在IA类PI3K的功能冗余,并且仅需要小部分I类PI3K活性就可以保持细胞的存活和增殖。同时,有研究表明,PI3KR3在维持肉瘤生长、迁移、侵袭方面起重要作用[26],另外,PI3KR3在结直肠癌中表达上调并促进癌细胞增殖[27]。在本研究筛选出的基因PI3KR3,作为PI3K-AKT-mTOR信号通路的关键基因,在药物处理后出现下调趋势,这与既往的研究相一致,上述的研究表明,PI3KR3可能是治疗癌症的一个重要的潜在靶点。
作为最古老、进化上最保守的信号通路之一,丝裂原活化蛋白激酶(MAPK)在免疫应答的许多过程中也起着重要作用。哺乳动物细胞中主要有3类MAPK:细胞外信号调节蛋白激酶(ERK)、p38 MAP激酶和C-Jun NH2末端激酶(JNK)[28]。当泰勒虫感染牛淋巴细胞时,在这3个主要激酶中,只有Jun-NH2的末端激酶(JNK)被激活[17]。已经证明JNK通过在泰勒虫转化的细胞中诱导转录因子:激活蛋白-1(AP-1)和ATF-2的结构性激活,间接引起泰勒虫感染细胞不受控制的增殖[29]。JNK失活(用JNK特异性抑制剂处理)导致淋巴细胞凋亡,提示JNK激活在泰勒虫诱导的淋巴细胞转化中具有抗凋亡作用。另外,ERK的激活与细胞增殖也有关,而p38和JNK以及其细胞底物C-Jun在细胞凋亡,尤其是Fas介导的细胞凋亡中起着积极的作用[30]。本研究中激活转录因子4(ATF4)在MAPK信号通路中表达显著,ATF4控制着与氨基酸运输、新陈代谢、氧化应激保护和蛋白质稳态有关的基因[31]。然而,ATF4也可以诱导细胞凋亡、细胞周期停滞和衰老[32]。尽管肿瘤细胞对凋亡敏感,但肿瘤细胞经常利用ATF4来减轻由于增殖过快而产生的压力。大量的细胞内代谢需要ATF4的激活来调节[33],此外,ATF4及其靶基因与血管的生成和转移也存在关系[34]。通过ATF4基因可以发现,TaNM Ⅰ与肿瘤细胞之间存在着很多微妙的联系,在一些肿瘤上的研究理论、现象、结论,同样适用于TaNM Ⅰ细胞。在后续的研究中可以重点把两者通过一些共同的基因联系起来,从而达到互补验证的效果。
NF-κB在细胞分化和增殖调控中起着核心作用,但它也参与了细胞凋亡的过程,也是炎症和免疫反应的中心调节器[35]。NF-κB对肿瘤坏死因子或化疗药物诱导的细胞凋亡具有保护作用,这涉及到诱导细胞生存所需的基因。另一方面,也有人提出NF-κB的激活是细胞凋亡所必需的,这似乎也是泰勒虫转化的淋巴细胞生存所必需的。目前研究表明,NF-κB通过将多亚单位IKB激酶(IKK)募集到寄生虫表面的活化灶中从而实现激活,活化后的NF-κB通过阻断Caspase-8的激活从而抑制细胞凋亡。
研究表明,PI3K-Akt信号通路、MAPK信号通路、NF-κB信号通路均与肿瘤细胞无限增殖有关。而且在环形泰勒虫感染宿主细胞导致其无限增殖的过程中,这几个信号通路也被活化。本研究中,这几个信号通路均被显著富集,说明它们可能共同调控了环形泰勒虫感染宿主细胞导致其无限增殖,从而引起了细胞的转化特性。
4 结论从转录组数据分析得知,环形泰勒虫感染宿主后,可能导致宿主细胞的一些靶基因发生改变从而使相应的信号通路激活,间接影响宿主细胞的增殖和凋亡。在本研究中,利用转录组技术对环形泰勒虫感染宿主细胞相关基因及信号通路进行了分析,最终筛选出PI3KR3、ATF4、IKK、PIK3CA、AKT等在感染细胞无限增殖过程中可能起重要作用的一些基因。为了验证上述基因是否参与癌症的发生及发展,又对Top20富集最明显的“癌症信号通路”中与癌症相关的基因做进一步分析,筛选出了SGK1、PLK2、RBL2、CREB3L4、NFKBIA、PI3KR3等基因。通过筛选发现无论在感染细胞还是在癌症中,PI3KR3基因都存在,而且通过参与不同的信号通路(如:PI3K-Akt、FOXO、cAMP)进而调控细胞周期的活动。这些结论为深入研究TaNM Ⅰ细胞无限增殖机制奠定了理论基础,也为TaNM Ⅰ和肿瘤细胞建立了新的联系,从而提供了新的研究思路和方向。
| [1] |
ORYAN A, NAMAZI F, SHARIFIYAZDI H, et al. Clinicopathological findings of a natural outbreak of Theileria annulata in cattle: an emerging disease in southern Iran[J]. Parasitol Res, 2013, 112(1): 123-127. DOI:10.1007/s00436-012-3114-4 |
| [2] |
NARLADKAR B W. Projected economic losses due to vector and vector-borne parasitic diseases in livestock of India and its significance in implementing the concept of integrated practices for vector management[J]. Vet World, 2018, 11(2): 151-160. DOI:10.14202/vetworld.2018.151-160 |
| [3] |
RIZK M A, EL-SAYED S A E S, NASSIF M, et al. Assay methods for in vitro and in vivo anti-Babesia drug efficacy testing: current progress, outlook, and challenges[J]. Vet Parasitol, 2020, 279: 109013. DOI:10.1016/j.vetpar.2019.109013 |
| [4] |
李友英, 蓝岚, 潘瑶, 等. 四川省理塘县牦牛感染泰勒虫的分子流行病学调查及虫种鉴定[J]. 畜牧与兽医, 2021, 53(6): 61-66. LI Y Y, LAN L, PAN Y, et al. Molecular epidemiological investigation and species identification of Theileria infection in yaks in Litang county of Sichuan province[J]. Animal Husbandry & Veterinary Medicine, 2021, 53(6): 61-66. (in Chinese) |
| [5] |
何晓东. 托克逊县部分地区牛环形泰勒虫病的流行病学调查[D]. 乌鲁木齐: 新疆农业大学, 2015. HE X D. Epidemiological investigation Theileria annulata for cattle in parts of Toksun country[D]. Urumqi: Xinjiang Agricultural University, 2015. (in Chinese) |
| [6] |
CHAUSSEPIED M, LANGSLEY G. Theileria transformation of bovine leukocytes: a parasite model for the study of lymphoproliferation[J]. Res Immunol, 1996, 147(3): 127-138. DOI:10.1016/0923-2494(96)83165-8 |
| [7] |
DOBBELAERE D A E, FERNANDEZ P C, HEUSSLER V T. Theileria parva: taking control of host cell proliferation and survival mechanisms: Microreview[J]. Cell Microbiol, 2000, 2(2): 91-99. DOI:10.1046/j.1462-5822.2000.00045.x |
| [8] |
LI Z, LIU J L, ZHAO S Y, et al. Theileria annulata subtelomere-encoded variable secreted protein-TA05575 binds to bovine RBMX2[J]. Front Cell Infect Microbiol, 2021, 11: 644983. DOI:10.3389/fcimb.2021.644983 |
| [9] |
DOBBELAERE D, HEUSSLER V. Transformation of leukocytes by Theileria parva and T. annulata[J]. Annu Rev Microbiol, 1999, 53: 1-42. DOI:10.1146/annurev.micro.53.1.1 |
| [10] |
KINNAIRD J H, WEIR W, DURRANI Z, et al. A bovine lymphosarcoma cell line infected with Theileria annulata exhibits an irreversible reconfiguration of host cell gene expression[J]. PLoS One, 2013, 8(6): e66833. DOI:10.1371/journal.pone.0066833 |
| [11] |
HALLER D, MACKIEWICZ M, GERBER S, et al. Cytoplasmic sequestration of p53 promotes survival in leukocytes transformed by Theileria[J]. Oncogene, 2010, 29(21): 3079-3086. DOI:10.1038/onc.2010.61 |
| [12] |
WOODS K, PERRY C, BRVHLMANN F, et al. Theileria's strategies and effector mechanisms for host cell transformation: from invasion to immortalization[J]. Front Cell Dev Biol, 2021, 9: 662805. DOI:10.3389/fcell.2021.662805 |
| [13] |
LIZUNDIA R, CHAUSSEPIED M, HUERRE M, et al. c-Jun NH2-terminal kinase/c-Jun signaling promotes survival and metastasis of B lymphocytes transformed by Theileria[J]. Cancer Res, 2006, 66(12): 6105-6110. DOI:10.1158/0008-5472.CAN-05-3861 |
| [14] |
ARAVETI P B, SRIVASTAVA A. Curcumin induced oxidative stress causes autophagy and apoptosis in bovine leucocytes transformed by Theileria annulata[J]. Cell Death Discov, 2019, 5(1): 100. DOI:10.1038/s41420-019-0180-8 |
| [15] |
HUBER S, KARAGENC T, RITLER D, et al. Identification and characterisation of a Theileria annulata proline-rich microtubule and SH3 domain-interacting protein (TaMISHIP) that forms a complex with CLASP1, EB1, and CD2AP at the schizont surface[J]. Cell Microbiol, 2018, 20(7): e12838. DOI:10.1111/cmi.12838 |
| [16] |
BAUMGARTNER M, CHAUSSEPIED M, MOREAU M F, et al. Constitutive PI3-K activity is essential for proliferation, but not survival, of Theileria parva-transformed B cells[J]. Cell Microbiol, 2000, 2(4): 329-339. DOI:10.1046/j.1462-5822.2000.00062.x |
| [17] |
CHAUSSEPIED M, LALLEMAND D, MOREAU M F, et al. Upregulation of Jun and Fos family members and permanent JNK activity lead to constitutive AP-1 activation in Theileria-transformed leukocytes[J]. Mol Biochem Parasitol, 1998, 94(2): 215-226. DOI:10.1016/S0166-6851(98)00070-X |
| [18] |
ECHEBLI N, MHADHBI M, CHAUSSEPIED M, et al. Engineering attenuated virulence of a Theileria annulata-infected macrophage[J]. PLoS Negl Trop Dis, 2014, 8(11): e3183. DOI:10.1371/journal.pntd.0003183 |
| [19] |
HAIDAR M, WHITWORTH J, NOÉ G, et al. TGF-β2 induces Grb2 to recruit PI3-K to TGF-RII that activates JNK/AP-1-signaling and augments invasiveness of Theileria-transformed macrophages[J]. Sci Rep, 2015, 5(1): 15688. DOI:10.1038/srep15688 |
| [20] |
YU L, WEI J, LIU P D. Attacking the PI3K/Akt/mTOR signaling pathway for targeted therapeutic treatment in human cancer[J]. Semin Cancer Biol, 2021, 25: S1044-579X(21)00188-7. |
| [21] |
DOBBELAERE D, FERNANDEZ P, MACHADO J, et al. Interference by the intracellular parasite Theileria parva with T-cell signal transduction pathways induces transformation and protection against apoptosis[J]. Vet Immunol Immunopathol, 1999, 72(1-2): 95-100. DOI:10.1016/S0165-2427(99)00121-X |
| [22] |
HEUSSLER V T, KVENZI P, FRAGA F, et al. The Akt/PKB pathway is constitutively activated in Theileria-transformed leucocytes, but does not directly control constitutive NF-κB activation[J]. Cell Microbiol, 2001, 3(8): 537-550. DOI:10.1046/j.1462-5822.2001.00134.x |
| [23] |
MAIDARTI M, ANDERSON R A, TELFER E E. Crosstalk between PTEN/PI3K/Akt signalling and DNA damage in the oocyte: implications for primordial follicle activation, oocyte quality and ageing[J]. Cells, 2020, 9(1): 200. DOI:10.3390/cells9010200 |
| [24] |
MARTÍNEZ-SÁEZ O, CHIC N, PASCUAL T, et al. Frequency and spectrum of PIK3CA somatic mutations in breast cancer[J]. Breast Cancer Res, 2020, 22(1): 45. DOI:10.1186/s13058-020-01284-9 |
| [25] |
CAI Y, YOUSEF A, GRANDIS J R, et al. NSAID therapy for PIK3CA-altered colorectal, breast, and head and neck cancer[J]. Adv Biol Regul, 2020, 75: 100653. DOI:10.1016/j.jbior.2019.100653 |
| [26] |
YOON C, LU J, RYEOM S W, et al. PIK3R3, part of the regulatory domain of PI3K, is upregulated in sarcoma stem-like cells and promotes invasion, migration, and chemotherapy resistance[J]. Cell Death Dis, 2021, 12(8): 749. DOI:10.1038/s41419-021-04036-5 |
| [27] |
WANG G H, YANG X, LI C, et al. PIK3R3 induces epithelial-to-mesenchymal transition and promotes metastasis in colorectal cancer[J]. Mol Cancer Ther, 2014, 13(7): 1837-1847. DOI:10.1158/1535-7163.MCT-14-0049 |
| [28] |
LIANG Y J, YANG W X. Kinesins in MAPK cascade: How kinesin motors are involved in the MAPK pathway?[J]. Gene, 2019, 684: 1-9. DOI:10.1016/j.gene.2018.10.042 |
| [29] |
DE LATÉ P L, HAIDAR M, ANSARI H, et al. Theileria highjacks JNK2 into a complex with the macroschizont GPI (Glycosyl Phosphatidyl Inositol)-anchored surface protein p104[J]. Cell Microbiol, 2019, 21(3): e12973. DOI:10.1111/cmi.12973 |
| [30] |
DUNN C, WILTSHIRE C, MACLAREN A, et al. Molecular mechanism and biological functions of c-Jun N-terminal kinase signalling via the c-Jun transcription factor[J]. Cell Signal, 2002, 14(7): 585-593. DOI:10.1016/S0898-6568(01)00275-3 |
| [31] |
HAN S T, ZHU L Y, ZHU Y R, et al. Targeting ATF4-dependent pro-survival autophagy to synergize glutaminolysis inhibition[J]. Theranostics, 2021, 11(17): 8464-8479. DOI:10.7150/thno.60028 |
| [32] |
ISHIZAWA J, KOJIMA K, CHACHAD D, et al. ATF4 induction through an atypical integrated stress response to ONC201 triggers p53-independent apoptosis in hematological malignancies[J]. Sci Signal, 2016, 9(415): ra17. |
| [33] |
BAGHERI-YARMAND R, WILLIAMS M D, GRUBBS E G, et al. ATF4 targets RET for degradation and is a candidate tumor suppressor gene in medullary thyroid cancer[J]. J Clin Endocrinol Metab, 2017, 102(3): 933-941. |
| [34] |
REN P, YUE M, XIAO D B, et al. ATF4 and N-Myc coordinate glutamine metabolism in MYCN-amplified neuroblastoma cells through ASCT2 activation[J]. J Pathol, 2015, 235(1): 90-100. DOI:10.1002/path.4429 |
| [35] |
DOBBELAERE D A E, ROTTENBERG S. Theileria-induced leukocyte transformation[J]. Curr Opin Microbiol, 2003, 6(4): 377-382. DOI:10.1016/S1369-5274(03)00085-7 |
(编辑 白永平)



