2. 华南农业大学兽医学院,广州 510642;
3. 广州市华南农大生物药品有限公司,广州 511300
2. College of Veterinary Medicine, South China Agricultural University, Guangzhou 510642, China;
3. Guangzhou South China Biological Medicine, Co., Ltd., Guangzhou 511300, China
CpG序列是一条含有未甲基化的胞嘧啶-鸟嘌呤二核苷酸的微生物单链DNA片段, 能够通过Toll样受体9(TLR 9)的识别刺激先天性免疫反应[1]。CpG ODN是人工合成的CpG序列(synthetic oligodeoxynucleotide containing CpG motifs,简称CpG ODN),目前,在临床和疫苗应用中作为免疫增强剂[2-3]。前期,作者实验室在鸡、鱼和猪上对CpG ODN和CpG质粒进行了大量研究, 有如下发现:CpG ODN能提升鸡特异性免疫[4];CpG ODN常温和低温下均能保护鱼类免受细菌感染[5];CpG质粒也与ODN有同样提升动物体抗感染的先天性和适应性免疫[6]。近来,三叶草生物公司研发的CpG联合铝佐剂的新冠疫苗的Ⅰ期临床试验报告显示,该疫苗可引发针对SARS-CoV-2的强大体液和细胞免疫反应[7]。以上研究证实了CpG制剂能激发机体产生显著的免疫反应,而长期广泛的应用印证了CpG ODN具有极高的安全性。然而,CpG ODN作为禽用疫苗佐剂的生产成本高昂,即使采用更为廉价CpG质粒,大规模生产中依旧无法负担,这严重阻碍了CpG制剂在畜牧养殖中的推广应用。有研究表明,CpG制剂联合其他免疫刺激物可以提升其作用效果[8],因而,在本研究中,作者希望寻求生产成本低的生物制剂与CpG制剂协同,在实现良好的免疫刺激效应的同时,减少CpG制剂的使用量,最终使成本可控。
赤红球菌(Rhodococcus ruber)是一类专性好氧革兰阳性菌,能被负责识别细菌的TLR2来刺激机体免疫[8]。早在1984年,珊瑚红球菌(Phodococcus corrallina, RC)的细胞壁成分就被报道在动物体内具有抗肿瘤的免疫特性[9]。此外,还有研究显示,赤红球菌提取物能够抵抗细菌和抗病毒感染,从而达到提高机体免疫的作用[10]。同时,相较于通过细菌单一成分给药引发的应答,通过完整菌体细胞的给药具有增强Th1(T helper)应答而不改变Th2引起的细胞免疫应答的优点,其调节作用还可以长期持续[11]。而且,经动物试验证实,赤红球菌作为免疫佐剂使用具有非特异性地增强体液免疫和细胞免疫应答,提高抗体峰值水平,延长抗体维持期,增强动物疫苗的免疫效果[12-13]。除了以上有关赤红球菌良好的免疫刺激功效的报道之外,作者还考虑到赤红球菌的生长速度快、易培养,产业化成本低,在生产上具有极大的优势。另外,研究指出,TLR2和TLR9能协同刺激免疫反应[14-16],同时,哺乳动物TLR9/禽类动物TLR21存在着同源关系和功能相似性[17-18],推断赤红球菌可以作为CpG制剂的联合制剂使用来提升禽类疫苗的功效。
禽流感是由禽流感病毒(avian influenza virus,AIV)引起的一种急性、高度接触性的人兽共患传染病[19],如果在养殖早期不能对其进行有效控制,将会在禽群中迅速传播和繁殖,造成经济巨大损失和危害公共卫生安全。禽流感疫苗对于我国禽流感的防控起着至关重要的作用。目前,在疫苗中常使用的佐剂有铝佐剂、油乳佐剂、脂质体佐剂、微生物类佐剂等,它们各有利弊,主要存在着免疫类型单一、抗体的产生时间长和持续时间短、品种间和佐剂间效果不确切等问题[20]。近年来,免疫调节分子类佐剂(CpG ODN),因其具有的免疫调节作用以及显著的安全性[21],日益受到人们的重视。随着社会发展,禽类养殖场不断规模化和产业化,成本低、免疫效力高、持久性良好是禽流感疫苗佐剂的发展趋势。因此,在本研究中首次将CpG ODN和赤红球菌联合使用作为禽流感疫苗的佐剂,希望在进一步强化禽流感疫苗的免疫应答效果的基础上,既提高疫苗免疫持久性、安全性,又降低CpG ODN的使用成本。本研究检测了赤红球菌联合CpG ODN复合佐剂对于提升禽流感疫苗的抗原特异性体液免疫和细胞免疫水平的能力,并通过检测细胞表面受体的表达情况来探索其提升免疫功效的机制。此外,还研究了该复合佐剂对于系统和局部免疫的效果。本研究确认赤红球菌的共刺激能在降低CpG ODN用量的同时,进一步强化CpG ODN的免疫增强功效。本研究为CpG制剂作为禽类疫苗佐剂提供高效且成本可控的应用策略奠定了研究基础。
1 材料与方法 1.1 试验材料1.1.1 试验鸡 1日龄普通黄羽肉鸡,购自广州华农正大禽业有限公司,于广州市华南农业大学实验动物中心养至10日龄,使试验鸡适应该养殖环境。
1.1.2 试验抗原 H5N2亚型重组禽流感病毒rSD57株抗原由广州市华南农大生物药品有限公司制备及提供,血凝效价大于28。
1.1.3 试验佐剂 CpG ODN,实验室保存[22];赤红球菌(Rhodococcus ruber),菌株由华南农业大学兽医学院廖明教授提供,并按相关专利的方式制备[23]。
1.2 疫苗制备与分组情况1.2.1 试验一 取10日龄普通黄羽肉鸡100只,随机分成5组,每组20只,分别经颈部皮下注射以下免疫佐剂—疫苗组合,0.33 mL·只-1。每组处理3次重复,所有试验鸡只免疫1次。
|
|
表 1 免疫佐剂—疫苗分组情况 Table 1 Different adjuvants combined with vaccine |
在接种后第7、14、21、28、35日,分别从鸡群中随机抽取5只进行颈部采血检测抗体滴度;接种后第0、7、14、21日,每组随机选3只鸡,宰杀取脾和支气管。第0、7、14、21日所取的各组部分脾样品用于细胞增殖试验测淋巴细胞刺激指数(SI)和检测特异性免疫产生的细胞因子IFN-γ和IL-4的相对表达量;第0、7日所取的另一部分脾样品快速冷冻于液氮中,在-80 ℃保存至分离RNA,检测IL-12、IFN-γ、TLR2和TLR21的相对表达量。第0、7日所取的支气管样品也快速冷冻于液氮后在-80 ℃保存至分离RNA,检测IL-12和IFN-γ的相对表达量。每组处理3次重复。
1.2.2 试验二 取10日龄普通黄羽肉鸡20只,随机分成4组,每组5只,分别经颈部皮下注射相应的疫苗,0.33 mL·只-1。每组处理3次重复,所有试验鸡只免疫1次。4组所注射的免疫佐剂—疫苗组合分别是PBS组、对照组、CpG+赤红球菌疫苗组和0.5CpG+赤红球菌疫苗组。前三组的制备方法与试验一中的相同;50%CpG+赤红球菌疫苗组疫苗制备方法:取3 mL rSD57抗原、0.75 mL无菌水和0.75 mLCpG ODN(60 μg·mL-1),再与10.5 mL矿物油ISA71混合,赤红球菌按0.5 mg·mL-1水相进行添加(约2.25 mg),用高剪切乳化机乳化10 min。在疫苗接种后第14、35天,各组分别采血测抗体滴度(HI)。
1.3 试验方法1.3.1 抗体滴度 进行HI试验。
试验一,各组接种后第7、14、21、28、35天,分别采血分离血清。制备1%鸡红细胞悬液,用H5N2亚型重组禽流感病毒rSD57株血凝抑制抗原制备4单位抗原(HAU);在96孔板的1~11孔中加入25 μL PBS,第12孔中加入50 μL PBS;吸取25 μL血清加入第1孔内,充分混匀后吸25 μL于第2孔,依次倍比稀释至第10孔,从第10孔吸取25 μL弃去;1~11孔均加入含4HAU混匀的病毒抗原液25 μL,静置30 min;每孔加入25 μL 1 %鸡红细胞悬液,混匀并封板,静置30 min(可适当延长),直至对照组(第11孔)红细胞呈明显的纽扣状沉于孔底,每组至少设3个重复。结果以完全抑制红细胞凝集的血清最大稀释度为该血清的HI滴度,用2的指数表示[24]。每组处理3次重复。
试验二,各组接种后第14、35天,分别采血分离血清。按上述方法检测抗体滴度。每组处理3次重复。
1.3.2 细胞增殖和特异性IFN-γ和IL-4诱生试验 取试验一疫苗接种后第0、7、14、21天各组的脾脏样品,制备单细胞悬液,利用淋巴细胞分离液(翌圣,广州)分离脾淋巴细胞,用不含酚红指示剂,含10%胎牛血清(Gbico,美国)、0.15%碳酸氢钠和1%抗生素的RPMI-1640培养基(Gbico,美国)调节细胞悬液达2.5 × 106个细胞·mL-1,细胞悬液以100 μL·孔-1加入96孔细胞培养板中,加入PBS作为阴性对照。抗原以终浓度10 μg·mL-1加入,每组重复3次,在37 ℃、5%CO2孵育24 h。其中,一半的细胞进行细胞增殖试验,另一半细胞保留作为后续试验的材料。每孔加入20 μL MTT(5 mg·mL-1,华奇盛,广州),在37 ℃、5%CO2二次孵育6 h。离心机离心除去未反应的MTT, 然后每孔加入100 μL二甲亚砜(DMSO),置摇床上低速振荡5 min,使结晶物充分溶解。使用酶联免疫检测仪OD570 nm读取吸光值。淋巴细胞增殖以刺激指数(SI)表示,SI定义:试验孔的平均OD值/阴性对照孔的平均OD值[22]。每组处理3次重复。
1.3.3 荧光定量PCR 把按上述细胞增殖试验操作培养好的细胞悬液(未加MTT和DMSO)和-80 ℃冷冻保存的脾和支气管样品提取RNA,然后经反转录为cDNA,按试剂盒说明书操作(RNA提取试剂盒,翌圣,广州;cDNA反转录试剂盒,碧云天,上海);利用Primer Premier 5.0软件,根据GenBank数据库, 使用β-actin对每个靶基因(引物见表 2)的值进行归一化处理。使用2-ΔΔCt方法计算表达值[25]。
|
|
表 2 本研究中荧光定量PCR中使用到的引物序列 Table 2 The primer sequences used in quantitative real-time PCR in this study |
所有试验至少设3个重复组,结果表示为“x±sx”。所有的数据和图表均使用GraphPad Prism 9软件进行数据统计分析和绘制。通过单向或双向方差分析(ANOVA)和t检验确定试验组与对照组、试验组之间的差异。当P<0.05时,差异被认为具有统计学显著性;当P<0.01时,差异被认为具有高度显著性。
2 结果 2.1 赤红球菌联合CpG ODN复合佐剂提升系统免疫应答2.1.1 赤红球菌联合CpG ODN提升抗原特异性体液免疫应答 为了直观地了解不同免疫佐剂——疫苗组合的免疫效力,试验一注射疫苗后第7、14、21、28、35天,对各组分别采血进行HI试验。试验结果显示(图 1),与对照组相比,自第14天起,各佐剂的抗体滴度都有明显的上升趋势,而赤红球菌+CpG佐剂疫苗组的效果最显著;在第35天,与对照组和CpG佐剂疫苗组相比,赤红球菌+CpG佐剂疫苗组的抗体滴度都有高度显著性差异(P<0.01)。这些数据都表明,赤红球菌联合CpG ODN介导了更强的特异性体液免疫应答且抗体持续时间长。

|
组间差异,*.P<0.05,**.P<0.01 *. P < 0.05, **. P < 0.01, vs other groups 图 1 赤红球菌联合CpG ODN提升疫苗诱导的抗体滴度水平 Fig. 1 Rhodococcus combined with CpG ODN enhances vaccine-induced antibody titers |
2.1.2 赤红球菌联合CpG ODN提升抗原特异性细胞免疫应答 研究指出,禽流感疫苗单独使用产生的特异性细胞免疫水平不高,需要辅助递送物质或佐剂来诱生良好的细胞免疫,进而提升疫苗免疫效果[29]。因而,既能够诱导体液免疫又能够诱导细胞免疫的疫苗是研究人员的普遍追求。于是,作者对接种后不同时间分离出的脾淋巴细胞进行了细胞增殖试验检测SI值(图 2A),并给予二次的抗原刺激,检测其特异性细胞免疫产生的IFN-γ(图 2B)和IL-4(图 2C)的相对表达量。与对照组相比,CpG+赤红球菌佐剂疫苗组中IFN-γ在第14、21天极显著上调(P<0.01), Th2相关细胞因子IL-4略有下降但无显著统计学意义(P>0.05)。SI指数的比较中,在第7、21天,CpG佐剂疫苗组和赤红球菌+CpG佐剂疫苗组的SI值均高于对照组,且赤红球菌+CpG佐剂疫苗组的SI峰值更高,与对照组差异更显著;尽管第14天赤红球菌+CpG佐剂疫苗组的SI指数较CpG佐剂疫苗组低,但就赤红球菌+CpG佐剂疫苗组的整体表现,并综合IFN-γ上调结果来看,赤红球菌联合CpG ODN发挥了更良好的细胞免疫刺激效果。疫苗抗原的免疫应答可分为Th1型和Th2型,IFN-γ/IL-4比值(图 2D)反映Th1型免疫的相对强度,数值升高,Th1型免疫增强。该比值结果显示,赤红球菌+CpG佐剂疫苗组在第14、21日时,IFN-γ/IL-4比值较对照组更高, 表明联合使用赤红球菌和CpG ODN作为疫苗佐剂可诱导更强的Th1细胞免疫反应,从而提高疫苗整体的免疫调节功能。
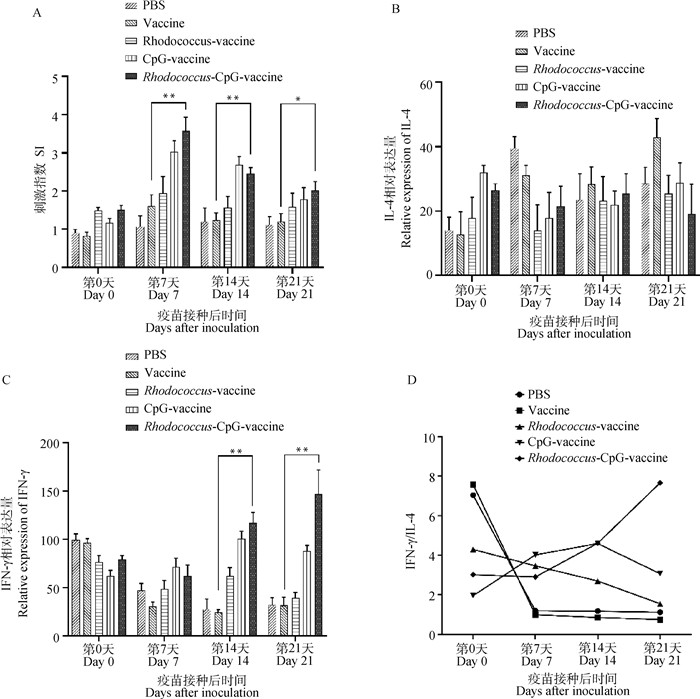
|
A.脾细胞的刺激指数(SI);B. IL-4的相对表达量; C. IFN-γ的相对表达量;D. IFN-γ/IL-4的比值。组间差异,*.P<0.05,**.P<0.01 A. Stimulation index (SI); B. The relative expression of IL-4; C. The relative expression of IFN-γ; D. The ratio of IFN-γ/IL-4. *. P < 0.05, **. P < 0.01, vs other groups 图 2 赤红球菌联合CpG ODN刺激脾细胞增殖和Th1型免疫反应 Fig. 2 Rhodococcus combined with CpG ODN stimulates proliferation of spleen cells and Th1-type immune response |
2.2.1 赤红球菌与CpG ODN协同上调TLR2和TLR 21的表达量 Toll样受体(Toll-like receptor,TLR)作为一种信号转导型抗原识别受体,既可以参与固有免疫,又可以连通适应性免疫和固有免疫之间的关系,而且还参与抗病毒免疫反应[30]。TLR2是动物体内识别细菌的关键受体,TLR21是鸡体内识别CpG ODN的受体,作者通过检测疫苗接种后各组这两种受体的表达量来探索赤红球菌和CpG ODN协同的关系。结果显示(图 3),在第7天赤红球菌疫苗佐剂组较对照组会上调TLR2表达量且差异极显著(P<0.01),而TLR21表达量无显著差异(P>0.05);CpG疫苗佐剂组较对照组会极显著上调TLR21表达量(P<0.01),而对TLR2表达量无显著影响(P>0.05);CpG+赤红球菌佐剂疫苗组与对照组相比,TLR2和TLR21表达量均有明显上调,差异极显著(P<0.01)。由此推断,此前得到的良好的结果,可能是由于这两种免疫刺激物分别通过TLR2和TLR21的识别,同时来增强免疫应答的。但可以肯定的是,CpG ODN与赤红球菌之间存在潜在的协同关系,具体机制有待进一步阐明。
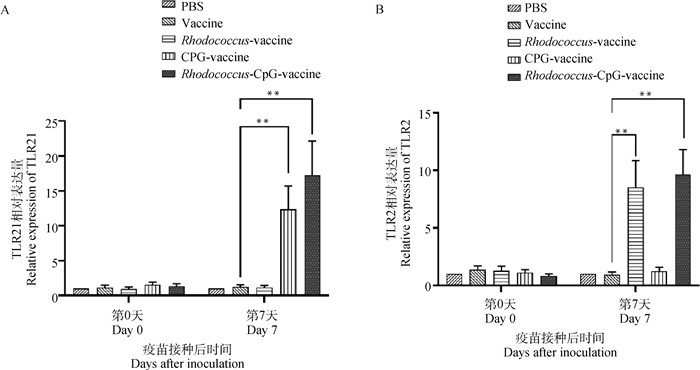
|
A. TLR21的相对表达量;B.TLR2的相对表达量。组间差异,*.P<0.05,**.P<0.01 A. The relative expressions of TLR21; B. The relative expressions of TLR2. *. P < 0.05, **. P < 0.01, vs other groups 图 3 赤红球菌联合CpG ODN通过提高TLR2和TLR21的表达形成协同 Fig. 3 Rhodococcus combined with CpG ODN forms synergy by increasing the expression of TLR2 and TLR21 |
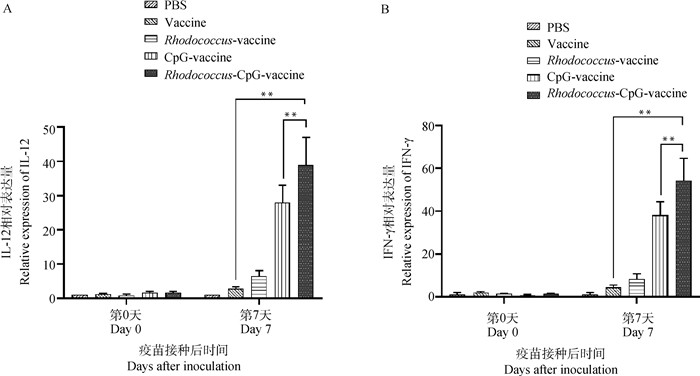
2.2.2 赤红球菌联合CpG ODN强化局部免疫 动物体的黏膜是接触到病原体的第一道防线,提升疫苗的局部免疫反应能力是一个重要的优化免疫策略[31]。支气管是动物体的重要黏膜之一,是面对禽流感病毒的“前沿”部位[32],作者选择鸡的支气管检测其Th1型相关细胞因子的相对表达量,检验该复合佐剂的局部免疫刺激效果。如图 4结果显示,CpG+赤红球菌疫苗组的IL-12和IFN-γ的相对表达量有高度显著差异(P<0.01 vs. vaccine control),也优于单独的CpG ODN佐剂组。这些结果表明,赤红球菌联合CpG ODN能够强化动物体局部产生的Th1型免疫反应,在“第一道防线”就发挥抗病毒功能。
|
A.IL-12的相对表达量;B.IFN-γ的相对表达量。组间差异,*.P<0.05,**.P<0.01 A. The relative expressions of IFN-γ; B. The relative expressions of IL-12. *. P < 0.05, **. P < 0.01, vs other groups 图 4 赤红球菌联合CpG ODN复合佐剂刺激局部免疫反应 Fig. 4 Rhodococcus combined with CpG ODN compound adjuvant stimulates local immune response |
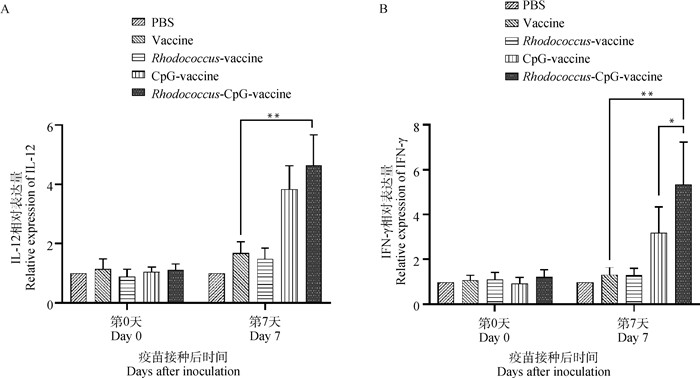
2.2.3 赤红球菌联合CpG ODN强化系统免疫 研究指出,局部免疫反应的发生依赖于系统免疫的协助和维持[33],脾中免疫细胞接受抗原刺激之后可以参与到局部免疫的抗外源物质的反应之中[34]。因此,检测了第0、7天所取脾中细胞的IFN-γ和IL-12的相对表达水平,来检验赤红球菌联合CpG ODN联合佐剂刺激系统免疫的效果。从试验结果来看(图 5),赤红球菌+CpG佐剂疫苗组的IFN-γ和IL-12表达量在第7天大幅上调,与对照组和CpG疫苗相比差异极显著(P<0.01),表明了该复合佐剂能诱导系统免疫,并产生与局部相同的Th1型免疫反应,更有利于病毒清除。
|
A.IL-12的相对表达量;B. IFN-γ的相对表达量。组间差异,*.P<0.05,**.P<0.01 A. The relative expressions of IL-12; B. The relative expressions of IFN-γ. *. P < 0.05, **. P < 0.01, vs other groups 图 5 赤红球菌联合CpG ODN复合佐剂刺激全身免疫反应 Fig. 5 Rhodococcus combined with CpG ODN compound adjuvant stimulates systematic immune response |
CpG ODN的安全性是公认的,但是作为动物疫苗来说价格高、成本贵,而赤红球菌价格低廉、易于培养,同时,从上面的数据结果可以得知,赤红球菌和CpG ODN之间存在协同机制,能够提高疫苗的免疫效力和免疫持久性。作者想知道能否通过赤红球菌来弥补降低CpG ODN用量带来的免疫效果损失,在保证免疫效果的同时又降低成本。因此,在试验二中设计了50%剂量的CpG+赤红球菌佐剂疫苗试验组,通过检测各组在第14、35天的抗体滴度来检验疫苗的免疫效果。结果显示(图 6),全剂量和半剂量的CpG ODN分别与等量的赤红球菌联合作为疫苗佐剂,在第14、35天的抗体滴度并无显著差异(P>0.05),证实了此前的猜想。
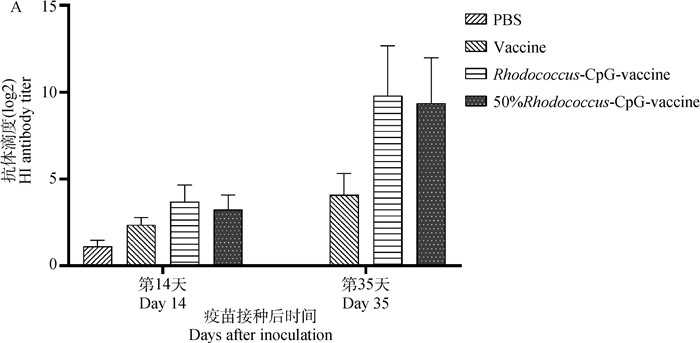
|
图 6 赤红球菌联合低剂量CpG ODN仍具有良好的免疫效应 Fig. 6 Rhodococcus combined with low-dose CpG ODN still has good immune effect |
当前,常用的禽流感疫苗存在着免疫效率低、免疫保护维持时间短、细胞免疫水平低等问题[35],而疫苗佐剂被认为是提高疫苗免疫效率并丰富免疫类型的解决策略[36]。免疫佐剂的类型多样、制价不尽相同,其中具备卓越安全性的免疫调节分子类佐剂(CpG ODN)备受关注。降低CpG ODN作为疫苗佐剂的制备和使用成本,是使之在养殖业中推广应用的关键。
CpG ODN在禽类动物中经由TLR21的识别,可以诱发动物体产生体液免疫和细胞免疫反应[2-3, 37]。它被广泛应用于畜牧疫苗佐剂,而且用于人类疫苗的制剂也已经问世。此外,在作者此前的研究发现了CpG ODN作为疫苗佐剂具有刺激特异性免疫的功效。大量的动物试验研究表明,相较于疫苗单独使用,添加佐剂能诱导更强的特异性细胞免疫反应,提升疫苗的免疫效力[29]。同样的,在本研究中,通过HI试验、细胞增殖试验和检测IFN-γ和IL-4的相对表达量再次确证了:CpG ODN作为禽流感疫苗的佐剂一样有提升抗原特异性的体液和细胞免疫功效;并且在HI试验结果中发现,免疫后有持续且较高的抗体滴度水平,表明CpG ODN的免疫保护持续时间长。试验结果与预期相符,赤红球菌联合CpG ODN复合佐剂试验组显示,赤红球菌的存在增强了这种提升功效。许多研究证实,赤红球菌是通过TLR2的识别来刺激机体免疫的,无论是它的提取物还是全菌都具有免疫刺激作用,而全菌更有定向增强Th1型免疫应答的能力,其免疫调节持续时间长。另外,已有报道指出,TLR2与TLR21同源且功能相似的TLR9存在着协同调节免疫反应的关系。据此,作者希望通过检测赤红球菌和CpG ODN各自的TLR受体的相对表达水平,探究两者的协同关系。试验结果显示,它们之间的协同关系可能是通过上调TLR2和TLR21的表达来实现的。但该协同关系还可能是通过其他多个作用累积达到的,就此需要更深入的探究。在进一步的试验中,通过分别检测脾细胞和支气管细胞的IFN-γ和IL-12的相对表达量,作者发现这种协同关系还诱发了显著的系统免疫和局部免疫反应。这表明该复合佐剂满足当前研究人员中普遍的追求,疫苗及其佐剂的开发应当同时实现系统和局部免疫[31]。通过检测IFN-γ/IL-4的比值以及IFN-γ和IL-12的相对表达量,该复合佐剂更倾向于诱导Th1免疫应答,而研究显示那些触发Th1型免疫与高中和抗体诱生反应的佐剂更有可能具有保护作用,并且能够避免免疫病理的风险[38]。因此,这些结果为进一步探究CpG ODN与赤红球菌的协同关系提供了研究基础。
在确认了赤红球菌联合CpG ODN复合佐剂具有良好的免疫刺激功效之后,进一步探究了如何降低该复合佐剂的使用成本。通过设置半剂量CpG ODN+赤红球菌的佐剂组合,作者发现与原剂量组合相比半剂量组合的试验结果并未显示出显著差异。这表明该复合佐剂通过赤红球菌和CpG ODN之间的协同关系弥补了CpG ODN剂量降低带来的免疫效果下降的代价,并达到与原剂量组合同等程度的免疫效果。从成本角度出发,赤红球菌具有成本上的显著优势,它可以经由全菌给药发挥作用,而且还可以提供长效免疫作用,另外其培养成本低,作用剂量少,完全符合最初选择它作为CpG ODN辅助佐剂的目标。在使用更低剂量的CpG ODN与赤红球菌共同发挥免疫功效这个思路上,由于试验中只设置了半剂量组,作者认为还可以据此进一步探索最佳剂量。此外,作者前期的工作已证实制备CpG质粒的价格要低于直接使用CpG ODN[22],因此拟通过CpG质粒代替ODN进一步降低成本。
4 结论本研究提出了一种高效、成本可控的赤红球菌联合CpG ODN复合佐剂作为禽流感疫苗的免疫佐剂来解决该疫苗存在的免疫效率等问题。作者通过试验确认了该复合佐剂优良的免疫提升效果,并且从成本角度出发,探究了降低该复合佐剂使用成本的方法。如此,不仅可以减少抗原和CpG佐剂的用量,节约成本,而且对于养殖周期40 d左右的肉鸡来说,疫苗免疫效力持久性的提高还能减少养殖期间疫苗的注射次数,更进一步地降低成本。本研究为高效、低成本地应用CpG制剂作为禽类疫苗佐剂奠定了研究基础。本研究还先行探索了赤红球菌与CpG ODN的协同关系,为后续采用CpG质粒来进一步控制制备和使用成本规划了方向。
| [1] |
KRIEG A M. CpG motifs in bacterial DNA and their immune effects[J]. Annu Rev Immunol, 2002, 20: 709-760. DOI:10.1146/annurev.immunol.20.100301.064842 |
| [2] |
BODE C, ZHAO G, STEINHAGEN F, et al. CpG DNA as a vaccine adjuvant[J]. Expert Rev Vaccines, 2011, 10(4): 499-511. DOI:10.1586/erv.10.174 |
| [3] |
KLINMAN D M, KLASCHIK S, SATO T, et al. CpG oligonucleotides as adjuvants for vaccines targeting infectious diseases[J]. Adv Drug Deliv Rev, 2009, 61(3): 248-255. DOI:10.1016/j.addr.2008.12.012 |
| [4] |
ZHANG L H, TIAN X S, ZHOU F Z. Vaccination with Newcastle disease vaccine and CpG oligodeoxynucleotides induces specific immunity and protection against Newcastle disease virus in SPF chicken[J]. Vet Immunol Immunopathol, 2007, 115(3-4): 216-222. DOI:10.1016/j.vetimm.2006.10.017 |
| [5] |
ZHAO Z J, HE R X, CHU P P, et al. YBX has functional roles in CpG-ODN against cold stress and bacterial infection of Misgurnus anguillicaudatus[J]. Fish Shellfish Immunol, 2021, 118: 72-84. DOI:10.1016/j.fsi.2021.08.018 |
| [6] |
CAI H M, WEI J T, SHEN H K, et al. Molecular cloning, characterization and expression profiles of Annexin family (ANXA1-A6) in yellow catfish (Pelteobagrus fulvidraco) and ANX regulation by CpG ODN responding to bacterial infection[J]. Fish Shellfish Immunol, 2020, 99: 609-630. DOI:10.1016/j.fsi.2020.02.032 |
| [7] |
RICHMOND P, HATCHUEL L, DONG M, et al. Safety and immunogenicity of S-Trimer (SCB-2019), a protein subunit vaccine candidate for COVID-19 in healthy adults: a phase 1, randomised, double-blind, placebo-controlled trial[J]. Lancet, 2021, 397(10275): 682-694. DOI:10.1016/S0140-6736(21)00241-5 |
| [8] |
GARDINER IV J H, KOMAZIN G, MATSUO M, et al. Lipoprotein N-acylation in Staphylococcus aureus is catalyzed by a two-component acyl transferase system[J]. mBio, 2020, 11(4): e01619-20. DOI:10.1128/mBio.01619-20 |
| [9] |
朱关平, 童乐民, 汪家芳, 等. 分枝杆菌和珊瑚红球菌细胞壁成分的免疫特性[J]. 抗生素, 1984(3): 259. ZHU G P, TONG L M, WANG J F, et al. Immunological properties of CWs from BCG and rhodococcus corallina[J]. Chinese Journal Of Antibiotics, 1984(3): 259. (in Chinese) |
| [10] |
张祝兰, 连云阳, 严凌斌, 等. 一种赤红球菌提取物的用途: 中国, 110101721A[P]. 2019-08-09. ZHANG Z L, LIAN Y Y, YAN L B, et al. The utility model relates to an extract of red coccus: CN, 110101721A[P]. 2019-08-09. (in Chinese) |
| [11] |
格雷厄姆·麦金太尔, 约翰·L·斯坦福, 辛西娅·A·斯坦福, 等. 作为免疫调节物的全细菌细胞: 英国, 1735431B[P]. 2006-02-15. GRAHAM M I, JOHN L S, CYNTHIA A S, et al. An entire bacterial cell serving as an immunomodulator: UK, 1735431B[P]. 2006-02-15. (in Chinese) |
| [12] |
付家栋. 一种赤红球菌发酵方法及其作为佐剂在动物疫苗中的应用: 中国, 109666609A[P]. 2019-04-23. FU J D. The invention relates to a method of red coccus fermentation and application of red coccus fermentation as an adjuvant in animal vaccine: CN, 109666609A[P]. 2019-04-23. (in Chinese) |
| [13] |
严悌昆, 张毓金, 陈珊, 等. 一种红色红球菌免疫增强剂及其在猪用疫苗中的应用: 中国, 113975383A[P]. 2022-01-28. YAN T K, ZHANG Y J, CHEN S, et al. The invention relates to an immunopotentiator of rhodococcus rubra and application thereof in swine vaccines: CN, 13975383A[P]. 2022-01-28. (in Chinese) |
| [14] |
SØRENSEN L N, REINERT L S, MALMGAARD L, et al. TLR2 and TLR9 synergistically control herpes simplex virus infection in the brain[J]. J Immunol, 2008, 181(12): 8604-8612. DOI:10.4049/jimmunol.181.12.8604 |
| [15] |
THAISS C A, LEVY M, ITAV S, et al. Integration of innate immune signaling[J]. Trends Immunol, 2016, 37(2): 84-101. DOI:10.1016/j.it.2015.12.003 |
| [16] |
TURSI S A, LEE E Y, MEDEIROS N J, et al. Bacterial amyloid curli acts as a carrier for DNA to elicit an autoimmune response via TLR2 and TLR9[J]. PLoS Pathog, 2017, 13(4): e1006315. DOI:10.1371/journal.ppat.1006315 |
| [17] |
LAI C Y, YU G Y, LUO Y P, et al. Immunostimulatory activities of CpG-Oligodeoxynucleotides in teleosts: toll-like receptors 9 and 21[J]. Front Immunol, 2019, 10: 179. DOI:10.3389/fimmu.2019.00179 |
| [18] |
CHUANG Y C, TSENG J C, YANG J X, et al. Toll-like receptor 21 of chicken and duck recognize a broad array of immunostimulatory CpG- oligodeoxynucleotide sequences[J]. Vaccines (Basel), 2020, 8(4): 639. DOI:10.3390/vaccines8040639 |
| [19] |
SAIF Y M, BARNES H J, GLISSON J R. Diseases of poultry[M]. 11th ed. SU J L, GAO F, SUO X, trans. Beijing: China Agriculture Press, 2005. (in Chinese)
|
| [20] |
刘元杰, 张媛, 王秀丽, 等. 新型动物疫苗佐剂的研究进展[J]. 中国兽药杂志, 2021, 55(2): 74-80. LIU Y J, ZHANG Y, WANG X L, et al. Research progress of new animal vaccine adjuvants[J]. Chinese Journal of Veterinary Drug, 2021, 55(2): 74-80. (in Chinese) |
| [21] |
曾振, 王海宁, 张志芳, 等. 新型疫苗佐剂的研究进展[J]. 生物工程学报, 2021, 37(1): 78-87. ZENG Z, WANG H N, ZHANG Z F, et al. Research progress of new vaccine adjuvants[J]. Chinese Journal of Biotechnology, 2021, 37(1): 78-87. (in Chinese) |
| [22] |
ZHANG S X, CAI H M, CAO D, et al. Recombinant plasmids containing CpG with porcine host defense peptides (PR-39/pBD-1) modulates the innate and adaptive intestinal immune responses (including maternal-derived) in piglets[J]. Int Immunopharmacol, 2019, 70: 467-476. DOI:10.1016/j.intimp.2019.03.007 |
| [23] |
詹少春, 孙超, 廖想. 一株赤红球菌及其作为免疫佐剂在制备疫苗中的应用: 中国, 109576180A[P]. 2019-04-05. ZHAN S C, SUN C, LIAO X. A strain of rhodococcus and its application as an immune adjuvant in preparation of vaccine: CN, 109576180A[P]. 2019-04-05. (in Chinese) |
| [24] |
PEDERSEN J C. Hemagglutination-inhibition assay for influenza virus subtype identification and the detection and quantitation of serum antibodies to influenza virus[M]//SPACKMAN E. Animal Influenza Virus. New York: Springer, 2014: 11-25.
|
| [25] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [26] |
张英楠, 张桂山, 徐晶, 等. 基于TLR2/4-NF-κB信号通路研究刺五加多糖对鸡淋巴细胞的调节作用[J]. 中国兽医杂志, 2021, 57(7): 94-99. ZHANG Y N, ZHANG G S, XU J, et al. Study of regulatory effects of Acanthopanax senticosus polysaccharide on TLR2/4-NF-κB signaling pathway in chicken lymphocytes[J]. Chinese Journal of Veterinary Medicine, 2021, 57(7): 94-99. (in Chinese) |
| [27] |
马占邦, 许丽文, 王芳芳, 等. 不同来源传染性支气管炎病毒诱导SPF鸡发病的免疫机制研究[J]. 中国畜牧兽医, 2021, 48(12): 4628-4640. MA Z B, XU L W, WANG F F, et al. Effects of different origins of infectious bronchitis virus on immune function in SPF chicken[J]. China Animal Husbandry & Veterinary Medicine, 2021, 48(12): 4628-4640. (in Chinese) |
| [28] |
董长贵, 何桂梅, 乔健, 等. 鸡IL-12的基因克隆与序列分析[J]. 中国兽医杂志, 2007, 43(10): 22-23. DONG C G, HE G M, QIAO J, et al. Cloning and sequencing of the chicken interleukin-12 genes[J]. Chinese Journal of Veterinary Medicine, 2007, 43(10): 22-23. (in Chinese) |
| [29] |
CAO W P, MISHINA M, AMOAH S, et al. Nasal delivery of H5N1 avian influenza vaccine formulated with GenJetTM or in vivo-jetPEI® induces enhanced serological, cellular and protective immune responses[J]. Drug Deliv, 2018, 25(1): 773-779. DOI:10.1080/10717544.2018.1450909 |
| [30] |
IBRAHIM Z A, ARMOUR C L, PHIPPS S, et al. RAGE and TLRs: relatives, friends or neighbours?[J]. Mol Immunol, 2013, 56(4): 739-744. DOI:10.1016/j.molimm.2013.07.008 |
| [31] |
RANASINGHE C, RAMSHAW I A. Genetic heterologous prime-boost vaccination strategies for improved systemic and mucosal immunity[J]. Expert Rev Vaccines, 2009, 8(9): 1171-1181. |
| [32] |
杨同涛, 孙法良, 崔京腾, 等. 一例白羽肉鸡H9N2禽流感的分离鉴定[J]. 北方牧业, 2019(20): 28. YANG T T, SUN F L, CUI J T, et al. Isolation and identification of H9N2 avian influenza virus in a white-feathered broiler[J]. BeiFang MuYe, 2019(20): 28. (in Chinese) |
| [33] |
HIAM-GALVEZ K J, ALLEN B M, SPITZER M H. Systemic immunity in cancer[J]. Nat Rev Cancer, 2021, 21(6): 345-359. |
| [34] |
BRONTE V, PITTET M J. The spleen in local and systemic regulation of immunity[J]. Immunity, 2013, 39(5): 806-818. |
| [35] |
沈双, 高明. 常用禽流感疫苗利弊分析[J]. 特种经济动植物, 2022, 25(3): 106-107. SHEN S, GAO M. Analysis of advantages and disadvantages of avian influenza vaccine[J]. Special Economic Animals and Plants, 2022, 25(3): 106-107. (in Chinese) |
| [36] |
陈生雷, 王一平, 谷崇高, 等. 免疫佐剂对禽流感疫苗抗体的影响评价[J]. 现代畜牧兽医, 2021(12): 63-65. CHEN S L, WANG Y P, GU C G, et al. Evaluation of the effect of immune adjuvant on avian influenza vaccine antibody[J]. Modern Journal of Animal Husbandry and Veterinary Medicine, 2021(12): 63-65. (in Chinese) |
| [37] |
SCHEIERMANN J, KLINMAN D M. Clinical evaluation of CpG oligonucleotides as adjuvants for vaccines targeting infectious diseases and cancer[J]. Vaccine, 2014, 32(48): 6377-6389. |
| [38] |
LURIE N, SAVILLE M, HATCHETT R, et al. Developing Covid-19 vaccines at pandemic speed[J]. N Engl J Med, 2020, 382(21): 1969-1973. |
(编辑 白永平)



