由于食物和环境的变化,断奶仔猪呈现出腹泻、消化能力下降和生长缓慢等症状[1]。断奶导致肠道氧化应激,肠道中活性氧和硫代巴比妥酸反应性物质浓度增加,同时一氧化氮和过氧化氢浓度显著增加,促进了大肠杆菌的生长,导致肠道炎症和氧化应激的进一步恶化[2]。肠道屏障功能对断奶仔猪的健康状况和生长性能有重要影响,肠道的紧密连接在上皮屏障的形成中发挥关键作用。紧密连接结构包括跨膜蛋白(Claudin、Occludin等)、连接黏附分子以及带状闭合蛋白ZO等[3]。在炎症性肠病下,Claudin、Occludin和ZO水平显著下调,肠道对有害代谢产物的通透性增强,引起全身炎症反应[4-5]。因此,改善断奶仔猪的肠道功能对于仔猪健康以及养猪业的高效生产具有重要意义。
L-苹果酸是三羧酸循环的中间代谢产物。研究发现,L-苹果酸可以影响机体肠道微生物,在抗应激和抗氧化方面有重要作用[6-7]。大鼠上的研究也表明,L-苹果酸可以通过增加NADPH的生成,改善衰老鼠的能量状态,增强机体抗氧化能力[8]。目前,L-苹果酸在养猪生产中的应用较少。本课题组前期研究发现,日粮添加L-苹果酸制品可以改善断奶仔猪机体抗氧化能力,增强有氧代谢,提高骨骼肌中氧化型肌纤维的比例[9],但是L-苹果酸对断奶仔猪肠道功能的影响尚不清楚。本试验以断奶仔猪为研究对象,在日粮中添加不同水平的L-苹果酸制品,旨在研究L-苹果酸对断奶仔猪肠道健康和机体健康状态的影响。
1 材料与方法 1.1 试验设计试验选取体重相近(平均体重(9.12±0.52)kg) 的28日龄“杜×长×大”三元杂交断奶仔猪192头,随机分为4个处理,每个处理6个重复,每个重复8头猪(公母各半)。对照组饲喂玉米-豆粕型基础日粮,3个处理组分别在基础日粮中添加0.25%、0.5%和1%的L-苹果酸制品,试验期28 d。L-苹果酸制品购自安徽雪郎生物科技股份有限公司,成分为20% L-苹果酸和80%载体(以沸石粉为主)。日粮营养水平满足NRC(2012)仔猪(11~25 kg)营养需要。基础日粮组成及营养水平见表 1。试验在农业农村部饲料工业中心动物试验基地(河北丰宁)进行,猪舍配备漏粪地板、不锈钢料槽与乳头式饮水器。在整个试验期内,仔猪自由采食和饮水。
|
|
表 1 基础日粮组成及营养水平(饲喂基础) Table 1 Composition and nutrient levels of basal diets (as-fed basis) |
于试验14和28 d,每个重复内选取1头接近本栏平均体重的健康仔猪,前腔静脉采集血液约5 mL,静置30 min。4 ℃条件下3 500 r·min-1离心15 min,收集血清于-20 ℃保存。试验结束时,每个处理选取6头接近平均体重的仔猪,禁食12 h后肌肉注射戊巴比妥钠进行完全麻醉,屠宰解剖,取出心、肝、脾、肺、肾,吸水纸吸干表面血液后称重。器官指数计算公式:器官指数(g·kg-1)=器官质量(g)/猪活体重(kg)。剖开腹腔,截取空肠中段约2 cm,用生理盐水冲洗干净后放入4%多聚甲醛溶液中固定;截取空肠中段约10 cm,排尽食糜后用生理盐水冲洗干净,使用载玻片轻轻刮取肠道内部表层黏膜,于液氮中速冻后转移至-80 ℃保存。
1.3 血清和空肠炎症指标使用相应的商业化试剂盒(南京建成生物工程研究所,中国),按照说明书步骤测定血清和空肠黏膜中TNF-α、IFN-γ、IL-6和IL-10的含量。
1.4 空肠抗氧化能力测定测定空肠黏膜SOD、CAT和GSH-Px的活性,以及T-AOC和MDA的含量。所用试剂盒购自南京建成生物工程研究所(中国),依照试剂盒说明书进行操作。
1.5 肠道形态学分析空肠样品在4%甲醛溶液中固定24 h,经过修块、脱水、透明和石蜡包埋后将包埋有样品的石蜡块切成5 μm厚的切片,随后经苏木精-伊红染色后晾干、制片。使用倒置显微镜(日本Olympus公司,型号为CK40)对切片进行观察和分析,在每个组织切片上选取至少10个典型视野(绒毛清晰完整),利用Adobe Photoshop软件(版本CS6)测量绒毛高度和隐窝深度。
1.6 空肠黏膜蛋白提取和Western blot分析取50~100 mg空肠黏膜样品在液氮中充分研磨,加入0.5~1 mL RIPA组织裂解液(北京华兴博创基因技术有限公司,中国),提取总蛋白质,使用BCA试剂盒(北京华兴博创基因技术有限公司,中国)测定蛋白质浓度。取约60 μg蛋白使用8%~10% SDS-PAGE进行分离,使用湿转法转印到PVDF膜上。使用含有5% BSA的封闭液进行封闭,加一抗(1∶1 000 Claudin-3多克隆抗体,1∶1 000 ZO-2多克隆抗体,1∶200 Occludin多克隆抗体,1∶10 000 GAPDH单克隆抗体),4 ℃孵育过夜,使用TBST缓冲液漂洗3次后,加入二抗山羊抗兔抗体(1∶15 000)室温孵育1 h。经TBST缓冲液洗涤3次后,使用Odyssey Clx荧光系统进行曝光和成像,最后通过ImageJ软件对条带进行分析并相对定量。
抗体来源:兔抗Claudin-3、ZO-2及Occludin多克隆抗体(Omnimabs公司产品,货号分别为OM123251、OM111126、OM200043);兔抗GAPDH单克隆抗体(Cell Signaling Technology公司产品,货号2118);二抗山羊抗兔抗体(Cell Signaling Technology公司产品,货号5151)。
1.7 数据分析使用Excel 2013整理所有原始数据,使用SAS(SAS 9.2)的GLM程序对试验数据进行线性和二次回归分析以及单因素方差分析,采用Duncan氏法进行多重比较检验,结果以“平均值±标准误”表示,P < 0.05为差异显著,P < 0.01为差异极显著,0.05≤P≤0.10为有变化趋势。
2 结果 2.1 L-苹果酸对断奶仔猪生长性能和器官指数的影响前期研究结果显示,日粮添加L-苹果酸制品对断奶仔猪的平均日增重没有显著影响,断奶仔猪的平均日采食量有升高的趋势,饲料转化效率有降低的趋势(0.05≤P≤0.10)[9]。此外,如表 2所示,日粮添加L-苹果酸制品不影响断奶仔猪心、肝、脾、肺以及肾重量。
|
|
表 2 L-苹果酸对断奶仔猪器官指数的影响 Table 2 Effects of dietary L-malic acid supplementation on organ index of weaned piglets |
TNF-α、IFN-γ和IL-6是典型的促炎因子,IL-10是典型的抗炎因子。如表 3所示,与对照组相比,日粮中添加1% L-苹果酸制品显著降低了试验第14天仔猪血浆中TNF-α和IL-6的水平(P < 0.01),升高了IL-10的水平(P < 0.01);显著降低了试验第28天血浆中IL-6的水平(P < 0.01),升高了IL-10的水平(P < 0.01),表明日粮添加1% L-苹果酸制品降低了断奶仔猪的炎症反应,而添加0.25%和0.5%的L-苹果酸制品对抗炎能力产生了不利影响。
|
|
表 3 L-苹果酸对断奶仔猪血清炎症因子水平的影响 Table 3 Effect of dietary supplementation of L-malic acid on inflammatory factor level in serum of weaned piglets |
鉴于日粮添加1% L-苹果酸制品显著改善了断奶仔猪的抗炎能力,本研究进一步关注了该浓度下小肠健康状态的变化,并把1% L-苹果酸制品组定义为L-苹果酸组。如图 1所示,日粮中添加L-苹果酸显著降低了空肠黏膜中促炎因子TNF-α、IFN-γ和IL-6的水平(P < 0.05或P < 0.01),升高了抗炎因子IL-10的水平(P < 0.01, 图 1A~D)。同时,添加L-苹果酸显著升高了空肠黏膜中SOD、CAT和GSH-Px的活性(P < 0.05或P < 0.01),显著提高了T-AOC(P < 0.01)、显著降低了MDA的水平(P < 0.05, 图 1E~I)。上述结果表明日粮添加1% L-苹果酸改善了断奶仔猪空肠的炎症反应,增强了抗氧化能力。
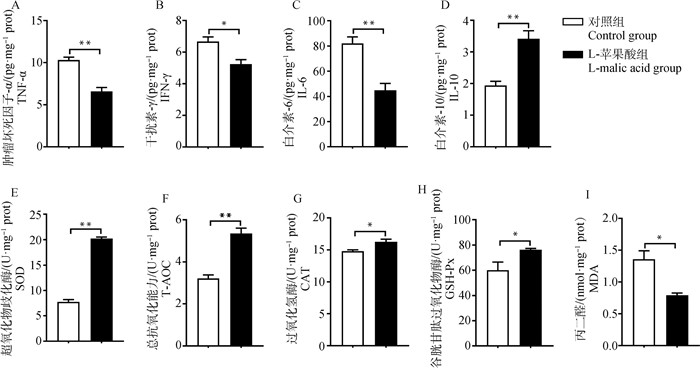
|
*.P < 0.05,**.P < 0.01。下同 *.P < 0.05, **.P < 0.01. The same as below 图 1 L-苹果酸对断奶仔猪空肠炎症反应和抗氧化能力的影响 Fig. 1 Effects of dietary supplementation of L-malic acid on the inflammatory response and antioxidant capacity in jejunum of weaned piglets |
本研究利用HE染色,进一步分析了L-苹果酸对空肠形态的影响。如图 2所示,与对照组相比,日粮添加L-苹果酸显著增加了空肠的绒毛高度(P < 0.01),对隐窝深度没有显著影响,显著升高了绒毛高度与隐窝深度的比值(P < 0.05)。
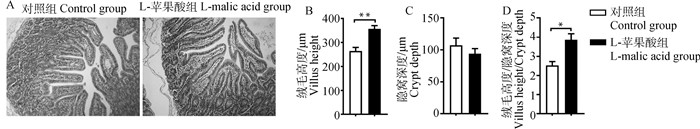
|
A.对照组和L-苹果酸组空肠HE染色(100×);B.对照组和L-苹果酸组的空肠绒毛高度;C.对照组和L-苹果酸组的隐窝深度;D.对照组和L-苹果酸组的绒毛高度与隐窝深度的比值 A. Jejunum HE staining in control group and L-malic acid group (100×); B. Villus height of jejunum in control group and L-malic acid group; C. Crypt depth of control group and L-malic acid group; D. Ratio of villus height to crypt depth in control and L-malic acid groups 图 2 L-苹果酸对断奶仔猪空肠形态的影响 Fig. 2 Effects of dietary supplementation of L-malic acid on jejunal morphology in weaned piglets |
本试验通过对断奶仔猪空肠黏膜紧密连接蛋白表达水平的分析,进一步研究了日粮添加L-苹果酸对肠道屏障功能的影响。与对照组相比,L-苹果酸组Occludin的蛋白表达水平有升高的趋势(P=0.07),Claudin-3的蛋白表达水平显著降低(P < 0.01),ZO-2表达无显著变化(图 3)。

|
A.Occludin多克隆抗体、ZO-2多克隆抗体和Claudin-3多克隆抗体蛋白免疫印记分析;B.Occludin、ZO-2和Claudin-3在对照组和L-苹果酸组中的相对表达量 A. Western blotting analysis of Occludin, ZO-2 and Claudin-3; B. The relative expression levels of Occludin, ZO-2 and Claudin-3 in control group and L-malic acid group 图 3 L-苹果酸对断奶仔猪空肠紧密连接蛋白表达的影响 Fig. 3 Effects of dietary supplementation of L-malic acid on the tight junction protein expression in the jejunum of weaned piglets |
小肠具有消化和吸收功能,肠道上皮是肠道的第一道防线[10]。同时,小肠也是重要的免疫器官。应激源可以通过激活肠道免疫系统,导致促炎细胞因子TNF-α和IL-6等一系列特殊细胞和信号分子的产生。随着炎症反应增强,肠道形态遭到破坏,黏膜和屏障功能受损,动物的采食量和饲料转化效率降低[11-13],并且断奶应激对早期断奶仔猪免疫功能和肠道屏障功能的影响会一直延续到成年[13]。因此,改善肠道健康对于提升断奶仔猪的消化吸收能力、免疫功能以及全期的生长性能至关重要。
L-苹果酸是自然界广泛存在的一种有机酸,是动植物新陈代谢的产物。作为三羧酸循环中间体,L-苹果酸可以促进NADH从细胞质到线粒体的转运,提高老龄大鼠电子传递链酶的活性并提高还原性谷胱甘肽的水平,增强机体抗氧化能力,缓解脂质过氧化状态[14]。与模式动物上的研究结果相一致,本研究中,日粮添加L-苹果酸提高了空肠黏膜SOD、CAT和GSH-Px的活性,提高了T-AOC,显著降低了MDA的水平,意味着断奶仔猪肠道的抗氧化能力得到增强。
有研究发现,仔猪断奶后第2天肠道CD4+和CD8+ T淋巴细胞数量急剧增加,空肠中部炎症细胞因子TNF-α、IL-6、白细胞介素-1β(IL-1β)以及白细胞介素-8(IL-8)的mRNA表达水平升高[15-16]。此外,断奶应激可以通过激活免疫细胞和下调空肠黏膜I类主要组织相容性复合体的表达导致基质金属蛋白酶局部表达增加,造成绒毛萎缩[15, 17]。在本研究中,日粮添加1%的L-苹果酸制品显著降低了空肠黏膜促炎因子TNF-α、IFN-γ和IL-6的水平,升高了抗炎因子IL-10的水平。IFN-γ和TNF-α等促炎因子主要介导细胞免疫应答作用,是临床上常见的抗病毒细胞因子[18]。IL-6由白细胞产生又在白细胞间发挥作用,作为主要炎症细胞因子,在机体感染后的病理生理过程中起到重要作用[19]。而几乎所有淋巴细胞均能合成IL-10,IL-10等抗炎因子主要介导体液免疫。根据本试验结果分析可知,日粮中添加L-苹果酸可能通过增强细胞免疫和体液免疫来提高空肠的免疫能力,从而降低断奶仔猪肠道炎症反应,这很可能跟空肠抗氧化能力的提升有关。值得关注的是,添加1%的L-苹果酸制品同样降低了第14天血浆中TNF-α和IL-6的水平,显著降低了第28天血浆中IL-6的水平,升高了第14和28天血浆中IL-10的水平,说明添加1%的L-苹果酸制品可能通过增强肠道的抗炎能力缓解机体的炎症反应。但令人迷惑的是,与对照组相比,日粮添加0.25%和0.5%的L-苹果酸制品对机体抗炎能力产生了不利影响,其中的机制有待进一步的研究。
有研究报道,增强小肠的抗炎能力可以减轻肠道损伤,提高小肠绒毛高度[20]。微绒毛是肠黏膜上皮的特殊结构,大量的上皮细胞有营养吸收的功能[21]。研究人员指出,氧化应激导致了十二指肠细胞周转减少、微绒毛高度降低、部分微绒毛糜烂[22]。本研究显示,添加L-苹果酸显著提高了空肠绒毛高度,升高了绒毛高度与隐窝深度的比值。肠道绒毛高度和隐窝深度作为肠道物理屏障功能的重要组成部分,与营养物质的消化吸收密切相关[23]。绒毛高度/隐窝深度反映了断奶仔猪肠道功能状况,比值上升表示肠道健康且消化能力较强,下降表示肠道黏膜受损,消化吸收功能降低[24]。因此,L-苹果酸能够改善空肠形态,提高肠道的消化吸收能力,这可能得益于空肠抗炎能力提升和氧化应激的缓解。此外,有研究发现,仔猪断奶应激导致过多活性氧的释放,引发促炎细胞因子的上调,增强肠道通透性[25],这表明氧化应激对仔猪肠道屏障功能也会产生不利影响。本研究中,添加L-苹果酸显著降低了断奶仔猪空肠黏膜Claudin-3的蛋白表达水平,Occludin的蛋白表达水平有升高的趋势。Occludin介导了紧密连接链分支点的形成和稳定,并有助于维持上皮屏障的完整性[26]。紧密连接调节的细胞旁通透性的主要决定因素是Claudins,Claudin-3的降解是肠道屏障功能受损的典型特征[27]。细胞因子能够通过与细胞凋亡无关的信号通路直接改变紧密连接的组成和结构[28]。紧密连接蛋白能够适应细胞因子的刺激,在结构完整的情况下具有分子重塑的潜力[29]。因此,在本研究中,Claudin-3和Occludin蛋白表达水平的变化可能与L-苹果酸引起的炎症因子水平的变化有关,但是细胞因子调节紧密连接的过程尚不清楚,L-苹果酸对肠道屏障功能的影响还需要进一步的研究。
4 结论本研究表明,日粮添加1% L-苹果酸制品可以降低断奶仔猪的炎症反应,改善空肠炎症反应和氧化应激状态,影响空肠形态和屏障功能,进而发挥改善肠道健康的作用。
| [1] |
WANG K L, CAO G T, ZHANG H R, et al. Effects of Clostridium butyricum and Enterococcus faecalis on growth performance, immune function, intestinal morphology, volatile fatty acids, and intestinal flora in a piglet model[J]. Food Function, 2019, 10(12): 7844-7854. DOI:10.1039/C9FO01650C |
| [2] |
WEI H K, XUE H X, ZHOU Z X, et al. A carvacrol-thymol blend decreased intestinal oxidative stress and influenced selected microbes without changing the messenger RNA levels of tight junction proteins in jejunal mucosa of weaning piglets[J]. Animal, 2017, 11(2): 193-201. DOI:10.1017/S1751731116001397 |
| [3] |
OTANI T, FURUSE M. Tight junction structure and function revisited[J]. Trends Cell Biol, 2020, 30(10): 805-817. DOI:10.1016/j.tcb.2020.08.004 |
| [4] |
LANDY J, RONDE E, ENGLISH N, et al. Tight junctions in inflammatory bowel diseases and inflammatory bowel disease associated colorectal cancer[J]. World J Gastroenterol, 2016, 22(11): 3117-3126. DOI:10.3748/wjg.v22.i11.3117 |
| [5] |
VINDIGNI S M, ZISMAN T L, SUSKIND D L, et al. The intestinal microbiome, barrier function, and immune system in inflammatory bowel disease: A tripartite pathophysiological circuit with implications for new therapeutic directions[J]. Therap Adv Gastroenterol, 2016, 9(4): 606-625. DOI:10.1177/1756283X16644242 |
| [6] |
YU Y D, ZHANG M D, LIN S Y, et al. Assessment the levels of tartrate-resistant acid phosphatase (TRAP) on mice fed with eggshell calcium citrate malate[J]. Int J Biol Macromol, 2013, 58: 253-257. DOI:10.1016/j.ijbiomac.2013.04.027 |
| [7] |
梁静, 张文举, 王博. L-苹果酸的生理功能及其在反刍动物生产应用中的研究进展[J]. 中国畜牧兽医, 2016, 43(7): 1916-1921. LIANG J, ZHANG W J, WANG B. Research progress on the physiological function of L-malic acid and its application in ruminant production[J]. China Animal Husbandry & Veterinary Medicine, 2016, 43(7): 1916-1921. (in Chinese) |
| [8] |
WU J L, WU Q P, PENG Y P, et al. Effects of L-malate on mitochondrial oxidoreductases in liver of aged rats[J]. Physiol Res, 2011, 60(2): 329-336. |
| [9] |
ZHANG X, CHEN M X, YAN E F, et al. Dietary malic acid supplementation induces skeletal muscle fiber-type transition of weaned piglets and further improves meat quality of finishing pigs[J]. Front Nutr, 2022, 8: 825495. DOI:10.3389/fnut.2021.825495 |
| [10] |
LALLÈS J P. Microbiota-host interplay at the gut epithelial level, health and nutrition[J]. J Anim Sci Biotechnol, 2016, 7: 66. DOI:10.1186/s40104-016-0123-7 |
| [11] |
LIU Y L, CHEN F, ODLE J, et al. Fish oil enhances intestinal integrity and inhibits TLR4 and NOD2 signaling pathways in weaned pigs after LPS challenge[J]. J Nutr, 2012, 142(11): 2017-2024. DOI:10.3945/jn.112.164947 |
| [12] |
LEE J S, AWJI E G, LEE S J, et al. Effect of Lactobacillus plantarum CJLP243 on the growth performance and cytokine response of weaning pigs challenged with enterotoxigenic Escherichia coli[J]. J Anim Sci, 2012, 90(11): 3709-3717. DOI:10.2527/jas.2011-4434 |
| [13] |
UPADHAYA S D, KIM I H. The impact of weaning stress on gut health and the mechanistic aspects of several feed additives contributing to improved gut health function in weanling piglets—A review[J]. Animals (Basel), 2021, 11(8): 2418. |
| [14] |
WU J L, WU Q P, YANG X F, et al. L-malate reverses oxidative stress and antioxidative defenses in liver and heart of aged rats[J]. Physiol Res, 2008, 57(2): 261-268. |
| [15] |
MCCRACKEN B A, SPURLOCK M E, ROOS M A, et al. Weaning anorexia may contribute to local inflammation in the piglet small intestine[J]. J Nutr, 1999, 129(3): 613-619. DOI:10.1093/jn/129.3.613 |
| [16] |
PIÉ S, LALLÈS J P, BLAZY F, et al. Weaning is associated with an upregulation of expression of inflammatory cytokines in the intestine of piglets[J]. J Nutr, 2004, 134(3): 641-647. DOI:10.1093/jn/134.3.641 |
| [17] |
PONTA H, CATO A C B, HERRLICH P. Interference of pathway specific transcription factors[J]. Biochim Biophys Acta, 1992, 1129(3): 255-261. DOI:10.1016/0167-4781(92)90501-P |
| [18] |
MORBACH H, SCHNABEL A, BRUCK N, et al. Choosing the right treatment for patients with a severe course of chronic non-bacterial osteomyelitis (CNO)-pamidronate or TNF-α blockade?[J]. Pediatr Rheumatol Online J, 2015, 13(S1): P190. DOI:10.1186/1546-0096-13-S1-P190 |
| [19] |
HOFMANN S R, BÖTTGER F, RANGE U, et al. Serum interleukin-6 and CCL11/eotaxin may be suitable biomarkers for the diagnosis of chronic nonbacterial osteomyelitis[J]. Front Pediatr, 2017, 5: 256. DOI:10.3389/fped.2017.00256 |
| [20] |
ZHANG X M, HU X, OU J Y, et al. Glycyrrhizin ameliorates radiation enteritis in mice accompanied by the regulation of the HMGB1/TLR4 pathway[J]. Evid Based Complement Alternat Med, 2020, 2020: 8653783. |
| [21] |
HAMPSON D J. Alterations in piglet small intestinal structure at weaning[J]. Res Vet Sci, 1986, 40(1): 32-40. DOI:10.1016/S0034-5288(18)30482-X |
| [22] |
SRIGIRIDHAR K, NAIR K M, SUBRAMANIAN R, et al. Oral repletion of iron induces free radical mediated alterations in the gastrointestinal tract of rat[J]. Mol Cell Biochem, 2001, 219(1-2): 91-98. |
| [23] |
CHEN H, MAO X B, HE J, et al. Dietary fibre affects intestinal mucosal barrier function and regulates intestinal bacteria in weaning piglets[J]. Br J Nutr, 2013, 110(10): 1837-1848. DOI:10.1017/S0007114513001293 |
| [24] |
韩正康. 家畜营养生理学[M]. 北京: 中国农业出版社, 1993: 16-17. HAN Z K. Nutritional physiology of livestock[M]. Beijing: China Agriculture Press, 1993: 16-17. (in Chinese) |
| [25] |
VERGAUWEN H, TAMBUYZER B, JENNES K, et al. Trolox and ascorbic acid reduce direct and indirect oxidative stress in the IPEC-J2 cells, an in vitro model for the porcine gastrointestinal tract[J]. PLoS One, 2015, 10(3): e0120485. DOI:10.1371/journal.pone.0120485 |
| [26] |
SAITO A C, HIGASHI T, FUKAZAWA Y, et al. Occludin and tricellulin facilitate formation of anastomosing tight-junction strand network to improve barrier function[J]. Mol Biol Cell, 2021, 32(8): 722-738. DOI:10.1091/mbc.E20-07-0464 |
| [27] |
LYNN K S, PETERSON R J, KOVAL M. Ruffles and spikes: Control of tight junction morphology and permeability by Claudins[J]. Biochim Biophys Acta Biomembr, 2020, 1862(9): 183339. DOI:10.1016/j.bbamem.2020.183339 |
| [28] |
CAPALDO C T, NUSRAT A. Cytokine regulation of tight junctions[J]. Biochim Biophys Acta, 2009, 1788(4): 864-871. DOI:10.1016/j.bbamem.2008.08.027 |
| [29] |
CAPALDO C T, NUSRAT A. Claudin switching: physiological plasticity of the tight junction[J]. Semin Cell Dev Biol, 2015, 42: 22-29. DOI:10.1016/j.semcdb.2015.04.003 |
(编辑 范子娟)



