2. 江西农业大学家禽研究所,南昌 330045
2. Poultry Research Institute of Jiangxi Agricultural University, Nanchang 330045, China
近年来,蛋鸭笼养因其环境友好、经济效益高而得到大力推广[1]。蛋鸭笼养模式解决了蛋鸭污染问题,提高了生物安全性和产品质量;实施标准化生产更具优势[2]。相比蛋鸭单笼饲养,叠层笼饲养密度更大,可进一步提高空间利用率。但高密度饲养下的叠层笼养方式在生产中依然存在包括蛋鸭死亡率上升、种蛋受精率低下、鸭腹水的比例增高、机体应激反应强烈等问题[3-4]。研究表明,蛋鸭上笼1和2 d后应激水平与平养组相比差异较大,不仅造成肝组织一定程度的损伤,而且导致炎症损伤因子表达增加,但随着应激时间增加,肝损伤在上笼第4、7、10天后逐渐好转[2]。笼养应激是一种非病理性慢性应激,蛋鸭对笼养应激的耐受性在很大程度上取决于鸭的应激反应能力。笼养应激反应会降低蛋鸭体重、减少食物摄入并导致直接经济损失,减少应激造成的经济损失仍然是笼养蛋鸭养殖业的主要目标[5]。
代谢组学(metabolomics)是一种基于高通量检测技术研究在特定条件下细胞、组织或生物体内所有小分子化合物的系统生物学方法[6]。在过去十年里,随着高通量质谱技术的发展,代谢组学已被广泛用于识别标志代谢物,探索潜在的生物化学作用机制[7-8]。特别是代谢组学已广泛应用于畜牧行业所涉及的相关研究中,如产品品质[9]、营养调控[10]、遗传育种[11]、应激[12]等方面。迄今为止,基于组学技术探究叠层笼高密度饲养应激对蛋鸭生产性能影响的研究还未见报道,笼养应激调控蛋鸭繁殖性状的机制仍不清楚。
基于以上研究背景,试验以山麻鸭母鸭为研究对象,比较110日龄山麻鸭在平养与叠层笼养模式下第3天个体血浆代谢物的异同,为建立解决蛋鸭笼养应激的新方法提供理论基础,促进水禽笼养技术的发展和推广。
1 材料与方法 1.1 试验材料试验所用蛋鸭均由江西天韵农业开发股份有限公司提供。试验蛋鸭在100日龄时运到试验场地在平养模式下饲养,适应10 d后随机选15只上笼饲养(四层阶梯式笼,笼具规格:长×宽×高为100 cm× 45 cm×50 cm),第3天随机挑选平养组(floor-water rearing system,FWR组)和叠层式笼养组(cage-rearing system,CR组)各10只均采用跖骨静脉采血法采血至抗凝管中。每只采血3 mL,4 ℃ 3 000 r·min-1离心10 min收集上清血浆,分装后-80 ℃保存备用。
1.2 试验仪器与试剂Triple TOFTM 5600高效液相色谱-质谱(high performance liquid chromatography-high resolution mass spectrometer,HPLC-HRMS)联用仪(配有DBS和MMDF Trigger IDA数据采集系统及MarkerView、PeakView、MetabolitePilot数据分析软件,美国AB Sciex公司);Heraeus Fresco17离心机(美国Thermo Fisher Scientific公司);BSA124S-CW电子天平(德国Sartorius公司);明澈D24 UV纯水仪(美国Merck Millipore公司);ACQUITY UPLC HSS T3 1.8 μm,2.1 mm×100 mm色谱柱(美国Waters公司);超低温冷冻冰箱(日本,Panasonnic公司)。
甲醇(Methanol)、乙腈(Acetonitrile)购自美国Honeywell公司;甲酸(Formic acid)购自美国SIGMA公司;均为LC-MS级纯度。
1.3 LC-MS/MS分析通过有机试剂沉淀蛋白法对样本进行代谢物提取,用120 μL预冷的50%甲醇溶液提取20 μL血浆样品,充分混匀,常温静置10 min;提取液于-20 ℃冰箱储存过夜,将样品中的蛋白质充分沉淀;4 000×g离心20 min,转移上清液到96孔板;样品在-80 ℃冰箱保存,后进行HPLC-HRMS分析。等量取出20个样品稀释液混合成QC样品。对所提取的样本进行随机上机排序检测,在样品前、中、后分别插入QC样品作为试验技术重复评估。
数据采集所用到的液相体系为SCIEX,UK公司的超高压液相。采集时,ACQUITY UPLC T3(100 mm×2.1 mm,1.8 μm,Waters,UK)色谱柱;柱温设置为35 ℃,流速为0.4 mL·min-1。采用的流动相为A相:水(1%甲酸);B相:乙腈(1%甲酸)。洗脱梯度为0~0.5 min,5% B;0.5~7 min,5%~100% B;7~8 min,100% B;8~8.1 min,100%~5% B;8.1~10 min;5% B。
采集所用的高分辨率质谱仪为TripleTOF 5600 Plus(SCIEX,UK)飞行时间质谱。每个样本进行正负两种模式采集,正离子模式电压为5 000 V,负离子模式时为-4 500 V。离子源的气帘气压为30 PSI,气体1(辅气)和气体2(鞘气)压力均设置为60 PSI。离子源温度650 ℃。通过IDA(信息依赖性采集)模式对数据进行采集。详细方法见参考文献[13]。
在采集过程中,每20个样本进行一次质量精度校准。同时,每10个样本进行一次QC品的扫描。用QC间的质量差距来校正整批试验的系统误差。
1.4 多元数据处理和数据分析首先在XCMS软件中导入由MSConver软件转换原始文件得到的mzXML文件,以达到代谢物峰提取、保留时间矫正的目的;通过CAMERA软件对代谢物同位素、加和离子进行分析。metaX软件结合KEGG、HMDB数据库完成物质注释。通过in-house图谱库对质谱二级碎片数据进行匹配、打分,完成对相似度大于80%的代谢物的提取。通过metaX软件,去掉在50% QC样品和80%样品中缺失的代谢物。利用KNN(k-nearest neighbor)算法补充缺失值,所有样品通过PQN(probabilistic quotient normalization)算法进行数据归一化,同时利用QC样品进行QC-RSC(QC-robust spline batch correction)校正。校正数据后去除在QC样品中变异系数(coefficient of variation,CV)>30%的代谢物,得到高质量代谢物。详细方法参照文献[13]。
1.5 差异代谢物鉴定和通路分析利用metaX软件对代谢物结果进行单变量分析和多变量分析。主要方法是通过计算代谢物强度在两表型间的比值,利用t检验进行统计学分析,对检验结果作多重检验分析,再利用BH(Benjamini-Hochberg)矫正,到q值。同时利用偏最小二乘法判别分析(partial least square discriminate analysis,PLS-DA),得到每个代谢物的变量重要性(variable importance in projection,VIP)。取差异倍数(Fold-change)ratio≥2或ratio≤1/2、VIP>1、q<0.05为筛选条件得到显著差异代谢物。
找出差异代谢物KEGG号,通过在线网站MBRole 2.0 (http://csbg.cnb.csic.es/mbrole2/index.php)进行代谢通路富集分析。进入网站上传需要分析的数据,选择Annotation、KEGG pathway,Background set选择分析背景,点击Enrichment analysis开始进行分析,得出代谢通路富集分析结果。
2 结果 2.1 代谢物检测及质控按照代谢组样品处理步骤每隔10个样品插入1个QC样品,以验证系统的可靠性。将QC样本总离子色谱(TIC)叠加比较,结果发现QC的响应强度和保留时间重叠良好,说明该方法具有较强的稳定性。LC-MS获得的血浆样品总离子流图(TIC)如图 1所示,峰间分离良好,表明色谱和质谱条件适用于本研究样品的测定。
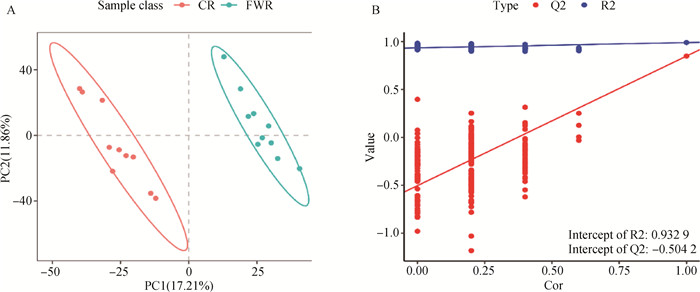
2.2 差异代谢物多元统计分析2.2.1 差异代谢物PCA分析 为了验证组内个体的重复性,本研究进行了代谢物质的PCA分析,结果取PC1、PC2二维主成分进行展示。结果如图 2所示,其中第一主成分(PC1)可以解释原始数据集的18.78%特征,第二主成分(PC2)可以解释原始数据集14.47%特征。差异代谢离子的主成分分析识别出的离散点聚集,代表相似性较好。在本研究中,PCA结果中不同组样本间分离明显,表明组间代谢物发生了明显的变化。
|
A.正离子模式下总离子流图;B.负离子模式下总离子流图 A. Total ion chromatograms in ES+ mode. B. Total ion chromatograms in ES-mode 图 1 CR和FWR组血浆代谢物总离子流图(TIC) Fig. 1 Total ion chromatograms (TIC) of plasma metabolites from CR and FWR groups |

|
图 2 CR和FWR组血浆代谢物主成分分析(PCA) Fig. 2 Principal component analysis (PCA) of the plasma metabolites of CR and FWR |
2.2.2 差异代谢物PLS-DA分析 PLS-DA分析结果如图 3A所示,CR组和FWR组的主成分模式分离显著,没有重叠。通过分析血浆差异代谢物获得的R2Y为0.99,Q2Y为0.85,这表明该模型能够反映CR组和FWR组之间99%的差异,并且该模型的差异代谢物预测能力为85%,R2Y和Q2Y均高于0.5,说明当前PLS-DA模型较为可靠。对该模型参数R2和Q2进行置换检验,设置检验次数为200次。置换检验分析结果如图 3B所示,差异代谢物的R2Y值均高于Q2Y值,Q2<0说明没有过拟合现象。
|
A. PLS-DA分析结果;B. PLS-DA模型置换检验 A. Analysis of PLS-DA; B. Permutation test of PLS-DA 图 3 CR和FWR组血浆代谢物PLS-DA模型分析 Fig. 3 PLS-DA model analysis of plasma metabolites of CR and FWR groups |
2.2.3 差异代谢物分析 采用单变量分析差异倍数(Fold-change)和t检验,进行BH校正得到q-value,结合多变量统计分析PLS-DA得到衡量各代谢物表达模式对各组样本分类判别的影响强度和解释能力的VIP值。以表达差异倍数(Fold-change)ratio≥2或ratio≤1/2;VIP≥1.0并结合t检验的P值(P<0.05)作为筛选条件寻找显著性差异代谢物(图 4)。差异代谢物分析共筛选到差异代谢物30种,其中上调表达的差异代谢物14种,下调表达的差异代谢物16种。差异代谢物种类包括甘油磷脂Glycerophospholipids(16种)、脂酰Fatty Acyls(4种)、羧酸及其衍生物Carboxylic acids and derivatives(2种)等物质外,还包括苯丙酸、酚类、有机硫酸及其衍生物、甾醇脂质、嘌呤核苷、有机氧化合物、类固醇和类固醇衍生物、有机磺酸及其衍生物等代谢物(表 1)。

|
灰色代表无显著差异的代谢物,红色代表上调代谢物,绿色代表下调代谢物,图中点的大小代表VIP值 Grey dots represent no significant differential metabolites, red dots represent up-regulated differential metabolites, green dots represent down-regulated differential metabolites, the size of the dots in the figure represents the VIP value 图 4 CR和FWR组血浆差异代谢物火山图 Fig. 4 Volcano plot of plasma differential metabolites of CR and FWR groups |
|
|
表 1 CR组与FWR组的差异代谢物分布 Table 1 Differential metabolites distribution in CR compared to FWR |
为了更直观地表达样本之间的关系以及在不同样本中代谢组的表达差异,通过利用差异代谢物在不同样品中的表达情况,对每个代谢物的强度值归一化以聚类热图表示(图 5)。聚类热图结果表明,CR组和FWR组样本分别聚类在同一簇中,具有相似表达模式的代谢物聚类在同一簇中,说明组间代谢物相对定量值层次聚类区分明显。

|
图 5 CR和FWR组血浆差异代谢物聚类热图 Fig. 5 Heat map of plasma differential metabolites of CR and FWR groups |
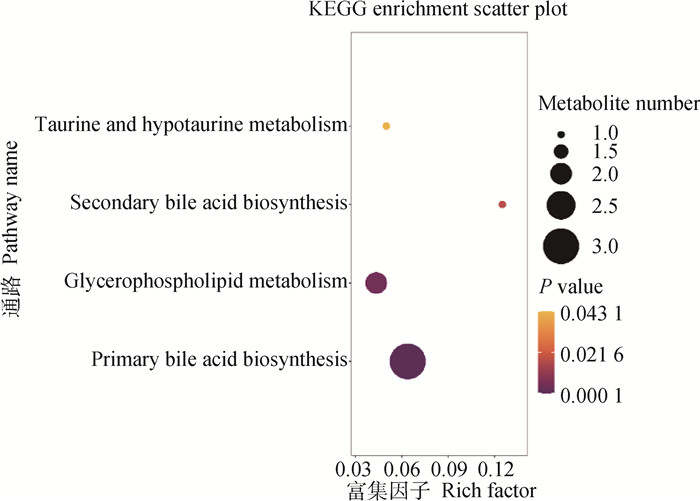
KEGG通路富集分析结果显示,上述差异代谢物极显著富集到初级胆汁酸生物合成、甘油磷脂代谢通路,显著富集到次级胆汁酸生物合成、牛磺酸和亚牛磺酸代谢通路(图 6),说明这4条代谢通路可能是调节蛋鸭笼养急性应激的关键通路。
|
图 6 CR和FWR组血浆差异代谢物KEGG通路富集分析 Fig. 6 KEGG pathway enrichment analysis of plasma differential metabolites of CR and FWR groups |
应激在人类社会和动物生产中广泛存在,影响个体的行为、代谢等生命进程。应激是指机体受到外界刺激而产生的一种非特异性反应,分为急性应激和慢性应激[14-15]。应激主要通过下丘脑-垂体-肾上腺轴(hypothalamic-pitutary-adrenal axis,HPA)调节机体反应[16]。外界刺激作用于机体体表感受器,通过交感神经传到神经中枢,从而激活HPA轴。HPA轴产生的激素可上调促性腺激素抑制激素(gonadotropin inhibiting hormone,GnIH)抑制促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)发挥作用,导致垂体分泌促卵泡生成素(follicle-stimulating hormone,FSH)和促黄体生成素(luteinizing Hormone,LH)减少,从而抑制动物繁殖[17-18]。
叠层笼养过程中,蛋鸭上笼初期因多种环境因素的改变会产生强烈的应激反应导致生长缓慢、免疫力下降等,严重阻碍了蛋鸭笼养技术的推广普及[19]。因此,减少应激有利于解决蛋鸭笼养的产蛋性能下降问题。目前,笼养应激导致蛋鸭机体最终代谢通路的变化以及最终代谢物的变化还未见报道。本研究利用LC-MS技术共鉴定出蛋鸭血浆中343种代谢物,其中差异代谢物30种。通过代谢通路富集分析发现,初级胆汁酸生物合成、甘油磷脂代谢通路发生极显著变化,次级胆汁酸生物合成、牛磺酸和亚牛磺酸代谢通路发生显著变化。
3.1 初级胆汁酸和次级胆汁酸合成通路胆汁酸主要分为初级和次级胆汁酸两种。由肝中胆固醇代谢合成的初级胆汁酸是胆汁的主要成分,主要包括由胆固醇合成的胆酸(cholic acid,CA)、熊脱氧胆酸(ursodeoxycholic acid,UDCA)、鹅脱氧胆酸(chenodeoxycholic acid,CDCA)以及其与牛磺酸和甘氨酸结合的胆酸盐[20-21]。次级胆汁酸通过初级胆汁酸在肠道菌群作用下合成,其中CA转化为脱氧胆酸(deoxycholic acid,DCA),CDCA转化为石胆酸(lithocholic acid,LCA)[22]。家禽体内主要包含CA、DCA、CDCA以及牛磺鹅脱氧胆酸(taurochenodeoxycholic acid,TCDCA)等胆汁酸[21]。属于肠-肝轴和微生物-宿主轴交互信号分子的胆汁酸可由肝排到肠道以达到维护肠道屏障及改善肠道菌群的目的,通过次级胆汁酸和短链脂肪酸(short-chain fatty acids,SCFA)等代谢产物肠道菌群可以在肠-肝轴传递信号,影响宿主采食和能量代谢[23]。
本研究中,初级胆汁酸合成通路富集到3种差异代谢物,其中胆酸极显著下调,牛磺酸、甘胆酸极显著上调。胆酸属于初级胆汁酸的一种,通过法尼醇X受体(FXR)和G蛋白偶联受体(TGR5)影响物质吸收和调节免疫应答、糖代谢、脂代谢和能量代谢、肠道菌群稳态[24-26]。有研究发现,肝细胞癌发生的全过程有胆汁酸代谢、肠道菌群以及胆汁酸受体调控通路的参与,肝细胞癌小鼠的肝组织和肝细胞癌患者的血浆和粪便中的甘氨胆酸(glycocholate,GCA)、牛磺胆酸(taurocholate,TCA)、牛磺鹅脱氧胆酸(taurochenodeoxycholate,TCDCA)等胆汁酸水平显著升高[27-29]。杜雪儿等[30]在对胆汁酸肠肝循环过程中所关联到的转运蛋白以及FXR对其的调控机制进行综合阐述的同时认为,肠肝循环对调节胆汁酸稳态有重要意义。本研究中笼养蛋鸭受到急性应激后胆汁酸合成下调,可能由于笼养蛋鸭上笼后体重下降、食物摄入减少、机体免疫应答、糖代谢、脂代谢以及肠道菌群受到影响所导致。
3.2 甘油磷脂代谢通路甘油磷脂是机体内含量最多的磷脂之一,是构成活体细胞膜的主要成分,还参与细胞膜对蛋白质的识别以及信号传导,包含磷脂酸(phosphatidicacid,PA)、磷脂酰乙醇胺(phosphatidylethanilamine,PE)、磷脂酰胆碱(phosphatidylcholine,PC)、磷脂酰丝氨酸(phosphatidylserine,PS)、磷脂酰肌醇(phosphatidylinoitide,PI)和磷脂酰甘油(phosphatidylglycerol,PG)等[31]。甘油磷脂可被磷脂酶水解并与细胞膜上G蛋白偶联受体结合,调节细胞内信号传导途径,并参与如炎症、免疫和肿瘤等过程[32]。甘油磷脂在细胞增殖、分化和凋亡中同样起到至关重要的作用[33]。在脑组织中,甘油磷脂代谢产物和鞘脂代谢产物之间的相互作用可能在与神经系统疾病相关的氧化应激的启动和维持中发挥重要作用[34]。在高盐环境下,酵母会提高甘油磷脂成分、增加细胞膜的完整性来对抗渗透压应激[35]。在本研究中,甘油磷脂代谢通路富集到2种甘油磷脂,磷脂酰胆碱(phosphatidylcholine,PC),磷脂酰乙醇胺(phosphatidylethanolamine,PE)。磷脂酰胆碱中LysoPC(24:4)、LysoPC(22:6)、LysoPC(22:5)、LysoPC(22:4)、LysoPC(17:1)、LysoPC(16:2)显著上调;LysoPC(20:5)、LysoPC(20:3)、LysoPC(16:1)、LysoPC(15:1)、LysoPC(14:1)显著下调。磷脂酰乙醇胺中LysoPE(22:5)、LysoPE(22:4)显著上调;LysoPE(20:1)、LysoPE(18:1)、LysoPE(16:1)显著下调。这些结果表明,笼养急性应激导致蛋鸭血浆中甘油磷脂代谢途径紊乱,影响机体健康。有研究发现,黄连解毒汤及其正丁醇组分可通过调节花生四烯酸代谢通路和甘油磷脂代谢通路缓解小鼠急性溃疡性结肠炎[36]。
3.3 牛磺酸和亚牛磺酸代谢通路牛磺酸(taurine,2-氨基乙磺酸),是一种广泛存在于各种组织中的含硫游离氨基酸,可在体内通过蛋氨酸、半胱氨酸合成[37]。牛磺酸在多种代谢和生理过程中发挥重要作用,如葡萄糖和脂质调节、能量代谢、抗炎调节和抗氧化作用[38-39]。张金秋等[40]研究表明,外源性牛磺酸可以提高蛋鸡肾组织抗氧化水平,改善饲养应激造成的肾组织损伤,进而提高蛋鸡的健康水平。近年来研究发现,牛磺酸在抗应激方面具有积极作用,能有效保护应激机体的神经、心血管、消化系统等[41]。同时,牛磺酸在降低血浆和肝组织胆固醇浓度方面具有显著作用,这与胆汁酸稳态相关[42]。本研究中,牛磺酸和亚牛磺酸代谢通路和胆汁酸代谢通路所富集到的牛磺酸在FWR组极显著上调。蛋鸭机体可能通过调整这两条通路以对抗笼养急性应激。
研究表明,牛磺酸具有较强的抗氧化能力,可以显著降低心肌细胞中线粒体的蛋白氧化水平,对基因敲除小鼠的抗氧化应激能力有所提升[43]。本研究中,牛磺酸在受到急性应激后的笼养蛋鸭血浆中上调,说明笼养蛋鸭机体可通过上调血浆中的牛磺酸以抵抗笼养应激。牛磺酸能够与胆酸结合形成牛磺胆酸,随胆汁排到消化道中,促进脂肪乳化,提高胆固醇、脂溶性维生素等脂溶性物质消化吸收的水平。牛磺酸也可通过增加肠道绒毛高度和降低肠道隐窝深度,以达到维持肠黏膜正常结构,修复热应激造成的肠道损伤[44]。杨小然等[45]研究发现,日粮中添加0.1%牛磺酸可以显著提高蛋雏鸭的平均日增重,提高肝组织中超氧化物歧化酶和谷胱甘肽过氧化物酶的活性,总抗氧化能力以及法氏囊和脾脏指数。卢宇等[46]研究表明,日粮中添加牛磺酸可缓解急性热应激导致的输卵管损伤,提高机体免疫抗氧化机能。
4 结论本研究应用非靶向代谢组学方法研究了笼养蛋鸭急性应激时血浆中代谢物的变化。通过差异代谢物鉴定及通路富集分析发现,蛋鸭在笼养条件下机体代谢发生适应性变化。研究结果为深入探讨笼养模式影响蛋鸭的健康机制,解决蛋鸭笼养应激奠定理论基础。
| [1] |
陈开丰. 不同笼养条件下山麻鸭生产性能和生理状态比较分析[D]. 南昌: 江西农业大学, 2019. CHEN K F. Comparison of production performance and physiological status in Shan Partridge duck under different cage conditions[D]. Nanchang: Jiangxi Agricultural University, 2019. (in Chinese) |
| [2] |
ZHANG Y, GU T T, TIAN Y, et al. Effects of cage and floor rearing system on the factors of antioxidant defense and inflammatory injury in laying ducks[J]. BMC Genet, 2019, 20(1): 103. DOI:10.1186/s12863-019-0806-0 |
| [3] |
熊婷, 万磊, 陈开丰, 等. 本交笼模式下山麻鸭交配行为与受精率的相关性研究[J]. 中国家禽, 2021, 43(4): 72-77. XIONG T, WAN L, CHEN K F, et al. Prevalence and correlates of fertilization rate and mating behavior of ShanMa ducks in the mating cage[J]. China Poultry, 2021, 43(04): 72-77. (in Chinese) |
| [4] |
熊婷, 万磊, 熊刚华, 等. 本交笼养山麻鸭受精率与公鸭精液品质、生殖器官发育的研究[J]. 中国家禽, 2021, 43(11): 7-13. XIONG T, WAN L, XIONG G H, et al. Fertilization rate, semen quality and reproductive organ development of Shanma male duck in the mating cage[J]. China Poultry, 2021, 43(11): 7-13. (in Chinese) |
| [5] |
ZHENG C, WU Y, LIANG Z H, et al. Plasma metabolites associated with physiological and biochemical indexes indicate the effect of caging stress on mallard ducks (Anas Platyrhynchos)[J]. Anim Biosci, 2022, 35(2): 224-235. DOI:10.5713/ab.21.0241 |
| [6] |
刘艳利, 孙文强, 韩迪, 等. 基于GC-MS代谢组学技术对叶酸调控鸡原代肝细胞代谢的研究[J]. 畜牧兽医学报, 2018, 49(9): 1919-1927. LIU Y L, SUN W Q, HAN D, et al. The study on folic acid regulating metabolism of chicken primary hepatocytes by GC-MS metabolomics[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(9): 1919-1927. (in Chinese) |
| [7] |
BAIRA E, DAGLA I, SIAPI E, et al. UHPLC-HRMS-based tissue untargeted metabolomics study of naringin and hesperidin after dietary supplementation in chickens[J]. Food Chem, 2018, 269: 276-285. DOI:10.1016/j.foodchem.2018.06.146 |
| [8] |
JANG C, CHEN L, RABINOWITZ J D. Metabolomics and isotope tracing[J]. Cell, 2018, 173(4): 822-837. DOI:10.1016/j.cell.2018.03.055 |
| [9] |
XIAO Z C, GE C R, ZHOU G H, et al. 1 H NMR-based metabolic characterization of Chinese Wuding chicken meat[J]. Food Chem, 2019, 274: 574-582. DOI:10.1016/j.foodchem.2018.09.008 |
| [10] |
GIANNENAS I, GRIGORIADOU K, SIDIROPOULOU E, et al. Untargeted UHPLC-MS metabolic profiling as a valuable tool for the evaluation of eggs quality parameters after dietary supplementation with oregano, thyme, sideritis tea and chamomile on brown laying hens[J]. Metabolomics, 2021, 17(6): 51. DOI:10.1007/s11306-021-01801-7 |
| [11] |
周萌, 景军红, 毛瑞涵, 等. 代谢组学在家养动物遗传育种中的应用[J]. 遗传, 2019, 41(2): 111-124. ZHOU M, JING J H, MAO R H, et al. Applications of metabonomics in animal genetics and breeding[J]. Hereditas(Beijing), 2019, 41(2): 111-124. (in Chinese) |
| [12] |
贺绍君, 丁金雪, 李静, 等. 基于气相色谱-质谱联用技术的急性热应激肉鸡血清物质代谢组学研究[J]. 动物营养学报, 2018, 30(8): 3116-3124. HE S J, DING J X, LI J, et al. Study on serum substance metabolomics in acutely Heat-stressed Broilers using gas chromatography-mass spectrometry technique[J]. Chinese Journal of Animal Nutrition, 2018, 30(8): 3116-3124. (in Chinese) |
| [13] |
郑海英, 张冬青, 赵晓丹. 代谢组学法研究转录因子SlNAC4对番茄果实代谢产物的影响[J]. 食品科学, 2019, 40(10): 36-42. ZHENG H Y, ZHANG D Q, ZHAO X D. Metabonomic study on the effect of transcriptional factor SlNAC4 on tomato fruit metabolites[J]. Food Science, 2019, 40(10): 36-42. (in Chinese) |
| [14] |
BALTZER NIELSEN S, STANISLAUS S, SAUNAMÄKI K, et al. Can acute stress be fatal?A systematic cross-disciplinary review[J]. Stress, 2019, 22(3): 286-294. DOI:10.1080/10253890.2018.1561847 |
| [15] |
KUANG X D, YU X B, CAO Y, et al. Interaction between the circadian clock and chronic stress[J]. Biomed Environ Sci, 2018, 31(9): 686-699. |
| [16] |
DICK A, PROVENCAL N. Central neuroepigenetic regulation of the hypothalamic-pituitary-adrenal axis[J]. Prog Mol Biol Transl Sci, 2018, 158: 105-127. |
| [17] |
ULLAH R, BATOOL A, WAZIR M, et al. Gonadotropin inhibitory hormone and RF9 stimulate hypothalamic-pituitary-adrenal axis in adult male rhesus monkeys[J]. Neuropeptides, 2017, 66: 1-7. DOI:10.1016/j.npep.2017.07.005 |
| [18] |
TSUTSUI K, UBUKA T. How to contribute to the progress of neuroendocrinology: discovery of GnIH and progress of GnIH research[J]. Front Endocrinol, 2018, 9: 662. DOI:10.3389/fendo.2018.00662 |
| [19] |
顾天天, 田勇, 周玮, 等. 上笼应激对绍兴鸭十二指肠组织结构、抗氧化能力及基因mRNA表达量的影响[J]. 浙江大学学报: 农业与生命科学版, 2020, 46(2): 234-242. GU T T, TIAN Y, ZHOU W, et al. Effects of caged stress on the duodenal tissue structure, antioxidant capacity and gene mRNA expression level of Shaoxing duck[J]. Journal of Zhejiang University: Agriculture & Life Sciences, 2020, 46(2): 234-242. (in Chinese) |
| [20] |
ZHANG Q, CHANG X H, WANG X X, et al. A metabolomic-based study on disturbance of bile acids metabolism induced by intratracheal instillation of nickel oxide nanoparticles in rats[J]. Toxicol Res, 2021, 10(3): 579-591. DOI:10.1093/toxres/tfab039 |
| [21] |
尹畅, 吴维达, 曹爱智, 等. 外源性胆汁酸对畜禽抗热应激作用研究进展[J]. 动物营养学报, 2021, 33(6): 3081-3090. YIN C, WU W D, CAO A Z, et al. Research progress on effects of exogenous bile acids on heat stress in livestock and poultry[J]. Chinese Journal of Animal Nutrition, 2021, 33(6): 3081-3090. (in Chinese) |
| [22] |
李森, 贾子衡, 魏雪睿, 等. 胆汁酸的代谢稳态调控作用综述[J]. 上海交通大学学报: 医学版, 2020, 40(8): 1126-1130. LI S, JIA Z H, WEI X R, et al. Role of bile acid on maintaining metabolic homeostasis[J]. Journal of Shanghai Jiaotong University: Medical Science, 2020, 40(8): 1126-1130. (in Chinese) |
| [23] |
RINGSEIS R, GESSNER D K, EDER K. The gut-liver axis in the control of energy metabolism and food intake in animals[J]. Annu Rev Anim Biosci, 2020, 8: 295-319. DOI:10.1146/annurev-animal-021419-083852 |
| [24] |
CHÁVEZ-TALAVERA O, TAILLEUX A, LEFEBVRE P, et al. Bile acid control of metabolism and inflammation in obesity, type 2 diabetes, dyslipidemia, and nonalcoholic fatty liver disease[J]. Gastroenterology, 2017, 152(7): 1679-1694. DOI:10.1053/j.gastro.2017.01.055 |
| [25] |
CHIANG JY L, FERRELL J M. Bile acid receptors FXR and TGR5 signaling in fatty liver diseases and therapy[J]. Am J Physiol Gastrointest Liver Physiol, 2020, 318(3): G554-G573. DOI:10.1152/ajpgi.00223.2019 |
| [26] |
SAYIN S I, WAHLSTROM A, FELIN J, et al. Gut microbiota regulates bile acid metabolism by reducing the levels of tauro-beta-muricholic acid, a naturally occurring FXR antagonist[J]. Cell Metab, 2013, 17(2): 225-235. DOI:10.1016/j.cmet.2013.01.003 |
| [27] |
刘哲睿, 贾晓东, 陆荫英. 肝细胞癌相关胆汁酸代谢失衡及调控机制的研究进展[J]. 临床肝胆病杂志, 2021, 37(3): 690-694. LIU Z R, JIA X D, LU Y Y. Research advances in hepatocellular carcinoma -related imbalance of bile acid metabolism and related regulatory mechanism[J]. Journal of Clinical Hepatology, 2021, 37(3): 690-694. (in Chinese) |
| [28] |
XIE G X, WANG X N, HUANG F J, et al. Dysregulated hepatic bile acids collaboratively promote liver carcinogenesis[J]. Int J Cancer, 2016, 139(8): 1764-1775. DOI:10.1002/ijc.30219 |
| [29] |
GAO L, LV G, LI R, et al. Glycochenodeoxycholate promotes hepatocellular carcinoma invasion and migration by AMPK/mTOR dependent autophagy activation[J]. Cancer Lett, 2019, 454: 215-223. DOI:10.1016/j.canlet.2019.04.009 |
| [30] |
杜雪儿, 王菁, 姚军虎, 等. 胆汁酸肠肝循环转运蛋白及FXR对其的调控机制[J]. 畜牧兽医学报, 2021, 52(10): 2721-2739. DU X E, WANG J, YAO J F, et al. Bile acid enterohepatic circulation transporter and its regulatory mechanism by FXR[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(10): 2721-2739. (in Chinese) |
| [31] |
马会芳, 魏芳, 董绪燕, 等. 基于衍生化技术的甘油磷脂分析方法研究进展[J]. 分析测试学报, 2018, 37(11): 1396-1404. MA H F, WEI F, DONG X Y, et al. Progress in analysis methods of glycerophospholipid based on chemical derivatization[J]. Journal of Instrumental Analysis, 2018, 37(11): 1396-1404. (in Chinese) |
| [32] |
MAKIDE K, UWAMIZU A, SHINJO Y, et al. Novel lysophosphoplipid receptors: their structure and function[J]. J Lipid Res, 2014, 55(10): 1986-1995. |
| [33] |
VAN MEER G, VOELKER D R, FEIGENSON G W. Membrane lipids: where they are and how they behave[J]. Nat Rev Mol Cell Biol, 2008, 9(2): 112-124. |
| [34] |
FAROOQUI A A, HORROCKS L A, FAROOQUI T. Interactions between neural membrane glycerophospholipid and sphingolipid mediators: A recipe for neural cell survival or suicide[J]. J Neurosci Res, 2007, 85(9): 1834-1850. |
| [35] |
WU C J, ZHANG J L, ZHU G X, et al. CgHog1-mediated CgRds2 phosphorylation alters glycerophospholipid composition to coordinate osmotic stress in Candida glabrata[J]. Appl Environ Microbiol, 2019, 85(6): e02822-18. |
| [36] |
YUAN Z W, YANG L H, ZHANG X S, et al. Mechanism of Huang-lian-Jie-du decoction and its effective fraction in alleviating acute ulcerative colitis in mice: regulating arachidonic acid metabolism and glycerophospholipid metabolism[J]. J Ethnopharmacol, 2020, 259: 112872. |
| [37] |
WEN C Y, LI F N, ZHANG L Y, et al. Taurine is involved in energy metabolism in muscles, adipose tissue, and the liver[J]. Mol Nutr Food Res, 2019, 63(2): 1800536. |
| [38] |
HAIDARI F, ASADI M, MOHAMMADI-ASL J, et al. Evaluation of the effect of oral taurine supplementation on fasting levels of fibroblast growth factors, β-Klotho co-receptor, some biochemical indices and body composition in obese women on a weight-loss diet: a study protocol for a double-blind, randomized controlled trial[J]. Trials, 2019, 20(1): 315. |
| [39] |
MURAKAMI S. Role of taurine in the pathogenesis of obesity[J]. Mol Nutr Food Res, 2015, 59(7): 1353-1363. |
| [40] |
张金秋, 马子力, 韩立秋, 等. 牛磺酸对不同饲养方式蛋鸡肾脏功能、抗氧化能力和细胞因子水平的影响[J]. 天津农学院学报, 2014, 21(1): 9-14. ZHANG J Q, MA Z L, HAN L Q, et al. Influence of dietary taurine on renal functions, anti-oxidation activity and cytokines level in laying hens with different rearing patterns[J]. Journal of Tianjin Agricultural University, 2014, 21(1): 9-14. (in Chinese) |
| [41] |
吕秋凤, 董公麟, 曹双, 等. 牛磺酸抗应激作用的研究进展[J]. 中国畜牧杂志, 2014, 50(21): 78-81. LÜ Q F, DONG G L, CAO S, et al. Research progress on taurine anti-stress[J]. Chinese Journal of Animal Science, 2014, 50(21): 78-81. (in Chinese) |
| [42] |
CHEN W, GUO J X, CHANG P. The effect of taurine on cholesterol metabolism[J]. Mol Nutr Food Res, 2012, 56(5): 681-690. |
| [43] |
CHEN G, NAN C, TIAN J, et al. Protective effects of taurine against oxidative stress in the heart of MsrA knockout mice[J]. J Cell Biochem, 2012, 113(11): 3559-3566. |
| [44] |
刘事奇, 胡睿智, 李岩利, 等. 牛磺酸维护肠道健康的潜在作用机理及其在畜禽生产中的应用[J]. 动物营养学报, 2019, 31(11): 5003-5011. LIU S Q, HU R Z, LI Y L, et al. Taurine: Potential mechanisms in maintaining intestinal health and application in livestock and poultry production[J]. Chinese Journal of Animal Nutrition, 2019, 31(11): 5003-5011. (in Chinese) |
| [45] |
杨小然, 王安, 郭志杰. 牛磺酸对笼养蛋雏鸭生长性能、抗氧化功能及免疫器官发育的影响[J]. 动物营养学报, 2011, 23(5): 807-812. YANG X R, WANG A, GUO Z J. Effects of taurine on growth performance, antioxidant function and immune organ development of caged egg-type ducklings[J]. Chinese Journal of Animal Nutrition, 2011, 23(5): 807-812. (in Chinese) |
| [46] |
卢宇, 贾雪波, 张金秋, 等. 牛磺酸对急性热应激蛋鸡输卵管损伤的保护作用[J]. 江苏农业学报, 2011, 27(4): 807-812. LU Y, JIA X B, ZHANG J Q, et al. Protection of layer oviduct under acute heat stress by taurine[J]. Jiangsu Journal of Agricultural Sciences, 2011, 27(4): 807-812. (in Chinese) |
(编辑 范子娟)



