2. 湖南农业大学动物科学技术学院, 长沙 410128;
3. 长沙绿叶生物科技有限公司, 长沙 410100;
4. 湖南省畜禽安全生产协同创新中心, 长沙 410128
2. College of Animal Science and Technology, Hunan Agricultural University, Changsha 410128, China;
3. Changsha Lüye Biotechnology Co., Ltd., Changsha 410100, China;
4. Hunan Collaborative Innovation Center of Animal Production Safety, Changsha 410128, China
“生殖应激”是由文利新、袁慧等在2003年首次提出的区别于“应激”的原创理论假说[1],是指人类和动物的生殖过程如发情、妊娠、分娩和哺乳等特殊生殖生理活动的全身非特异性适应性反应。生殖应激是一个持续、长期的过程,其必然导致机体一系列神经内分泌改变,从而引起母体营养代谢改变、免疫力减弱、生殖功能障碍以及并发多种疾病的临床征候群,称为“生殖应激综合征”[2]。生殖应激及其学说[2]的指导意义普遍适用于母猪[3]和奶牛[4]等动物的生殖应激及其综合征的防控。羊作为世界上最重要的家畜之一,是多个国家(如澳大利亚、法国等)的重要肉品来源和经济支柱。随着人们对羊肉和羊毛的消费日益增长,我国已成为全球山羊和绵羊饲养量、出栏量以及羊肉产量最高的国家,羊的养殖也成为我国北方草原牧区省份乡村振兴的支柱产业。但在生产临床上,除烈性传染性疾病给养殖业带来的损失,羊的非传染性疾病(生殖应激综合征)给养殖业带来的损失同样不可小觑。本文根据生殖应激理论学说,定义了“母羊生殖应激”和“母羊生殖应激综合征”,阐释了其生理机制、发病机理以及临床表现,旨在为母羊生殖相关重大疾病(如羊妊娠毒血症)的发病机制提供新的诠释,为其临床防治提供新的理论指导。
1 母羊生殖应激概念及其生理机制母羊在完成生殖活动时引起的下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis,HPAA)和交感-肾上腺髓质系统(sympathetico-adrenomedullary system,SAS)激活等类似于“经典应激”的全身非特异性适应性反应,称为母羊生殖应激。母羊生殖应激主要包括3个部分:母羊主动生殖应激、母羊被动生殖应激和胎羊宫内应激。
1.1 母羊主动生殖应激“母羊主动生殖应激”是指由发情、妊娠、分娩、哺乳等生殖活动作为应激源,激活母羊HPAA和SAS等应激反应(图 1)。在生殖生理状态下,母羊的体内激素水平变化与常规应激状态时期高度一致。在发情期和妊娠期,母羊HPAA激活,促肾上腺皮质激素释放激素(corticotropin-releasing hormone, CRH)、促肾上腺皮质激素(adrenocorticotropic hormone, CACTH)、皮质醇激素均显著升高[5-6];分娩时的剧烈疼痛引起肾上腺素(epinephrine, E)、去甲肾上腺素(norepinephrine, NE)、内啡肽(endorphin)和精氨酸加压素(arginine vasopressin, AVP)等交感-肾上腺髓质系统相关激素分泌增加[7]。通常而言,在正常生理状态下,ACTH的分泌受循环游离皮质醇的负反馈调节,而在妊娠期间,ACTH-皮质醇的反馈轴重置,ACTH的分泌对于皮质醇的反馈抑制敏感性降低[8-9],此外,妊娠期母体的盐皮质激素受体(MR)对HPAA反馈抑制作用的减弱,也进一步刺激了HPAA的激活[10]。因此,妊娠期母体循环中的CRH、ACTH与皮质醇浓度长期维持较高水平,妊娠期母羊皮质醇激素更是长期维持在非妊娠时期的2倍左右[8]。妊娠期母体适当浓度的皮质醇对母体和胎羊来说都是必需的。在妊娠后期的胎羊肾上腺开始分泌皮质醇之前,胎羊体内所需的皮质醇98%由母体肾上腺分泌,并对胎羊的发育和成熟至关重要,高皮质醇血症或低皮质醇血症均可引起胎羊的发育延迟、早熟、死胎或产后夭折[8, 11]。此外,母羊游离皮质醇在适当范围内的升高,可促进胎盘对葡萄糖的吸收和利用,在子宫胎盘组织内通过糖酵解生成乳酸,供子宫和胎羊利用[12]。另一方面,有研究发现,在妊娠后期,母绵羊的肾上腺皮质细胞对CRH和AVP的敏感性降低,一定程度上稳定了ACTH的分泌水平和HPAA的激活程度,降低母羊对外界刺激的过度反应[13]。而在哺乳期间,母绵羊可降低因应激引起的血浆ACTH和皮质醇浓度增加[14],其次有研究证明,泌乳中期和绝情或断奶后绵羊的基础血浆ACTH和皮质醇浓度没有差异[15],表明此阶段母体仍稳定着ACTH的分泌水平和HPAA的激活。由此可见,母羊适当的主动生殖应激对于顺利完成生殖活动具有重要意义。
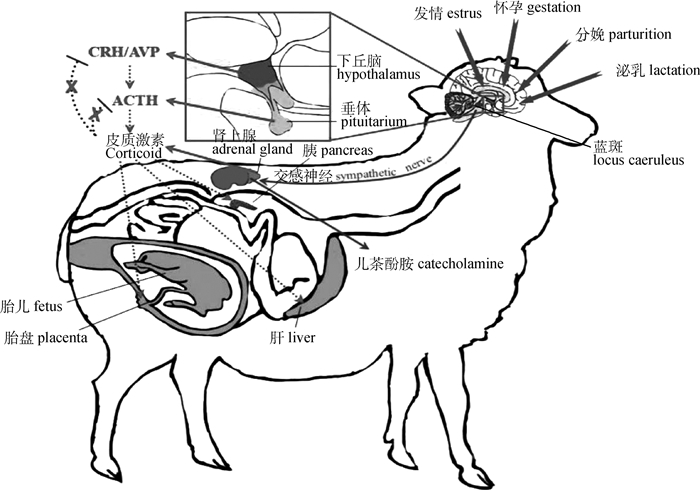
|
发情、怀孕、分娩和哺乳等生殖活动激活母羊的HPAA、SAS和其他应激反应。CRH.促肾上腺皮质激素释放激素;AVP.精氨酸加压素;ACTH.促肾上腺皮质激素 The activation of the ewe's HPAA, SAS, and other stress responses by reproductive activities such as estrus, pregnancy, parturition, and lactation. CRH. Corticotropin-releasing hormone; AVP. Arginine vasopressin; ACTH. Adrenocorticotropic hormone 图 1 母羊主动生殖应激的机制 Fig. 1 Mechanism of ewe's active reproductive stress |
胎羊在子宫内受到子宫壁压力增加,羊水质量改变,母源或胎盘分泌的CRH和皮质醇进入胎羊体内,以及母羊负性行为等引起胎羊产生的应激,称为“胎羊宫内应激”(图 2)。如前文所说,在胎羊的生长发育过程中,皮质醇是胎羊在出生前各器官,包括肺、脑、肝、肠、肾和肾上腺等发育成熟的必需物质[16]。在妊娠120 d前,由于自身分泌功能不全,胎羊所需的皮质醇绝大部分来自于母体[17]。随着妊娠的进程不断发展,胎羊的HPAA功能也逐渐发育成熟,胎羊HPAA功能的激活是妊娠后期胎羊发育的重要机制[18]。据大量研究报道,胎羊的HPAA,包括下丘脑、垂体和肾上腺功能基本在妊娠125 d左右全部发育成熟并开始工作,并且各激素水平在妊娠的最后2~3 d达到峰值[17, 19-21]。胎羊的SAS同样在妊娠125 d左右才被激活,开始分泌E和NE等儿茶酚胺,临近分娩时达到峰值[22]。HPAA和SAS的发育成熟,标志着胎羊对应激作出反应的功能系统被正式建立。对于不断成长的胎羊来说,在子宫内生长发育所需的空间不断增大,氧气需求不断增加,营养需要量也不断增长,而母羊则越来越难以满足其需求,此时的宫内环境逐渐变成了胎羊的应激源,能激活胎羊的HPAA和SAS,引起胎羊宫内应激。

|
应激来自子宫壁压力的增加、羊水质量的变化、母源或胎盘分泌的CRH和皮质醇进入胎羊体内以及母羊的负性行为。HPAA.下丘脑-垂体-肾上腺轴;SAS.交感-肾系统;CRH.促肾上腺皮质激素释放激素;ACTH.促肾上腺皮质激素;AVP.精氨酸加压素 Stress comes from the increased uterine wall pressure, changes in the quality of amniotic fluid, secretions of CRH and cortisol by the mother or placenta entering the fetus, and negative behaviors of ewes. HPAA. Hypothalamus-pituitary-adrenal axis; SAS. Sympathoadrenal system; CRH. Corticotropin-releasing hormone; ACTH. Adrenocorticotropic hormone; AVP. Arginine vasopressin 图 2 胎儿宫内应激的机制 Fig. 2 Mechanism of fetal intrauterine stress |
研究显示,在妊娠后期胎羊宫内应激状态下,胎羊下丘脑室旁核(paraventricular nucleus of hypothalamus, PVN)中CRH和AVP mRNA的表达增加,大量分泌的CRH和AVP在协同作用下,促进ACTH的前体POMC mRNA在垂体前叶中的表达,激活了垂体中ACTH的分泌[20, 23-24]。ACTH的分泌刺激了胎羊肾上腺的成熟,诱发肾上腺皮质细胞的增殖和大量分泌皮质醇激素[16]。胎羊因宫内应激分泌的皮质醇能够作用于胎盘,促使后者分泌前列腺素(PG)E2和雌二醇,其中PGE2和雌二醇不仅能再度刺激HPAA的激活[19, 25],且前者能促进子宫肌层的收缩,诱发分娩反应[24, 26]。与此同时,胎羊HPAA的激活还使下丘脑室旁核大量分泌后叶催产素,通过级联信号促进分娩时子宫肌层的收缩力[24]。在常规应激的生理机制中,当肾上腺分泌的皮质醇激增时,会负反馈作用于下丘脑和垂体,抑制CRH和ACTH的过度分泌。但在胎羊宫内应激中,这一负反馈调节作用的效率降低,CRH、ACTH和皮质醇三者在产前均升高[23]。这可能是由于皮质醇促进了肝的成熟,肝中的CRH结合球蛋白(CBG)表达升高并与皮质醇结合,从而降低了游离皮质醇的水平[19]。此外,出生对于胎羊来说也是一个严重的应激,胎羊宫内应激大量分泌的皮质醇激素,可以促进胎羊的器官成熟并成功适应产后的新环境[21]。
生殖应激学说提出:胎羊宫内应激是母羊正常发动分娩的原始动因。消减胎羊宫内应激,阻断其HPAA的激活,必然会引起分娩发动障碍,已有研究证实,将胎羊的下丘脑、垂体或肾上腺切除[19, 26],或阻断垂体与下丘脑的联系[27],或对胎羊使用CRH受体拮抗剂[21],抑制了胎羊的HPAA功能,阻断了胎羊宫内应激,均造成了母羊的延期流产。反之如果在妊娠后期对胎羊进行ACTH或糖皮质激素宫内给药,则会引起母羊的早产[19, 26]。以上研究从正面和侧面证实了生殖应激参与了母羊的正常分娩启动。
1.3 母羊被动生殖应激胎羊的下丘脑、垂体和肾上腺分泌的CRH、ACTH和皮质醇,或由胎盘、蜕膜和胎膜组织分泌的CRH和类固醇激素直接进入母羊循环系统,其不同于母羊的普通应激所激活的HPAA而产生的应激反应,这种特殊应激称为“母羊被动生殖应激”(图 3)。有研究报道,妊娠后期胎羊的宫内缺氧导致的宫内应激反应,诱导胎羊肾上腺分泌糖皮质激素增加,而持续高水平的糖皮质激素作用于胎盘组织,促使胎盘合成并分泌大量的CRH进入胎羊和母体的血液循环[26]。另有一系列通过人类模型开展的研究也发现,妊娠前期由胎盘、蜕膜、胎膜分泌的CRH大量进入母体血液,而母体循环中的CRH结合蛋白(CRHbp)对游离的CRH结合能力有限,致使母体循环中的CRH显著上升,并作用于垂体等靶器官[21, 28-30]。如前文所述,在母羊的妊娠晚期,尤其是在妊娠第120天以后,胎羊的下丘脑、垂体和肾上腺组织已发育成熟,且胎羊在宫内应激状态下,HPAA相关激素CRH、ACTH和皮质醇激素的分泌激增,这些激素除了作用于胎羊自身HPAA和供胎羊器官发育所需以外,还可通过子宫胎盘屏障进入母羊血液循环,作用于母羊的HPAA或其他靶器官,激活母羊的被动生殖应激反应。母羊的被动生殖应激与主动生殖应激互相协同促进,致使母羊在妊娠期间的HPAA功能持续地处于激活状态,发挥其生理作用。
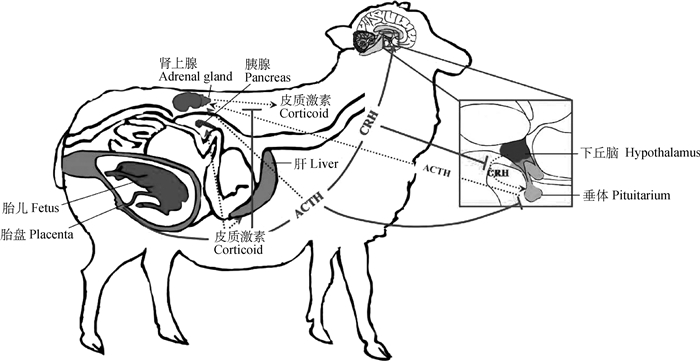
|
由胎羊下丘脑、垂体和肾上腺分泌的CRH、ACTH和皮质醇,或由胎盘、蜕膜和胎膜组织分泌的CRH和类固醇激素,进入母羊的循环系统,作用于各靶器官,同时反馈抑制母体自身的HPAA诱导的应激反应。CRH. 促肾上腺皮质激素释放激素;ACTH. 促肾上腺皮质激素 CRH, ACTH, and cortisol secreted by the hypothalamus, pituitary, and adrenal gland of the fetus, or CRH and steroid hormones secreted by the placenta, decidua, and fetal membrane tissue, enter the ewe's circulation system to act directly on target organs and simultaneously inhibit the maternal HPAA activation. CRH. Corticotropin-releasing hormone; ACTH. Adrenocorticotropic hormone 图 3 母羊被动生殖应激的机制 Fig. 3 Mechanism of ewe's passive reproductive stress |
母羊在正常的生殖生理状态下,适当的生殖应激有益于受精、着床、胎羊发育、分娩发动以及泌乳,但在围孕期、妊娠期、围产期、哺乳期等生殖生理过程中,由于环境恶劣、营养供给不足、多胎、胎羊体型过大等原因,可引起母体和胎羊过度的生殖应激,从而引起代谢紊乱、免疫功能损害、生殖障碍,胎羊或羔羊发育受阻等临床表现,定义为“母羊生殖应激综合征”。
2.1 母羊代谢紊乱和妊娠毒血症生殖应激学说提出了“在营养供给不足或生殖任务加重时(如双胞胎),母体会动员机体贮备优先保证胎儿和繁殖所需,导致机体负氮平衡从而加重生殖应激(甚至付出生命)”的理论观点。母羊在妊娠期间对营养物质的需求发生了巨大的改变,因此物质和能量在其体内的代谢途径也大为不同。一般情况下,反刍动物体内约50%的葡萄糖来自于瘤胃微生物的发酵产物丙酸通过糖异生而产生。妊娠期间,由于胎羊的生长发育所需,母羊对营养物质的需求大量增加,在营养物质的利用方面,母羊也会调动全身激素信号,优先将能量和蛋白质等营养物质提供给胎羊。因此,不难理解,为什么尽管生殖应激状态下的母羊糖代谢相关激素与常规应激状态时相一致,即胰高血糖素、儿茶酚胺、生长激素分泌升高[31-33]、胰岛素分泌降低且伴随胰岛素抵抗[34-36],但仍然普遍出现低糖血症[37]。其中的机理是由于胎羊不能利用母体循环中的脂肪酸作为能量来源,因此,胎羊作为应激源,母体糖原分解及糖异生而来的葡萄糖被大量地运往胎盘供胎羊利用,而不是留在母体循环系统中供能或合成糖原被储存[38-39]。
当母羊采食量严重下降,瘤胃中的菌群被破坏,挥发性脂肪酸的含量降低,外源性的糖异生底物缺乏导致机体血糖降低和能量供给受限而造成的负能平衡(NEB),对母羊来说是一种附加的应激源,会加重母羊的生殖应激,此时机体必须通过动员脂肪、同时加强有机酸和氨基酸的利用来为自身及胎羊提供能量[40-41]。脂肪的动员可产生大量的甘油和游离脂肪酸(NEFA),前者可通过肝脏糖异生途径生成葡萄糖,但NEFA必须在肝脏中通过β氧化生成乙酰CoA,再进入三羧酸循环代谢或者转化为酮体,运往肝外组织作为能源物质被利用[41]。但在妊娠后期,母羊对酮体的利用能力下降,过度的脂肪动员会造成体内NEFA和酮体蓄积过多,高水平的酮体还会抑制糖的生成,进一步刺激脂肪的动员、产生更多的NEFA和酮体[42]。大量的NEFA在肝内被重新合成三酰甘油,使母羊逐渐发展为高脂血症和脂肪肝[43],而循环中酮体的严重升高,最终会发展为高酮血症甚至妊娠毒血症[37, 44]。在母羊营养不良和高酮血症的病理状态下,还会再度反馈刺激母体皮质醇的生物合成[26, 45],进一步激活其HPAA,加重生殖应激反应,形成恶性循环。与此同时,过度生殖应激引起的妊娠毒血症[46]和肝脂肪浸润[47]还能损害维生素D在肝中的转化,进而影响机体肠道对钙的吸收,引起母体的低钙血症,且血浆中钙含量和酮体的含量成反比,即母畜的低钙血症随着生殖应激的发展而加重[48],母羊生殖应激引起的代谢紊乱机制见图 4。
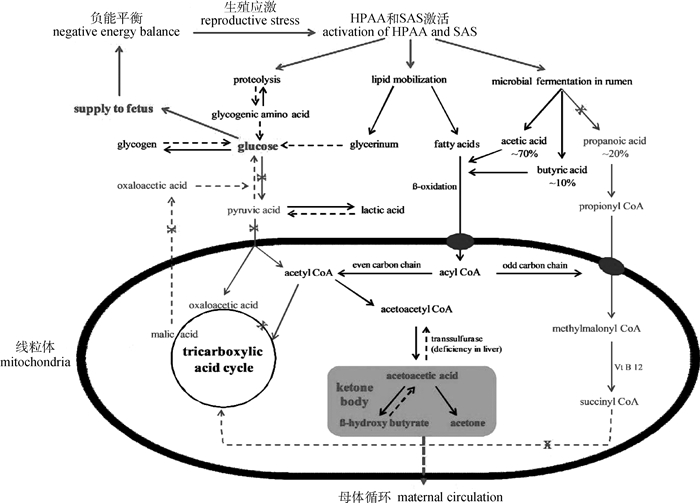
|
生殖应激通过激活HPAA和SAS改变碳水化合物、蛋白质和脂质代谢,最终加速酮体生成进入母体循环。HPAA.下丘脑-垂体-肾上腺轴;SAS.交感-肾系统 Reproductive stress changes carbohydrate, protein, and lipid metabolism via activating HPAA and SAS, ultimately accelerating ketone-body produce into the maternal circulation. HPAA. Hypothalamus-pituitary-adrenal axis; SAS. Sympathoadrenal system 图 4 生殖应激诱发母羊代谢紊乱的机制 Fig. 4 Mechanism of ewe's metabolic disorders induced by reproductive stress |
中国北方冬季绵羊妊娠毒血症和南方山羊双羔妊娠毒血症其发病机理:北方自然放牧条件下,母羊怀孕,因冬季草料枯黄,营养供给绝对不足,或怀双羔、营养供给相对不足,妊娠中后期胎儿迅速发育,需要大量营养物质,母羊为了后代动员自己的体脂、体蛋白等营养物质优先保证胎儿和繁殖所需,导致机体负氮平衡和代谢紊乱,从而出现高酮血症、高脂血症、低血钙、低血糖以及骨软症、脂肪肝等“两高两低”为主的病理特征。临床上主要表现:病羊体态瘦弱,反应迟钝,精神萎靡,食欲减退或废绝,反刍停止,流产,步态异常,产后瘫痪等[49]。临床上,生殖应激引起的母羊代谢紊乱和妊娠毒血症在多胎妊娠母羊中高发。这是由于多胎妊娠因胎羊数的增多造成母羊被动生殖应激的加重,同时因胎儿数的增加,子宫胎盘组织对营养的需求以及泌乳需求也成倍数增加[50],母羊饲粮供应跟不上就会造成主动生殖应激加重,随之代谢紊乱和妊娠毒血症的发病也会更严重,且这一现象随着子宫内胎羊数量越多而越发明显[39, 44, 47, 51],因此,母羊的妊娠毒血症在生产中常被称为“双羔症”。此外,代谢紊乱和毒血症在冬季和早春季节高发。由于冬季和早春的新鲜牧草不足,对于主要依赖于放牧的羊群,如果额外的饲粮补充不及时,妊娠母羊将出现严重的NEB [52];另一方面,低温环境对于母羊来说也是一个应激源[53],两个因素同时作用于妊娠母羊或哺乳母羊,引发严重的生殖应激,促成代谢紊乱和毒血症。
2.2 母羊免疫功能损害母羊在妊娠期间的生殖应激状态下,为保证胎羊的营养所需,体内的营养策略是优先供应给胎羊,必将会减少其对免疫系统的投入,影响免疫系统的功能发挥,并且免疫反应能力会随着妊娠的发展而逐渐降低,这与生殖应激引起的激素变化密切相关[54]。
严重的生殖应激引起的母体高浓度糖皮质激素,已被证明具有广泛的免疫抑制作用[55]。糖皮质激素能抑制所有免疫细胞的成熟、分化和增殖,并能诱导成熟的T细胞和B细胞凋亡,抑制IL-1的转录、翻译和分泌,减少循环淋巴细胞、嗜酸性粒细胞、嗜碱性粒细胞、巨噬细胞和单核细胞数量等[56-58]。Hefnawy等[45]在绵羊试验中发现,双胎妊娠母羊在妊娠晚期限饲引起强烈的生殖应激,循环皮质醇升高的同时,血浆中的免疫球蛋白IgA、IgM和IgG显著下降,严重影响母羊的体液免疫功能。除了糖皮质激素,妊娠期间高水平的孕酮也对机体的天然免疫反应系统有一定的影响。母体内孕酮随妊娠的发展而逐渐升高,减弱巨噬细胞和自然杀伤细胞(NK)的细胞活性以及NF-κB的信号转导;降低调节性T细胞活性,抑制抗体的产生;影响辅助性T淋巴细胞(Th)的平衡,抑制Th1型细胞因子并促进Th2型细胞因子的产生,形成Th2型偏倚。这些变化虽然有助于妊娠的维持,但同时也增加了母体对疾病的易感性[59]。此外,有研究证明了母绵羊在产后体液免疫的反应性也降低,血浆炎症细胞因子如IL-6、IL-1、和IL-10在分娩至分娩后2周显著下降[60]。临床上过度的生殖应激会导致母羊在围产期容易出现各种感染性疾病,如乳房炎、产后热、阴道炎症、子宫炎、子宫内膜炎及其他细菌或病毒性疾病等。
2.3 母羊生殖障碍母羊自妊娠晚期至哺乳期,经历了胎羊的快速增长、分娩、泌乳和哺乳等一系列能引起强烈生殖应激的生理活动,容易引发严重的NEB和代谢紊乱。在反刍动物的发情周期里,促黄体生成素(luteinizing hormone, LH)和胰岛素或胰岛素样生长因子-1(insulin-like growth factor-1, IGF-1)的协同作用是卵泡的发育机制之一,而NEB会导致垂体分泌LH减少、胰腺分泌胰岛素降低以及肝合成IGF-1降低,从而影响卵泡的功能和雌二醇的分泌,最终导致母畜的卵巢功能低下、产后乏情、返情率高等表现[61-62]。另有研究报道,母羊在黄体期短期严重的营养不良则会引起LH和孕酮的激增,从而延长发情周期并影响卵巢的排卵[63]。此外,过度的生殖应激会分泌大量的CRH,据Ciechanowska等报道,卵泡期母羊高水平的CRH抑制下丘脑视前区GnRH mRNA和垂体前叶GnRHR mRNA的表达,从而降低GnRH和LH的分泌,影响发情和正常排卵[64]。母羊生殖应激引起的生殖障碍,在临床上主要表现为持久黄体、发情周期延长、产后乏情、返情率高、流产,以及前文所述的因母羊免疫力低下而罹患的子宫炎、子宫内膜炎、乳房炎等疾病阻碍母羊的产后泌乳、发情以及配种。因此可推断,任何能加重生殖应激的因素,如环境刺激、营养不良、多胎妊娠等均会加重母羊的生殖障碍,影响母羊的生产繁殖。
2.4 胎羊或羔羊发育受阻胎羊在子宫内受到过度的宫内应激同样对胎羊和母体造成损害。研究表明,生理状态下的胎羊宫内应激引起SAS激活,能促进E和NE的分泌增加,帮助胎羊在妊娠后期适应子宫内的低氧环境,但长期的E和NE过度升高,则会引起胎羊的组织发育迟缓[65-67]。Rakers等[68]研究发现妊娠早期母体的过度应激产生的大量皮质醇通过胎盘屏障进入胎羊循环,造成胎羊在妊娠晚期对的HPAA活性增强,肾上腺皮质醇的生物合成增加;且长期过高的母体游离皮质醇还会导致胎盘生成和分泌进入胎羊的乳酸过多,严重影响胎羊的生长和宫内福利[12],降低胎羊的初生重[54],影响胎羊出生后的存活率,还可引起胎羊和新生羔羊心脏中的氨基酸、脂质和TCA循环代谢紊乱,增加羔羊罹患心肌疾病的风险[69]。母羊、胎盘分泌的CRH和ACTH同样也能进入胎羊体内,激活胎羊的HPAA,使胎羊过早或过度暴露于糖皮质激素,最终引起胎羊的器官发育紊乱[16, 21]。此外,母羊在妊娠期间营养不良会导致胎羊的营养供给不足,加重生殖应激,通过影响胎羊葡萄糖-胰岛素-IGF轴,胎羊血糖、胰岛素、IGF-1的水平下降,引起胎羊生长受限[70];造成胎羊的胸腺发育受损,胸腺细胞的增殖降低,氧化应激和细胞凋亡增加[71];胎羊血浆IgA、IL-1β和IL-10的浓度以及淋巴细胞和单核细胞的数量降低[72],引发免疫功能障碍。围产期的母体营养不良会降低母乳质量,影响羔羊出生后的生长发育及免疫系统的建立[73]。临床上胎羊或羔羊受生殖应激的影响发育受阻的主要表现为早产或晚产、胎羊发育不良或宫内死亡、羔羊初生重偏低、羔羊存活率低、羔羊生长缓慢以及免疫力低下等。
3 母羊生殖应激综合征的防控原则在母羊的生殖活动期间,因饲粮等营养供给不足或怀双羔、甚至多羔引起的营养相对供给不足,高温应激、人为隔离、病原感染等危险因素下引起采食量下降,或低温胁迫引起的营养消耗增多等,均造成过度的母羊生殖应激从而引发生殖应激综合征,在临床上的主要表现为母羊的代谢紊乱、免疫功能失调、母羊生殖障碍、胎羊或羔羊发育受阻。临床上可据母羊生殖应激综合征的发病机理指导该病的综合防控。
3.1 营养策略母羊生殖应激综合征其主要病因是因妊娠中后期或哺乳期,由于严重的营养供给不足或双羔、多羔引起营养供给相对不足而导致的NEB和代谢紊乱以及并发症。根据发病机理可以制定其综合防控的精准营养原则:妊娠前期,安全均衡营养;妊娠中期,优质适度营养;妊娠后期,加强营养;哺乳期:充分营养。因此,生产上应根据母羊的生殖生理特点实施“精准营养、按需分配”,尤其应保证在妊娠期晚期(妊娠后1/3阶段)和哺乳期饲粮供应充足。生产实践和试验研究证实,在妊娠中期至晚期,及时地提高母羊的饲粮供应,能有效缓解其生殖应激引起的代谢紊乱,母羊的血浆NEFA、孕酮、雌二醇的水平随着母羊的采食量增加而降低,胰岛素和甲状腺激素(T3/T4)则随采食量的增加而升高[34]。在生产管理方面,对于围产期的双胞胎或者三胞胎母羊应给与特殊照顾,特别是在放牧区,除额外补充饲粮外,还应将多胎妊娠的母羊集中放牧在牧草更优质的区域[74],以确保更优质的营养供给。在牧草的质量上,新鲜牧草优于青贮草和干草,青贮草优于干草[75],但在主要依赖放牧的地区,在冬季新鲜牧草不足的情况下,充足的青贮草和干草供应以及适量的玉米和豆粕等精料补饲对母羊生殖应激综合征的预防具有重要价值。
除牧草以外,母羊在生殖期间对于一些营养元素,如多不饱和脂肪酸、氨基酸、维生素和微量元素等有特殊的需求,需额外补充。有研究证明,母羊在围产期膳食补多不饱和脂肪,如鱼油[76]、亚麻籽[60],能提升机体对炎症的反应性,改善机体的免疫性能;另有研究报道,在妊娠后期给母羊补充二十二碳六烯酸类(DHA)和二十碳五烯酸(EPA)能有效改善胎羊的初生重,并显著提高羔羊出生后的采食量和日增重[77]。妊娠期母羊日粮补充N-氨基甲酰谷氨酸和瘤胃保护L-精氨酸,能降低胎羊胸腺内氧化应激,改善胎羊胸腺发育和免疫功能[72],还能促进母体-胎盘-胎羊的氨基酸转移,促进胎羊的生长发育[78]。补充维生素E、维生素A和硒,能增加血液中性粒细胞对细菌的杀伤作用,且硒和维生素E的添加,能够通过增加硒依赖的谷胱甘肽过氧化物酶(GSH-Px)去除过氧化氢的活性,降低一氧化氮(NO)和ROM(活性氧代谢产物)的产生,降低氧化损伤,能有效预防乳房炎发生和降低线虫对肠道的影响[79]。
3.2 饲养管理羊是群居动物,妊娠期分群、栓绳、隔群、剪毛等行为均会刺激母羊的HPAA,造成生殖应激的加重[80],但让母羊在妊娠期保持适当的运动则可以有效预防酮血症的发生[81],还有助于胎羊对葡萄糖的吸收和利用,促进胎羊的生长[82]。另有研究显示,母羊在哺乳期,HPAA对应激的敏感性降低,并且胎羊的存在和哺乳行为都能进一步降低其敏感性[83],因此人为地强制提前断奶会刺激母羊的HPAA,加重生殖应激并产生相应的临床表现[14]。此外,在生殖应激的治疗方面,早期的研究发现药物的应用,如CRH拮抗剂等对母羊的生殖应激的治疗也具有一定的效果[64]。
妊娠期和哺乳期母羊本身就处于生殖应激状态,而恶劣的环境或不当的生产管理对母羊来说也是一种强烈的应激源[84]。长期的冷或热暴露,会叠加于生殖应激,影响母羊的HPAA功能[85]。Indu等[86]研究发现,持续热应激会通促性腺激素的降低,引起母羊卵巢卵泡发育抑制,影响母羊的发情行为和排卵率,母羊血清皮质醇水平升高,雌激素分泌降低,孕酮分泌升高,发情周期显著延长;另外,冬季极端的低温也会引起母羊的酮体升高和生产性能降低[53]。因此,对于围产期的母羊,在保证饲粮供给充分的同时,应做好夏季降温和冬季保暖的工作。夏季天气炎热时应防晒降温,保持良好的空气,特别是在干旱或高盐碱牧区,补充饲粮的同时保障母羊有充足的饮水也对其生殖性能具有积极作用[87]。在冬春季牧草不足的情况下,妊娠母羊,特别是多胎妊娠的母羊,更容易出现NEB,应该更加注意防寒保暖,减少应激的影响。这也提示了在品种选育以及配种的工作中,也无需刻意追求多胎品种或人工诱导多胎妊娠,不当的多胎妊娠会造成母羊严重的生殖应激,对母羊的生产性能和羔羊的存活及生长产生负面影响。
3.3 疫病防治在母羊的生产过程中做好疫病防控对保持羊生产规模的稳定和扩大具有重要意义。处于生殖应激状态的发情期和围产期母羊,过度的生殖应激会促进病原感染,造成母羊出现生殖障碍、流产、羔羊发病或死亡等。母羊的发情周期大致可分为卵泡期和黄体期。在卵泡期,雌二醇水平升高,孕酮水平下降至基础水平;在黄体期,水平反向变化。Álvarez等[88]研究发现,孕酮水平的增加或雌二醇水平的降低,会降低母羊对宫内衣原体感染的易感性,而该种致病原进入母羊机体后,若母羊未到妊娠阶段,该病常呈隐性经过,直到妊娠后期才会引起流产。因此,在发情前应进行严格的检验检疫,对于已患有传染病的母羊要及时淘汰,通过疫苗有效预防病原微生物引起的细菌性疾病、病毒性疾病流产。此外,在妊娠后期更应警防病原感染,胎羊因宫内应激分泌的皮质醇能够作用于胎盘,促使胎盘分泌雌二醇,其中,雌二醇不仅能刺激HPAA的激活,还能促进分娩,但此时雌二醇水平的增加也会促进衣原体的易感性。有研究表明绵羊妊娠晚期流产衣原体的复发与妊娠晚期发生的血清雌二醇/孕酮比值的显著生理变化相一致[89],所以,在时疫多发的季节,要格外加强羊圈的清洁和消毒工作,通过杀灭环境病原菌来减少妊娠母羊疾病的发生。另一方面,Beasley等[90]研究发现瘦素和皮质醇浓度与母羊的寄生虫负荷和免疫状态相关,低的血液皮质醇水平有助于Th1偏向性免疫反应,导致对胃肠道线虫的易感性增加。而母羊的妊娠期,适当的生殖应激可以促进HPAA相关激素CRH、ACTH和皮质醇激素的分泌增加,一定程度预防寄生虫的感染。但定期开展对羊群的全面驱虫工作,定期观察羊群的活动情况和排泄物状态,做好疾病诊断工作是降低寄生虫的感染率的重要方法。
总之,在临床上,母羊生殖应激综合征主要以预防为主,工作人员应通过综合管理的手段,保障饲粮充足,避免NEB;做好精准营养,避免特殊营养元素的缺乏;加强母羊的围产期护理,尤其对于多胎妊娠母羊应给与特殊照顾;在天气条件恶劣时,保证温度、湿度、空气质量以及光照强度的稳定;生产管理过程中避免对羊群的强烈惊吓、驱赶或人为隔离,避免过早断奶,防止病原微生物的感染等,尽量减缓母羊的生殖应激,保证其生殖活动的顺利进行。
4 小结与展望生殖应激理论对于对于母羊而言是一把“双刃剑”,适当的生殖应激是保证母羊顺利完成发情、妊娠和哺乳等生殖活动的生理基础,但过度的生殖应激却是影响母羊代谢、免疫以及生殖系统的危险因素。因此,在生产实践中,应根据母羊生殖应激理论的生理机制以及生殖应激综合征的发病机理,通过综合防控的手段,针对性地开展防控工作,预防母羊生殖应激综合征的发生和发展。尽管目前已有大量的研究佐证了生殖应激理论对母羊生殖具有重要意义,但该理论学说仍需要研究者们去不断地完善,未来的研究应全面扩宽论证生殖应激理论的普适性,并从分子层面和表观遗传角度探究生殖应激的分子机制及其表观遗传特性,为生殖应激学说的发展和生殖健康护理以及羊产业的健康发展提供更多的理论基础和试验支撑。
| [1] |
文利新, 袁慧, 蒋政云, 等. 135保健养猪技术及应用[C]//2003全国家畜内科学学术研讨会论文专辑. 长沙: 《湖南农业大学学报》编辑委员会, 2003: 166-168. WEN L X, YUAN H, JIANG Z Y, et al. 135 Health care pig raising technology and application[C]//Paper album of the 2003 National Symposium on Domestic Animal Medicine. Changsha: Editorial Committee of Journal of Hunan Agricultural University, 2003: 166-168. (in Chinese) |
| [2] |
WEN L X, LI R F, WANG J, et al. The reproductive stress hypothesis[J]. Reproduction, 2019, 158(6): R209-R218. DOI:10.1530/REP-18-0592 |
| [3] |
文利新, 袁慧, 谢岚. 母猪生殖应激及其综合征[J]. 中国兽医杂志, 2009, 45(1): 56-57. WEN L X, YUAN H, XIE L. Reproductive stress and its syndrome in sows[J]. Chinese Journal of Veterinary Medicine, 2009, 45(1): 56-57. DOI:10.3969/j.issn.0529-6005.2009.01.029 (in Chinese) |
| [4] |
文利新, 袁慧, 易金娥. 奶牛生殖应激综合征及其防治原则[J]. 中国奶牛, 2008(3): 28-30. WEN L X, YUAN H, YI J E. Reproducing stress syndrome in cows and its principle of prevention and treatment[J]. China Cows, 2008(3): 28-30. DOI:10.3969/j.issn.1004-4264.2008.03.011 (in Chinese) |
| [5] |
LINGIS M, RICHARDS E, PERRONE D, et al. Serotonergic effects on feeding, but not hypothalamus-pituitary-adrenal secretion, are altered in ovine pregnancy[J]. Am J Physiol Endocrinol Metab, 2012, 302(10): E1231-E1238. DOI:10.1152/ajpendo.00582.2011 |
| [6] |
KELLER-WOOD M, WOOD C E. Regulation of maternal ACTH in ovine pregnancy: does progesterone play a role?[J]. Am J Physiol Endocrinol Metab, 2008, 295(4): E913-E920. DOI:10.1152/ajpendo.90399.2008 |
| [7] |
HYDBRING E, MADEJ A, MACDONALD E, et al. Hormonal changes during parturition in heifers and goats are related to the phases and severity of labour[J]. J Endocrinol, 1999, 160(1): 75-85. DOI:10.1677/joe.0.1600075 |
| [8] |
KELLER-WOOD M. Evidence for reset of regulated cortisol in pregnancy: studies in adrenalectomized ewes[J]. Am J Physiol, 1998, 274(1): R145-R151. |
| [9] |
KELLER-WOOD M, WOOD C E. Pregnancy alters cortisol feedback inhibition of stimulated ACTH: studies in adrenalectomized ewes[J]. Am J Physiol Regul Integr Comp Physiol, 2001, 280(6): R1790-R1798. DOI:10.1152/ajpregu.2001.280.6.R1790 |
| [10] |
LINGIS M, RICHARDS E M, KELLER-WOOD M. Differential effects of mineralocorticoid blockade on the hypothalamo-pituitary-adrenal axis in pregnant and nonpregnant ewes[J]. Am J Physiol Endocrinol Metab, 2011, 300(3): E592-E599. DOI:10.1152/ajpendo.00560.2010 |
| [11] |
ANTOLIC A, WOOD C E, KELLER-WOOD M. Chronic maternal hypercortisolemia in late gestation alters fetal cardiac function at birth[J]. Am J Physiol Regul Integr Comp Physiol, 2018, 314(3): R342-R352. DOI:10.1152/ajpregu.00296.2017 |
| [12] |
VAUGHAN O R, DAVIES K L, WARD J W, et al. A physiological increase in maternal cortisol alters uteroplacental metabolism in the pregnant ewe[J]. J Physiol, 2016, 594(21): 6407-6418. DOI:10.1113/JP272301 |
| [13] |
YOUNG S F, ROSE J C. Attenuation of corticotropin-releasing hormone and arginine vasopressin responsiveness during late-gestation pregnancy in sheep[J]. Biol Reprod, 2002, 66(6): 1805-1812. DOI:10.1095/biolreprod66.6.1805 |
| [14] |
HASIEC M, TOMASZEWSKA-ZAREMBA D, MISZTAL T. Suckling and salsolinol attenuate responsiveness of the hypothalamic-pituitary-adrenal axis to stress: focus on catecholamines, corticotrophin-releasing hormone, adrenocorticotrophic hormone, cortisol and prolactin secretion in lactating sheep[J]. J Neuroendocrinol, 2014, 26(12): 844-852. DOI:10.1111/jne.12222 |
| [15] |
HASIEC M, HERMAN A P, MISZTAL T. Salsolinol: a potential modulator of the activity of the hypothalamic-pituitary-adrenal axis in nursing and postweaning sheep[J]. Domest Anim Endocrinol, 2015, 53: 26-34. DOI:10.1016/j.domaniend.2015.04.004 |
| [16] |
COULTER C L, ROSS J T, OWENS J A, et al. Role of pituitary POMC-peptides and insulin-like growth factor Ⅱ in the developmental biology of the adrenal gland[J]. Arch Physiol Biochem, 2002, 110(1-2): 99-105. DOI:10.1076/apab.110.1.99.894 |
| [17] |
RÉPÉRANT E N, DURAND P. The development of the ovine fetal adrenal gland and its regulation[J]. Reprod Nutr Dev, 1997, 37(1): 81-95. DOI:10.1051/rnd:19970109 |
| [18] |
COTTRELL E C, SECKL J R. Prenatal stress, glucocorticoids and the programming of adult disease[J]. Front Behav Neurosci, 2009, 3: 19. |
| [19] |
CHALLIS J R G, BROOKS A N. Maturation and activation of hypothalamic-pituitary adrenal function in fetal sheep[J]. Endocr Rev, 1989, 10(2): 182-204. DOI:10.1210/edrv-10-2-182 |
| [20] |
MYERS D A, MYERS T R, GROBER M S, et al. Levels of corticotropin-releasing hormone messenger ribonucleic acid (mRNA) in the hypothalamic paraventricular nucleus and proopiomelanocortin mRNA in the anterior pituitary during late gestation in fetal sheep[J]. Endocrinology, 1993, 132(5): 2109-2116. DOI:10.1210/endo.132.5.8386607 |
| [21] |
MASTORAKOS G, ILIAS I. Maternal and fetal hypothalamic-pituitary-adrenal axes during pregnancy and postpartum[J]. Ann N Y Acad Sci, 2003, 997(1): 136-149. DOI:10.1196/annals.1290.016 |
| [22] |
SPERLING M A, GANGULI S, LESLIE N, et al. Fetal-perinatal catecholamine secretion: role in perinatal glucose homeostasis[J]. Am J Physiol, 1984, 247(1): E69-E74. |
| [23] |
MATTHEWS S G, CHALLIS J R G. Regulation of the hypothalamo-pituitary-adrenocortical axis in fetal sheep[J]. Trends Endocrinol Metab, 1996, 7(7): 239-246. DOI:10.1016/S1043-2760(96)00126-9 |
| [24] |
CHALLIS J R G, MATTHEWS S G, GIBB W, et al. Endocrine and paracrine regulation of birth at term and preterm[J]. Endocr Rev, 2000, 21(5): 514-550. |
| [25] |
WOOD C E. Estrogen/hypothalamus-pituitary-adrenal axis interactions in the fetus: The interplay between placenta and fetal brain[J]. J Soc Gynecol Invest, 2005, 12(2): 67-76. DOI:10.1016/j.jsgi.2004.10.011 |
| [26] |
CHALLIS J R, SLOBODA D, MATTHEWS S G, et al. The fetal placental hypothalamic-pituitary-adrenal (HPA) axis, parturition and post natal health[J]. Mol Cell Endocrinol, 2001, 185(1-2): 135-144. DOI:10.1016/S0303-7207(01)00624-4 |
| [27] |
ANTOLOVICH G C, MCMILLEN I C, ROBINSON P M, et al. The effect of hypothalamo-pituitary disconnection on the functional and morphologic development of the pituitary-adrenal axis in the fetal sheep in the last third of gestation[J]. Neuroendocrinology, 1991, 54(3): 254-261. DOI:10.1159/000125883 |
| [28] |
GOLAND R S, WARDLAW S L, BLUM M, et al. Biologically active corticotropin-releasing hormone in maternal and fetal plasma during pregnancy[J]. Am J Obstetr Gynecol, 1988, 159(4): 884-890. DOI:10.1016/S0002-9378(88)80162-5 |
| [29] |
LAATIKAINEN T, VIRTANEN T, RÄISÄNEN I, et al. Immunoreactive corticotropin-releasing factor and corticotropin during pregnancy, labor and puerperium[J]. Neuropeptides, 1987, 10(4): 343-353. DOI:10.1016/S0143-4179(87)90101-6 |
| [30] |
JESKE W, SOSZYŃSKI P, LUKASZEWICZ E, et al. Enhancement of plasma corticotropin-releasing hormone in pregnancy-induced hypertension[J]. Eur J Endocrinol, 1990, 122(6): 711-714. DOI:10.1530/acta.0.1220711 |
| [31] |
GILL R D, HART I C. Hepatic receptors for insulin and glucagon in relation to plasma hormones and metabolites in pregnant and unmated ewes[J]. J Endocrinol, 1982, 93(2): 231-238. DOI:10.1677/joe.0.0930231 |
| [32] |
GILL R D, HART I C. Properties of insulin and glucagon receptors on sheep hepatocytes: a comparison of hormone binding and plasma hormones and metabolites in lactating and non-lactating ewes[J]. J Endocrinol, 1980, 84(2): 237-247. DOI:10.1677/joe.0.0840237 |
| [33] |
CHADIO S E, KOTSAMPASI B, PAPADOMICHELAKIS G, et al. Impact of maternal undernutrition on the hypothalamic-pituitary-adrenal axis responsiveness in sheep at different ages postnatal[J]. J Endocrinol, 2007, 192(3): 495-503. DOI:10.1677/JOE-06-0172 |
| [34] |
VONNAHME K A, NEVILLE T L, PERRY G A, et al. Maternal dietary intake alters organ mass and endocrine and metabolic profiles in pregnant ewe lambs[J]. Anim Reprod Sci, 2013, 141(3-4): 131-141. DOI:10.1016/j.anireprosci.2013.07.010 |
| [35] |
DUEHLMEIER R, FLUEGGE I, SCHWERT B, et al. Insulin sensitivity during late gestation in ewes affected by pregnancy toxemia and in ewes with high and low susceptibility to this disorder[J]. J Vet Int Med, 2013, 27(2): 359-366. DOI:10.1111/jvim.12035 |
| [36] |
DUEHLMEIER R, NOLDT S, GANTER M. Pancreatic insulin release and peripheral insulin sensitivity in German black headed mutton and Finish Landrace ewes: evaluation of the role of insulin resistance in the susceptibility to ovine pregnancy toxemia[J]. Domest Anim Endocrinol, 2013, 44(4): 213-221. DOI:10.1016/j.domaniend.2013.01.003 |
| [37] |
DUEHLMEIER R, FLUEGGE I, SCHWERT B, et al. Post-glucose load changes of plasma key metabolite and insulin concentrations during pregnancy and lactation in ewes with different susceptibility to pregnancy toxaemia[J]. J Anim Physiol Anim Nutr, 2013, 97(5): 971-985. DOI:10.1111/jpn.12010 |
| [38] |
KANETA M, LIECHTY E A, MOOREHEAD H C, et al. Ovine fetal and maternal glycogen during fasting[J]. Biol Neonate, 1991, 60(3-4): 215-220. DOI:10.1159/000243411 |
| [39] |
MOALLEM U, ROZOV A, GOOTWINE E, et al. Plasma concentrations of key metabolites and insulin in late-pregnant ewes carrying 1 to 5 fetuses[J]. J Anim Sci, 2012, 90(1): 318-324. DOI:10.2527/jas.2011-3905 |
| [40] |
HU F, XUE Y F, GUO C Z, et al. The response of ruminal fermentation, epithelium-associated microbiota, and epithelial barrier function to severe feed restriction in pregnant ewes[J]. J Anim Sci, 2018, 96(10): 4293-4305. DOI:10.1093/jas/sky306 |
| [41] |
XUE Y F, GUO C Z, HU F, et al. Hepatic metabolic profile reveals the adaptive mechanisms of ewes to severe undernutrition during late gestation[J]. Metabolites, 2018, 8(4): 85. DOI:10.3390/metabo8040085 |
| [42] |
SCHLUMBOHM C, HARMEYER J. Hyperketonemia impairs glucose metabolism in pregnant and nonpregnant ewes[J]. J Dairy Sci, 2004, 87(2): 350-358. DOI:10.3168/jds.S0022-0302(04)73174-4 |
| [43] |
HOU L, HELLGREN L I, KONGSTED A H, et al. Pre-natal undernutrition and post-natal overnutrition are associated with permanent changes in hepatic metabolism markers and fatty acid composition in sheep[J]. Acta Physiol, 2014, 210(2): 317-329. DOI:10.1111/apha.12211 |
| [44] |
HARMEYER J, SCHLUMBOHM C. Pregnancy impairs ketone body disposal in late gestating ewes: implications for onset of pregnancy toxaemia[J]. Res Vet Sci, 2006, 81(2): 254-264. DOI:10.1016/j.rvsc.2005.10.010 |
| [45] |
HEFNAWY A E, YOUSSEF S, SHOUSHA S. Some immunohormonal changes in experimentally pregnant toxemic goats[J]. Vet Med Int, 2010, 2010: 768438. |
| [46] |
YAMEOGO N, OUEDRAOGO G A, KANYANDEKWE C, et al. Relationship between ketosis and dairy cows' blood metabolites in intensive production farms of the periurban area of Dakar[J]. Trop Anim Health Prod, 2008, 40(7): 483-490. DOI:10.1007/s11250-007-9124-z |
| [47] |
LOTFOLLAHZADEH S, ZAKIAN A, TEHRANI-SHARIF M, et al. Assessment the alterations of some biochemical parameters in Afshari sheep with possible metabolic disorders[J]. Small Rumin Res, 2016, 145: 58-64. DOI:10.1016/j.smallrumres.2016.10.012 |
| [48] |
BROZOS C, MAVROGIANNI V S, FTHENAKIS G C. Treatment and control of peri-parturient metabolic diseases: pregnancy toxemia, hypocalcemia, hypomagnesemia[J]. Vet Clin North Am Food Anim Pract, 2011, 27(1): 105-113. DOI:10.1016/j.cvfa.2010.10.004 |
| [49] |
VASAVA P R, JANI R G, GOSWAMI H V, et al. Studies on clinical signs and biochemical alteration in pregnancy toxemic goats[J]. Vet World, 2016, 9(8): 869-874. DOI:10.14202/vetworld.2016.869-874 |
| [50] |
DHAOUI A, CHNITER M, ATIGUI M, et al. Factors affecting the milk yield and composition over lactation of prolific D'man ewes in Tunisian oases[J]. Trop Anim Health Prod, 2019, 51(3): 507-518. DOI:10.1007/s11250-018-1713-5 |
| [51] |
SCHLUMBOHM C, HARMEYER J. Twin-pregnancy increases susceptibility of ewes to hypoglycaemic stress and pregnancy toxaemia[J]. Res Vet Sci, 2008, 84(2): 286-299. DOI:10.1016/j.rvsc.2007.05.001 |
| [52] |
BOLLO E, BASSANO B, PERACINO V, et al. Effect of emanciation on liver histology of alpine chamois during winter[J]. J Wildlife Dis, 1999, 35(4): 770-773. DOI:10.7589/0090-3558-35.4.770 |
| [53] |
RATANAPOB N, VANLEEUWEN J, MCKENNA S, et al. The association of serum β-hydroxybutyrate concentration with fetal number and health indicators in late-gestation ewes in commercial meat flocks in Prince Edward Island[J]. Prev Vet Med, 2018, 154: 18-22. DOI:10.1016/j.prevetmed.2018.03.009 |
| [54] |
DOWNS C J, BOAN B V, LOHUIS T D, et al. Investigating relationships between reproduction, immune defenses, and cortisol in dall sheep[J]. Front Immunol, 2018, 9: 105. DOI:10.3389/fimmu.2018.00105 |
| [55] |
MINTON J E. Function of the hypothalamic-pituitary-adrenal axis and the sympathetic nervous system in models of acute stress in domestic farm animals[J]. J Anim Sci, 1994, 72(7): 1891-1898. DOI:10.2527/1994.7271891x |
| [56] |
SAPOLSKY R M, ROMERO L M, MUNCK A U. How do glucocorticoids influence stress responses?Integrating permissive, suppressive, stimulatory, and preparative actions[J]. Endocr Rev, 2000, 21(1): 55-89. |
| [57] |
STERNBERG E M. Neural regulation of innate immunity: a coordinated nonspecific host response to pathogens[J]. Nat Rev Immunol, 2006, 6(4): 318-328. DOI:10.1038/nri1810 |
| [58] |
MARTIN L B. Stress and immunity in wild vertebrates: timing is everything[J]. General Comparat Endocrinol, 2009, 163(1-2): 70-76. DOI:10.1016/j.ygcen.2009.03.008 |
| [59] |
ROBINSON D P, KLEIN S L. Pregnancy and pregnancy-associated hormones alter immune responses and disease pathogenesis[J]. Horm Behav, 2012, 62(3): 263-271. DOI:10.1016/j.yhbeh.2012.02.023 |
| [60] |
CAROPRESE M, CILIBERTI M G, ALBENZIO M, et al. Dietary polyunsaturated fatty acids from flaxseed affect immune responses of dairy sheep around parturition[J]. Vet Immunol Immunopathol, 2015, 168(1-2): 56-60. DOI:10.1016/j.vetimm.2015.08.006 |
| [61] |
WALSH S W, WILLIAMS E J, EVANS A C O. A review of the causes of poor fertility in high milk producing dairy cows[J]. Anim Reprod Sci, 2011, 123(3-4): 127-138. DOI:10.1016/j.anireprosci.2010.12.001 |
| [62] |
ROCHE J F. The effect of nutritional management of the dairy cow on reproductive efficiency[J]. Anim Reprod Sci, 2006, 96(3-4): 282-296. DOI:10.1016/j.anireprosci.2006.08.007 |
| [63] |
KIYMA Z, ALEXANDER B M, VAN KIRK E A, et al. Effects of feed restriction on reproductive and metabolic hormones in ewes[J]. J Anim Sci, 2004, 82(9): 2548-2557. DOI:10.2527/2004.8292548x |
| [64] |
CIECHANOWSKA M, ŁAPOT M, MALEWSKI T, et al. Effects of corticotropin-releasing hormone and its antagonist on the gene expression of gonadotrophin-releasing hormone (GnRH) and GnRH receptor in the hypothalamus and anterior pituitary gland of follicular phase ewes[J]. Reprod Fertil Dev, 2011, 23(6): 780-787. DOI:10.1071/RD10341 |
| [65] |
BASSETT J M, HANSON C. Prevention of hypoinsulinemia modifies catecholamine effects in fetal sheep[J]. Am J Physiol Regulat Integrat Comparat Physiol, 2000, 278(5): R1171-R1181. DOI:10.1152/ajpregu.2000.278.5.R1171 |
| [66] |
DAVIS M A, CAMACHO L E, ANDERSON M J, et al. Chronically elevated norepinephrine concentrations lower glucose uptake in fetal sheep[J]. Am J Physiol Regul Integr Comp Physiol, 2020, 319(3): R255-R263. DOI:10.1152/ajpregu.00365.2019 |
| [67] |
LIMESAND S W, ROZANCE P J. Fetal adaptations in insulin secretion result from high catecholamines during placental insufficiency[J]. J Physiol, 2017, 595(15): 5103-5113. DOI:10.1113/JP273324 |
| [68] |
RAKERS F, FRAUENDORF V, RUPPRECHT S, et al. Effects of early- and late-gestational maternal stress and synthetic glucocorticoid on development of the fetal hypothalamus-pituitary-adrenal axis in sheep[J]. Stress, 2013, 16(1): 122-129. DOI:10.3109/10253890.2012.686541 |
| [69] |
WALEJKO J M, ANTOLIC A, KOELMEL J P, et al. Chronic maternal cortisol excess during late gestation leads to metabolic alterations in the newborn heart[J]. Am J Physiol Endocrinol Metabo, 2019, 316(3): E546-E556. DOI:10.1152/ajpendo.00386.2018 |
| [70] |
OSGERBY J C, WATHES D C, HOWARD D, et al. The effect of maternal undernutrition on ovine fetal growth[J]. J Endocrinol, 2002, 173(1): 131-141. DOI:10.1677/joe.0.1730131 |
| [71] |
LIU Y C, HE S, ZHANG Y, et al. Effects of intrauterine growth restriction during late pregnancy on the development of the ovine fetal thymus and the T-lymphocyte subpopulation[J]. Am J Reprod Immunol, 2015, 74(1): 26-37. DOI:10.1111/aji.12371 |
| [72] |
ZHANG H, ZHAO F F, NIE H T, et al. Dietary N-carbamylglutamate and rumen-protected L-arginine supplementation during intrauterine growth restriction in undernourished ewes improve fetal thymus development and immune function[J]. Reprod Fertil Dev, 2018, 30(11): 1522-1531. DOI:10.1071/RD18047 |
| [73] |
CHADIO S, KATSAFADOU A, KOTSAMPASI B, et al. Effects of maternal undernutrition during late gestation and/or lactation on colostrum synthesis and immunological parameters in the offspring[J]. Reprod Fertil Dev, 2016, 28(3): 384-393. DOI:10.1071/RD14147 |
| [74] |
KERSLAKE J, KENYON P, MORRIS S, et al. Does offering concentrate supplement during late pregnancy affect twin- and triplet-bearing ewe and lamb performance?[J]. New Zeal J Agric Res, 2010, 53(3): 315-325. |
| [75] |
SORMUNEN-CRISTIAN R, JAUHIAINEN L. Comparison of hay and silage for pregnant and lactating Finnish Landrace ewes[J]. Small Rumin Res, 2001, 39(1): 47-57. DOI:10.1016/S0921-4488(00)00167-X |
| [76] |
VESHKINI A, MOHAMMADI-SANGCHESHMEH A, ALAMOUTI A A, et al. Maternal supplementation with fish oil modulates inflammation-related MicroRNAs and genes in suckling lambs[J]. Trop Anim Health Prod, 2020, 52(4): 1561-1572. DOI:10.1007/s11250-019-02157-w |
| [77] |
NICKLES K R, HAMER L, COLEMAN D N, et al. Supplementation with eicosapentaenoic and docosahexaenoic acids in late gestation in ewes changes adipose tissue gene expression in the ewe and growth and plasma concentration of ghrelin in the offspring[J]. J Anim Sci, 2019, 97(6): 2631-2643. DOI:10.1093/jas/skz141 |
| [78] |
ZHANG H, SUN L W, WANG Z Y, et al. Dietary N-carbamylglutamate and rumen-protected L-arginine supplementation ameliorate fetal growth restriction in undernourished ewes[J]. J Anim Sci, 2016, 94(5): 2072-2085. DOI:10.2527/jas.2015-9587 |
| [79] |
CELI P. The role of oxidative stress in small ruminants' health and production[J]. Rev Bras Zootecn, 2010, 39(S1): 348-363. |
| [80] |
CARCANGIU V, VACCA G M, PARMEGGIANI A, et al. The effect of shearing procedures on blood levels of growth hormone, cortisol and other stress haematochemical parameters in Sarda sheep[J]. Animal, 2008, 2(4): 606-612. DOI:10.1017/S1751731108001651 |
| [81] |
CHANDLER K D, LEURY B J, BIRD A R, et al. Effects of undernutrition and exercise during late pregnancy on uterine, fetal and uteroplacental metabolism in the ewe[J]. Br J Nutr, 1985, 53(3): 625-635. DOI:10.1079/BJN19850072 |
| [82] |
LEURY B J, BIRD A R, CHANDLER K D, et al. Glucose partitioning in the pregnant ewe: effects of undernutrition and exercise[J]. Br J Nutr, 1990, 64(2): 449-462. DOI:10.1079/BJN19900045 |
| [83] |
TILBROOK A J, TURNER A I, IBBOTT M D, et al. Activation of the hypothalamo-pituitary-adrenal axis by isolation and restraint stress during lactation in ewes: effect of the presence of the lamb and suckling[J]. Endocrinology, 2006, 147(7): 3501-3509. DOI:10.1210/en.2005-1632 |
| [84] |
DOBSON H, ROUTLY J E, SMITH R F. Understanding the trade-off between the environment and fertility in cows and ewes[J]. Anim Reprod, 2020, 17(3): e20200017. DOI:10.1590/1984-3143-ar2020-0017 |
| [85] |
SILVA P S, HOOPER H B, MANICA E, et al. Heat stress affects the expression of key genes in the placenta, placental characteristics, and efficiency of Saanen goats and the survival and growth of their kids[J]. J Dairy Sci, 2021, 104(4): 4970-4979. DOI:10.3168/jds.2020-18301 |
| [86] |
INDU S, SEJIAN V, NAQVI S M K, et al. Impact of simulated semiarid tropical environmental conditions on growth, physiological adaptability, blood metabolites and endocrine responses in Malpura ewes[J]. Anim Prod Sci, 2014, 55(6): 766-776. |
| [87] |
DIGBY S N, MASTERS D G, BLACHE D, et al. Reproductive capacity of Merino ewes fed a high-salt diet[J]. Animal, 2008, 2(9): 1353-1360. DOI:10.1017/S1751731108002449 |
| [88] |
ÁLVAREZ D, CARO M R, BUENDÍA A J, et al. Effect of female sex hormones on the developmental cycle of Chlamydia abortus compared to a penicillin-induced model of persistent infection[J]. BMC Vet Res, 2019, 15(1): 259. DOI:10.1186/s12917-019-2013-7 |
| [89] |
RAHMAN A N M A. Hormonal changes in the uterus during pregnancy-lessons from the Ewe: a review[J]. J Agric Rur Dev, 2006, 4(1): 1-7. |
| [90] |
BEASLEY A M, KAHN L P, WINDON R G. The periparturient relaxation of immunity in Merino ewes infected with Trichostrongylus colubriformis: endocrine and body compositional responses[J]. Vet Parasitol, 2010, 168(1-2): 51-59. DOI:10.1016/j.vetpar.2009.12.012 |
(编辑 白永平)



