2. 天康生物股份有限公司, 乌鲁木齐 830000;
3. 西安交通大学生命科学与技术学院, 西安 710000
2. Tecon Biology Co. Ltd., Urumqi 830000, China;
3. College of Life Science and Technology, Xi'an Jiaotong University, Xi'an 710000, China
口蹄疫(food-and-mouth disease,FMD)是严重危害动物健康的病毒性疾病。广泛接种含有油乳剂ISA-206、ISA-201的口蹄疫灭活疫苗(foot-and-mouth disease inactivated vaccine, FMDV)是预防和控制FMD的有效策略。但是,FMDV诱导的细胞免疫反应较弱,且疫苗中的油乳剂伴有较高的毒性,易造成注射部位脓肿、肉芽肿等不良反应[1-2]。因此,研制能够激发Th1/Th2免疫应答的高效、低毒新型佐剂对于提高FMDV效力至为关键[3]。
中草药及其活性成分具有良好的免疫调节作用,例如菊粉、香菇、党参、人参等多糖作为流感、COVID-19、艾滋病、乙肝、新城疫及禽流感等疫苗佐剂通过促进树突状细胞成熟、促进T/B淋巴细胞增殖及CTL反应等增强体液和细胞免疫反应从而提高疫苗效力。中草药因其具有低毒性、资源丰富等优点而成为了新型疫苗佐剂的候选物[4-5]。同时,中草药多糖成分也用于FMDV新型佐剂的研究中,例如川明参、马齿苋等通过有效激活B细胞,促进脾淋巴细胞增殖,诱导CTL反应而提高FMDV效力,并具有良好的安全性[6-7],在FMD预防中展现出应用的潜力。
新疆一枝蒿(Artemisia rupestris L.)为菊科蒿属植物,主要包括多糖、黄酮、生物碱等化学成分,多糖作为主要免疫活性成分具有抗病毒、抗炎等免疫调节作用,毒副作用少,临床上常应用于流感、过敏、荨麻疹等疾病的治疗[8]。本课题组前期发现野生一枝蒿水提物作为流感疫苗和FMDV的佐剂可以提高小鼠血清中IgG抗体水平,促进脾中T细胞亚群的增殖及Th1/Th2型细胞因子的分泌[9-10];栽培一枝蒿粗多糖配伍卵清白蛋白免疫小鼠能增强Th1/Th2反应而表现出良好的佐剂活性[11]。中草药的免疫调节活性受多种因素影响,如种类、来源和提取条件等。一枝蒿的化学成分分析表明,野生和栽培品种均含有黄酮、多糖、生物碱、挥发油等成分,在野生和栽培品种中这些化学成分的含量有所差异,例如,野生品种黄酮含量高于栽培品种,栽培品种多糖含量高于野生品种[12-13]。由于野生一枝蒿资源稀缺,栽培一枝蒿已经成功种植并应用于临床。为进一步探讨栽培一枝蒿粗多糖作为疫苗佐剂的可行性,本试验通过肌肉途径免疫ICR小鼠,比较栽培/野生一枝蒿粗多糖(cultivated/wild Artemisia rupestris L. crude polysaccharides,CARCP/WARCP)作为FMDV佐剂对小鼠体液和细胞免疫的影响,探究CARCP/WARCP的佐剂活性和安全性,为栽培一枝蒿粗多糖作为FMDV新型佐剂的有效开发利用提供重要的依据。
1 材料和方法 1.1 试验材料及试剂CARCP/WARCP(多糖含量分别为32.53%、30.94%)[13]。口蹄疫灭活抗原(foot-and-mouth disease antigen, FMD-Ag 146S 5.63 μg·mL-1)O3/My098株、ISA-206油乳剂购自天康生物股份有限公司;辣根过氧化物酶标记的山羊抗小鼠IgG、IgG1、IgG2a与IgE购自Southbiotech公司;N-四甲基联苯胺(Tetramethyl-benzidine, TMB)购自Sigma公司;CD3-PE、CD4-APC、CD8-FITC、CD8-APC、CD44-PE、CD62L-FITC等流式抗体均购自BD公司,其余试剂为国产纯试剂。
1.2 动物及免疫分组雌性ICR小鼠(体重20~30 g)购于新疆医科大学动物实验中心。30只ICR小鼠随机分为6组,每组5只,分组如下:1)0.9% NaCl组(空白对照组);2)FMDV组(146S 0.3 μg·只-1);3)FMDV/CARCP1组(146S 0.3 μg·只-1,CARCP1总物质150 μg·只-1);4)FMDV/WARCP1组(146S 0.3 μg·只-1,WARCP1总物质150 μg·只-1);5)FMDV/CARCP2组(146S 0.3 μg·只-1,CARCP2多糖含量150 μg·只-1);6)FMDV/WARCP2组(146S 0.3 μg·只-1,WARCP2多糖含量150 μg·只-1)。根据文献[10]制备疫苗,简述如下:将FMD-Ag分别与CARCP/WARCP水剂和ISA-206油乳剂乳化制备成水包油包水(W/O/W)疫苗,经肌肉途径,于0、14 d免疫小鼠2次(120 μL·只-1)。
1.3 抗体及亚型水平检测ELISA检测小鼠初次免疫后14~28 d血清中IgG及28 d IgG1和IgG2a水平[10]。简述如下:FMD-Ag(1 μg·mL-1)包被于96孔板中4 ℃过夜。用含PBST(0.05%吐温20)洗板后加入5%脱脂奶粉在37 ℃封闭60 min。加入检测血清(1∶1 000)37 ℃孵育60 min后PBST洗板。加入辣根过氧化物酶标记的IgG、IgG1和IgG2a二抗(1∶10 000)37 ℃孵育60 min。TMB避光显色10~20 min后终止显色,酶标仪450 nm检测吸光度(Optimal density, OD)。
1.4 T细胞亚群检测加强免疫后14 d收集各组小鼠脾组织,裂解红细胞后获得脾单细胞悬浮液,细胞浓度调到每毫升1×106个,离心7 min后,分别用CD3-PE/CD4-APC/CD8-FITC、CD4-APC/CD44-PE、CD8-APC/CD44-PE、CD62L-FITC/CD44-PE的荧光抗体进行表面避光染色30 min,终止染色用流式细胞仪检测,FlowJo软件进行数据分析。
1.5 安全性检测CARCP/WARCP免疫后定期称量初次免疫后0、14、28 d小鼠体重,监测临床症状,观察注射部位反应,并进行初次免疫后28 d血清中IgE水平检测,进行CARCP/WARCP对小鼠的安全性的初步评价。
1.6 统计学分析试验数据以“平均值±标准差”展示,统计学分析采用GraphPad Prism 5.0软件进行单因素方差分析和Tukey's多重比较,P < 0.05表示差异显著。
2 结果 2.1 CARCP/WARCP对IgG抗体水平的影响为了比较CARCP/WARCP对小鼠体液免疫的影响,ELISA检测初次免疫后14~28 d小鼠血清中FMDV特异性IgG水平,结果如图 1所示,总物质量一致时,CARCP1/WARCP1均能极显著提高初次免疫后14~28 d小鼠血清IgG水平(P < 0.01)。在14和21 d时,CARCP1的增强效果显著高于WARCP1(P < 0.05),在28 d时CARCP1/WARCP1 IgG水平之间差异不显著(P>0.05)。多糖含量一致时,在14 d时,与FMDV相比,CARCP2/WARCP2差异不显著(P>0.05),且CARCP2/WARCP2 IgG水平之间差异不显著(P>0.05)。在21和28 d时,CARCP2/WARCP2均显著增强了IgG水平(P < 0.05),且CARCP2和WARCP2之间差异不显著(P>0.05)。

|
与 FMDV 相比,*.P < 0.05,**.P < 0.01,***.P < 0.001;CARCP1与 WARCP1 相比,CARCP2 与 WARCP2 相比,#.P < 0.05,ns. P>0.05。下同 Compared with FMDV, *.P < 0.05, **.P < 0.01, ***.P < 0.001; CARCP1 compared with WARCP1, CARCP2 compared with WARCP2, #.P < 0.05, ns. P>0.05. The same as below 图 1 血清中FMDV特异性IgG抗体水平检测 Fig. 1 Detection of FMDV-specific IgG antibody levels in serum |
ELISA检测初次免疫后28 d血清中抗体亚型水平,结果如图 2所示,总物质量一致时,与FMDV相比,CARCP1/WARCP1均能显著提高FMDV特异性IgG1水平(P < 0.05),且CARCP1/WARCP1之间差异不显著(P>0.05)。CARCP1/WARCP1均能极显著提高IgG2a水平(P < 0.01),且CARCP1组IgG2a水平高于WARCP1(P < 0.05)。CARCP1/WARCP1均能显著提高IgG2a/IgG1比值(P < 0.01),且CARCP1 IgG2a/IgG1比值显著高于WARCP1(P < 0.05)。多糖含量一致时,CARCP2/WARCP2均能显著增强IgG2a水平(P < 0.05),极显著提高IgG2a/IgG1比值(P < 0.01),CARCP2/WARCP2 IgG1水平与FMDV相比差异不显著(P>0.05),且CARCP2/WARCP2之间差异不显著(P>0.05)。

|
A. 28 d血清中 IgG1水平;B. 28 d IgG2a水平;C. IgG2a/IgG1比值 A. IgG1 levels in the serum at 28 d; B. IgG2a levels at 28 d; C. IgG2a/IgG1 ratio 图 2 血清中FMDV特异性IgG1、IgG2a抗体亚型检测 Fig. 2 Detection of FMDV-specific IgG1, IgG2a antibody isotypes in serum |
加强免疫后14 d用流式细胞术检测小鼠脾T细胞亚群的百分比,结果如图 3所示,总物质量一致时,CARCP1/WARCP1均能极显著促进脾T细胞亚群CD3+CD4+百分比(P < 0.01),显著促进CD3+CD8+比例(P < 0.05),且CARCP1的增强效果显著高于WARCP1(P < 0.05)。多糖含量一致时,CARCP2/WARCP2对CD3+CD4+和CD3+CD8+T细胞的作用与FMDV相比差异不显著(P>0.05),且CARCP2/WARCP2之间差异不显著(P>0.05)。
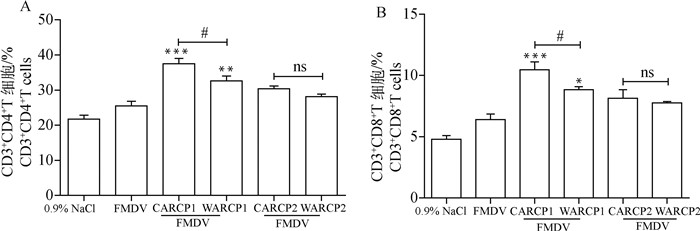
|
A. 脾 CD3+CD4+T 细胞百分比;B. 脾 CD3+CD8+T 细胞百分比 A. Percentage of spleen CD3+CD4+lymphocytes; B. Percentage of spleen CD3+CD8+ lymphocytes 图 3 T细胞亚群CD3+CD4+、CD3+CD8+比例检测 Fig. 3 Detection of CD3+CD4+, CD3+CD8+T cells proportion |
加强免疫后14 d,流式细胞术检测小鼠脾效应T细胞亚群比例结果如图 4所示,总物质量一致时,CARCP1/WARCP1均能极显著提高CD4+CD44+(P < 0.01),显著提高CD8+CD44+T细胞亚群比例(P < 0.05),且CARCP1增强效果高于WARCP1(P < 0.05)。多糖含量一致时,CARCP2/WARCP2均能显著提高CD4+CD44+比例(P < 0.05),且CARCP2/WARCP2之间差异不显著(P>0.05)。CARCP2/WARCP2对CD8+CD44+比例与FMDV相比差异不显著(P>0.05),且CARCP2/WARCP2之间差异不显著(P>0.05)。

|
A. 脾 CD4+CD44+ 效应T细胞百分比;B. 脾CD8+CD44+效应T细胞百分比 A. Percentage of spleen CD4+CD44+effector T lymphocytes; B. Percentage of spleen CD8+CD44+ effector T lymphocytes 图 4 效应T细胞亚群CD4+CD44+、CD8+CD44+检测 Fig. 4 Detection of effector CD4+CD44+, CD8+CD44+T cells |
加强免疫后14 d小鼠脾记忆T细胞亚群水平检测结果如图 5所示,总物质量一致时,CARCP1/WARCP1均极显著提高CD8+CD44+CD62L+比例(P < 0.01),显著增强记忆T细胞CD8+CD44+CD62L-(P < 0.05)比例,且CARCP1增强效果显著高于WARCP1(P < 0.05)。多糖含量一致时,CARCP2/WARCP2对CD8+CD44+CD62L-/CD62L+T细胞的作用与FMDV相比差异不显著(P>0.05),且CARCP2/WARCP2之间差异不显著(P>0.05)。
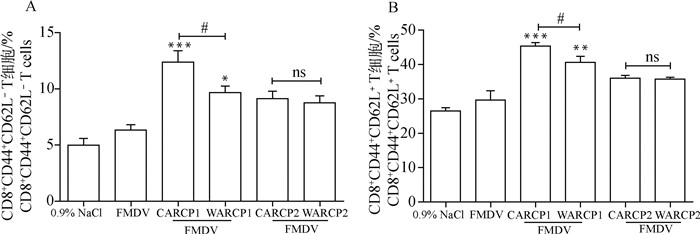
|
A. 脾CD8+CD44+CD62L-记忆T细胞百分比;B. 脾CD8+CD44+CD62L+记忆T细胞百分比 A. Percentage of spleen CD8+CD44+CD62L-memory T lymphocytes; B. Percentage of spleen CD8+CD44+CD62L+memory T lymphocytes 图 5 记忆T细胞亚群CD8+CD44+CD62L+/CD62L-检测 Fig. 5 Detection of CD8+CD44+CD62L+/CD62L- memory T cells |
小鼠免疫后每天观察其临床症状,整个免疫过程中没有出现皮毛褶皱、肌肉抽搐、呼吸窘迫等症状。CARCP/WARCP佐剂FMDV免疫0、14、28 d后,同一时间点各组小鼠体重差异不显著(图 6A,P>0.05)。初免后28 d,CARCP1/WARCP1配伍FMDV免疫组小鼠IgE抗体之间差异不显著(P>0.05)。CARCP2/WARCP2之间差异不显著(图 6B,P>0.05)。
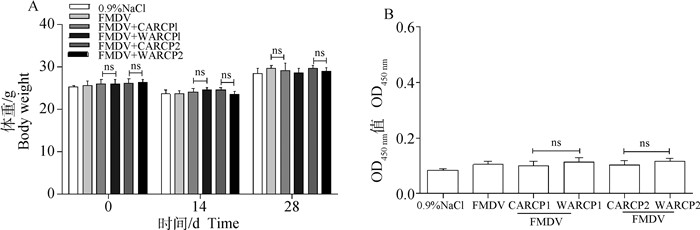
|
A. 小鼠体重;B. 小鼠血清 IgE 水平 A. Body weight of mice; B. Serum IgE level of mice 图 6 免疫后小鼠体重变化和IgE水平检测 Fig. 6 Detection of body weight change and IgE level of mice after immunization |
中草药多糖作为新型疫苗佐剂在传染病治疗和预防方面具有良好的应用前景[14]。安全有效的佐剂对于FMDV发挥免疫增强效应具有重要的辅助作用,然而也会伴随着一些副作用,如铝佐剂能够增强抗体产生,但是细胞反应较弱且伴随疼痛、肿胀等限制了其在FMDV中应用[2]。前期研究表明,CARCP/WARCP具有良好佐剂活性[9-11],为此,本研究选用CARCP/WARCP作为FMDV候选佐剂,基于总物质量和多糖含量比较CARCP/WARCP对体液免疫及细胞免疫反应的影响,观察CARCP/WARCP的免疫增强作用和安全性的异同。
CARCP/WARCP配伍FMDV免疫后小鼠注射部位没有出现肉芽肿、脓肿等不良反应,没有出现食欲不振、脱毛、肌肉抽搐等症状,对各组小鼠生长没有影响,也没有引起过敏反应,提示CARCP/WARCP作为FMDV佐剂具有较好的安全性。
有效的体液免疫反应在抵御FMD病毒感染及提供长期保护中起至关重要的作用,IgG水平的高低是评价疫苗效力的间接指标。菊粉多糖作为H1N1佐剂能够提高体液免疫反应[15]。因此,本研究以总物质量和多糖含量为标准,比较CARCP/WARCP对FMDV免疫小鼠IgG水平的增强效果。初次免疫后14~28 d IgG结果表明,总物质量一致时,CARCP1/WARCP1均能增强FMDV特异性IgG水平,且CARCP1效果高于WARCP1,这与CARCP多糖含量高于WARCP相关。多糖含量一致时,CARCP2/WARCP2均能提高IgG水平,且CARCP2/WARCP2增强作用相当,这与CARCP2/WARCP2多糖含量相同相关。
有研究表明,马齿苋、川明参等中草药多糖作为FMDV佐剂可以诱导Th1/Th2反应,尤其激发Th1反应而增强了FMDV效力[6-7]。本研究中,初次免疫后28 d IgG1、IgG2a结果表明,总物质量一致时,CARCP1/WARCP1均能提高FMDV特异性IgG2a(Th1)、IgG1(Th2)以及IgG2a/IgG1比值,且CARCP1增强效果高于WARCP1。多糖含量一致时,CARCP2/WARCP2均能增强IgG2a水平及IgG2a/IgG1比值,且CARCP2/WARCP2增强效果相当。这些结果显示,CARCP/WARCP均能促进Th1/Th2反应,尤其是Th1反应,激发针对FMD的有效体液和细胞免疫反应。
效应及记忆T细胞活化对FMD防治具有重要意义[16-17],黄芪等中草药多糖能够促进效应及记忆T细胞而增强了针对FMD的细胞免疫应答[18]。为此,本研究为评估CARCP/WARCP对细胞免疫的影响,加强免疫后14 d检测了脾中T细胞亚群,结果表明总物质量一致时,CARCP1/WARCP1均能增强CD3+CD4+和CD3+CD8+及CD4+CD44+和CD8+CD44+效应T细胞及CD8+CD44+CD62L-/CD62L+记忆T细胞比例,且CARCP1增强效果优于WARCP1,这与CARCP1的多糖含量高于WARCP1相关。多糖含量一致时,CARCP2/WARCP2均能增强效应T细胞及记忆T细胞比例,且CARCP2/WARCP2的作用没有差异,表明CARCP2/WARCP2促进效应及记忆T细胞活化与多糖含量相同相关。
4 结论综上所述,总物质量一致时,CARCP1/WARCP1均能增强FMDV特异性体液和细胞免疫水平,尤其是Th1反应,CARCP1效果优于WARCP1,这与CARCP1的多糖含量高于WARCP1相关;多糖含量一致时,CARCP2/WARCP2佐剂效应并无差异,表明CARCP2/WARCP2促进FMDV特异性免疫反应与多糖含量相同相关。这些研究结果提示,CARCP作为FMDV新型佐剂的有效性和安全性,也为探索中草药多糖作为新型佐剂预防和控制其他传染病提供试验借鉴。
| [1] |
ÇOKCALISKAN C, TÜRKOǦLU T, TUNCER-GÖKTUNA P, et al. Evaluation of antibody response of sheep to foot-and-mouth disease vaccine prepared by using different MontanideTM oil adjuvants[J]. Trop Biomed, 2021, 38(1): 154-159. DOI:10.47665/tb.38.1.027 |
| [2] |
CAO Y M. Adjuvants for foot-and-mouth disease virus vaccines: recent progress[J]. Expert Rev Vaccines, 2014, 13(11): 1377-1385. DOI:10.1586/14760584.2014.963562 |
| [3] |
O'HAGAN D T, LODAYA R N, LOFANO G. The continued advance of vaccine adjuvants-'we can work it out'[J]. Semin Immunol, 2020, 50: 101426. DOI:10.1016/j.smim.2020.101426 |
| [4] |
LI L, HONDA-OKUBO Y, HUANG Y, et al. Immunisation of ferrets and mice with recombinant SARS-CoV-2 spike protein formulated with Advax-SM adjuvant protects against COVID-19 infection[J]. Vaccine, 2021, 39(40): 5940-5953. DOI:10.1016/j.vaccine.2021.07.087 |
| [5] |
WANG D Y, LIU Y H, ZHAO W. The adjuvant effects on vaccine and the immunomodulatory mechanisms of polysaccharides from traditional Chinese medicine[J]. Front Mol Biosci, 2021, 8: 655570. DOI:10.3389/fmolb.2021.655570 |
| [6] |
FENG H B, FAN J, QIU H, et al. Chuanminshen violaceum polysaccharides improve the immune responses of foot-and-mouth disease vaccine in mice[J]. Int J Biol Macromol, 2015, 78: 405-416. DOI:10.1016/j.ijbiomac.2015.04.044 |
| [7] |
ZHAO R, MENG X Y, JIA G Y, et al. Oral pre-administration of Purslane polysaccharides enhance immune responses to inactivated foot-and-mouth disease vaccine in mice[J]. BMC Vet Res, 2019, 15(1): 38. DOI:10.1186/s12917-019-1782-3 |
| [8] |
万英洁, 夏建新, 唐丽. 新疆一枝蒿化学成分、药理作用及临床应用研究进展[J]. 中国中药杂志, 2017, 42(23): 4565-4573. WAN Y J, XIA J X, TANG L. Chemical constituents, biological activities and clinical applications from Artemisia rupestris[J]. China Journal of Chinese Materia Medica, 2017, 42(23): 4565-4573. DOI:10.19540/j.cnki.cjcmm.20170928.006 (in Chinese) |
| [9] |
张爱莲, 王丹阳, 赵淑述, 等. 新疆野生一枝蒿粗多糖对流感疫苗小鼠免疫增强效果的分析[J]. 畜牧兽医学报, 2016, 47(10): 2089-2097. ZHANG A L, WANG D Y, ZHAO S S, et al. The analysis of immune enhancement effect of Xinjiang wild Artemisia rupestris L.crude polysaccharides on influenza viruses vaccines in mice[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(10): 2089-2097. DOI:10.11843/j.issn.0366-6964.2016.10.018 (in Chinese) |
| [10] |
WANG D Y, CAO H, LI J Y, et al. Adjuvanticity of aqueous extracts of Artemisia rupestris L.for inactivated foot-and-mouth disease vaccine in mice[J]. Res Vet Sci, 2019, 124: 191-199. DOI:10.1016/j.rvsc.2019.03.016 |
| [11] |
张爱莲, 王丹阳, 赵淑述, 等. 新疆栽培一枝蒿粗多糖对OVA蛋白的免疫增强作用[J]. 中华微生物学和免疫学杂志, 2016, 36(9): 654-661. ZHANG A L, WANG D Y, ZHAO S S, et al. Crude polysaccharides extracted from cultivated Artemisia rupestris L.in Xinjiang enhances the efficacy of OVA[J]. Chinese Journal of Microbiology and Immunology, 2016, 36(9): 654-661. DOI:10.3760/cma.j.issn.0254-5101.2016.09.003 (in Chinese) |
| [12] |
李军, 刘文丽, 哈尔·札衣尔, 等. 人工栽培与野生新疆一枝蒿质量及有效成分的比较[J]. 中草药, 1996, 27(4): 235-237. LI J, LIU W L, ZHAYIER H, et al. A comparison on the quality and active ingredient in wild and cultivated Yizhihao (Artemisia rupestris)[J]. Chinese Traditional and Herbal Drugs, 1996, 27(4): 235-237. (in Chinese) |
| [13] |
杨雨, 杨秀梅, 赵干, 等. 新疆野生及栽培一枝蒿多糖对树突状细胞免疫功能的影响[J]. 生物技术通报, 2016, 32(7): 217-226. YANG Y, YANG X M, ZHAO G, et al. Immunoregulative action of polysaccharides in wild and cultivated Artemisia rupestris in Xinjiang on bone marrow dendritic cells[J]. Biotechnology Bulletin, 2016, 32(7): 217-226. (in Chinese) |
| [14] |
SUN B N, YU S, ZHAO D Y, et al. Polysaccharides as vaccine adjuvants[J]. Vaccine, 2018, 36(35): 5226-5234. DOI:10.1016/j.vaccine.2018.07.040 |
| [15] |
SAKALA I G, HONDA-OKUBO Y, LI L, et al. A M2 protein-based universal influenza vaccine containing Advax-SM adjuvant provides newborn protection via maternal or neonatal immunization[J]. Vaccine, 2021, 39(36): 5162-5172. DOI:10.1016/j.vaccine.2021.07.037 |
| [16] |
UYANGAA E, CHOI J Y, PATIL A M, et al. Functional restoration of exhausted CD4+ and CD8+ T cells in chronic viral infection by vinegar-processed flos of Daphne genkwa[J]. Comp Immunol Microbiol Infect Dis, 2015, 39: 25-37. DOI:10.1016/j.cimid.2015.02.001 |
| [17] |
LEE M J, JO H, SHIN S H, et al. Mincle and sting-stimulating Adjuvants elicit robust cellular immunity and drive long-lasting memory responses in a foot-and-mouth disease vaccine[J]. Front Immunol, 2019, 10: 2509. DOI:10.3389/fimmu.2019.02509 |
| [18] |
ZHANG N W, LI J F, HU Y X, et al. Effects of Astragalus polysaccharide on the immune response to foot-and-mouth disease vaccine in mice[J]. Carbohydr Polym, 2010, 82(3): 680-686. DOI:10.1016/j.carbpol.2010.05.030 |
(编辑 范子娟)



