骨关节炎(osteoarthritis,OA)是一种退行性全关节疾病。早期阶段动物表现为关节疼痛、肿胀或跛行等临床症状,病情加重后可出现关节僵硬、肌肉无力,功能障碍甚至致残[1]。作为动物临床高发的关节疾病,OA导致的跛行严重影响家畜使役,促使家畜过早淘汰,也影响动物健康和生活质量[2]。目前,OA发病机制不明确且治疗手段十分有限,兽医临床上使用非甾体抗炎药、COX-2抑制剂等药物仅能够缓解疼痛。而且长期使用会导致胃肠道和心血管不良反应以及肝功能损伤[3]。因此迫切需要一种有效、安全的策略来预防或治疗OA。
齐墩果酸(oleanolic acid,OLA)是从女贞子果实等植物中分离的五环三萜类化合物。OLA具有抗炎、抗氧化和护肝等药理作用。有研究表明,OLA通过miR-148-3p/FGF2通路减轻IL-1β诱导的软骨细胞功能障碍[5]。OLA可以激活SIRT3通过抑制成纤维细胞样滑膜细胞中的NF-κB信号通路来抑制滑膜炎症[6],并且抑制OA大鼠软骨MMP-3的表达。这些研究表明,OLA对OA软骨和滑膜炎症具有积极作用,但其对于OA导致的肌肉功能障碍和软骨下骨异常骨重建的作用还有待于挖掘。
软骨下骨异常骨重建是OA软骨下骨的特征性病变,现有研究表明,其可能是OA发病的始发因素[8-9],表现为软骨下骨板厚度减少、孔隙率增加、软骨下骨小梁退化、软骨下骨囊肿、骨赘形成等特征。此外,OA患畜临床表现的肌肉无力,主要影响股四头肌[10]。股四头肌功能障碍可能早于关节疼痛和影像学形态改变的发生[11],并直接参与OA发病机制[12]。藏红花素通过抑制肌肉氧化损伤和炎症反应,减轻大鼠关节疼痛和肌肉功能障碍[13]。同时大量报道显示,靶向调控Nrf2/NQO1/HO-1通路抑制肌肉氧化损伤是治疗OA的潜在策略[14-15]。因此本研究通过ACLT+PMMx方法建立大鼠OA模型,以阐述OLA对OA大鼠肌肉功能障碍和软骨下骨异常骨重建的作用及可能的分子机制,为下一步的药物研发和临床应用提供理论支持。
1 材料与方法 1.1 实验动物Sprague-Dawley大鼠购自长春易思实验动物技术有限公司。动物饲养管理和试验操作均遵循东北农业大学动物实验伦理审查相关规定。
1.2 主要试剂齐墩果酸(纯度≥98%,CAS:508-02-1)购自成都曼思特生物科技有限公司。手术缝线购自上海浦东金环医疗用品股份有限公司。异氟烷购自北京友诚盛达生物科技有限公司。大鼠CTX-Ⅰ、MHC、CS、OCN、IL-1和IL-6 ELISA试剂盒购于上海酶联生物科技有限公司。GAPDH抗体和NQO1抗体购于武汉爱博泰克生物科技有限公司,HO-1抗体购于沈阳万类生物科技有限公司,Nrf2抗体购于Affinity公司,高敏型ECL化学发光检测试剂盒购于南京诺唯赞生物科技股份有限公司。
1.3 主要仪器外科显微镜(科奥达,中国);Epoch酶标仪(BioTek,美国);大鼠足底触敏痛觉测试仪(UGO,意大利);Micro-CT(Bruker,德国)。
1.4 大鼠OA模型的建立将18只大鼠随机分为3组:对照组(CON组)、模型组(OA组)和给药组(OLA组),每组6只。大鼠适应1周后进行试验,OA组和OLA组的大鼠通过ACLT+PMMx方法[16]建立OA模型:大鼠异氟烷吸入麻醉,在右膝内侧切开2~4 cm切口,髌骨外侧脱位后膝关节完全屈曲,外科显微镜下切断前十字韧带,进行抽屉试验确保韧带完全切断。并以前十字韧带胫骨起点为圆点外旋45°切除内侧半月板的1/3,无菌生理盐水冲洗关节腔。可吸收线缝合伤口,消毒后放入笼内自由活动。CON组进行假手术,只切开关节囊后缝合,避免损伤其他韧带和半月板。术后大鼠连续3 d给予适量抗生素。
1.5 给药及样本采集OLA组大鼠手术后每日灌胃50 mg·(kg·d)-1 OLA,连续灌胃4周。OLA溶于含有20 mL·L-1 Tween 80的无菌生理盐水中,OLA剂量的选择参考之前的研究[17]。CON组与OA组灌胃等体积的含20 mL·L-1Tween 80的无菌生理盐水。所有大鼠分别于造模后第0、7、14和28天进行疼痛行为学测试。试验第28天,采集大鼠血液样本后1 000 g离心20 min,收集上清液进行血清ELISA试验。试验第28天所有大鼠实施安乐死,收集各组大鼠右侧包括股直肌在内的股四头肌样本,注意避免包含任何脂肪组织或其他肌肉,进行Western blot和肌肉ELISA试验。收集膝关节样本,进行Micro-CT扫描。
1.6 疼痛行为学1.6.1 伸膝发声试验 根据前人的方法[18],通过大鼠发声次数反映膝关节疼痛情况。从静止姿势、膝略微弯曲开始测试。首先保定大鼠,伸展膝关节,保证膝关节完全伸展,将膝盖夹在大拇指和食指之间,在内侧方向对膝关节挤压,上下左右伸膝。大鼠发声记“X”,不发声记“O”,每次间隔5 min,共测5次,记录发声次数之和。
1.6.2 热敏感试验 根据前人的方法[19]。在每次试验开始前,将大鼠放在玻璃板上方的不透明塑料室中15 min以适应环境。将大鼠足底触敏痛觉测试仪上的“十”字形标记置于大鼠左后跖足底中央,但避开足垫。接下来开启仪器,从开始至大鼠出现抬腿回避的时间作为大鼠的足热痛敏潜伏期(paw withdrawal latency, PWL)。每5 min重复1次,每只大鼠检测3次取平均值。大鼠每次接受辐射热刺激最长时间为20 s,以避免损伤其他组织。
1.7 ELISA试验采用ELISA试剂盒测定各组大鼠肌肉中柠檬酸合酶(citrate synthase, CS)、肌球蛋白重链(myosin heavy chain, MHC)、白细胞介素1(interleukin 1, IL-1)和IL-6的水平,以及血清中骨钙素(osteocalcin, OCN)和Ⅰ型胶原羧基末端肽(C-terminal typeⅠ collagen telopeptide, CTX-Ⅰ)的水平,严格按照ELISA试剂盒的说明书操作。
1.8 Micro-CT对软骨下骨影像学的检测与分析分别对各组大鼠膝关节进行Micro-CT扫描,包括胫骨和股骨各5 mm,射线管电流200 μA,电压85 kV,扫描分辨率10 μm,曝光时间384 ms。使用三维重建软件NRecon(V1.7.4.2版本,德国Bruker公司)对原始图像进行选择区域的重建。使用CT Analyser(1.18.8.0版本,德国Bruker公司)对感兴趣区域ROI进行分析。设定统一参数,由CT Analyser软件计算出骨体积分数(BV/TV)、骨小梁数(Tb.N)、骨小梁厚度(Tb.Th)和骨矿物质密度(BMD)参数。
1.9 Western blot检测目的蛋白使用含蛋白酶抑制剂的RIPA裂解缓冲液提取各组肌肉的总蛋白。用BCA蛋白分析试剂盒测定蛋白浓度。将蛋白样品加入凝胶泳道电泳,然后使用300 mA恒流,湿转法转移到PVDF膜上。用50 g·L-1牛血清白蛋白(BSA)封闭1 h后,在4 ℃下与一抗孵育过夜,一抗稀释比:GAPDH(1∶2 000)、Nrf2(1∶2 000)、HO-1(1∶1 000)和NQO1(1∶2 000)。将膜与二抗(1∶3 000)室温孵育1 h,使用高敏型ECL化学发光试剂显影,用自动凝胶图像分析系统显示蛋白条带,Image J软件分析灰度值。
1.10 统计学分析本试验数据使用SPSS软件(Windows版本19.0,USA)进行分析。数据均采用“平均值±标准偏差(SD)”表示。组间采用单因素方差分析(ANOVA),然后进行Tukey检验,P < 0.05为差异具有统计学意义,制图软件为GraphPad Prism 8。P < 0.05表示差异显著,P < 0.01表示差异极显著。
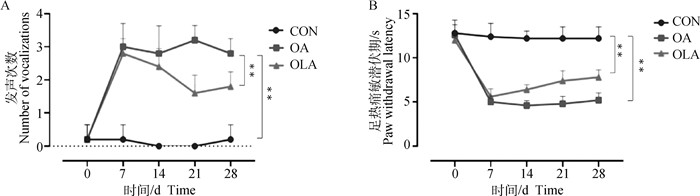
2 结果 2.1 OLA抑制OA大鼠的关节疼痛如图 1A伸膝发声行为学检测结果显示,与CON组比较,OA组造模28 d内发声次数极显著增加(P < 0.01),与OA组比较,OLA组大鼠发生次数极显著减少(P < 0.01)。如图 1B所示,与CON组比较,OA组大鼠的PWL极显著缩短(P < 0.01),与OA组比较,OLA组大鼠的PWL极显著增加(P < 0.01)。
|
A. 伸膝发声试验;B. 热敏感试验;*.P<0.05,**.P<0.01,下同 A. Knee joint vocalization test; B. Knee joint heat sensitivity test; *. P < 0.05, **. P < 0.01, the same as below 图 1 OLA抑制OA大鼠的关节疼痛 Fig. 1 OLA inhibits joint pain in OA rats |
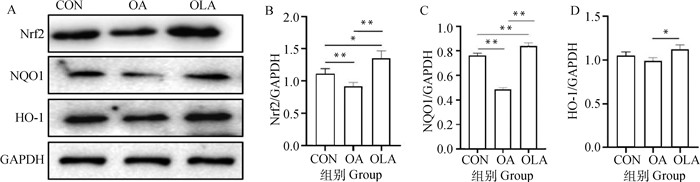
如图 2结果显示,与CON组比较,OA组大鼠股四头肌组织中Nrf2和NQO1蛋白表达极显著下降(P < 0.01),OLA组中Nrf2和NQO1蛋白表达显著(P < 0.05)或极显著(P < 0.01)升高。与OA组比较,OLA组中Nrf2、NQO1和HO-1蛋白表达水平极显著(P<0.01)或显著(P < 0.05)升高。综上所述,OLA通过调控Nrf2/NQO1/HO-1通路抑制OA大鼠肌肉氧化损伤。
|
A. OLA 干预对 OA 大鼠 Nrf2/NQO1/HO-1 蛋白表达的影响;B~D. 各蛋白表达情况灰度分析 A. Effect of OLA intervention on Nrf2/NQO1/HO-1 protein expression in OA rats; B-D. Gray-scale analysis of the expression of each protein 图 2 OLA通过Nrf2/NQO1/HO-1通路抑制OA大鼠肌肉氧化损伤 Fig. 2 OLA inhibits muscle oxidative damage in OA rats through Nrf2/NQO1/HO-1 pathway |
通过ELISA方法检测大鼠股四头肌组织中CS、MHC以及炎症因子IL-1和IL-6含量变化。如图 3A~D结果显示,与CON组比较,OA组大鼠肌肉组织中MHC和CS含量极显著(P < 0.01)或显著(P < 0.05)降低,OLA组中CS和MHC含量无明显变化。与OA组比较,OLA组中MHC和CS含量显著增加(P < 0.05)。此外,与CON组比较,OA组大鼠肌肉组织中IL-1和IL-6含量极显著增加(P < 0.01),OLA组中IL-6含量极显著降低(P < 0.01)。与OA组比较,OLA组肌肉组织中IL-1和IL-6含量显著(P < 0.05)或极显著(P < 0.01)降低。

|
图 3 OLA能够改善OA大鼠肌肉功能障碍 Fig. 3 OLA can improve muscle dysfunction in OA rats |
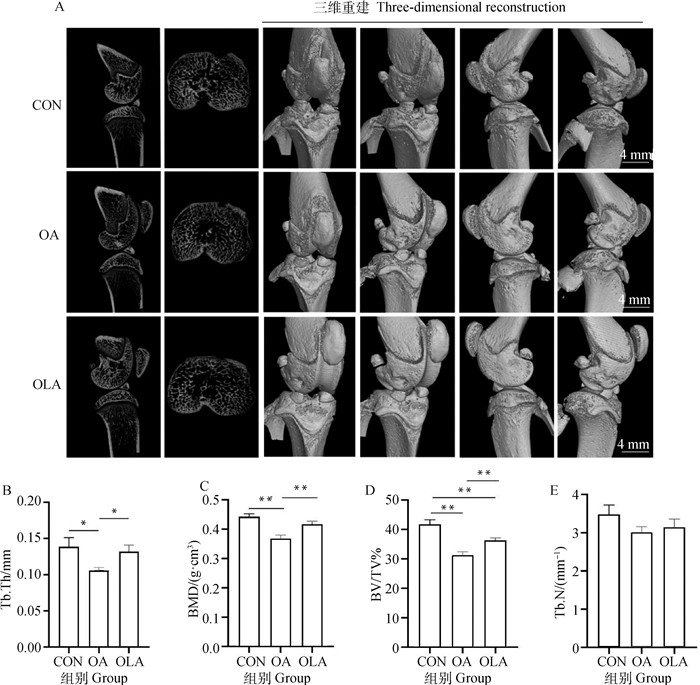
如图 4所示,与CON相比,OA组中Tb.Th、BMD和BV/TV显著(P < 0.05)或极显著(P < 0.01)降低,OLA组中BV/TV极显著降低(P < 0.01)。与OA组相比,OLA组中Tb.Th、BMD和BV/TV显著(P < 0.05)或极显著(P < 0.01)增加。Tb.N在CON组、OA组和OLA组的组间变化均不显著。
|
A. 各组大鼠右膝关节 Micro-CT 扫描代表性图像;B. Tb.Th(骨小梁厚度);C. BMD(骨矿物质密度);D. BV/TV(骨体积分数);E. Tb.N(骨小梁数) A. Representative images of Micro-CT scans of the right knee joint in each group of rats; B. Tb.Th (trabecular thickness); C. BMD (bone mineral density); D. BV/TV (percent bone volume); E. Tb.N (trabecular number) 图 4 OLA抑制OA大鼠软骨下骨的异常骨重建 Fig. 4 OLA inhibits abnormal bone remodeling in subchondral bone of OA rats |
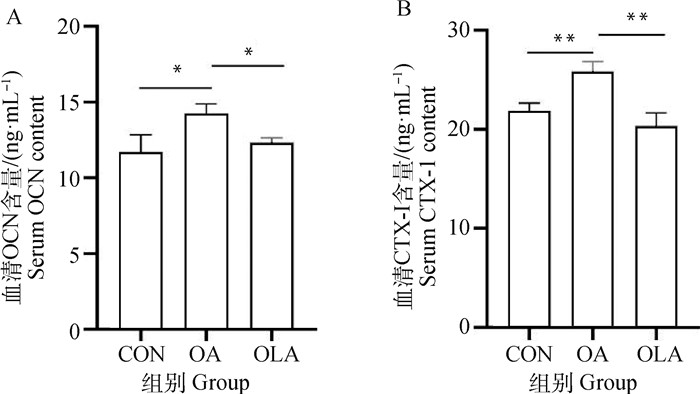
如图 5所示,与CON组比较,OA组大鼠血清中OCN含量显著升高(P < 0.05),CTX-Ⅰ浓度呈极显著升高(P < 0.01),OLA组中OCN和CTX-Ⅰ无显著变化。与OA组比较,OLA组大鼠血清中OCN和CTX-Ⅰ含量显著降低(P < 0.05),其中CTX-Ⅰ浓度呈极显著降低(P < 0.01)。
|
图 5 OLA抑制骨关节炎大鼠血清中骨代谢标志物OCN和CTX-Ⅰ的表达 Fig. 5 Effect of OLA on the concentration of bone metabolism markers OCN and CTX-Ⅰ in the serum of OA rats |
OLA是一种广泛使用的植物三萜类化合物,具有很强的抗氧化活性。以往研究表明,OLA对OA具有积极作用,但具体作用机制不明确。肌肉功能障碍和软骨下骨异常骨重建与OA病理有关,本研究发现OLA能够有效减轻OA大鼠疼痛反应,通过Nrf2/NQO1/HO-1通路抑制炎症反应和肌肉氧化损伤,并且抑制软骨下骨的异常骨重建,这为OLA治疗OA机制提供了新思路。
氧化应激能够参与OA肌肉功能障碍和炎症的发病机制。肌肉氧化应激会使Nrf2在细胞质中积累,然后最终转移到细胞核,启动醌氧化还原酶-1(NQO1)和血红素加氧酶1(HO-1)的基因转录。有研究表明,OA的肌肉Nrf2水平降低,而芝麻油能够显着增加肌肉Nrf2表达,抑制氧化应激从而减轻早期关节疼痛。本研究发现OLA干预后大鼠股四头肌中Nrf2、HO-1和NQO1蛋白水平较OA组显著上升,从而诱导促炎因子IL-1和IL-6的产生,这说明OLA能够调控Nrf2/NQO1/HO-1通路抑制OA大鼠肌肉氧化损伤。此外,与OA相关的股四头肌无力的潜在机制已被阐明[24],其中,MHC的改变在肌力中起主导作用[11]。细胞因子IL-1和IL-6以及CS与肌肉质量和肌力损失有关[25]。本研究发现ACLT+PMMx大鼠肌肉中IL-1和IL-6增加,CS活性和MHC表达降低,表明OA大鼠肌无力,持续的氧化应激导致细胞膜的脂质过氧化,损害细胞器的功能和细胞破坏最终导致炎症反应,而OLA通过恢复CS活性和MHC含量可以改善OA中股四头肌功能障碍。
OA是软骨、软骨下骨、韧带和滑膜等所有关节结构的系统性疾病[26]。在OA中,软骨下骨和关节软骨之间进行信号交互。在OA早期,软骨下骨板变薄、疏松,软骨下骨小梁退化。在OA晚期,钙化的软骨和软骨下骨板变厚,并伴有软骨下骨小梁硬化等特征[28]。不同造模方法和造模时长软骨下骨的变化时期有所不同。既往对OA软骨下骨的研究大多通过切除前十字韧带或半月板造成关节不稳而建立OA模型[31]。本研究通过ACLT+PMMx方法诱导大鼠创伤性OA,以探讨软骨下骨力学结构改变在OLA干预后的变化。有研究表明,在ACLT+MMx模型后两周表现出显著的软骨下骨丢失,BV/TV下降,而在造模后6周BV/TV较对照组上升,呈现骨硬化。因此本试验采取ACLT+PMMx模型造模4周,模拟OA早期阶段,结果发现,造模后软骨下骨BV/TV、BMD和Tb.Th均较CON组下降,而通过OLA干预后,BV/TV、BMD和Tb.Th参数显著上升。此外,骨代谢标志物CTX-Ⅰ和CON分别是骨吸收过程中Ⅰ型胶原释放入血的产物和成骨细胞分泌的非胶原蛋白[33]。在本研究中,OA大鼠血清中OCN和CTX-Ⅰ含量均显著上升,OLA干预显著降低了CTX-Ⅰ和OCN表达。这表明OLA参于OA导致的软骨下骨异常骨重建,不仅可以改善OA发病早期阶段关节软骨下骨生物学损伤,还能够调节其生物力学特性。OLA调节OA软骨下骨代谢,抑制骨小梁三维结构的破坏,并缓解OA大鼠的骨侵蚀,从而有效阻止OA病理过程中软骨下骨异常骨重建和微结构改变的可能性。但OLA如何参与软骨下骨代谢的分子机制,以及对破骨细胞和成骨细胞的调控作用仍需进一步研究。
4 结论OLA可能够抑制OA大鼠关节疼痛反应,并通过调控Nrf2/NQO1/HO-1通路抑制OA大鼠肌肉功能障碍,改善OA早期软骨下骨生物力学性能和微结构改变,从而延缓OA大鼠软骨下骨异常骨重建的发生。
| [1] |
GLYN-JONES S, PALMER A J R, AGRICOLA R, et al. Osteoarthritis[J]. Lancet, 2015, 386(9991): 376-387. DOI:10.1016/S0140-6736(14)60802-3 |
| [2] |
HEINOLA T, DE GRAUW J C, VIRKKI L, et al. Bovine chronic osteoarthritis causes minimal change in synovial fluid[J]. J Comp Pathol, 2013, 148(4): 335-344. DOI:10.1016/j.jcpa.2012.08.001 |
| [3] |
HUNTER D J, BIERMA-ZEINSTRA S. Osteoarthritis[J]. Lancet, 2019, 393(10182): 1745-1759. DOI:10.1016/S0140-6736(19)30417-9 |
| [4] |
SÁNCHEZ-QUESADA C, LÓPEZ-BIEDMA A, GAFORIO J J. Oleanolic acid, a compound present in grapes and olives, protects against genotoxicity in human mammary epithelial cells[J]. Molecules, 2015, 20(8): 13670-13688. DOI:10.3390/molecules200813670 |
| [5] |
LI Y L, NIE J L, JIANG P. Oleanolic acid mitigates interleukin-1β-induced chondrocyte dysfunction by regulating miR-148-3p-modulated FGF2 expression[J]. J Gene Med, 2020, 22(5): e3169. |
| [6] |
BAO J P, YAN W F, XU K, et al. Oleanolic acid decreases IL-1β-induced activation of fibroblast-like synoviocytes via the SIRT3-NF-κB axis in osteoarthritis[J]. Oxid Med Cell Longev, 2020, 2020: 7517219. |
| [7] |
KANG D G, LEE H J, KIM K T, et al. Effect of oleanolic acid on the activity, secretion and gene expression of matrix metalloproteinase-3 in articular chondrocytes in vitro and the production of matrix metalloproteinase-3 in vivo[J]. Korean J Physiol Pharmacol, 2017, 21(2): 197-204. DOI:10.4196/kjpp.2017.21.2.197 |
| [8] |
陆锦炜, 陈曦, 叶陈毅, 等. 骨性关节炎中的软骨下骨囊肿: 软骨下骨异常重建[J]. 中国组织工程研究, 2019, 23(32): 5209-5215. LU J W, CHEN X, YE C Y, et al. Subchondral bone cysts in osteoarthritis: abnormal reconstruction of subchondral bone[J]. Chinese Journal of Tissue Engineering Research, 2019, 23(32): 5209-5215. DOI:10.3969/j.issn.2095-4344.1400 (in Chinese) |
| [9] |
ZHU X B, CHAN Y T, YUNG P S H, et al. Subchondral bone remodeling: a therapeutic target for osteoarthritis[J]. Front Cell Dev Biol, 2020, 8: 607764. |
| [10] |
BECKER R, BERTH A, NEHRING M, et al. Neuromuscular quadriceps dysfunction prior to osteoarthritis of the knee[J]. J Orthop Res, 2004, 22(4): 768-773. DOI:10.1016/j.orthres.2003.11.004 |
| [11] |
CALLAHAN D M, MILLER M S, SWEENY A P, et al. Muscle disuse alters skeletal muscle contractile function at the molecular and cellular levels in older adult humans in a sex-specific manner[J]. J Physiol, 2014, 592(20): 4555-4573. DOI:10.1113/jphysiol.2014.279034 |
| [12] |
IKEDA S, TSUMURA H, TORISU T. Age-related quadriceps-dominant muscle atrophy and incident radiographic knee osteoarthritis[J]. J Orthop Sci, 2005, 10(2): 121-126. DOI:10.1007/s00776-004-0876-2 |
| [13] |
LEI M, GUO C H, HUA L M, et al. Crocin attenuates joint pain and muscle dysfunction in osteoarthritis rat[J]. Inflammation, 2017, 40(6): 2086-2093. DOI:10.1007/s10753-017-0648-8 |
| [14] |
HAO Y, MIAO J, LIU W J, et al. Formononetin protects against cisplatin-induced acute kidney injury through activation of the PPARα/Nrf2/HO-1/NQO1 pathway[J]. Int J Mol Med, 2020, 47(2): 511-522. DOI:10.3892/ijmm.2020.4805 |
| [15] |
HUAI B, DING J Y. Atractylenolide Ⅲ attenuates bleomycin-induced experimental pulmonary fibrosis and oxidative stress in rat model via Nrf2/NQO1/HO-1 pathway activation[J]. Immunopharmacol Immunotoxicol, 2020, 42(5): 436-444. DOI:10.1080/08923973.2020.1806871 |
| [16] |
DAI M L, SUI B, XUE Y, et al. Cartilage repair in degenerative osteoarthritis mediated by squid type Ⅱ collagen via immunomodulating activation of M2 macrophages, inhibiting apoptosis and hypertrophy of chondrocytes[J]. Biomaterials, 2018, 180: 91-103. DOI:10.1016/j.biomaterials.2018.07.011 |
| [17] |
LONG C M, YANG J R, YANG H, et al. Attenuation of renal ischemia/reperfusion injury by oleanolic acid preconditioning via its antioxidant, antiinflammatory, and antiapoptotic activities[J]. Mol Med Rep, 2016, 13(6): 4697-4704. DOI:10.3892/mmr.2016.5128 |
| [18] |
IM H J, KIM J S, LI X, et al. Alteration of sensory neurons and spinal response to an experimental osteoarthritis pain model[J]. Arthritis Rheum, 2010, 62(10): 2995-3005. DOI:10.1002/art.27608 |
| [19] |
TALIYAN R, SHARMA P L. Possible mechanism of protective effect of thalidomide in STZ-induced-neuropathic pain behavior in rats[J]. Inflammopharmacology, 2012, 20(2): 89-97. DOI:10.1007/s10787-011-0106-4 |
| [20] |
WANG X, YE X L, LIU R, et al. Antioxidant activities of oleanolic acid in vitro: possible role of Nrf2 and MAP kinases[J]. Chem Biol Interact, 2010, 184(3): 328-337. DOI:10.1016/j.cbi.2010.01.034 |
| [21] |
张鹏, 李俞甫, 吴尚泽, 等. 丹皮酚对L-精氨酸诱导的小鼠急性胰腺炎氧化损伤的影响[J]. 畜牧兽医学报, 2021, 52(7): 1983-1990. ZHANG P, LI Y F, WU S Z, et al. Effects of paeonol on the oxidative damage of acute pancreatitis in mice induced by L-arginine[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(7): 1983-1990. (in Chinese) |
| [22] |
LOBODA A, DAMULEWICZ M, PYZA E, et al. Role of Nrf2/HO-1 system in development, oxidative stress response and diseases: an evolutionarily conserved mechanism[J]. Cell Mol Life Sci, 2016, 73(17): 3221-3247. DOI:10.1007/s00018-016-2223-0 |
| [23] |
HSU D Z, CHU P Y, JOU I M. Daily sesame oil supplement attenuates joint pain by inhibiting muscular oxidative stress in osteoarthritis rat model[J]. J Nutr Biochem, 2016, 29: 36-40. DOI:10.1016/j.jnutbio.2015.10.007 |
| [24] |
TONGE D P, BARDSLEY R G, PARR T, et al. Evidence of changes to skeletal muscle contractile properties during the initiation of disease in the ageing guinea pig model of osteoarthritis[J]. Longev Healthspan, 2013, 2(1): 15. DOI:10.1186/2046-2395-2-15 |
| [25] |
CHEN D S, CAO J G, ZHU B, et al. Baicalin attenuates joint pain and muscle dysfunction by inhibiting muscular oxidative stress in an experimental osteoarthritis rat model[J]. Arch Immunol Ther Exp, 2018, 66(6): 453-461. DOI:10.1007/s00005-018-0518-6 |
| [26] |
LOESER R F, GOLDRING S R, SCANZELLO C R, et al. Osteoarthritis: a disease of the joint as an organ[J]. Arthritis Rheum, 2012, 64(6): 1697-1707. DOI:10.1002/art.34453 |
| [27] |
KOVÁCS B, VAJDA E, NAGY E E. Regulatory effects and interactions of the wnt and OPG-RANKL-RANK signaling at the bone-cartilage interface in osteoarthritis[J]. Int J Mol Sci, 2019, 20(18): 4653. DOI:10.3390/ijms20184653 |
| [28] |
HU W H, CHEN Y Q, DOU C, et al. Microenvironment in subchondral bone: predominant regulator for the treatment of osteoarthritis[J]. Ann Rheum Dis, 2021, 80(4): 413-422. DOI:10.1136/annrheumdis-2020-218089 |
| [29] |
AIZAH N, CHONG P P, KAMARUL T. Early alterations of subchondral bone in the rat anterior cruciate ligament transection model of osteoarthritis[J]. Cartilage, 2021, 13(2_suppl): 1322S-1333S. DOI:10.1177/1947603519878479 |
| [30] |
MOHAN G, PERILLI E, KULIWABA J S, et al. Application of in vivo micro-computed tomography in the temporal characterisation of subchondral bone architecture in a rat model of low-dose monosodium iodoacetate-induced osteoarthritis[J]. Arthritis Res Ther, 2011, 13(6): R210. DOI:10.1186/ar3543 |
| [31] |
SHARMA A R, JAGGA S, LEE S S, et al. Interplay between cartilage and subchondral bone contributing to pathogenesis of osteoarthritis[J]. Int J Mol Sci, 2013, 14(10): 19805-19830. DOI:10.3390/ijms141019805 |
| [32] |
HAYAMI T, PICKARSKI M, ZHUO Y, et al. Characterization of articular cartilage and subchondral bone changes in the rat anterior cruciate ligament transection and meniscectomized models of osteoarthritis[J]. Bone, 2006, 38(2): 234-243. DOI:10.1016/j.bone.2005.08.007 |
| [33] |
MADSEN J O B, HERSKIN C W, ZERAHN B, et al. Decreased markers of bone turnover in children and adolescents with type 1 diabetes[J]. Pediatr Diabetes, 2020, 21(3): 505-514. DOI:10.1111/pedi.12987 |
(编辑 白永平)



